修回日期: 2013-03-25
接受日期: 2013-04-12
在线出版日期: 2013-05-08
目的: 观察N-乙酰半胱氨酸(N-acetylcysteine, NAC)对重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠血浆肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白细胞介素1β(interleukin-1β, IL-1β)、IL-10及小肠组织细胞间黏附分子1(intercellular cell adhesion molecule-1, ICAM1)表达的影响, 并探讨其对大鼠SAP相关肠损伤保护作用的机制.
方法: 72只Wistar大鼠随机分为假手术组(SO组)、SAP组及NAC干预组(NAC组). 每组再分为6、12、24 h共3个时相点, 每个时相点各8只大鼠. 通过胰胆管逆行注射5%牛磺胆酸钠制作大鼠SAP模型, SO组用同样方法经胰胆管逆行注射生理盐水, NAC组大鼠在制作SAP模型前1 h经腹腔注射NAC, SO组及SAP组在术前1 h经腹腔注射同NAC等体积的生理盐水. 动物分别于术后6、12、24 h麻醉后取材, 检测血浆淀粉酶(plasma amylase, AMY)、内毒素、D-乳酸, 二胺氧化酶(diamine oxidase, DAO)、TNF-α、IL-1β及IL-10含量, 观察小肠组织病理学变化并进行评分, 实时荧光定量PCR(Real-time PCR)检测小肠组织ICAM1 mRNA的表达, Western blot法检测小肠组织ICAM1蛋白变化.
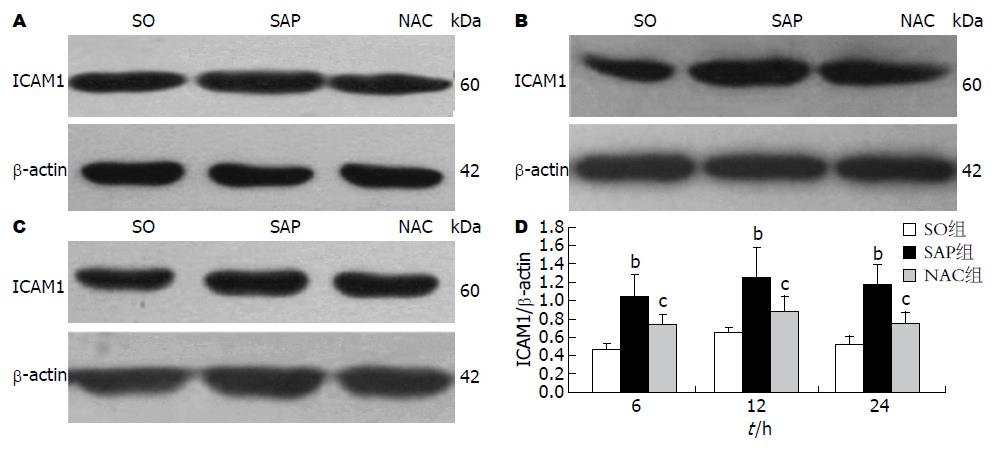
结果: NAC组各时相点大鼠AMY、TNF-α及IL-β水平均较SAP组各对应时相点降低, IL-10水平则明显增高, 内毒素、DAO和D-乳酸在12和24 h时也明显降低; SO组大鼠小肠组织无明显病理学改变, NAC组大鼠小肠病理改变较SAP组明显改善, 小肠组织病理学评分在12及24 h亦明显降低. NAC组大鼠小肠组织中ICAM1 mRNA(6 h: 1.13±0.28 vs 2.37±0.63; 12 h: 1.27±0.34 vs 2.94±0.82; 24 h: 1.19±0.26 vs 2.68±0.95, 均P<0.05)及蛋白(6 h: 0.74±0.11 vs 1.04±0.25; 12 h: 0.88±0.17 vs 1.25± 0.33; 24 h: 0.75±0.13 vs 1.18±0.22, 均P<0.05)的表达与SAP组相应时相点比较均明显减弱.
结论: NAC可以减轻SAP大鼠肠损伤, 其机制除其可以抑制TNF-α、IL-1β并促进IL-10的释放外, 还可能与其对小肠组织ICAM1表达的调节作用有关.
核心提示: 抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine)可以减轻大鼠重症急性胰腺炎(severe acute pancreatitis)相关肠损伤, 其机制除可以调节促炎及抗炎因子的平衡外, 对小肠组织中细胞间黏附分子1(intercellular cell adhesion molecule-1)表达的调节亦发挥一定的作用.
引文著录: 牛天平, 王映珍, 曹云华, 王军, 李自力, 肖文, 张有成, 王世文. N-乙酰半胱氨酸在减轻大鼠重症急性胰腺炎肠损伤中的作用. 世界华人消化杂志 2013; 21(13): 1211-1217
Revised: March 25, 2013
Accepted: April 12, 2013
Published online: May 8, 2013
AIM: To investigate the effects of treatment with n-acetylcysteine (NAC) on plasma levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and IL-10 and ICAM1 expression in small intestine tissue in rats with severe acute pancreatitis (SAP) and to explore the possible mechanisms involved.
METHODS: Seventy Wistar rats were randomly divided into a sham operation group (SO, n = 24), a SAP group (n = 24) and a NAC treatment group (n = 24). SAP was induced in rats by injecting 5.0% sodium taurocholate into the biliary-pancreatic duct. Rats in the SO group were given an infusion of normal saline instead. Rats in the NAC group underwent SAP induction and were given an intraperitoneal injection of NAC 1 hour before the operation, and rats in the SO group and SAP group were given an intraperitoneal injection of normal saline. Eight rats were sacrificed 6, 12 or 24 h after operation in each group. Plasma levels of amylase (AMY), endotoxin, diamine oxidase (DAO), D-lactic acid, TNF-α, IL-1β and IL-10 were measured. Pathologic changes in the small intestine were observed and scored. ICAM1 mRNA and protein expression in the small intestine was tested by real-time PCR and Western blot, respectively.
RESULTS: Compared to the SAP group, plasma levels of AMY, TNF-α and IL-β were significantly lower at all three time points (all P < 0.05) and serum levels of endotoxin, DAO and D- lactic acid were significantly lower at 12 and 24 h (both P < 0.05) in the NAC group. Serum levels of IL-10 in the NAC group were increased compared to the SAP group at all three time points. The pathology score of the small intestinal was significantly lower in the NAC group than the SAP group at 12 and 24 h. Although the mRNA expression of ICAM1 was increased at each time point in the SAP group compared with the SO group, it was significantly decreased in the NAC group compared with the SAP group (6 h: 1.13 ± 0.28 vs 2.37 ± 0.63; 12 h: 1.27 ± 0.34 vs 2.94 ± 0.82; 24 h: 1.19 ± 0.26 vs 2.68 ± 0.95; all P < 0.05). The protein expression of ICAM1 had the same trend as the mRNA expression between the NAC and SAP groups (6 h: 0.74 ± 0.11 vs 1.04 ± 0.25; 12 h: 0.88 ± 0.17 vs 1.25 ± 0.33; 24 h: 0.75 ± 0.13 vs 1.18 ± 0.22; all P < 0.05).
CONCLUSION: Administration of NAC ameliorates severe acute pancreatitis-associated intestinal injury in rats possibly by regulating plasma levels of TNF-α, IL-1β and IL-10 and inhibiting ICAM1 expression in the small intestine.
- Citation: Niu TP, Wang YZ, Cao YH, Wang J, Li ZL, Xiao W, Zhang YC, Wang SW. N-acetylcysteine ameliorates severe acute pancreatitis-associated intestinal injury in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(13): 1211-1217
- URL: https://www.wjgnet.com/1009-3079/full/v21/i13/1211.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i13.1211
重症急性胰腺炎(severe acute pancreatitis, SAP)约占急性胰腺炎(acute pancreatitis, AP)的10%-15%, 死亡率可高达20%-30%[1,2], 而多器官功能障碍(multiple organ dysfunction syndrome, MODS)和感染是SAP相关死亡的主要原因[3]. SAP时众多因素导致的肠屏障功能障碍(intestine barrier functional disturbance, IBFD)是发生细菌移位、内毒素血症和MODS的始动因素[4,5], 因此早期保护肠屏障功能对SAP的防治具有重要作用[6]. N-乙酰半胱氨酸(N-acetylcysteine, NAC)是一种含有巯基的抗氧化剂, 实验研究表明, NAC具有抗氧自由基、稳定细胞膜、抑制炎症反应等广泛的生物学作用和活性[7-11]. 本研究通过建立大鼠SAP模型并应用NAC进行干预, 观察NAC对SAP大鼠血浆肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白细胞介素1β(interleukin-1β, IL-1β)、IL-10水平及小肠组织细胞间黏附分子1(intercellular cell adhesion molecule-1, ICAM1)表达的影响, 以进一步探讨其对大鼠SAP相关肠损伤保护作用的分子机制.
Wistar大鼠由兰州大学医学实验动物中心提供. 动物术前禁食12 h, 自由饮水. NAC及牛磺胆酸钠购自Sigma公司; 内毒素(endotoxin)测定试剂盒购自厦门鲎试剂实验厂有限公司; TNF-α、IL-β及IL-10 ELISA试剂盒均购自北京达科为生物技术有限公司; RNAiso Plus及实时荧光定量PCR(real-time PCR)相关试剂购自大连宝生物公司; ICAM1引物由大连宝生物公司合成; ICAM1多克隆兔抗鼠抗体、β-actin兔抗鼠抗体及辣根过氧化物酶标记的羊抗兔二抗Ig G购自北京博奥森.
1.2.1 实验分组: 72只健康Wistar大鼠, SPF级, 体质量200-220 g, 雌雄不限, 随机分为SO组、SAP组、NAC组, 每组再分为3个时相点(6、12、24 h), 每个时相点8只大鼠.
1.2.2 动物模型的制备: 2%戊巴比妥钠溶液(0.25 mL/100 g体质量)腹腔内注射麻醉后, 大鼠平卧位固定, 常规备皮、消毒铺巾. 上腹部正中切口进腹, 仔细辨认十二指肠管壁内侧潜行的十二指肠乳头后, 用5号注射针头于十二指肠乳头对侧缘无血管区肠壁刺一小孔, 用特制细塑硅胶管经小孔进入十二指肠肠腔后, 沿十二指肠乳头方向插入胰胆管, 以2枚血管夹分别夹持贴近十二指肠的胰胆管远段和肝门处胆总管后, 导管末端连接输液转换器, SAP组和NAC组以0.2 mL/min的速度向胰胆管内逆行注入5%牛磺胆酸钠溶液, SO组用生理盐水代替牛磺胆酸钠溶液, 剂量均为0.10 mL/100 g体质量. 注射完毕后, 停留5 min, 移去显微血管夹和细塑硅胶管, 缝合十二指肠外侧壁小孔, 观察SAP组和NAC组大鼠胰腺出现水肿伴出血灶后, 用消毒棉球吸干腹腔内残留麻药, 缝合腹壁各层. NAC组于术前1小时经腹腔注射NAC溶液500 μg/kg(浓度50 μg/mL, pH = 7.3), 即10 mL/kg, 而SO组及SAP组则于相同时间点经上述途径注射生理盐水10 mL/kg. 大鼠术后禁食, 自由饮水.
1.2.3 标本采集及预处理: 各组动物于相应时相点麻醉后无菌条件下取右心室血5 mL加入灭热源的肝素抗凝管, 分离血浆后保存于-80 ℃待检. 取距回盲部2 cm处回肠组织长约5 cm, 置于冰冷的生理盐水中, 沿纵轴剪开肠管, 冲洗干净肠内容物, 用滤纸吸干水后, 部分用10%中性甲醛固定做病理形态学检查, 其余装入用DEPC处理过的冻存管后即刻投入液氮内保存待检.
1.2.4 指标检测: (1)血浆淀粉酶检测, 用全自动生化分析仪测定; (2)血浆TNF-α、IL-β及IL-10检测: 采用双抗夹心ELISA法, 严格按照说明书操作, 用酶标仪测定A值后, 以标准品的浓度和A值绘制标准曲线, 从标准曲线计算样品对应浓度, 单位均为pg/mL; (3)血浆内毒素、DAO及D-乳酸检测: 改良的鲎试剂凝胶法测定血浆内毒素含量, 单位为ng/L; 分光光度法测定血浆DAO及D-乳酸含量, 单位分别为U/mL和μg/mL; (4)小肠组织病理形态学观察及评分: 小肠组织石蜡切片行苏木素-伊红染色(HE染色), 由两名病理医师盲法采用Chiu氏6级评分法[12]评估损伤程度并评分, 取其平均值; (5)Real-time PCR法检测小肠组织ICAM1 mRNA的表达: 称取80-100 mg超低温冻结的小肠组织样品, 用RNAiso Plus提取总RNA并测定浓度, 取总量500 ng RNA进行反转录, 体系为10 μL, 反转录反应条件如下: 37 ℃ 15 min, 85 ℃ 5 s. 采取Real-time PCR扩增ICAM1 mRNA, 反应体系为25 mL, 反应条件如下: 95 ℃变性30 s; 95 ℃变性5 s, 60 ℃退火30 s, 共40个循环; 72 ℃延伸5 min. ICAM1引物: 上游引物5'-GGCGTCCATTTACACCTATTA-3', 下游引物5'-TTCCTTTTCTTCTCTTGCTTG-3'(413 bp); β-actin引物: 上游引物5'- GCAAG TACTCTGTGTGGATTGG-3', 下游引物5'- AATCAAAGTCCTCAGCCACATT-3'(395 bp), 实验重复3次, 选用β-actin作为内参. 用Rotor-Gene 6000荧光定量PCR仪自带软件进行数据分析, 采用比较CT值法(2-∆∆Ct法)进行PCR相对定量; (6)Western blot检测小肠组织ICAM1蛋白表达: 取50-100 mg冰冻小肠组织用预冷的PBS洗涤2次, 离心弃去PBS, 置于玻璃匀浆器中剪成碎块, 加入0.5-1.0 mL预冷的蛋白裂解液, 用玻璃匀浆器充分匀浆后12000 g、4 ℃离心30 min, 将上清转移到新的离心管中, 取适量上清用BCA蛋白浓度试剂盒进行定量, 剩余溶液溶于5×loading buffer后95 ℃变性15 min, 取总量40 μg蛋白, 用5%浓缩胶、15%分离胶进行电泳, 恒流20 mA下待溴酚蓝进入分离胶时改为恒流30 mA继续电泳, 直到溴酚蓝移至胶底时终止电泳. 根据预染Maker指示, 恒压100 V、60 min将相应蛋白转移至PVDF膜上, 转膜结束后将PVDF膜立即移至5%脱脂牛奶封闭液中, 室温下摇床上摇动封闭2 h. 然后将封闭好的膜放入溶有兔抗鼠一抗(ICAM1 1:500; β-actin 1:1000)的新鲜配制的TBST中, 室温下摇床上摇动1 h后4 ℃孵育过夜. 第2天取出置于摇床上室温下摇动1 h, TBST洗涤8 min×5次后, 置于封闭液稀释的辣根过氧化物酶标记的山羊抗兔二抗(IgG l:10000)中, 室温下摇床上摇动2 h, TBST洗涤8 min×5次. ECL显色后在暗室内曝光, 显影定影, 自来水冲洗晾干后胶片用扫描仪扫描成像, 用Quantity-One软件测定灰度值, 目的蛋白与β-actin灰度值的比值为目的蛋白的相对表达量.
统计学处理 计量资料以mean±SD表示, 采用SPSS13.0进行统计学处理, 组间差异比较采用方差分析, 多重比较采用SNK法或LSD法, 以P<0.05为差异有统计学意义.
结果示SAP组各时相点大鼠血浆AMY与SO组各相应时相点相比均显著升高(均P<0.05); NAC组6 h大鼠血浆AMY与SAP组相比虽然有所降低, 但差异无统计学意义(P>0.05), 而12和24 h时均明显降低, 差异有统计学意义(均P<0.05), 尤以12 h最为显(P<0.01, 表1).
小肠组织HE染色示SO组无明显病理改变; SAP组大鼠6 h即有小肠壁充血、水肿、伴少量炎症细胞浸润, 少部分绒毛融合、脱落、缺损, 此后上述改变逐渐加重, 尤以24 h更明显; NAC组大鼠上述病理变化与SAP组相应时相点相比均明显减轻. SAP组大鼠小肠组织病理学评分较SO组各相应时相点均明显增高(P<0.05), 而NAC组则较SAP组各相应时相点明显降低, 差异均有统计学意义(P<0.05, 表1).
SAP组大鼠血浆内毒素浓度与SO组各相应时相点相比均明显增高(均P<0.01). 而NAC组大鼠血浆内毒素浓度在6 h虽较SAP组相应时相点为低, 但差异无统计学意义(P>0.05), 12及24 h与SAP组相应时相点相比则明显下降, 差异有统计学意义(P<0.05, 表2).
| 分组 | 内毒素(ng/L) | DAO(U/mL) | D-乳酸(mg/L) | ||||||
| 6 h | 12 h | 24 h | 6 h | 12 h | 24 h | 6 h | 12 h | 24 h | |
| SO组 | 41.0±6.2 | 39.1±7.3 | 35.2±6.3 | 0.41±0.11 | 0.43±0.15 | 0.34±0.16 | 4.09±1.76 | 3.53±0.93 | 3.74±1.02 |
| SAP组 | 137.5±19.0b | 168.6±20.6b | 173.4±21.1b | 0.99±0.50a | 1.94±0.42b | 2.81±0.80b | 9.74±1.96b | 11.73±2.71b | 15.39±3.05b |
| NAC组 | 127.5±12.4b | 142.5±13.3bc | 128.7±15.2bd | 1.44±0.49b | 1.32±0.31bc | 1.26±0.24bd | 7.36±1.48b | 8.23±2.98bc | 10.24±1.65bd |
SAP组大鼠血浆DAO浓度与SO组各相应时相点相比均增高, 差异有统计学意义(P<0.05), 尤以12和24 h为显(P<0.01). NAC组大鼠在6 h与SAP组相应时相点相比仍处于较高水平, 但12和24 h与SAP组相应时相点相比则明显下降, 尤以24 h为显(P<0.01, 表2).
SAP组大鼠血浆D-乳酸水平与SO组各对应时相点相比均明显升高, 差异有统计学意义(P<0.01); NAC治疗组与SAP组各相应时相点比, 6 h虽有所降低, 但差异无统计学意义; 12和24 h时则均明显下降(P<0.05), 尤以24 h最为显著(P<0.01, 表2).
标准曲线拟合度分别为0.9987, 0.9925和0.9936. SAP组大鼠血浆TNF-α水平均明显高于SO组各相应时相点, 12 h达高峰, 而NAC组与SAP组各相应时相点相比均明显下降, 差异均有统计学意义(P<0.05). SAP组大鼠血浆IL-β水平均明显高于SO组各相应时相点, 24 h仍处于较高水平, NAC干预后各时相点均明显下降, 差异有统计学意义(P<0.05). SAP组大鼠血浆IL-10水平与SO组各对应时相点相比均降低, 但NAC组与SAP组各对应时相点相比均增高, 差异有统计学意义(P<0.05, 表3).
| 分组 | TNF-α(pg/mL) | IL-β(pg/mL) | IL-10(pg/mL) | ||||||
| 6 h | 12 h | 24 h | 6 h | 12 h | 24 h | 6 h | 12 h | 24 h | |
| SO组 | 42.9±9.6 | 36.4±8.9 | 42.1±10.3 | 36.5±9.6 | 40.1±10.7 | 42.6±8.8 | 79.6±14.9 | 74.3±10.6 | 80.5±15.8 |
| SAP组 | 106.1±26.8b | 127.4±29.1b | 121.6±25.3b | 96.4±19.6b | 101.8±20.1b | 106.3±22.4b | 46.1±7.8a | 40.3±6.4a | 42.9±7.5a |
| NAC组 | 65.3±13.2ac | 75.2±16.9ac | 70.7±11.8ac | 63.2±15.9ac | 70.1±16.4ac | 79.8±18.1bd | 56.8±11.2a | 57.7±9.6ac | 62.6±12.1ac |
Real-time PCR结果显示, SAP组大鼠ICAM1 mRNA的表达明显高于SO组各相应时相点(6 h: 2.37±0.63 vs 1; 12 h: 2.94±0.82 vs 1; 24 h: 2.68±0.95 vs 1)(均P<0.01), 12 h即达高峰; NAC组大鼠与SAP组各相应时相点相比则明显下降(6 h: 1.13±0.28 vs 2.37±0.63; 12 h: 1.27±0.34 vs 2.94±0.82; 24 h: 1.19±0.26 vs 2.68±0.95), 差异均有统计学意义(P<0.05).
Western blot结果显示, 与SO组各相应时相点相比较, ICAM1蛋白的表达在SAP组大鼠均明显增高(P<0.01), 尤以12 h最为显著; 而在NAC组与SAP各相应时相点相比则明显下降, 差异均有统计学意义(P<0.05, 图1).
大量研究证实, 肠黏膜损伤、肠屏障功能损害引起的细菌及内毒素移位是导致SAP患者发生继发感染、全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)、MODS及死亡率居高不下的重要原因[3]. 而肠道血流减少和缺血再灌注损伤、内皮完整性破坏、肠道微生态改变、自身抵抗力下降及肠黏膜免疫受损、肠动力异常、肠上皮细胞凋亡、胃肠运动及分泌机能障碍、氧化应激以及SIRS与代偿性抗炎反应综合征(compensatory anti-inflammatory response syndrome, CARS)的平衡失调等因素均参与了SAP时IBFD的发生[3,4]. 肠屏障功能一旦受损, 肠道细菌及内毒素可以通过肠壁进入外周血循环, 因此血浆内毒素水平可以作为肠屏障受损的敏感指标; DAO是人类和所有哺乳动物肠黏膜上层绒毛细胞胞浆中有高度活性的细胞酶, 在外周血中活性稳定, 他的变化可以反映肠黏膜屏障的完整性和损伤程度; D-乳酸是细菌发酵的代谢产物, 肠道多种细菌均可产生, 正常情况下很少被吸收, 当肠黏膜通透性增加时, 大量D-乳酸即通过受损黏膜入血, 使血浆D-乳酸水平升高, 因此监测他们在血液中的水平及变化可反映肠屏障损害程度和通透性变化[13,14].
NAC是天然氨基酸L-半胱氨酸与还原型谷胱甘肽(glutathione, GSH)的前体, 是一种含有巯基的抗氧化剂. 近年研究表明NAC具有干扰自由基生成, 清除自由基, 调节细胞的代谢活性、抗细胞凋亡、抑制炎症反应等多种生物学功能及活性[9,11,15-17]. 在NAC对AP作用的研究中发现, NAC可以通过清除氧自由基、抑制核因子-κB(nuclear factor-κB, NF-κB)的激活、抑制MAPK的活性、降低腺细胞内钙离子浓度及减少细胞因子的合成和释放等作用从而可以阻断AP的发生发展[18], 另外NAC对肠缺血再灌注、炎症性肠病、烧伤、感染及放化疗损伤等多种疾病导致的IBFD亦具有一定的防治作用[16,17].
我们研究发现, SAP组大鼠血浆AMY水平较SO组相应时相点明显增高, 反映肠屏障功能的指标内毒素、D-乳酸及二胺氧化酶亦明显增高; SAP组各时相点大鼠小肠组织病理评分亦明显高于SO组, 小肠病理学检查均可见特征性病理改变, 这说明SAP早期即存在肠屏障功能的改变. NAC组大鼠血浆AMY水平、小肠病理评分均较SAP组各对应时相点明显降低, 小肠病理改变亦明显改善, 这说明NAC对SAP所致肠损伤具有一定的保护作用, 这与NAC对其他原因导致的IBFD均具有较好的防治作用的研究结果相一致.
SAP时过度释放的炎症介质是发生IBFD的主要原因, 促炎因子如TNF-α、血小板活化因子、IL-1β、IL-6、IL-8等的释放促进了全身炎性反应, 这种过度的炎性反应引起抗炎物质释放增多, 而这一过程可导致免疫抑制, 他们共同参与了IBFD的发生[4,5,19,20]. 本研究发现, SAP时血浆TNF-α和IL-1β的水平均较SO组明显增高, 而NAC干预后均可使其降低; 另外血浆IL-10的水平在SAP各时相点大鼠均低于SO组, 但在NAC组则明显增高, 这说明NAC对SAP时肠损伤的保护作用至少部分是与其对促炎细胞因子TNF-α、IL-1β及抗炎细胞因子IL-10的调节相关的, 在维持SIRS/CARS的平衡中发挥了一定的作用.
黏附分子是存在于细胞表面的一类具有复杂功能的糖蛋白, 介导细胞与细胞、细胞与细胞外基质相互识别、相互黏着及信号传递, 在免疫及炎症反应等生理、病理过程中起重要作用[21]. 生理情况下, 大多数组织不表达或仅低水平表达ICAM1, 炎症反应时ICAM1水平上调且能促进中性粒细胞介导的细胞毒作用. SAP时肠黏膜内皮细胞ICAM1的表达可与白细胞表达的L-选择蛋白相互作用, 从而促进了中性粒细胞的边集效应, 并且中性粒细胞通过与整合素受体和配体ICAM-1的相互作用迅速黏附到内皮细胞, 导致肠黏膜损伤的发生[4]. 本研究发现SAP时大鼠小肠组织中ICAM1 mRNA和蛋白的表达与SO组相应时相点比较均明显增强; 而经NAC干预后其表达与SAP各对应时相点相比均明显减弱. 这提示NAC可能通过对小肠组织ICAM1的表达的调控, 从而抑制SAP导致的中性粒细胞黏附、游走和聚集, 并减轻由于补体及中性粒细胞激活所介导的细胞毒性作用, 避免肠黏膜内皮细胞受损, 而对SAP所致的肠损伤具有一定的保护作用.
总之, 本研究表明, NAC能够降低SAP大鼠内毒素血症的发生, 对SAP相关肠损伤有一定的保护作用, 其机制除与NAC可降低血浆促炎细胞因子TNF-α、IL-1β的水平, 同时增加抗炎细胞因子IL-10的作用外, 还可能与其对小肠组织ICAM1表达的调节作用有关.
肠道是重症急性胰腺炎(severe acute pancreatitis, SAP)患者最易发生损害的脏器之一, 而由此导致的肠屏障功能障碍是重症急性胰腺炎患者发生细菌移位、内毒素血症和多器官功能障碍综合征(multiple organ dysfunction syndrome)的始动因素, 因此寻求有效的治疗措施, 早期保护肠屏障功能对SAP的防治具有重要作用.
巩鹏, 教授, 大连医科大学附属第一医院普外二科; 郭晓钟, 教授, 沈阳军区总医院消化内科; 陈海龙, 教授, 大连医科大学附属第一医院院办
本文通过建立大鼠SAP模型并应用N-乙酰半胱氨酸(N-acetylcysteine, NAC)进行早期干预, 观察NAC对SAP大鼠血浆肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白细胞介素1β(interleukin-1β, IL-1β)、IL-10水平及小肠组织细胞间黏附分子1表达的影响, 以进一步探讨其对SAP时肠损伤的影响以及可能机制.
国内外关于NAC在急性胰腺炎(acute pancreatitis, AP)中的研究主要是从他通过清除氧自由基、抑制NF-kB的激活、抑制MAPK的活性、降低腺细胞内钙离子浓度及减少细胞因子的合成和释放, 从而阻断胰腺炎的发生发展, 对AP具有重要的治疗保护作用等方面, 另外NAC对肠缺血再灌注、炎症性肠病、烧伤、感染及放化疗损伤等多种疾病导致的肠屏障功能障碍亦具有一定的防治作用.
早期予以NAC对大鼠重症急性胰腺炎相关肠损伤具有一定的保护作用, 其机制除与NAC可降低血浆促炎细胞因子TNF-α、IL-1β的水平, 同时增加抗炎细胞因子IL-10的作用外, 还与其对小肠组织细胞间粘附分子1的调节有关.
NAC可以减轻大鼠SAP相关肠损伤的分子机制,以期为SAP相关肠损伤的治疗寻找一条新途径, 为临床上SAP的综合治疗提供实验依据和新思路.
本文对抗氧化剂NAC在大鼠SAP相关肠损伤中保护作用的机制进行了探讨, 拓展了NAC的作用, 另外对临床上应该早期重视肠道屏障功能的防护具有一定的提示作用.
编辑: 田滢 电编: 鲁亚静
| 3. | Jha RK, Ma Q, Lei Z, Sha H. Resveratrol ameliorates the deleterious effect of severe acute pancreatitis. Cell Biochem Biophys. 2012;62:397-402. [PubMed] [DOI] |
| 4. | Zhang XP, Zhang J, Song QL, Chen HQ. Mechanism of acute pancreatitis complicated with injury of intestinal mucosa barrier. J Zhejiang Univ Sci B. 2007;8:888-895. [PubMed] |
| 6. | 王 映珍, 王 世文, 李 培杰, 党 登峰, 孙 志江, 王 先坤, 徐 庆杰. 胰岛素样生长因子-Ⅰ对重症急性胰腺炎大鼠小肠黏膜上皮细胞bax和bcl-2 mRNA表达的影响. 世界华人消化杂志. 2008;16:1396-1401. [DOI] |
| 7. | Werner J, Hartwig W, Hackert T, Kaiser H, Schmidt J, Gebhard MM, Büchler MW, Klar E. Multidrug strategies are effective in the treatment of severe experimental pancreatitis. Surgery. 2012;151:372-381. [PubMed] [DOI] |
| 8. | Oz S, Okay E, Karadenizli A, Cekmen MB, Ozdogan HK. N-acetylcysteine improves intestinal barrier in partially hepatectomized rats. ANZ J Surg. 2007;77:173-176. [PubMed] |
| 9. | Johnson ST, Bigam DL, Emara M, Slack G, Jewell LD, Obaid L, Korbutt G, Van Aerde J, Cheung PY. Effects of N-acetylcysteine on intestinal reoxygenation injury in hypoxic newborn piglets resuscitated with 100% oxygen. Neonatology. 2009;96:162-170. [PubMed] [DOI] |
| 10. | Takatsuka S, Morita T, Horikiri Y, Yamahara H, Saji H. Absorption enhancement of poorly absorbed hydrophilic compounds from various mucosal sites by combination of mucolytic agent and non-ionic surfactant. Int J Pharm. 2007;338:87-93. [PubMed] |
| 11. | Nguyen-Khac E, Thevenot T, Piquet MA, Benferhat S, Goria O, Chatelain D, Tramier B, Dewaele F, Ghrib S, Rudler M. Glucocorticoids plus N-acetylcysteine in severe alcoholic hepatitis. N Engl J Med. 2011;365:1781-1789. [PubMed] [DOI] |
| 12. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] |
| 15. | Ancha HR, Kurella RR, McKimmey CC, Lightfoot S, Harty RF. Effects of N-acetylcysteine plus mesalamine on prostaglandin synthesis and nitric oxide generation in TNBS-induced colitis in rats. Dig Dis Sci. 2009;54:758-766. [PubMed] [DOI] |
| 16. | Tayman C, Tonbul A, Kosus A, Hirfanoglu IM, Uysal S, Haltas H, Tatli MM, Andiran F. N-acetylcysteine may prevent severe intestinal damage in necrotizing enterocolitis. J Pediatr Surg. 2012;47:540-550. [PubMed] [DOI] |
| 17. | Hou Y, Wang L, Zhang W, Yang Z, Ding B, Zhu H, Liu Y, Qiu Y, Yin Y, Wu G. Protective effects of N-acetylcysteine on intestinal functions of piglets challenged with lipopolysaccharide. Amino Acids. 2012;43:1233-1242. [PubMed] [DOI] |
| 18. | Sevillano S, de la Mano AM, Manso MA, Orfao A, De Dios I. N-acetylcysteine prevents intra-acinar oxygen free radical production in pancreatic duct obstruction-induced acute pancreatitis. Biochim Biophys Acta. 2003;1639:177-184. [PubMed] |