修回日期: 2013-04-01
接受日期: 2013-04-12
在线出版日期: 2013-05-08
目的: 探讨甘丙肽受体在肝星状细胞(hepatic stellate cell, HSC)中表达和对细胞增殖的影响.
方法: 使用胶原酶原位灌注法分离大鼠原代HSC体外培养, 半定量RT-PCR法检测静止期(0 wk)和培养活化(1 wk)HSC中甘丙肽及其3种受体(GalR1、GalR2和GalR3)表达变化. 大鼠HSC-T6细胞株体外培养, 免疫荧光法检测GalR2蛋白在HSC-T6细胞中表达; 给或不给GalR2中和抗体(5 μg/mL), MTT法观察不同浓度甘丙肽(0-10000 nmol/L)干预后甘丙肽对HSC增殖和活力的影响.
结果: 成功分离大鼠原代HSC和体外培养. 静止期及活化的HSC均可检测到甘丙肽及GalR3 mRNA表达, 但无GalR1 mRNA表达, 而GalR2 mRNA在活化HSC中表达. 细胞免疫荧光法进一步证实GalR2蛋白在HSC-T6中表达. 甘丙肽处理时, HSC-T6增殖水平在1、10、100和1000 nmol/L甘丙肽时分别下降至对照组的86.7%(t = 3.976, P = 0.028)、83.1%(t = 4.45, P = 0.012)、78.1% (t = 5.75, P = 0.006)和73.1%(t = 5.38, P = 0.008); 给予GalR2中和抗体联合干预时, HSC-T6增殖抑制在甘丙肽1和10 nmol/L时即降至相应对照组67.9%(t = 5.11, P = 0.015)和73.1%(t = 6.56, P = 0.003), 与相应浓度甘丙肽组相比, 分别下降21.7%(t = 3.35, P = 0.028)和12.6%(t = 2.78, P = 0.049).
结论: HSC活化时新表达GalR2拮抗GalR1介导的甘丙肽对HSC增殖抑制作用.
核心提示: 通过研究甘丙肽及其3种受体在不同活化状态下在肝星状细胞(hepatic stellate cell, HSC)中的表达情况以及比较不同受体对HSC增殖活性的影响, 为甘丙肽在HSC生物学功能调控中的作用提供了实验基础, 且为甘丙肽在肝纤维化中的重要作用研究提供实验依据.
引文著录: 丁永年, 李郑红, 徐雷鸣, 熊静平, 陈源文, 范建高. 活化大鼠肝星状细胞新表达甘丙肽2型受体拮抗甘丙肽增殖抑制作用. 世界华人消化杂志 2013; 21(13): 1205-1210
Revised: April 1, 2013
Accepted: April 12, 2013
Published online: May 8, 2013
AIM: To investigate the expression of galanin receptors in hepatic stellate cells (HSCs) and their role in HSC proliferation.
METHODS: HSCs were isolated from rats by in situ liver perfusion with collagenase and pronase E and cultured for 1 wk. Cells were then harvested and the mRNA expression of galanin and its three receptors (GalR1, GalR2 and GalR3) was determined by semi-quantitative RT-PCR. HSC-T6, an immortalized and activated rat liver stellate cell line, was cultured in vitro to confirm the presence of GalR2 protein by immunocytofluorescence. Cultured HSC-T6 cells were then treated with galanin at concentrations from 0 to 10000 nmol/L for 24 h, in the presence or absence of a GalR2 neutralization antibody (5 μg/mL). Cell proliferation was assessed by MTT assay.
RESULTS: Galanin mRNA and GalR3 mRNA were expressed by both quiescent and activated HSCs. GalR2 mRNA was undetectable in quiescent HSCs but was markedly expressed by activated HSCs. GalR1 mRNA was not detected in either quiescent or activated HSCs. The presence of GalR2 protein in activated HSC was further confirmed by immunocytofluorescence in HSC-T6 cells. Treatment with galanin at a concentration of 1, 10, 100 or 1000 nmol/L resulted in a reduction of cell proliferation to 86.7% (t = 3.976, P = 0.028), 83.1% (t = 4.45, P = 0.012), 78.1% (t = 5.75, P = 0.006) and 73.1% (t = 5.38, P= 0.008) of that of controls. Complete GalR2 neutralization enhanced the inhibitory effect of galanin, and the proliferation of cells treated with 1 or 10 nmol/L of galanin was reduced to 67.9% (t = 5.11, P = 0.015) and 73.1% (t = 6.56, P = 0.003) of that of controls. There was a further reduction of 21.7% (t = 3.35, P = 0.028) and 12.6% (t = 2.78, P = 0.049) compared with the corresponding galanin-treated group.
CONCLUSION: Newly expressed GalR2 counteracts GalR1-mediated inhibitory effect of galanin on the proliferation of activated HSCs.
- Citation: Ding YN, Li ZH, Xu LM, Xiong JP, Chen YW, Fan JG. Newly expressed galanin type 2 receptor suppresses proliferation of activated hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2013; 21(13): 1205-1210
- URL: https://www.wjgnet.com/1009-3079/full/v21/i13/1205.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i13.1205
肝纤维化是慢性肝病发展至肝硬化的必由病理阶段, 其基本特征为过量细胞外基质沉积于肝脏[1]. 虽然肝纤维化时产纤维细胞来源目前存在一些争议, 但大多数研究认为由肝窦内静止期肝星状细胞(hepatic stellate cell, HSC)活化转化而来的肌成纤维母细胞样(myofibroblast-like)细胞, 是肝纤维化时细胞外基质的主要来源[2], 调控HSC功能是治疗肝纤维化关键靶点[1,3]. HSC功能受细胞因子调控, 其中瘦素起重要的促纤维化作用. 瘦素作用于活化HSC, 促进HSC增殖并抑制其凋亡[4]、促进肝内转化生长因子-β1表达、减少基质金属蛋白酶1形成抑制细胞外基质(extracellular matrix, ECM)降解和上调促炎症因子等, 导致肝纤维化进展[4,5].
甘丙肽是瘦素的内源性生理拮抗因子. 甘丙肽由29个氨基酸残基组成, 目前已经克隆出3种甘丙肽受体(galanin receptor, GalR), 分别是GalR1, GalR2和GalR3[6]. 甘丙肽及其受体在哺乳动物组织中分布广泛, 作用多样, 包括参与学习记忆、能量代谢、摄食活动和抑制胰岛素释放[7]、炎症反应调控[8]、细胞增殖与凋亡[9]等. 甘丙肽的许多能量代谢相关生物学功能与瘦素相互拮抗[10,11], 其分泌水平还存在负反馈调控[12,13].
甘丙肽在肝纤维化发生发展过程中的作用迄今未见报道, 也未见甘丙肽及其受体在HSC中的表达情况和功能的研究报道. 为此, 本研究将通过分离大鼠原代静止期HSC和大鼠HSC-T6细胞株, 初步观察甘丙肽及其受体在HSC中的表达情况和对其增殖作用的影响, 为甘丙肽与肝纤维化关系研究提供细胞学基础.
♂, SD大鼠6只, 购自中国科学院上海实验动物中心, 体质量300-350 g, 饲养于新华医院实验动物中心.
链酶蛋白酶(pronase E)、DNA酶Ⅰ、Ⅳ型胶原酶和Nycodenz为Sigma公司产品; 甘丙肽(C141H211N43O41)(产品批号114547-31-8)购自Sigma公司; TRIzol购自Invitrogen公司; PrimeScript RT reagent kit购自TaKaRa宝生物; 山羊抗大鼠GalR2单克隆抗体购自Abcam公司; Dulbecco's Modified Eagle's Medium(DMEM)购自Gibco公司; 胎牛血清购自Gibco公司; 四甲基偶氮唑蓝[3-(3,5-dimethylthazol-2-y)-2,5-diphenyl tetrazolium bromide, MTT]为Sigma公司产品.
1.2.1 细胞培养: 原代HSC分离与培养HSC分离方式、纯度及活力鉴定参见先前报道[14]. 新分离HSC纯度和细胞活力均>90%. 新分离HSC冻存于液氮或培养于6孔板细胞1 wk后用于抽提总RNA.
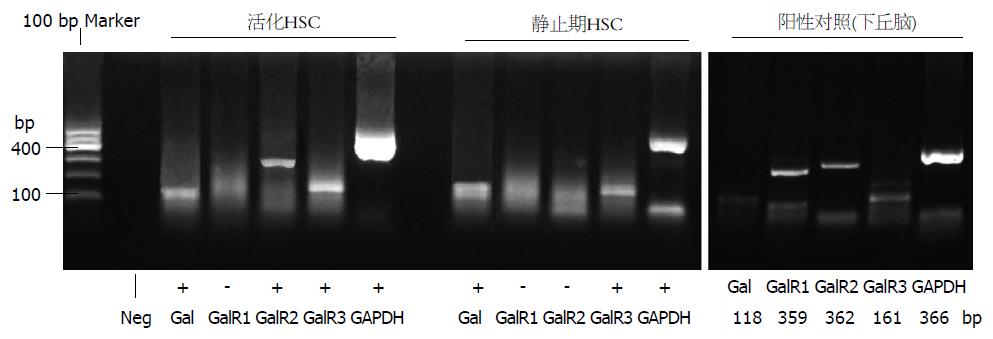
1.2.2 RT-PCR检测甘丙肽及其受体表达: 采用TRIzol抽提细胞总RNA, 用Takara公司RT-PCR试剂盒, 参照说明书对总RNA进行扩增. Galanin引物序列: 上游5'-TACCCCTGCCTGAGAGCAAT-3'; 下游5'-TCTTCTGAGGAGGTGGCCAA-3', 扩增片段长度为118 bp. GalR1引物序列: 上游5'-TGCTTTTGCTATGCCAAGGTTC-3'; 下游5'-TCGGTTCTTTTCTTTAGCATCGC-3', 扩增片段长度为359 bp. GalR2引物序列: 上游5'-TTCTGCCTCTGTTGGATGCC-3'; 下游5'-TCTACTCGAGGCTGTGCAGTTG-3', 扩增片段长度为362 bp. GalR3引物序列: 上游5'-AGCCAAGCAGTACCACAGAT-3'; 下游5'-GGTGAGGTAGATGAGCAGAT-3', 扩增片段长度为161 bp. 内参GAPDH引物序列: 上游 5'-CATGGTCTACACGTIECAGT-3'; 下游 5'- GGCAAGCAGTI'GGTGGTGC-3', 扩增片段长度为366 bp. 退火温度分别为: 61 ℃、61 ℃、58 ℃、62 ℃、58 ℃, 扩增40循环后用1.2%琼脂糖凝胶电泳, 并以Bio-rad成像系统成像.
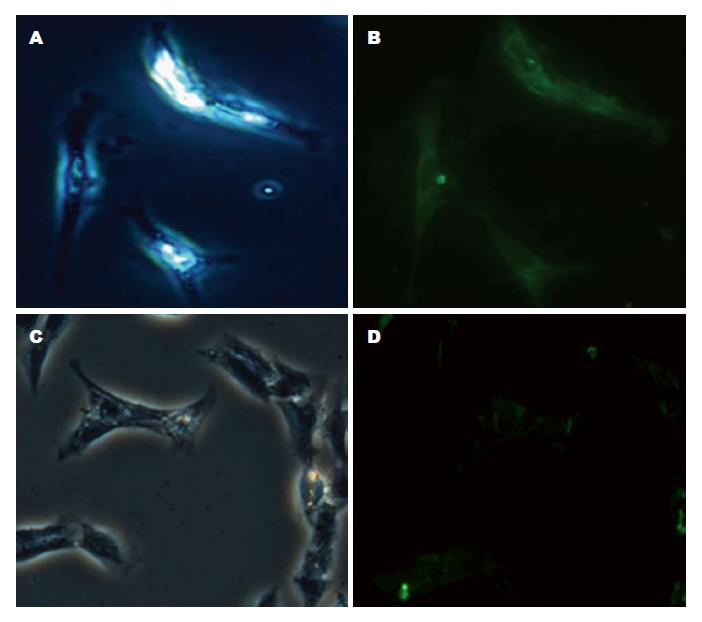
1.2.3 细胞免疫荧光法检测GalR2表达: 取培养皿中HSC-T6细胞爬片, 4%多聚甲醛固定, 山羊血清封闭后, GalR2一抗(1:50)4 ℃过夜, 以FITC标记二抗37 ℃孵育2h, 荧光显微镜成像, 阳性细胞为绿色荧光. 另设不加一抗的平行阴性对照.
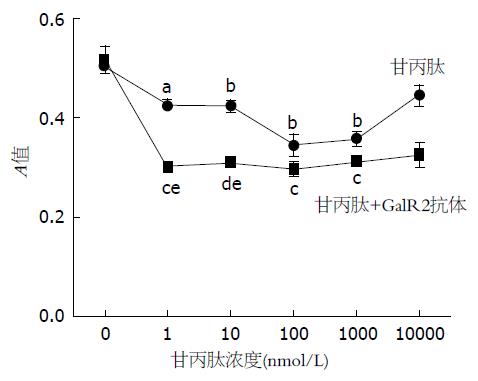
1.2.4 MTT法检测甘丙肽及GalR2对HSC-T6细胞增殖的影响: HSC-T6细胞株培养于96孔板细胞(2000个/孔)24 h. 甘丙肽处理组每孔加入甘丙肽工作液至终浓度为0、1、10、100、1000和10000 nmol/L; 甘丙肽抗体组除加入上述浓度甘丙肽外, 另加5 μg/mL的GalR2抗体, 并确保为先加入抗体, 再加入甘丙肽; 对照组加入甘丙肽溶媒PBS. 培养基为10%胎牛血清DMEM, 各组3复孔. 作用24 h后, 向每孔加入MTT原液(质量浓度5g/L)20 μL, 继续孵育4 h后, 小心去除培养基, 然后每空加入二甲基亚砜200 μL, 震荡裂解10 min, 二甲基亚砜空白对照调零, 酶标测试仪测定A值, 测定波长为492 nm, 参考波长为620 nm, A =A492-A620. 实验重复3次.
统计学处理 采用SAS6.0统计学软件进行分析, 计量资料用mean±SD表示, 组间比较采用t检验, P<0.05为差别有统计学意义.
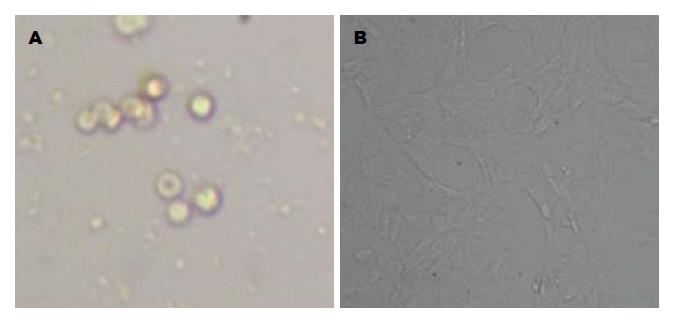
新分离获得的HSC, 台盼蓝染色显示活细胞约95%, 细胞小而圆(图1A). 培养24 h后, 细胞开始贴壁. 培养7 d时细胞膜状伸展, 活化为肌成纤维母细胞样细胞(图1B).
RT-PCR结果显示, 在静止期及培养7 d(活化期)HSC中均可检测到甘丙肽及GalR3 mRNA表达, 但均无GalR1表达. 活化HSC中有显著GalR2 mRNA表达, 但并不见于静止期HSC中(图2).
免疫荧光细胞化学法结果显示, GalR2在HSC-T6细胞株胞膜及胞浆中呈高表达, 荧光显微镜下可见明显特异性绿色荧光, 而阴性对照组无特异性荧光(图3).
不同浓度甘丙肽干预HSC-T6 24 h后, 当甘丙肽终浓度为10、 100和1000 nmol/L时, A值与空白对照组相比有统计学差异(P<0.05), 且甘丙肽终浓度为100 nmol/L时, A值降到最低, 其余浓度甘丙肽对HSC-T6增殖无明显影响. 与单纯甘丙肽处理组相比, GalR2抗体中和组A值明显降低, 在1-10 mmol/L时差别有统计学意义(P<0.05, 图4).
本实验利用原代HSC分离培养和大鼠HSC-T6细胞系, 证实静止期和活化HSC均表达甘丙肽及GalR3受体. 更重要的是, 活化HSC新表达GalR2. 新表达GalR2可能拮抗甘丙肽通过GalR1受体介导的HSC增殖抑制作用. 因此, HSC活化过程中, 可通过改变甘丙肽受体表达类型, 改变甘丙肽对其生物学效应.
虽然在能量代谢上甘丙肽生物学功能与瘦素关系密切, 但是目前甘丙肽与瘦素在肝内生物学功能认识水平差距巨大. 瘦素在肝纤维化进展中起重要作用. 瘦素作用于活化HSC, 可促进HSC增殖并抑制其凋亡[4,5,15]; 瘦素还促进肝内转化生长因子-β1、血小板衍生因生长因子等细胞因子的表达; 减少基质金属蛋白酶1形成和促细胞外基质沉积; 并能上调促炎症因子和促血管因子, 促进肝纤维化进展[4,5,15]. 然而, 甘丙肽在肝内作用的认识目前仅限于其参与糖原等能量代谢调控的交感神经肽功能, 甘丙肽在肝脏多种疾病(脂肪肝、肝纤维化、急性肝损伤等)发生发展过程中作用迄今鲜有报道[16].
为明确甘丙肽及其受体是否直接参与调控肝纤维化发生发展, 首先需要了解甘丙肽受体是否在HSC中表达, 因为HSC活化增殖是肝纤维化发生的中心环节, 而受体表达是甘丙肽作用的物理基础. 本实验利用原代分离的静止期HSC、体外培养活化HSC和永生化大鼠活化HSC细胞系HSC-T6, 发现甘丙肽及GalR3在静止期和活化HSC中均持续表达, 而GalR2在HSC活化后全新表达. GalR2的表达变化在mRNA和蛋白水平均得到了证实. 我们的发现与Waters等[17]的研究结果相似, 他们在正常肝组织及静止期HSC中检测到GalR3 mRNA的表达; 而我们曾经报道在肝组织中检测到GalR3和甘丙肽表达, 且在脂肪性肝炎阶段才出现GalR2表达[16]. 目前研究未能明确HSC新表达GalR2的分子机制, 我们推测这可能是HSC活化时一系列基因表达改变的一部分, 其意义与功能, 值得深入研究.
甘丙肽不同受体存在生物学功能差异在其他研究中已有报道. 不同甘丙肽受体序列上的差异对于其偶联不同的G蛋白和下游信号系统至关重要. 在神经元细胞中, GalR2不仅可与Gq/11蛋白偶联, 引起细胞内Ca2+浓度升高, 及Cl-依赖的Ca2+通道开放, 也可以与Gi/o蛋白偶联, 抑制腺苷酸环化酶活性[18]; 而GalR3可与Gi/o蛋白偶联, 抑制腺苷酸环化酶而激活与其共表达的内向整流钾通道, 从而对情绪、摄食、代谢和垂体激素释放等生理过程起调节作用[19]. 颈肿瘤细胞中GalR2介导细胞增殖抑制而非GalR1[6]. Tofighi等[9]在嗜铬细胞瘤PC12细胞株中发现, 甘丙肽通过GalR2抑制细胞增殖、介导细胞凋亡, 该机制与Gq/11 G-蛋白转导通路有关. 因此, 在HSC活化增殖过程中, 甘丙肽与其受体结合后可能正是通过Gq/11或Gi/o蛋白信号转导通路, 激活和/或抑制肌醇磷脂转化率, 对某些关键基因进行磷酸化/去磷酸化调控, 发挥其调控HSC增殖的作用.
甘丙肽、GalR2和GalR3在HSC中表达, 为甘丙肽对HSC功能研究提供了坚实的结构基础. 本研究发现实验浓度(10-1000 nmol/L)甘丙肽不同程度抑制HSC-T6增殖, 其中以100和1000 nmol/L作用最为明显. 这种作用是增殖抑制而非甘丙肽细胞毒作用, 因为实验中未发现细胞出现明显的核固缩和悬浮, 且MTT法也证实甘丙肽在100 nmol/L抑制作用达到最大, 而后随着浓度的升高, 抑制作用不但没有加强反而有所降低. GalR2中和抗体抑制GalR2时, 活化HSC中GalR3的被甘丙肽单独激活表现为更加显著的增殖抑制, 即使在低浓度甘丙肽(1 nmol/L)中亦如此. 这提示在HSC活化后, 新表达的GalR2使甘丙肽通过GalR3介导的对HSC的增殖抑制作用显著减弱. 这是活化HSC功能转化的又一重要特征, 其生物学意义尚待更深入研究.
总之, 本实验初步证实甘丙肽及其GalR3存在于HSC中, 且在HSC活化过程中新表达GalR2, 影响HSC对甘丙肽的生物学反应. 新表达GalR2的重要生物学意义需要更深入研究, 特别是其与HSC活化、增殖、抗凋亡和分泌等的关系, 使甘丙肽可能成为预防及治疗肝纤维化的新靶点.
肝星状细胞(hepatic stellate cell, HSC)活化是肝纤维化的中心环节, 瘦素促进HSC的促纤化功能, 而甘丙肽是瘦素的内源性生理拮抗因子, 许多能量代谢相关生物学功能与瘦素相互拮抗, 但是甘丙肽是否也影响HSC功能参与肝纤维化的发病目前未见报道.
金山, 主任医师, 内蒙古医学院附属医院普通外科
HSC活化过程中功能调控机制的研究是肝纤维化防治研究的热点.
甘丙肽及其受体在脂肪性肝病中的表达动态变化, 但其与肝损伤修复的关系目前尚不明确. 除能量代谢平衡调控外, 也发现瘦素与甘丙肽在脂肪细胞中与细胞增殖密切相关, 因此肝星状细胞是否与瘦素一样, 表达甘丙肽受体并产生生物学功能值得探讨.
抑制甘丙肽2型受体, 将有效提高甘丙肽对活化HSC的增殖抑制效应, 恢复活化HSC对甘丙肽的正常生物学功能. 甘丙肽2型受体抑制剂可能有重要抗肝纤维化作用.
本文探讨了甘丙肽及其受体在大鼠原代HSC中的表达以及对细胞增殖的影响, 具有重要的基础研究意义.
编辑: 黄新珍 电编: 鲁亚静
| 1. | Kocabayoglu P, Friedman SL. Cellular basis of hepatic fibrosis and its role in inflammation and cancer. Front Biosci (Schol Ed). 2013;5:217-230. [PubMed] |
| 2. | Brenner DA, Kisseleva T, Scholten D, Paik YH, Iwaisako K, Inokuchi S, Schnabl B, Seki E, De Minicis S, Oesterreicher C. Origin of myofibroblasts in liver fibrosis. Fibrogenesis Tissue Repair. 2012;5:S17. [PubMed] [DOI] |
| 3. | Li J, Ghazwani M, Zhang Y, Lu J, Li J, Fan J, Gandhi CR, Li S. miR-122 regulates collagen production via targeting hepatic stellate cells and suppressing P4HA1 expression. J Hepatol. 2013;58:522-528. [PubMed] [DOI] |
| 4. | Wang J, Leclercq I, Brymora JM, Xu N, Ramezani-Moghadam M, London RM, Brigstock D, George J. Kupffer cells mediate leptin-induced liver fibrosis. Gastroenterology. 2009;137:713-723. [PubMed] [DOI] |
| 5. | Marra F, Navari N, Vivoli E, Galastri S, Provenzano A. Modulation of liver fibrosis by adipokines. Dig Dis. 2011;29:371-376. [PubMed] [DOI] |
| 6. | Kanazawa T, Misawa K, Carey TE. Galanin receptor subtypes 1 and 2 as therapeutic targets in head and neck squamous cell carcinoma. Expert Opin Ther Targets. 2010;14:289-302. [PubMed] |
| 7. | Poritsanos NJ, Mizuno TM, Lautatzis ME, Vrontakis M. Chronic increase of circulating galanin levels induces obesity and marked alterations in lipid metabolism similar to metabolic syndrome. Int J Obes (Lond). 2009;33:1381-1389. [PubMed] [DOI] |
| 8. | Lang R, Kofler B. The galanin peptide family in inflammation. Neuropeptides. 2011;45:1-8. [PubMed] [DOI] |
| 9. | Tofighi R, Joseph B, Xia S, Xu ZQ, Hamberger B, Hökfelt T, Ceccatelli S. Galanin decreases proliferation of PC12 cells and induces apoptosis via its subtype 2 receptor (GalR2). Proc Natl Acad Sci USA. 2008;105:2717-2722. [PubMed] [DOI] |
| 10. | Barrachina MD, Martínez V, Wei JY, Taché Y. Leptin-induced decrease in food intake is not associated with changes in gastric emptying in lean mice. Am J Physiol. 1997;272:R1007-R1011. [PubMed] |
| 11. | Yuan CS, Dey L, Xie JT, Aung HH. Gastric effects of galanin and its interaction with leptin on brainstem neuronal activity. J Pharmacol Exp Ther. 2002;301:488-493. [PubMed] |
| 12. | Karatayev O, Baylan J, Leibowitz SF. Increased intake of ethanol and dietary fat in galanin overexpressing mice. Alcohol. 2009;43:571-580. [PubMed] [DOI] |
| 13. | Li RY, Song HD, Shi WJ, Hu SM, Yang YS, Tang JF, Chen MD, Chen JL. Galanin inhibits leptin expression and secretion in rat adipose tissue and 3T3-L1 adipocytes. J Mol Endocrinol. 2004;33:11-19. [PubMed] |
| 14. | Chen YW, Liu BW, Zhang YJ, Chen YW, Dong GF, Ding XD, Xu LM, Pat B, Fan JG, Li DG. Preservation of basal AcSDKP attenuates carbon tetrachloride-induced fibrosis in the rat liver. J Hepatol. 2010;53:528-536. [PubMed] |
| 15. | Yang YY, Huang YT, Tsai TH, Hou MC, Lee FY, Lee SD, Lin HC. Kupffer cell depletion attenuates leptin-mediated methoxamine-stimulated portal perfusion pressure and thromboxane A2 release in a rodent model of NASH-cirrhosis. Clin Sci (Lond). 2012;123:669-680. [PubMed] [DOI] |
| 16. | 李 郑红, 段 晓燕, 陈 源文, 徐 雷鸣, 丁 永年, 范 建高. 甘丙肽在高脂饮食诱导脂肪性肝病大鼠循环中动态变化. 胃肠病学和肝病学杂志. 2012;5:458-461. |
| 17. | Waters SM, Krause JE. Distribution of galanin-1, -2 and -3 receptor messenger RNAs in central and peripheral rat tissues. Neuroscience. 2000;95:265-271. [PubMed] |
| 18. | Kolakowski LF, O'Neill GP, Howard AD, Broussard SR, Sullivan KA, Feighner SD, Sawzdargo M, Nguyen T, Kargman S, Shiao LL. Molecular characterization and expression of cloned human galanin receptors GALR2 and GALR3. J Neurochem. 1998;71:2239-2251. [PubMed] |
| 19. | Smith KE, Walker MW, Artymyshyn R, Bard J, Borowsky B, Tamm JA, Yao WJ, Vaysse PJ, Branchek TA, Gerald C. Cloned human and rat galanin GALR3 receptors. Pharmacology and activation of G-protein inwardly rectifying K+ channels. J Biol Chem. 1998;273:23321-23326. [PubMed] |