修回日期: 2013-03-15
接受日期: 2013-04-17
在线出版日期: 2013-05-08
目的: 观察溃疡性结肠炎(ulcerative colitis, UC)大鼠脾脏组织Delta阿片受体、β-arrestin1、Bcl-2 mRNA和蛋白表达及乌梅丸的干预作用, 旨在研究乌梅丸治疗结肠炎的机制.
方法: 56只SD大鼠随机分成空白对照组、结肠炎模型组、美沙拉嗪组、乌梅丸组(每组14只). 除空白对照组外, 其他3组均应用2,4,6-三硝基苯磺酸灌肠. 模型建成2 d后, 空白对照组和结肠炎模型组分别以蒸馏水3 mL/只灌胃, 美莎拉嗪组用美莎拉嗪混悬液(浓度50 g/L)、乌梅丸组用乌梅丸液(浓度0.51 g/L)以3 mL/只灌胃, 连续给药15 d后取脾脏组织, 应用Real time-PCR检测Delta阿片受体、β-arrestin1、Bcl-2 mRNA的表达, 应用Western blot技术检测Delta阿片受体、β-arrestin1、Bcl-2蛋白的表达.
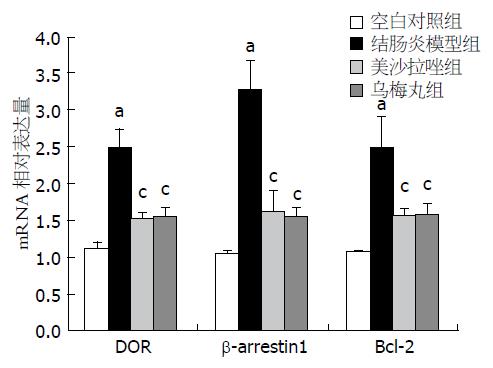
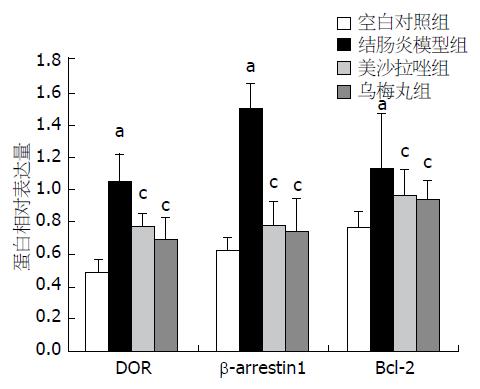
结果: 空白对照组Delta阿片受体、β-arrestin1及Bcl-2 mRNA的相对表达分别为1.11±0.10、1.05±0.06及1.06±0.04; 蛋白的相对表达分别为0.48±0.08、0.62±0.07及0.76±0.10. 结肠炎模型组Delta阿片受体、β-arrestin1及Bcl-2的mRNA的相对表达分别为2.50±0.25、3.27±0.41及2.48±0.43; 蛋白的相对表达分别为1.04±0.17、1.50±0.15及1.26±0.20. 美沙拉嗪组Delta阿片受体、β-arrestin1及Bcl-2 mRNA的相对表达分别为1.52±0.09、1.63±0.27及1.56±0.09; 蛋白的相对表达分别为0.68±0.17、0.77±0.15及0.96±0.16. 乌梅丸组Delta阿片受体、β-arrestin1及Bcl-2 mRNA的相对表达分别为1.54±0.13、1.54±0.14及1.57±0.15; 蛋白的相对表达分别为0.68±0.14、0.74±0.19及0.93±0.11. 与空白对照组相比, 结肠炎模型组Delta阿片受体、β-arrestin1、Bcl-2 mRNA和蛋白表达显著升高(P<0.05); 与结肠炎模型组相比, 乌梅丸组、美沙拉嗪组Delta阿片受体、β-arrestin1、Bcl-2 mRNA和蛋白表达显著下降(P<0.05), 且乌梅丸组和美沙拉嗪组Delta阿片受体、β-arrestin1、Bcl-2 mRNA和蛋白表达均无显著差异(P>0.05).
结论: 乌梅丸下调UC大鼠脾脏组织Delta阿片受体、β-arrestin1、Bcl-2 mRNA和蛋白表达发挥治疗结肠炎的作用.
核心提示: 乌梅丸下调溃疡性结肠炎(ulcerative colitis)大鼠脾脏组织Delta阿片受体、β-arrestin1、Bcl-2的mRNA和蛋白表达发挥治疗结肠炎的作用.
引文著录: 柯琴梅, 吴霁, 范恒. Delta阿片受体、β-arrestin1、Bcl-2在溃疡性结肠炎大鼠脾脏组织中的表达及乌梅丸的干预作用. 世界华人消化杂志 2013; 21(13): 1164-1170
Revised: March 15, 2013
Accepted: April 17, 2013
Published online: May 8, 2013
AIM: To investigate the effect of Wumeiwan treatment on the expression of delta-opioid receptor, β-arrestin 1 and Bcl-2 in the spleen tissue of rats with ulcerative colitis.
METHODS: Fifty-six SD rats were randomly devided into a control group, a colitis model group, a mesalazine group and a Wumeiwan group (14 rats in each group). Ulcerative colitis was induced in rats with 2, 4, 6-trinitrobenzenesulfonic acid. Two days after induction of ulcerative colitis, the control group and colitis model group were administered intragastrically with normal saline, while the mesalazine group and Wumeiwan group were intragastrically given mesalazine (50 g/L) and Wumeiwan (0.51 g/L), respectively. All rats were treated for 15 d. Spleen tissue samples were taken to detect the mRNA and protein expression of delta-opioid receptor, β-arrestin 1 and Bcl-2 by quantitative RT-PCR and Western blot.
RESULTS: The relative expression levels of delta-opioid receptor, β-arrestin 1 and Bcl-2 mRNAs and proteins were significantly higher in the colitis model group than in the control group (mRNA: 2.50 ± 0.25 vs 1.11 ± 0.10, 3.27 ± 0.41 vs 1.05 ± 0.06, 2.48 ± 0.43 vs 1.06 ± 0.04; all P < 0.05; protein: 1.04 ± 0.17 vs 0.48 ± 0.08, 1.50 ± 0.15 vs 0.62 ± 0.07, 1.26 ± 0.20 vs 0.76 ± 0.10; all P < 0.05). Treatment with Wumeiwan (mRNAs: 1.54 ± 0.13, 1.54 ± 0.14, 1.57 ± 0.15; proteins: 0.68 ± 0.14, 0.74 ± 0.19 and 0.93 ± 0.11) and mesalazine (mRNAs: 1.52 ± 0.09, 1.63 ± 0.27 and 1.56 ± 0.09; proteins: 0.68 ± 0.17, 0.77 ± 0.15 and 0.96 ± 0.16) significantly decreased the expression of delta-opioid receptor, β-arrestin1 and Bcl-2 mRNAs and proteins compared to the colitis model group (all P < 0.05). There was no significant difference in the expression of these mRNAs and proteins between the Wumeiwan group and the mesalazine group (all P > 0.05).
CONCLUSION: Wumeiwan treatment attenuates ulcerative colitis possibly by significantly decreasing the mRNA and protein expression of delta-opioid receptor, β-arrestin 1 and Bcl-2 in the spleen tissue of rats with ulcerative colitis.
- Citation: Ke QM, Wu J, Fan H. Wumeiwan treatment alters the expression of delta-opioid receptor, β-arrestin 1 and Bcl-2 in the spleen tissue of rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2013; 21(13): 1164-1170
- URL: https://www.wjgnet.com/1009-3079/full/v21/i13/1164.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i13.1164
溃疡性结肠炎(ulcerative colitis, UC)是炎症性肠病的一种, 其发病机制未完全明确. 目前认为是遗传、感染、环境、免疫等多个因素相互作用的结果. UC是Th2型免疫反应, 其产生的细胞因子主要是白介素(interleukin, IL-4)、IL-5、IL-13、转化生长因子-β(transforming growth factor-β, TGF-β)等[1]. 正常情况时, 机体通过T淋巴细胞活化增殖去除细菌、病毒等抗原, 而通过细胞凋亡抑制T细胞过度活化与增殖, 最终使免疫系统处于一种适合机体生存的平衡状态. 若T细胞凋亡失衡, 就会使体内T细胞过度活化与增殖, 并分泌炎性因子导致局部组织损伤. 因此T细胞的凋亡抑制是UC的重要因素.
Delta-阿片受体(delta-opioid receptor, DOR)是G蛋白偶联受体(G-protein coupled receptor, GPCR)的一种, 在免疫系统和神经系统广泛表达. 研究表明DOR通过β-arrestin1影响CD4+ T细胞的生存和凋亡[2,3]. β-arrestin1氨基酸末端都有一个β-折叠和一个α-螺旋, 在机体广泛表达, 参与多种信号通路, 对幼稚CD4+ T细胞和活化CD4+ T细胞的凋亡抑制基因Bcl-2的表达起关键性的调节作用[3], 在抗凋亡通路中起重要作用[4]. 廖奕等[5]研究表明氧化苦参碱可下调结肠组织β-arrestin1, 抑制Delta阿片受体-β-arrestin1-Bcl-2信号转导通路, 治疗TNBS诱导的实验性大鼠结肠炎. 众多临床观察研究[6-8]表明乌梅丸治疗UC患者有显著疗效. 范恒等研究表明乌梅丸可下调结肠组织β2AR、β-arrestin2、核转录因子(nuclear factor κB, NF-κB)p65的表达, 减少肠道炎症因子肿瘤坏死因子-a(tumor necrosis factor a, TNF-a)、IL-6、IL-8和IL-10释放, 减轻肠道炎症损伤[9-11]. 既往研究均关注乌梅丸对结肠组织炎症因子及相关蛋白的影响, 而对作为T细胞居住的场所及细胞免疫应答的重要场所的脾脏组织的炎症因子及相关蛋白有何影响, 相关研究尚未见报道. 因此本研究小组对此进行了系统研究.
本研究通过建立UC大鼠模型, 观察乌梅丸对UC大鼠脾脏组织DOR、β-arrestin1、Bcl-2 mRNA和蛋白表达影响, 旨在研究乌梅丸治疗结肠炎的机制.
♂SD大鼠56只, SPF级, 体质量250 g±20 g, 由华中科技大学同济医学院动物中心提供, 实验动物质量合格证为SCXK(鄂)2004-0007,使用许可证为SYXK(鄂)2004-0028; 5% 2,4,6-三硝基苯磺酸(TNBS)购自美国Sigma公司; TRIzol购自Invitrogen公司; RNA提取试剂盒DP430、cDNA第一链合成试剂盒KR104-02以及RNase抑制剂DP418购自天根; 引物合成于金斯瑞; SYBR Green PCR Master Mix(2X) #K0242购自Fermentas; 实时荧光定量PCR仪ABI7500. 引物由Primer6.0软件设计, 每对引物序列如下: DOR引物上游: 5'-agaccgccaccaacatctac-3', 下游5'-gaagtccagggctttgacag-3', 扩增片段长度为236 bp, 退火温度为55 ℃; β-arrestin1引物上游: 5'-ctcaagcatgaggacacgaa-3', 下游5'-ttaggcttggggtgcattag-3', 扩增片段长度为194 bp, 退火温度为54 ℃; Bcl-2引物上游: 5'-ggtggtggaggaactcttca-3', 下游: 5'-atgccggttcaggtactcag-3', 扩增片段长度为157 bp, 火温度为53 ℃; 内参β-actin引物上游: 5'-gtccctcaccctcccaaaag-3', 下游: 5'gctgcctcaacacctcaaccc-3', 扩增片段长度为265 bp, 退火温度55.7 ℃. RIPA裂解液(强)、BCA蛋白浓度测定试剂盒购自碧云天; PVDF膜购自Millipore; 相关一抗购自Bioworld; 二抗购自博士德; ECL底物液购自Thermo; 电泳槽、Millipore电转仪购自北京六一. 美沙拉嗪(0.5 g×10袋/盒, 法国爱的发制药集团). 乌梅丸组成药物及剂量如下: 乌梅16 g、细辛6 g、干姜10 g、黄连16 g、当归49 g、附子69 g、蜀椒49 g、桂枝69 g、生晒参6 g、黄柏6 g, 组方中各味生药均购自武汉协和医院, 按传统方法配制成含生药浓度为0.51 g/mL的水煎剂.
1.2.1 分组: 将56只大鼠随机分成空白对照组、结肠炎模型组、美沙拉嗪组、乌梅丸组, 每组14只, 各组体质量比较差异无统计学意义(P>0.05). 在湿度为50%-70%、温度为20 ℃动物房内饲养.
1.2.2 模型建立及药物干预: 依据Morris等[12]与廖奕等[5]及Fan等[9,13]提出的方法进行造模, 具体操作如下: 除空白对照组外, 其他组大鼠均在禁食不禁饮24 h后, 给予2,4,6-三硝基苯磺酸灌肠. 首先用10%的水合氯醛以3 mL/kg腹腔注射麻醉后, 将内径2 mm的橡胶导尿管缓缓插入大鼠肛门约8 cm, 将抽取好的50%的乙醇溶液注入0.25 mL后继续注入5% 2,4,6-三硝基苯磺酸液0.3 mL, 使药液缓慢进入肠道, 将大鼠提尾倒置30 s. 然后让大鼠平躺, 待其清醒后自由饮食, 自由进水. 模型建成后, 观察各组大鼠精神状态, 大便颜色、形状、皮毛等变化. 2 d后, 美沙拉嗪组每天用美沙拉嗪悬浊3 mL/只灌胃; 乌梅丸组每天用乌梅丸药液3 mL/只灌胃; 空白对照组和结肠炎模型组每天用蒸馏水3 mL/只灌胃, 1次/d, 连续灌胃15 d. 每组大鼠死亡4只, 因此每组实验大鼠最后各剩10只. 第16天每只大鼠禁食不禁水24 h后处死, 取大鼠的脾脏, 每个脾脏分为2份, 装于EP管中, 用液氮冰冻保存. 取4组大鼠中有明显病变的结肠组织石蜡包埋切片并HE染色, 镜下观察4组大鼠结肠组织病理学改变.
1.2.3 RT-PCR方法检测结肠炎大鼠脾脏组织DOR、β-arrestin1、Bcl-2的mRNA表达: 按RNA提取试剂盒DP430的方法提取脾脏组织的RNA, 并用分光光度计测量RNA的浓度, 取5 μL模板RNA、Oligo(dT)15(10 μmol/L)2 μL、ddH2O(Rnase free)6 μL混匀后放入PCR仪中, 70 ℃ 5 min, 立即置于冰上1 min, 然后瞬时离心并加入以下试剂: 5×RT buffer 4 μL、HRP(RRI)/RNase Inhibitor 0.5 μL、M-MLV 0.5 μL、dNTP(2.5 mmol/L)2 μL, 总体积为20 μL的反应体系. 逆转录条件: 42 ℃ 30 min, 99 ℃ 5 min, 4 ℃ 5 min. 各对引物序列见前. 扩增条件: 95 ℃ 60 s预变性, 进入PCR循环95 ℃ 15 s, 58 ℃ 15 s, 72 ℃ 45 s, 40个循环, 以β-actin为内参, 对DOR、β-arrestin1、Bcl-2的产物相对定量, 读取Ct值, 使用2-∆∆Ct方法进行相对定量分析.
1.2.4 Western blot检测脾脏标本中DOR、β-arrestin1、Bcl-2的蛋白表达: 取适量(250-500 mg)脾脏组织, 剪碎加1 mL RIPA裂解液(强), 匀浆抽提总蛋白, 并按BCA蛋白质定量试剂盒操作说明操作, 测定各组蛋白浓度. 各样品取70 μg总蛋白上样电泳, 根据蛋白分子量配制不同浓度的PAGE胶电泳, β-arrestin1和DOR用10%的PAGE胶; Bcl-2用12%PAGE胶电泳, 根据预染Marker的显示, 判断目的蛋白得到充分分离后, 停止电泳. 取出凝胶根据Marker切下目的条带, 用蒸馏水冲洗, 剪与PAGE凝胶相同大小的PVDF膜和滤纸, PVDF膜用甲醇浸泡数秒后和滤纸一同浸泡于电转缓冲液中. 按照黑色板-纤维垫-滤纸-凝胶-PVDF膜-滤纸-纤维垫-白色板依次放好, 夹紧板后放入转膜仪内, 黑色板的一面对照黑色负极. 转膜条件: β-arrestin1、DOR 200 mA, 120 min; Bcl-2 200 mA, 80 min. 用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜, 室温摇床封闭2 h. 一抗: 用封闭液稀释相应的一抗, 使PVDF膜浸泡于一抗孵育液中, 4 ℃孵育过夜. DOR 1:500稀释, β-arrestin1 1:700稀释, Bcl-2与GAPDH 1:1000稀释. 二抗: TBST充分洗涤PVDF膜5-6次, 5 min/次用封闭液稀释羊抗兔二抗 1:10000稀释, 使PVDF膜浸泡于二抗孵育液中, 室温摇床孵育2 h. 显色曝光: TBST充分洗涤PVDF膜5-6次. 结果采用光密度扫描灰度值分析.
统计学处理 所有数据采用mean±SD表示, 应用国际标准统计软件SPSS17.0统计分析, 多组间两两比较采用SNK-q检验, P<0.05为差异具有统计学意义.
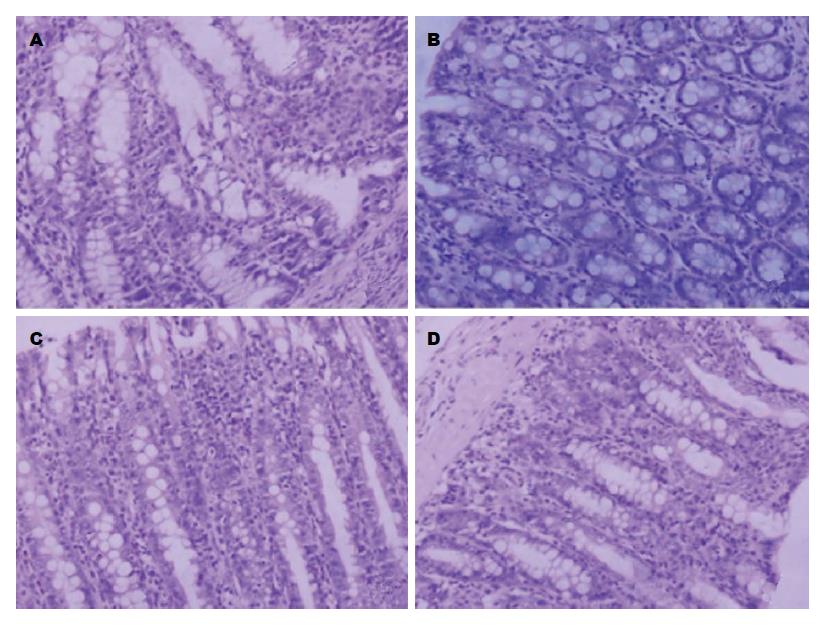
结肠炎模型组中固有层和黏膜层内可见弥漫性中性粒细胞、淋巴细胞、浆细胞浸润, 结肠黏膜腺体排列紊乱, 杯状细胞减少. 正常结肠组织黏膜和固有层结构完整, 腺体排列较整齐. 乌梅丸组和美沙拉嗪组淋巴细胞等炎性细胞浸润较模型组减轻, 黏膜及固有层结构相对完整, 杯状细胞较模型组多, 腺体排列相对整齐(图1).
各组大鼠脾脏组织中DOR、β-arrestin1、Bcl-2 mRNA的表达详见表1和图2. 与空白对照组相比, 结肠炎模型组DOR、β-arrestin1、Bcl-2 mRNA表达均升高, 差异均有统计学意义(P<0.05); 与结肠炎模型组相比, 乌梅丸组、美沙拉嗪组DOR、β-arrestin1、Bcl-2 mRNA表达下降, 差异均有统计学意义(P<0.05), 但乌梅丸组和美沙拉嗪组DOR、β-arrestin1、Bcl-2 mRNA表达差异均无统计学意义(P>0.05).
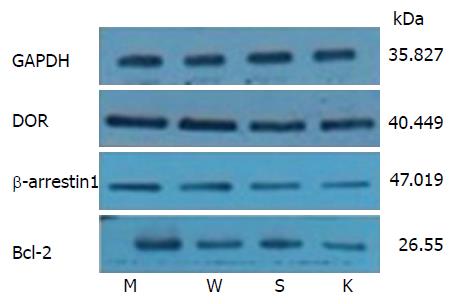
各组大鼠脾脏组织中DOR、β-arrestin1、Bcl-2蛋白的表达情况详见表2、图3及图4. 与空白对照组相比, 结肠炎模型组DOR、β-arrestin1、Bcl-2的蛋白表达均升高, 差异均有统计学意义(P<0.05); 与结肠炎模型组相比, 乌梅丸组、美沙拉嗪组DOR、β-arrestin1、Bcl-2的蛋白表达量下降, 差异均有统计学意义(P<0.05), 但乌梅丸组和美沙拉嗪组DOR、β-arrestin1、Bcl-2的蛋白表达差异均无统计学意义(P>0.05).
目前认为UC发病机制可能是易感患者肠道内环境改变导致体内T细胞的异常活化, 分泌大量的炎性细胞因子, 介导肠道的损伤[14,15]. 正常情况时, 机体通过细胞凋亡抑制T细胞的过度增殖和活化, 使肠黏膜免疫系统处于适应机体生存的平衡状态[16]. 若T细胞凋亡抑制失衡, 体内T细胞将过度活化与增殖, 并分泌炎性因子导致局部组织损伤. 脾脏是免疫细胞特别是T细胞的居住场所, 同时也是细胞免疫应答的重要场所[17], 脾脏组织T细胞数目及功能与机体免疫反应呈正相关[18,19]. 因此脾脏组织T细胞的凋亡抑制是UC发生的重要机制.
乌梅丸由乌梅、细辛、干姜、黄连、当归、附子、蜀椒、桂枝、党参、黄柏组成. 乌梅丸出自仲景《伤寒论•厥阴病篇》, 方中以乌梅酸敛收固, 附子、干姜、桂枝扶阳以胜寒, 蜀椒、细辛通阳以破阴, 附子、干姜、蜀椒、桂枝、细辛, 辛热以助其阳, 温以祛寒; 黄连、黄柏之苦寒以坚其阴, 清以泻热, 党参、当归益气养血, 诸药合用, 使寒热邪去, 阴阳协调, 气血恢复. 全方酸收熄风, 辛热助阳, 酸苦坚阴, 寒热温凉, 温清敛补, 攻补兼施, 诸药配伍, 调理阴阳寒热虚实, 使之归复于平和. 郭洪波、谢微杳等[6,7,20,21]临床观察研究, 乌梅丸治疗UC患者有显著疗效. 对于乌梅丸治疗UC的机制, 既往已有研究多关注乌梅丸对结肠组织而非脾脏组织的炎症因子及相关蛋白的影响[8-11]. 本研究主要针对作为T细胞居住的场所及细胞免疫应答的重要场所的脾脏组织, 研究乌梅丸治疗对其炎症因子及相关蛋白表达的影响究. 美沙拉嗪是柳氮磺胺吡啶的一种, 常用于UC的治疗, 可抑制前列腺素的合成和炎性介质白三烯的形成, 显著抑制肠黏膜的炎症反应, 本研究中用来作为乌梅丸治疗的阳性对照. 本研究结果发现乌梅丸组与美沙拉嗪组较结肠炎模型组结肠黏膜及固有层结构相对完整, 腺体排列相对整齐, 杯状细胞多, 炎性细胞浸润较结肠炎模型组减轻, 表明乌梅丸与美沙拉嗪对UC有较好的治疗作用.
阿片受体可在某些神经细胞高表达, 也可在中性粒细胞、单核细胞、巨噬细胞和T细胞上低表达, 其表达水平在调节一些生物学功能如快速诱导MAPK活化和细胞驱药性有重要意义[22]. 当配体与细胞膜上DOR结合后, G蛋白α亚基与GDP的亲和力降低而解离, 与GTP的亲和力增加而结合, 使异源三聚体G蛋白解离为Gα和Gβγ, 激活G蛋白, 介导信号传导通路, 传递生物学信息[23,24]. HEK293细胞膜上DOR受刺激后, 使细胞质β-arrestin1转移至细胞核, 募集乙酰化酶p300富集启动子(p27和c-fos等)区域, 启动子结合的组蛋白乙酰化增强, 导致相应的基因转录[25]. T细胞受体受刺激后, 可引起其免疫突触的脂筏(lipid raft)结构中的cAMP水平增高, 增加PKA(蛋白激酶A)活化, 使Csk(一种羧基端Src激酶)的S364位点磷酸化, 激活Csk, 使Lck(淋巴细胞特异性蛋白酪氨酸激酶)磷酸化并失活, 阻碍TCR的ξ磷酸化, 抑制T细胞的活性, 这种反馈性抑制作用使T细胞不能完全活化. T细胞的TCR/CD28共刺激信号被激活后, 使细胞质内β-arrestin募集到TCR上, 然后再通过两种途径使cAMP水平降低: (1)使Gs从活化的TCR上解偶联, 降低腺苷酸环化酶活性, 从而降低cAMP水平; (2)将PDE4(磷酸二酯酶4)募集到细胞膜的脂筏结构中, 使cAMP降解. cAMP水平降低, 可以下调抑制T细胞活化的cAMP-PKA-Csk抑制性信号, 完全活化T细胞, 使Csk移动到胞质中, 信号进一步传导[26-28]. TCR/CD28共刺激信号活化T细胞后, 可激活TrkA/IP3/Akt/NF-κB信号通路, 诱导T细胞表达更多的DOR[29].
DOR是G蛋白偶联受体的一种, 主要在神经系统和免疫细胞(如中性粒细胞、单核细胞、巨噬细胞、T细胞等)表达. 活化的DOR能诱导β-arrestin1从T细胞浆内转移至细胞核内. β-arrestin1属于Arrestin家族, 有细胞质功能和细胞核功能. β-arrestin1在细胞质参与GPCR的内化和脱敏, 使GPCR信号通路终止; β-arrestin1在细胞核介导某些基因的转录. β-arrestin1在机体广泛表达, 可作为脚手架蛋白与连接分子(比如磷脂类和β-衔接蛋白)连接, 参与多种信号通路, 在抗凋亡通路中起重要作用. 细胞核内的β-arrestin 1可募集组蛋白乙酰化酶p300至Bcl-2基因的启动子, 使编码基因Bcl-2的启动子序列区域组蛋白H4乙酰化作用增强, 导致Bcl-2基因转录, 促进抗凋亡蛋白Bcl-2表达[2,3,19]. Bcl-2表达增加, Bcl-2/BAX比例升高, 抗凋亡信号相对增强, 抑制细胞质线粒体释放细胞色素C和半胱天冬酶(caspase)[30]活化过程, 从而抑制CD4+ T细胞凋亡. T细胞数量增加, 分泌更多的炎性细胞因子, 介导肠道的炎症反应.
本研究结果显示结肠炎模型组DOR、β-arrestin1、Bcl-2 mRNA和蛋白表达较空白对照组显著升高; 乌梅丸组及美沙拉嗪组DOR、β-arrestin1、Bcl-2 mRNA和蛋白表达较结肠炎模型组显著下降, 且乌梅丸组和美沙拉嗪组DOR、β-arrestin1、Bcl-2 mRNA和蛋白表达均无明显差异. 提示乌梅丸下调UC大鼠脾脏组织DOR、β-arrestin1、Bcl-2 mRNA和蛋白表达, 使T细胞凋亡的抑制减弱, T细胞数量减少, 炎症反应减轻, 从而缓解UC的症状, 发挥治疗结肠炎的作用.
总之, 乌梅丸可能通过下调UC大鼠脾脏组织Delta阿片受体、β-arrestin1、Bcl-2 mRNA和蛋白的表达量, 使T细胞凋亡的抑制减弱, 即促使T细胞凋亡, 从而改善UC的临床症状.
溃疡性结肠炎(ulcerative colitis, UC)是一种以肠道免疫功能紊乱为主的慢性非特异性炎症性肠道疾病. 近20年来我国发病率呈逐年增加. 其发病是遗传、环境和免疫因素相互作用的结果, 其中免疫功能紊乱起关键性作用, 在遗传和环境因素的双重作用下, 机体对肠道菌群产生异常免疫反应, 最终导致肠道慢性炎症的发生, 但其确切的发病原因和机制还不明确, 治疗上也比较棘手. 因此对本病的发病机制和治疗上的研究显得十分必要.
刘凤斌, 教授, 广州中医药大学第一附属医院消化内科; 唐文富, 副教授, 四川大学华西医院中西医结合科
UC的发病机制与免疫异常有关, T细胞凋亡抑制失衡, 体内T细胞将过度活化与增殖, 并分泌炎性因子导致局部组织损伤. 脾脏组织T细胞的凋亡抑制是UC发生的重要机制. 脾脏组织T细胞Delta阿片受体-b-arrestin1-Bcl-2信号转导通路, 可能是UC发生发展的关键点, 对其进行研究为临床上开展中药治疗UC提供理论依据.
本课题组用乌梅丸治疗UC取得良好的临床效果. 氧化苦参碱可下调结肠组织β-arrestin1, 抑制Delta阿片受体-β-arrestin1-Bcl-2信号转导通路, 治疗TNBS诱导的实验性大鼠结肠炎.
本文通过研究大鼠结肠和脾脏中DOR、β-arrestin1、Bcl-2的表达来阐明溃疡性结肠炎的发病机制, 检测指标和UC密切相关, 为乌梅丸治疗UC提供理论依据和研究思路.
本文研究发现乌梅丸和美沙拉秦均可以有效治疗UC, 特别是中药乌梅丸具有较好的治疗作用, 药物安全, 疗效理想, 有一定临床应用前景.
本文选题新颖, 实验设计较严谨, 讨论较充分, 有一定科学意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Shih DQ, Targan SR. Immunopathogenesis of inflammatory bowel disease. World J Gastroenterol. 2008;14:390-400. [PubMed] |
| 3. | Shi Y, Feng Y, Kang J, Liu C, Li Z, Li D, Cao W, Qiu J, Guo Z, Bi E. Critical regulation of CD4+ T cell survival and autoimmunity by beta-arrestin 1. Nat Immunol. 2007;8:817-824. [PubMed] [DOI] |
| 4. | Povsic TJ, Kohout TA, Lefkowitz RJ. Beta-arrestin1 mediates insulin-like growth factor 1 (IGF-1) activation of phosphatidylinositol 3-kinase (PI3K) and anti-apoptosis. J Biol Chem. 2003;278:51334-51339. [PubMed] [DOI] |
| 9. | Fan H, Shen L, Tang Q, Xiong P, Shou Z, Liao Y, Liang L, Chen X. Effect of Wumeiwan on cytokines TNF-alpha, IL-6, IL-8, IL-10 and expression of NF-kappaBp65 in rats with ulcerative colitis. J Huazhong Univ Sci Technolog Med Sci. 2009;29:650-654. [PubMed] [DOI] |
| 10. | 梁 丽, 范 恒, 段 雪云. β2AR、β-arrestin2、NF-κB p65在溃疡性结肠炎大鼠中的表达及乌梅丸的干预作用. 世界华人消化杂志. 2010;18:1650-1655. [DOI] |
| 12. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 13. | Fan H, Qiu MY, Mei JJ, Shen GX, Liu SL, Chen R. Effects of four regulating-intestine prescriptions on pathology and ultrastructure of colon tissue in rats with ulcerative colitis. World J Gastroenterol. 2005;11:4800-4806. [PubMed] |
| 14. | Sartor RB. Mechanisms of disease: pathogenesis of Crohn's disease and ulcerative colitis. Nat Clin Pract Gastroenterol Hepatol. 2006;3:390-407. [PubMed] [DOI] |
| 15. | Maynard CL, Weaver CT. Intestinal effector T cells in health and disease. Immunity. 2009;31:389-400. [PubMed] [DOI] |
| 16. | Zhang SZ, Zhao XH, Zhang DC. Cellular and molecular immunopathogenesis of ulcerative colitis. Cell Mol Immunol. 2006;3:35-40. [PubMed] |
| 17. | Velásquez-Lopera MM, Correa LA, García LF. Human spleen contains different subsets of dendritic cells and regulatory T lymphocytes. Clin Exp Immunol. 2008;154:107-114. [PubMed] [DOI] |
| 18. | Neurath MF, Finotto S, Glimcher LH. The role of Th1/Th2 polarization in mucosal immunity. Nat Med. 2002;8:567-573. [PubMed] [DOI] |
| 19. | Strober W, Fuss IJ, Blumberg RS. The immunology of mucosal models of inflammation. Annu Rev Immunol. 2002;20:495-549. [PubMed] [DOI] |
| 22. | Bohn LM, Belcheva MM, Coscia CJ. Mitogenic signaling via endogenous kappa-opioid receptors in C6 glioma cells: evidence for the involvement of protein kinase C and the mitogen-activated protein kinase signaling cascade. J Neurochem. 2000;74:564-573. [PubMed] [DOI] |
| 23. | Rajagopal S, Rajagopal K, Lefkowitz RJ. Teaching old receptors new tricks: biasing seven-transmembrane receptors. Nat Rev Drug Discov. 2010;9:373-386. [PubMed] [DOI] |
| 24. | Musnier A, Blanchot B, Reiter E, Crépieux P. GPCR signalling to the translation machinery. Cell Signal. 2010;22:707-716. [PubMed] [DOI] |
| 25. | Kang J, Shi Y, Xiang B, Qu B, Su W, Zhu M, Zhang M, Bao G, Wang F, Zhang X. A nuclear function of beta-arrestin1 in GPCR signaling: regulation of histone acetylation and gene transcription. Cell. 2005;123:833-847. [PubMed] [DOI] |
| 26. | Abrahamsen H, Baillie G, Ngai J, Vang T, Nika K, Ruppelt A, Mustelin T, Zaccolo M, Houslay M, Taskén K. TCR- and CD28-mediated recruitment of phosphodiesterase 4 to lipid rafts potentiates TCR signaling. J Immunol. 2004;173:4847-4858. [PubMed] |
| 27. | Nguyen K, Miller BC. CD28 costimulation induces delta opioid receptor expression during anti-CD3 activation of T cells. J Immunol. 2002;168:4440-4445. [PubMed] |
| 28. | Taskén K, Stokka AJ. The molecular machinery for cAMP-dependent immunomodulation in T-cells. Biochem Soc Trans. 2006;34:476-479. [PubMed] [DOI] |
| 29. | Chen YL, Law PY, Loh HH. Sustained activation of phosphatidylinositol 3-kinase/Akt/nuclear factor kappaB signaling mediates G protein-coupled delta-opioid receptor gene expression. J Biol Chem. 2006;281:3067-3074. [PubMed] [DOI] |
| 30. | Shi Q, Hou Y, Yang Y, Bai G. Protective effects of glycyrrhizin against β₂-adrenergic receptor agonist-induced receptor internalization and cell apoptosis. Biol Pharm Bull. 2011;34:609-617. [PubMed] |