修回日期: 2013-03-06
接受日期: 2013-04-07
在线出版日期: 2013-04-28
目的: 观察二甲双胍、吡格列酮对非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)大鼠肝脏细胞色素P4502E1(CYP2E1)的影响.
方法: SD大鼠随机分为正常对照组(普通饲料喂养)、非酒精性脂肪肝组(高脂饮食喂养)、二甲双胍干预组[高脂饮食喂养加二甲双胍500 mg/(kg•d)灌胃]、吡格列酮干预组[高脂饮食喂养加吡格列酮15 mg/(kg•d)]. 饲养12 wk
末处死大鼠, 检测血清丙氨酸氨基转移酶(aspartate aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、碱性磷酸酶(bioactive alkaline phosphatase, ALP)活性、总胆固醇(total cholesterol, TC)、甘油三酯(total glyceride, TG)、游离脂肪酸(floating free acid, FFA)含量; 测量空腹血糖(fasting blood-sugar, FBG)及胰岛素(level and insulin, FINS), 计算胰岛素抵抗指数(insulin resistance index, HOMA-IR); 采用HE染色及Masson染色(显示胶原纤维), 观察肝脏病理形态学的改变; 采用RT-qPCR和免疫组织化学法分别检测肝脏中CYP2E1 mRNA及蛋白的表达.
结果: 与非酒精性脂肪肝组相比, 二甲双胍干预组的ALT(79.86 U/L±10.40 U/L vs 143.80 U/L±26.34 U/L)、AST(221.30 U/L±34.21 U/L vs 358.76±97.20 U/L)、ALP(153.32 U/L±24.20 U/L vs 207.47 U/L±35.39 U/L)、TC(1.70 mmol/L±0.34 mmol/L vs 2.76 mmol/L±0.28 mmol/L)、TG(3.96 mmol/L±0.23 mmol/L vs 5.67 mmol/L±0.54 mmol/L)、FFA(493.19 μmol/L±38.89 μmol/L vs 654.40 μmol/L±71.74 μmol/L)以及FBG(5.47 mmol/L±0.42 mmol/L vs 8.05 mmol/L±0.48 mmol/L)、FINS(20.89 mU/L±3.12 mU/L vs 27.51 mU/L±4.02 mU/L)、HOMA-IR(5.08±1.20 vs 9.84±2.11)均明显降低(P<0.05), 吡格列酮干预组的ALT(84.73 U/L±9.18 U/L vs 143.80 U/L±26.34 U/L)、AST(235.23 U/L±33.62 U/L vs 358.76 U/L±97.20 U/L)、ALP(160.02 U/L±25.32 U/L vs 207.47 U/L±35.39 U/L)、TC(1.68 mmol/L±0.26 mmol/L vs 2.76 mmol/L±0.28 mmol/L)、TG(3.60 mmol/L±0.30 mmol/L vs 5.67 mmol/L±0.54 mmol/L)、FFA(495.21 μmol/L±43.67 μmol/L vs 654.40 μmol/L±71.74 μmol/L)以及FBG(5.32 mmol/L±0.37 mmol/L vs 8.05 mmol/L±0.48 mmol/L)、FINS(21.01 mU/L±2.86 mU/L vs 27.51 mU/L±4.02 mU/L)、HOMA-IR(4.97±0.97 vs 9.84±2.11)均明显降低(P<0.05), 肝脏脂肪变性及纤维化程度均明显改善, CYP2E1 mRNA及蛋白的表达明显降低(P<0.05), 且两干预组间差异无统计学意义(P>0.05).
结论: 二甲双胍、吡格列酮均通过降低CYP2E1的表达, 预防NAFLD的发生.
核心提示: 二甲双胍、吡格列酮均可通过降低CYP2E1的表达, 预防非酒精性脂肪性肝病(non-alcoholic fatty liver disease)的发生.
引文著录: 赵东强, 张松筠, 于红艳, 马俊骥, 魏红, 刘红, 魏东敏, 康亚星, 周晓映. 二甲双胍、吡格列酮对非酒精性脂肪性肝病大鼠肝脏CYP2E1表达的影响. 世界华人消化杂志 2013; 21(12): 1102-1108
Revised: March 6, 2013
Accepted: April 7, 2013
Published online: April 28, 2013
AIM: To observe the preventive effects of metformin and pioglitazone on nonalcoholic fatty liver disease (NAFLD) and their influence on CYP2E1 expression in the liver.
METHODS: SD rats were randomly divided into four groups: normal control group (fed a normal diet), NAFLD group (fed a fat-rich diet), metformin group [fed a fat-rich diet and intragastrically given metformin 500 mg/(kg•d)], pioglitazone group [fed a fat-rich diet and intragastrically given pioglitazone 15 mg/(kg•d)]. The rats were killed at the end of 12 wk. The contents of alanine transferase (ALT), aspartate aminotransferase (AST), bioactive alkaline phosphatase (ALP), total cholesterol (TC), total glyceride (TG), and floating free acid (FFA) were determined. Fasting blood sugar (FBG) level and insulin (FINS) level were measured to calculate the insulin resistance index (HOMA-IR). HE staining and Masson staining were carried out to observe the pathological changes in the liver. The expression levels of CYP2E1 mRNA and protein in the liver were determined by RT-PCR and immunohistochemistry, respectively.
RESULTS: Compared to the NAFLD group, treatment with metformin significantly reduced the bioactivity of ALT (79.86 U/L ± 10.40 U/L vs 143.80 U/L ± 26.34 U/L), AST (221.30 U/L ± 34.21 U/L vs 358.76 U/L ± 97.20 U/L), and ALP (153.32 U/L ± 24.20 U/L vs 207.47 U/L ± 35.39 U/L), the contents of TC (1.70 mmol/L ± 0.34 mmol/L vs 2.76 mmol/L ± 0.28 mmol/L), TG (3.96 mmol/L ± 0.23 mmol/L vs 5.67 mmol/L ± 0.54 mmol/L), and FFA (493.19 μmol/L ± 38.89 μmol/L vs 654.40 μmol/L ± 71.74 μmol/L), FBG (5.47 mmol/L ± 0.42 mmol/L vs 8.05 mmol/L ± 0.48 mmol/L), FINS (20.89 mU/L ± 3.12 mU/L vs 27.51 mU/L ± 4.02 mU/L), and HOMA-IR (5.08 ± 1.20 vs 9.84 ± 2.11) (all P < 0.05); treatment with pioglitazone significantly reduced the bioactivity of ALT (84.73 U/L ± 9.18 U/L vs 143.80 U/L ± 26.34 U/L), AST (235.23 U/L ± 33.62 U/L vs 358.76 U/L ± 97.20 U/L), and ALP (160.02 U/L ± 25.32 U/L vs 207.47 U/L ± 35.39 U/L), the contents of TC (1.68 mmol/L ± 0.26 mmol/L vs 2.76 mmol/L ± 0.28 mmol/L), TG (3.60 mmol/L ± 0.30 mmol/L vs 5.67 mmol/L ± 0.54 mmol/L), and FFA (495.21 μmol/L ± 43.67 μmol/L vs 654.40 μmol/L ± 71.74 μmol/L), FBG (5.32 mmol/L ± 0.37 mmol/L vs 8.05 mmol/L ± 0.48 mmol/L), FINS (21.01 mU/L ± 2.86 mU/L vs 27.51 mU/L ± 4.02 mU/L), and HOMA-IR (4.97 ± 0.97 vs 9.84 ± 2.11) (all P < 0.05). Treatment with both metformin and pioglitazone ameliorated pathological changes in the liver and reduced the expression levels of CYP2E1 mRNA and protein in the liver (both P < 0.05). However, there were no significant differences in the above parameters between the two treatment groups (all P > 0.05).
CONCLUSION: Both metformin and pioglitazone can prevent the occurrence of NAFLD by reducing the expression of CYP2E1.
- Citation: Zhao DQ, Zhang SY, Yu HY, Ma JJ, Wei H, Liu H, Wei DM, Kang YX, Zhou XY. Metformin and pioglitazone reduce CYP2E1 expression in the liver of rats with nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2013; 21(12): 1102-1108
- URL: https://www.wjgnet.com/1009-3079/full/v21/i12/1102.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i12.1102
近年来, 肥胖、高血脂、代谢综合征、糖尿病患者越来越多, 由此引发的非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)发病率日益升高, 其发病机制尚未完全明确, 但目前普遍认为胰岛素抵抗参与其发生发展过程[1-4]. 二甲双胍和吡格列酮可从不同途径增加胰岛素敏感性, 改善胰岛素抵抗. 本实验以高脂饮食建立NAFLD大鼠模型, 观察CYP2E1在肝脏中的表达及二甲双胍、吡格列酮对NAFLD的预防作用.
♂SD大鼠40只, 清洁级, 体质量180 g±10 g, 购自河北医科大学动物实验中心, 许可证号: SCXK(冀)2008-1-003. 分笼喂养, 动物房内通风良好, 室温保持在18 ℃-25 ℃, 湿度40%-60%, 光照时间12 h/d. 盐酸二甲双胍片, 500 mg/片, 上海施贵宝公司生产; 盐酸吡格列酮片, 15 mg/片, 天津武田药品有限公司生产; 血清丙氨酸氨基转移酶(aspartate aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)试剂盒: 北京柏定生物工程有限公司; 碱性磷酸酶(bioactive alkaline phosphatase, ALP)试剂盒: 北京利德曼生化技术有限公司; 血糖测定采用葡萄糖氧化酶法; 胰岛素放免试剂盒购自北京福瑞生物工程公司; 总胆固醇(total Cholesterol, TC)、甘油三酯(total glyceride, TG)、游离脂肪酸(floating free acid, FFA)试剂盒购自南京建成生物工程研究所; CYP2E1多克隆抗体及DAB显色液购自武汉博士德公司; TRIzol试剂盒购自Invitrogen公司; TaKaRa RNA LA PCRTM Kit试剂盒购自日本TaKaRa有限公司.
1.2.1 动物模型建立与分组: 将大鼠随机分为: 正常对照组(NC组, n = 10), 普通饲料喂养12 wk; 非酒精性脂肪肝组(NF组, n = 10), 高脂饮食喂养12 wk, 高脂饮食配料包括: 80.5%基础饲料、2%高胆固醇、7%猪油、10%蛋黄粉及0.5%胆盐: 二甲双胍干预组(MN组, n = 10), 高脂饮食喂养同时加用二甲双胍500 mg/(kg•d)灌胃12 wk; 吡格列酮干预组(PN组, n = 10), 高脂饮食喂养同时加用吡格列酮15 mg/(kg•d)灌胃12 wk.
1.2.2 标本制备与保存: 饲养12 wk, 大鼠禁食12 h, 麻醉后下腔静脉取血, 分离血清, -70 ℃保存, 以检测血清学指标. 迅速取出肝脏, 称质量, 切取数块右叶肝组织保存于液氮内, 以提取蛋白及总RNA, 并取右叶肝组织固定于10%甲醛内, 用于病理学检查.
1.2.3 观察指标与检测方法: ALT、AST、ALP、TG、TC、FFA、空腹血糖均严格按照试剂说明书由自动生化仪进行测定, 胰岛素采用放射免疫法测定, 计算胰岛素抵抗指数(HOMA-IR = FBG×FINS/22.5)[5].
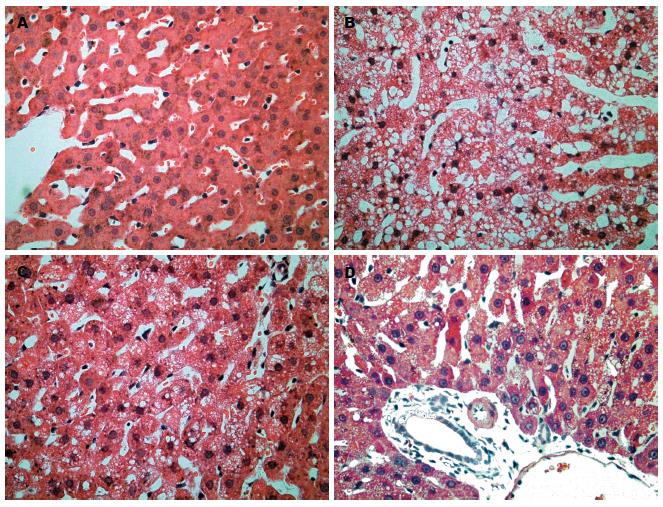
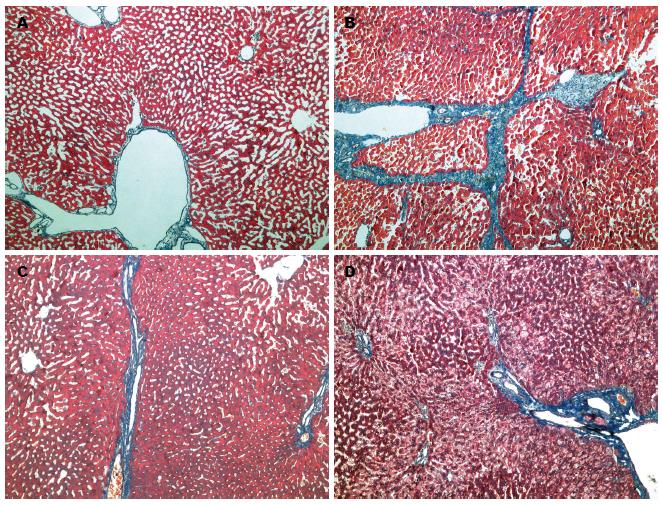
1.2.4 组织病理学观察: 将取出的肝组织浸泡在10%甲醛溶液内固定, 石蜡包埋, 切片, 行HE染色及Masson染色观察肝细胞脂肪变性程度、炎性活动度及肝纤维化的程度, 相关标准参照Musso等[6]提出的肝细胞脂肪变分级方法及2000年全国肝病会议通过的肝纤维化分期方法[7].
1.2.5 CYP2E1免疫组织化学的检测: 按照SP试剂盒操作说明进行, 石蜡切片常规脱蜡、水化, 置1 mmol/L Tris/EDTA缓冲液中进行微波抗原修复, 凉至室温; 30 g/L H2O2孵育10 min以消除内源性过氧化物酶活性, 滴加100 mL/L正常兔血清封闭非特异性抗原, 倾去血清, 滴加1:100稀释的CYP2E1一抗, 4 ℃放置过夜, PBS冲洗3 min×5 min, 滴加生物素化二抗, 37 ℃孵育10 min, PBS冲洗3 min×5 min; 滴加辣根过氧化物酶标记的卵白素工作液, 37 ℃孵育15 min; DAB显色, 苏木素复染, 脱水中性树脂封片.
1.2.6 CYP2E1 mRNA的测定: 提取肝组织标本总RNA, 依照试剂盒提供的说明书进行逆转录反应, PCR引物序列: 5'-CTCCTCGTCATATCCATCTG-3', 5'-GCAGCCAATCAGAAATG-3'. PCR反应条件: 94 ℃预变性5 min, 94 ℃变性30 s, 56 ℃退火l min, 72 ℃延伸l min, 25个循环, 最后72 ℃延伸8 min. 产物分析: PCR扩增产物10 μL加入1%琼脂凝胶中电泳, 紫外透视分光仪下观察结果并摄片, 用β-actin校正半定量, 凝胶图像分析系统测定各电泳带灰度值.
统计学处理 采用SPSS13.0进行数据统计, 统计结果用mean±SD表示, 计量资料采用单因素方差分析, 计数资料采用秩和检验, P<0.05为差异有统计学意义.
与正常对照组相比, 非酒精性脂肪肝组中FINS、HOMA-IR均有明显的上升趋势(P<0.05); 与非酒精性脂肪肝组相比, 二甲双胍干预组、吡格列酮干预组FINS、HOMA-IR均有明显的下降(P<0.05), 但后两组相比差异无统计学意义(表1).
与正常对照组相比, 非酒精性脂肪肝组ALT、AST、ALP 活性及TG、TC、FFA含量均有明显升高(P<0.05); 与非酒精性脂肪肝组相比, 二甲双胍干预组、吡格列酮干预组ALT、AST、ALP活性及TG、TC、FFA含量均有明显下降(P<0.05), 而后两组相比差异无统计学意义(表2, 3).
正常对照组HE染色可见正常肝小叶结构, 未见肝细胞脂肪变性或坏死及炎性细胞浸润; 非酒精性脂肪肝组HE染色后可见肝小叶结构紊乱或消失, 肝细胞肿大, 出现中重度脂肪变性; 二甲双胍干预组、吡格列酮干预组HE染色介于正常对照组与非酒精性脂肪肝组(图1).
正常对照组肝组织Masson染色可见正常的肝小叶结构, 窦周隙可见少量增生的胶原纤维; 非酒精性脂肪肝病组Masson染色可见肝小叶结构紊乱或消失、肝细胞坏死和纤维组织增生, 窦周隙纤维增生明显, 汇管区、肝小叶间、肝小叶中心可见粗条索状纤维组织. 二甲双胍干预组、吡格列酮干预组亦可见纤维组织增生, 程度较非酒精性脂肪肝病组明显减轻, 两干预组间无明显差异(图2).
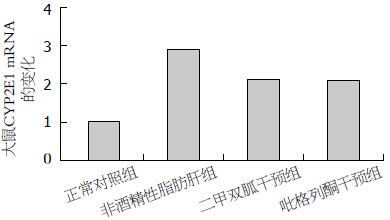
RT-PCR测定结果显示: 与正常对照组相比, 非酒精性脂肪肝组CYP2E1 mRNA表达量均有明显增多(P<0.05). 与非酒精性脂肪肝组相比, 二甲双胍干预组、吡格列酮干预组CYP2E1 mRNA表达量均有明显减少(P<0.05), 而后两组相比差异无统计学意义(P>0.05, 图3, 4).
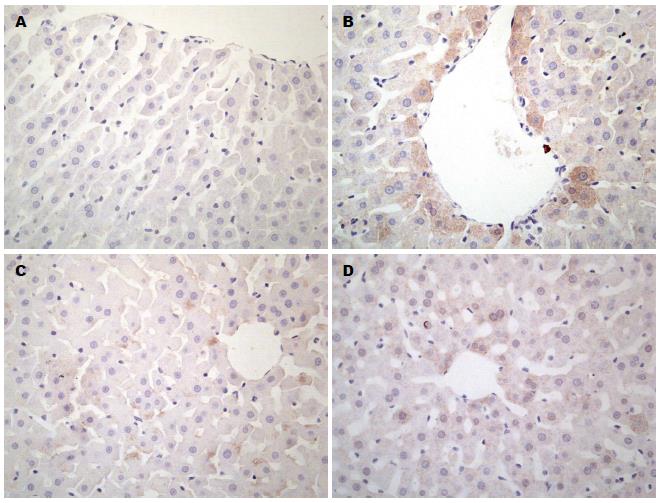
免疫组织化学染色法示: 正常对照组CYP2E1阳性细胞极少, 阳性率为0; 与正常对照组相比, 非酒精性脂肪肝组CYP2E1阳性细胞显著增加, 棕黄色颗粒主要分布于中央静脉周围, 与脂肪变一致(P<0.05). 与非酒精性脂肪肝组相比, 二甲双胍干预组、吡格列酮干预组CYP2E1阳性细胞明显减少(P<0.05), 后两组相比差异无统计学意义.
目前, NAFLD发病机制尚未完全明确, 但人们普遍接受Nagata等[8]提出的"二次打击学说". 初次打击为胰岛素抵抗导致的肝脏脂肪沉积, 肝细胞脂肪变性; 第二次打击为各种原因引起的氧化应激, 使肝细胞膜发生脂质过氧化损伤, 最终导致肝细胞坏死. CYP2E1是细胞色素P450的2E1亚型, 为微粒体混合功能氧化酶系中最重要的氧化酶, 参与肝脏的代谢与解毒, 高表达后可使肝细胞中氧化反应增强, 造成肝细胞膜脂质过氧化, 降低抗氧化系统的保护作用, 损伤肝细胞[9,10]. 研究发现NAFLD肝细胞中CYP2E1表达增多, 参与NAFLD的形成[11,12]. 机体处于胰岛素抵抗状态时, 胰岛素将会失去对CYP2E1的抑制作用, 使其含量增多, 活性增强, 导致氧化应激产物增多, 激活肝星状细胞, 出现肝纤维化[13,14]. 实验亦证实[15]: CYP2E1过度表达可导致氧化应激增强, 减少糖原储备, 促进葡萄糖的合成, 脂肪蓄积增多, 减少肝脏中胰岛素信号, 增强胰岛素抵抗, 加重肝脏损伤. 故在非酒精性脂肪性肝病中胰岛素抵抗和CYP2E1是相互独立又相互作用的两个因素.
二甲双胍及吡格列酮可分别通过不同的作用机制改善胰岛素敏感性, 减轻胰岛素抵抗. 本实验中, 我们以高脂饮食饲养大鼠, 同时应用二甲双胍及吡格列酮进行干预, 实验结果显示: 二甲双胍干预组及吡格列酮干预组大鼠肝脏病理改变较非酒精性脂肪肝组均减轻, 血清AST、ALT、ALP、TG、TC、FFA及胰岛素抵抗指数均低于非酒精性脂肪肝组. 非酒精性脂肪肝组CYP2E1的表达水平明显高于正常对照组, 而干预组CYP2E1表达水平均有明显的下降趋势, 但干预组间没有明显的区别, 提示二甲双胍、吡格列酮对非酒精性脂肪肝的预防作用相当, 其作用机制可能与调节CYP2E1的水平有关.
肥胖、高血脂、代谢综合征、糖尿病患者易并发非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD), 目前普遍认为胰岛素抵抗参与其发生发展过程. 二甲双胍和吡格列酮可从不同途径增加胰岛素敏感性, 改善胰岛素抵抗.
党双锁, 教授, 西安交通大学医学院第二附属医院感染科
NAFLD与代谢综合征有关, 但是其具体发病机制尚未完全明确, 因此探讨NAFLD发病机制及有效的防治措施是目前研究的热点和重点.
Day等提出了NAFLD发病的"二次打击学说". 初次打击为胰岛素抵抗导致肝脏脂肪沉积, 肝细胞脂肪变性; 第二次打击为各种原因引起的氧化应激, 使肝细胞膜发生脂质过氧化损伤, 伴随CYP2E1增加, 最终导致肝细胞坏死.
本文通过大鼠模型研究二甲双胍、吡格列酮对非酒精性脂肪肝的预防作用, 发现其作用机制可能与调节CYP2E1的水平有关.
认真分析临床非酒精性脂肪肝患者的实际情况, 可以建议其服用二甲双胍或吡格列酮防治脂肪肝病情的进展.
本文方案设计可行, 方法得当, 结果分析合理, 为临床应用二甲双胍、吡格列酮干预NAFLD的进展提供了实验依据.
编辑: 田滢 电编:闫晋利
| 1. | Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther. 2011;34:274-285. [PubMed] [DOI] |
| 2. | Bellentani S, Scaglioni F, Marino M, Bedogni G. Epidemiology of non-alcoholic fatty liver disease. Dig Dis. 2010;28:155-161. [PubMed] [DOI] |
| 4. | Bugianesi E, Moscatiello S, Ciaravella MF, Marchesini G. Insulin resistance in nonalcoholic fatty liver disease. Curr Pharm Des. 2010;16:1941-1951. [PubMed] [DOI] |
| 5. | Negami M, Takahashi E, Otsuka H, Moriyama K. Prediction of homeostasis model assessment of insulin resistance in Japanese subjects. Tokai J Exp Clin Med. 2012;37:102-106. [PubMed] |
| 6. | Musso G, Gambino R, Cassader M, Pagano G. A meta-analysis of randomized trials for the treatment of nonalcoholic fatty liver disease. Hepatology. 2010;52:79-104. [PubMed] [DOI] |
| 8. | Nagata K, Suzuki H, Sakaguchi S. Common pathogenic mechanism in development progression of liver injury caused by non-alcoholic or alcoholic steatohepatitis. J Toxicol Sci. 2007;32:453-468. [PubMed] [DOI] |
| 9. | Aroor AR, Roy LJ, Restrepo RJ, Mooney BP, Shukla SD. A proteomic analysis of liver after ethanol binge in chronically ethanol treated rats. Proteome Sci. 2012;10:29. [PubMed] [DOI] |
| 10. | Sakaguchi S, Takahashi S, Sasaki T, Kumagai T, Nagata K. Progression of alcoholic and non-alcoholic steatohepatitis: common metabolic aspects of innate immune system and oxidative stress. Drug Metab Pharmacokinet. 2011;26:30-46. [PubMed] [DOI] |
| 11. | Orellana M, Rodrigo R, Varela N, Araya J, Poniachik J, Csendes A, Smok G, Videla LA. Relationship between in vivo chlorzoxazone hydroxylation, hepatic cytochrome P450 2E1 content and liver injury in obese non-alcoholic fatty liver disease patients. Hepatol Res. 2006;34:57-63. [PubMed] [DOI] |
| 12. | Videla LA. Oxidative stress signaling underlying liver disease and hepatoprotective mechanisms. World J Hepatol. 2009;1:72-78. [PubMed] [DOI] |
| 13. | Chiang DJ, Pritchard MT, Nagy LE. Obesity, diabetes mellitus, and liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2011;300:G697-G702. [PubMed] [DOI] |
| 14. | Bosserhoff A, Hellerbrand C. Obesity and fatty liver are 'grease' for the machinery of hepatic fibrosis. Dig Dis. 2011;29:377-383. [PubMed] |
| 15. | Kathirvel E, Morgan K, French SW, Morgan TR. Overexpression of liver-specific cytochrome P4502E1 impairs hepatic insulin signaling in a transgenic mouse model of nonalcoholic fatty liver disease. Eur J Gastroenterol Hepatol. 2009;21:973-983. [PubMed] [DOI] |