修回日期: 2013-03-05
接受日期: 2013-04-12
在线出版日期: 2013-04-28
目的: 探讨高度微卫星不稳定性(high level of microsatellite instability, MSI-H)结直肠癌临床病理学特征. 应用免疫组织化学方法检测肿瘤组织中DNA错配修复蛋白缺失表达, 判断肿瘤MSI状态, 建立筛选与遗传相关结直肠癌常规诊断流程.
方法: 分析临床特点, 光镜下观察肿瘤组织形态学特征, 免疫组织化学SP法分析肿瘤DNA错配修复蛋白表达缺失情况, 判断肿瘤MSI状态, 荧光定量PCR法进一步证实肿瘤MSI状态.
结果: 400例散发性结直肠癌, 以男性左半结肠多见, 免疫组织化学方法检测到MSI-H 18例, MSI-L 98例, MSS 284例, MSI-H肿瘤以老年女性左半结肠多见. MSI-H结直肠癌形态学多见绒毛乳头状结构, 高、低分化, 黏液腺癌、印戒细胞癌或伴有黏液分化, 肿瘤上皮内淋巴细胞浸润、肿瘤间质内见Crohn样淋巴细胞反应及瘤周淋巴浆细胞浸润明显, 多数缺乏坏死. 荧光定量PCR法进一步对18例MSI-H肿瘤进行分析, 证实MSI-H 7例, MSI-L 1例, MSS 6例, 同时发现4例肿瘤存在等位基因杂合性缺失.
结论: 散发性MSI-H结直肠癌与病理形态学具有明显相关性, 与患者年龄、性别、部位无显著相关. 结合形态学及免疫组织化学检测错配修复蛋白可作为判断MSI-H肿瘤的常规筛查方法, 对患者进行临床监控、个体化治疗及筛选与遗传相关结直肠癌具有重要临床意义, 但对MSI-H肿瘤最终确诊及是否与遗传相关仍需进行分子生物学方法检测进一步证实.
核心提示: 本文初次报道应用免疫组织化学方法联合4种错配修复基因(mismatch repair gene, MMR)蛋白检测散发性结直肠癌的MMR-d, 为今后进一步阐述肿瘤的分子遗传学机制奠定基础.
引文著录: 李新霞, 胡晓杰, 吴涛, 胡昌明, 徐炜, 李洪波, 赵彤. 散发性结直肠癌组织病理学特征及微卫星不稳定状态分析400例. 世界华人消化杂志 2013; 21(12): 1080-1089
Revised: March 5, 2013
Accepted: April 12, 2013
Published online: April 28, 2013
AIM: To investigate the clinicopathologic features of sporadic colorectal carcinoma with high level of microsatellite instability (MSI-H), detect deficient expression of DNA mismatch repair protein, predict tumor microsatellite instability (MSI) status, and create a platform for diagnosis and screening of genetic colorectal carcinoma.
METHODS: Clinical data for 400 cases of sporadic colorectal carcinoma were analyzed. All cases underwent histological assessment. The deficiency expression of mismatch repair protein was detected by immunohistochemistry. The MSI status of carcinoma was predicted and then confirmed by PCR.
RESULTS: Male patients and left-side location predominated in the present series. Of 400 cases of sporadic colorectal carcinoma, 18 cases of MSI-H, 98 cases of MSI-L and 284 cases of MSS were detected by immunohistochemistry. Pathological features of MSI-H colorectal carcinoma included villous and papilloma structures, poor or good differentiation, mucinous type, signet-cell carcinoma or any mucinous differentiation, increased tumor-infiltrating lymphocytes (TIL cells), the presence of Crohn-like reaction, and the lack of necrosis. PCR analysis confirmed that there were 7 cases of MSI-H tumors, 1 case of MSI-L, 6 cases of MSS and 4 cases of allele of heterozygosity.
CONCLUSION: Sporadic MSI-H colorectal carcinoma has unique morphology, but shows no correlation with patient age, sex, and tumor size. Morphological assessment with immunohistochemistry can be used as a routine method for screening MSI-H and genetic colorectal carcinoma and guiding individualized treatment.
- Citation: Li XX, Hu XJ, Wu T, Hu CM, Xu W, Li HB, Zhao T. Histopathologic features and microsatellite instability of sporadic colorectal carcinoma: An analysis of 400 cases. Shijie Huaren Xiaohua Zazhi 2013; 21(12): 1080-1089
- URL: https://www.wjgnet.com/1009-3079/full/v21/i12/1080.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i12.1080
DNA错配修复基因(mismatch repair gene, MMR)在DNA复制过程中修复错配的碱基使DNA精确复制, 保证人类遗传的保守性和稳定性. 当该基因功能丧失则导致细胞在增殖过程中出现的错误掺入和缺失不能修复, 表现出高度微卫星不稳定性(high level of microsatellite instability, MSI-H)[1,2]. MSI是错配修复基因的突变表型, 80%以上的遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)肿瘤和10%-15%的散发性结直肠癌表现为MSI[1-3]. 大量文献报道MSI-H结直肠癌的临床病理学特征及生物学行为与MSS/MSI-L肿瘤存在显著差别[4-6]. 对具有家族史或具有MSI-H肿瘤临床病理特征的结直肠癌患者进行MSI和MMR基因突变检测, 可能筛选出HNPCC综合征, 有助于预测异时多发性结直肠癌的发生, 为指导患者选择个体化化疗方案及肿瘤预后判断, 具有重要临床意义[7-9]. 目前国内外关于结直肠癌MSI状态的研究主要集中在遗传相关结直肠癌, 散发性结直肠癌MSI的检测均为小样本且缺乏系统性报道[10-12]. 尤其国内尚缺乏以结直肠癌形态学研究为基础、从蛋白水平检测DNA MMR的大宗病例报道[11], MSI的检测多为复杂的分子检测[13], 难以实现肿瘤患者及高危人群的常规筛查. 本课题拟对随机选择的400例散发性结直肠癌的临床病理特征进行观察, 应用免疫组织化学方法检测肿瘤DNA MMR缺失情况, 筛选MSI-H结直肠癌, 再应用PCR技术对该组病例进行MSI分子检测, 以期建立MSI的常规方法, 为指导患者个体化治疗及早期发现与遗传相关结直肠癌肿瘤提供依据.
随机选择广州金域医学检验中心病理科2006-2010年结直肠癌手术根治标本400例, HE切片由两名资深消化病理医师复片, 按照2007年新版WHO消化系肿瘤组织病理诊断标准进行形态学分型及分级. 临床病理学特征包括病变部位、肿瘤大小、肿瘤边缘、肿瘤出芽、间质类型以及肿瘤周围淋巴细胞反应和克隆样间质反应.
1.2.1 免疫组织化学: 所有标本均经40 g/L甲醛溶液固定, 石蜡包埋, 4 μm切片, 免疫组织化学SP法染色. 所有抗体均购自Novocastra公司. 抗体稀释度为: hMLH1: 1:600; hMSH2: 1:600; MSH6 1:800; PSM2抗体1:1 000. 以距肿瘤组织5 cm以上的正常黏膜上皮和肿瘤内浸润的淋巴细胞为内对照. MSI结果判定: 4个DNA MMR中出现2个或2个以上蛋白失表达者为MSI-H; 出现1个蛋白失表达者为MSI-L; 4个MMR蛋白均表达者为MSS; 由于MSI-L和MSS的临床特征相似, 本组将此两类合并一组统计.
1.2.2 MSI的荧光定量PCR检测: (1)DNA提取: 根据HE染色结果, 对免疫组织化学检测的18例MSI-H病例分别挑选正常和肿瘤组织, 标记出最适合行显微切割的部位(肿瘤组织达80%以上)进行显微切割, 以酚/氯仿/异戊醇法分别提取肿瘤组织和其对应正常组织的DNA(采用QIAGEN QIAamp DNA FFPE Tissue Kit, Cat #56404); (2)微卫星不稳定性检测: 5对微卫星引物的位置和序列见表1(引物序列参考基因数据库(GDB: http://www.gdb.org); (3)微卫星扩增: BAT25、BAT26、APC(D5S346)和AFM093xh3(D2S123): 94 ℃ 2 min; 94 ℃ 20 s, 62 ℃ 20 s, 72 ℃ 30 s; 10个循环; 94 ℃ 20 s, 60 ℃ 20 s, 72 ℃ 30 s; 25个循环; 72 ℃ 5 min; 室温25 ℃保存. Mfd26CA(D17S250): 94 ℃ 2 min; 94 ℃ 20 s, 55 ℃ 20 s, 72 ℃ 30 s; 35个循环; 72 ℃ 5 min; 室温25 ℃保存; (4)毛细管电泳进行片段分析(ABI 3130XL): 取2个新PCR管, 标记为1、2管, 其中1管加入BAT25、AFM093xh3(D2S123)产物各2 μL, BAT26产物4 μL, 加入H2O 42 μL; 2管加入APC(D5S346)和Mfd26CA(D17S250)产物各2 μL, 加入H2O 46 μL; 震荡混匀后微离. 取一新管, 以8.8 μL: 0.2 μL的比例加入Hi-Di formamide和500 Liz Size Standards, 混合均匀后, 短暂离心. 在96孔板中, 每孔加入9 μL的Hi-Di formamide和500 Liz Size Standards混合液. 于每孔中加入1 μL混匀后的扩增产物, 震荡混匀后, 短暂离心. 盖Plate Septa 96-Well盖, 置于热循环仪上, 95 ℃变性3 min, 4 ℃冷却5 min. 在ABI 3130xl上进行片段分析. 收集数据与结果; (5)电泳结束后实验数据采用片段分析软件Genemapperid V3.2进行数据整理和分析, 确定微卫星状态. MSI结果判定: (1)5个Mark中, 2个或2个以上Mark显示为微卫星序列不稳定时, 结果报告为MSI-H; (2)5个Mark中, 1个Mark显示为微卫星序列不稳定时, 结果报告为MSI-L; (3)5个Mark均显示稳定性, 结果报告为MSS.
| 引物名称 | 引物序列 | 扩增片段(bp) |
| BAT25F | 6FAM-TCGCCTCCAAGAATGTAAGT | chr4: 55598151+55598274 |
| BAT25R | TCTGCATTTTAACTATGGCTC | 124 |
| BAT26F | HEX-TGACTACTTTTGACTTCAGCC | chr2: 47641487+47641608 |
| BAT26R | AACCATTCAACATTTTTAACCC | 122 |
| APCF(D5S346) | HEX-ACTCACTCTAGTGATAAATCG | chr5: 112213624-112213748 |
| APCR(D5S346) | AGCAGATAAGACAGTATTACTAGTT | 125 |
| Mfd26CAF(D17S250) | 6FAM-GGAAGAATCAAATAGACAAT | chr17: 37152092-37152243 |
| Mfd26CAR(D17S250) | GCTGGCCATATATATATTTAAACC | 152 |
| AFM093xh3F(D2S123) | HEX-AAACAGGATGCCTGCCTTTA | chr2: 51288437+51288647 |
| AFM093xh3R(D2S123) | GGACTTTCCACCTATGGGAC | 211 |
统计学处理 采用χ2检验分析组间差异, 应用Spearman等级相关检验分析相关性. 采用SPSS10.0软件进行统计分析.
本组选择的2006-2010年结直肠癌手术切除标本400例, 男242例, 女158例, 年龄分布为22-85岁(中位年龄61岁). 病变部位: 左半结肠包括: 直肠185例、乙状结肠90例、降结肠8例, 共计283例; 右半结肠包括: 升结肠18例、横结肠17例、盲肠5例, 结肠肝曲、脾曲肿瘤77例, 共计117例.
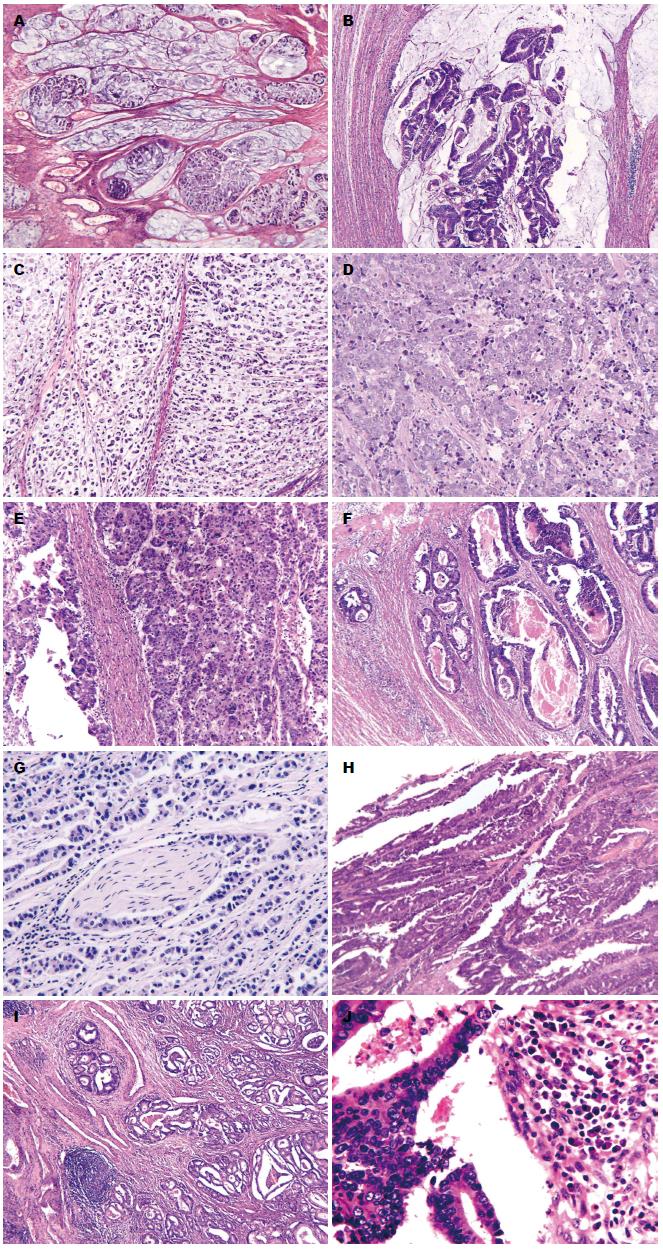
2.2.1 组织学分型: 本组400例散发性结直肠癌中, 黏液腺癌53例(超过50%的肿瘤区域内见细胞外黏液, 图1A); 伴有黏液分化21例(肿瘤内可见细胞外黏液的量<50%, 图1B); 印戒细胞癌8例(超过50%的肿瘤由印戒细胞组成, 图1C); 髓样癌15例(肿瘤细胞弥漫片状生长, 泡状核、显著核仁、胞浆丰富淡染以及明显上皮内淋巴细胞浸润, 图1D, E);混合性生长方式者57例(同一张切片内至少存在2种不同的组织学亚型和生长方式). 非特殊类型腺癌: 246例.
2.2.2 组织学分级: 高分化腺癌23例(腺体成分>95%); 中分化腺癌281例(腺体成分占50%-95%); 低分化腺癌(腺体成分占5%-50%, 包括黏液腺癌和印戒细胞癌, 图1H)73例; 未分化腺癌23例(腺体成分<5%).
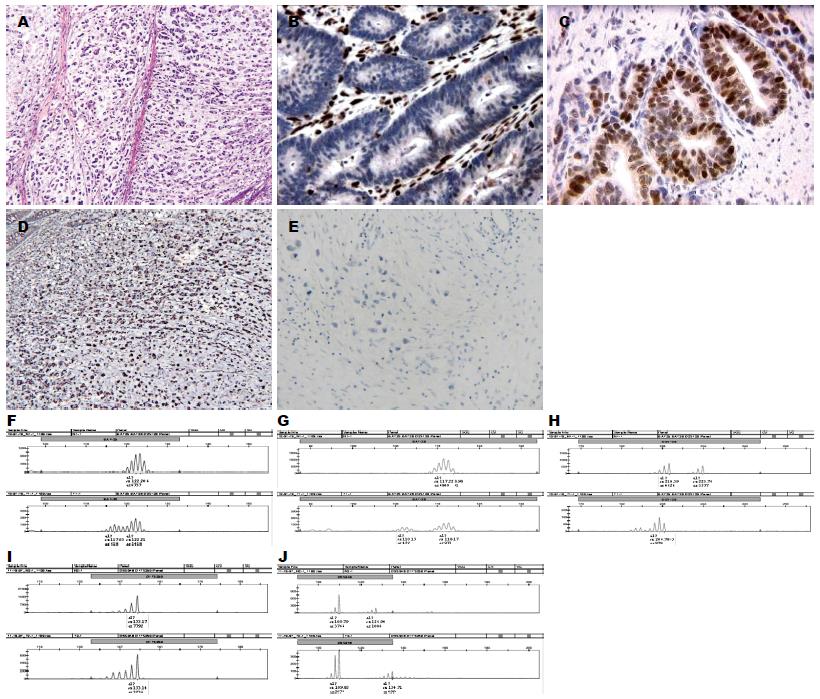
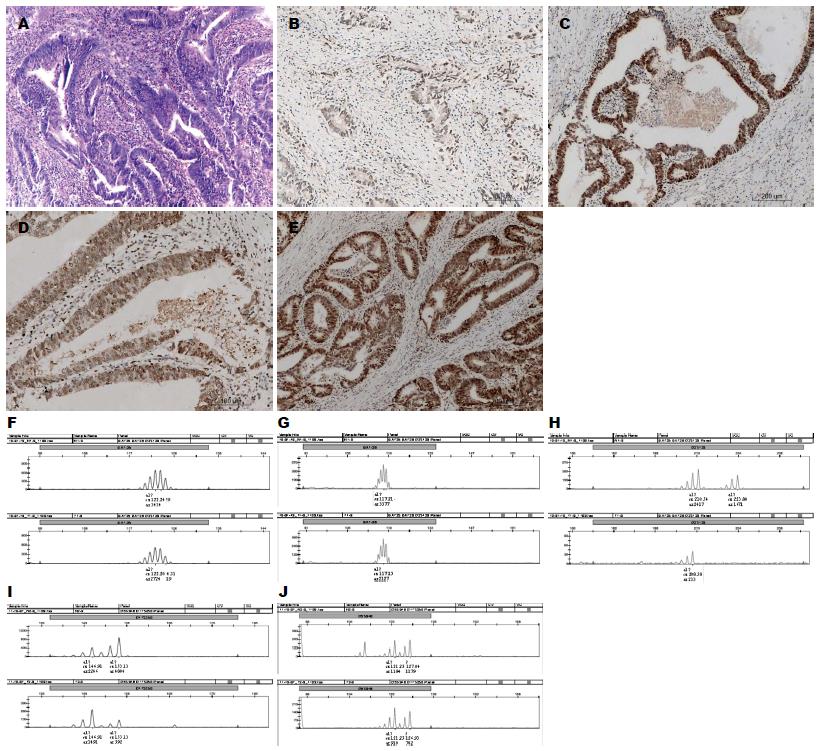
2.3.1 MLH1、MSH2、MSH6和PMS2蛋白表达特征: 免疫组织化学染色证实: MSS肿瘤284例, MSI-L肿瘤98例, MSI-H肿瘤18例. 其中MLH1-/MSH2- 8例; MLH1-/MSH6- 11例; MLH1-/PMS2- 2例. MSH2-/MSH6- 12例; MSH2-/PMS2- 1例; MSH6-/PMS2- 1例; MLH1-/MSH2-/MSH6- 7例(表2). 400例肿瘤组织对应的手术切端正常大肠黏膜的4种抗体均呈阳性表达.
| 序号 | MSI状态 | ||||
| MLH1 | MSH2 | MSH6 | PSM2 | MSI | |
| 1 | - | + | - | - | MSI-H |
| 2 | + | - | - | + | MSI-H |
| 3 | - | + | - | + | MSI-H |
| 4 | - | - | - | + | MSI-H |
| 5 | - | - | - | + | MSI-H |
| 6 | + | - | - | + | MSI-H |
| 7 | - | - | - | + | MSI-H |
| 8 | + | - | - | + | MSI-H |
| 9 | - | - | - | + | MSI-H |
| 10 | - | + | - | + | MSI-H |
| 11 | - | - | + | - | MSI-H |
| 12 | + | - | - | + | MSI-H |
| 13 | + | - | + | + | MSI-H |
| 14 | - | + | - | + | MSI-H |
| 15 | - | - | - | + | MSI-H |
| 16 | - | - | - | + | MSI-H |
| 17 | + | - | - | + | MSI-H |
| 18 | - | - | - | + | MSI-H |
2.3.2 MLH1、MSH2、MSH6和PMS2蛋白表达与散发性结直肠癌临床病理学特征关系: MSS及MSI-L肿瘤组织学多为中分化腺癌, 周围常伴腺瘤结构, 可见腔内坏死(图1F)以及浸润性穿透性生长模式, 常见脉管及神经侵犯(图1G), 间质以瘢痕疙瘩样的胶原纤维束C型间质多见. MSI-H肿瘤有18例, 男6例, 女12例. 发病年龄从27-80岁, 其中20-30岁2例; 50-60岁3例; 60-70岁5例; 70-80岁8例. 发病部位右半结肠5例; 左半结肠13例. 9例生长方式为膨胀性生长, 9例为浸润性生长. 间质反应A型层状纤细的胶原纤维基质、B型厚透明变性的瘢痕样胶原纤维间质及C型黏液基质相关瘢痕疙瘩样的胶原纤维束间质在MSI-H肿瘤组织中均可见. 3例腺癌组织中见绒毛状结构(图1H), 7例肿瘤浸润性前沿间质内或肿瘤上皮内可见克隆样淋巴细胞反应(图1I), 11例伴有黏液成分, 12例可见瘤周淋巴细胞增多及间质内浆细胞增多改变(图1G), 9例可见肿瘤上皮内淋巴细胞浸润(tumor infiltrating lymphocyte, TIL)>2个/HPF.
18例免疫组织化学方法检测的MSI-H病例中, PCR技术检测到MSI-H7例(7/18, 38.9%)(图2), MSI-L 1例(1/18, 5.6%), MSS 6例(6/18, 33.3%), 该方法还检测到等位基因杂合性缺失(allele of heterozygosity, LOH)病例4例(4/18, 22.2%)(图3), 4例均累及D2S123位点. 1例LOH位于D5S346位点; 3例LOH位于D17S250位点. LOH的判定标准: 肿瘤组织中微卫星DNA两个等位基因的相对强度与正常组织的等位基因相对强度的比值作为判定依据, 即RF = (P2/P1-T)/(P2/P1-N), RF<0.667或>1.50时, 我们判断该位点发生了LOH.
本研究对2006-2010年随机选择的400例散发性结直肠癌肿瘤组织首先进行临床特征及形态学观察, 男性占入选病例的60.5%(242/400), 女性39.5%(158/400), 患者中位年龄61岁. 组织形态学观察: 非特殊类型腺癌以中分化腺癌多见, 占总病例数的61.5%(246/400). 其余分别为黏液腺癌53例(13.25%, 53/400), 两种或以上混合性生长方式者57例(14.25%, 57/400), 伴有黏液分化的腺癌21例(5.25%, 21/400), 髓样癌15例(28.75%, 15/400), 印戒细胞癌8例(2%, 8/400); 免疫组织化学检测MMR蛋白表达, 有18例为MSI-H肿瘤, 阳性率仅4.5%(18/400), 低于文献报道[14-16], 分析原因可能与入选病例以左半结肠老年男性多见, 组织学以中分化腺癌为主有一定相关性. 本组MSI-H结直肠癌患者中位年龄为67.5岁, 略低于文献报道的74岁, 但高于修订Bethesda指南推荐的<50岁的诊断年龄, 说明需要扩大年龄范围在低龄因素之外去寻找MSI-H表型; 在18例MSI-H肿瘤中, 男6例, 女12例, 女性比例66.7%, 与以前报道的比例接近. 18例MSI-H表型肿瘤中右半结肠5例; 左半结肠13例. 在病理形态学上多表现为低分化且多伴有黏液分化, 黏液腺癌和印戒细胞癌分别有5例, 3例, 多见肿瘤上皮内淋巴细胞TIL、克隆样淋巴细胞间质反应及缺乏结直肠癌腺腔内脏的坏死, 淋巴结转移相对少见、且常出现组织学异质性的混合性形态学特征(7例), 与非特异性中分化腺癌常见腺腔内脏的坏死, 胶原化的癌性间质以及肿瘤周围常见管状腺瘤改变明显不同, 散发性MSI-H结直肠癌肿瘤患者与发病部位、患者年龄及性别无显著相关, 而与病理组织学分型及分级具有明显相关性. 病理医生可通过其独特的形态学特征来鉴别微卫星状态、尽早认识HNPCC综合征. 校正的Bethesda指导方针也明确指出病理形态学观察的重要性, 对于50-60岁的结直肠癌患者, 如病理医师明确肿瘤MSI-H形态学特征, 则应推荐患者做进一步的检测, 存在风险的患者即可在肿瘤切除术后的常规病理检查中得到MMR蛋白表达情况的判断, 为今后在临床常规工作中对具有上述组织学特征的结直肠癌患者进行进一步MSI准确的分子检测及筛选与遗传相关结直肠癌起提示作用[17].
免疫组织化学法能检测针吸和肠镜活检的微小肿瘤碎块组织, 便于早期筛选HNPCC患者. 该方法具有技术简单、费用较低、报告时间短的优点, 利于在基层医院病理科广泛开展[18,19]. 我们应用免疫组织化学方法对400例病例进行MSI检测, 116例(29%)表现出MSI, 其中MSI-H 18例(4.5%), MSI-L 98例(24.5%), MSS为71%. 本组MSI-H肿瘤以MLH1、MSH2、MSH6蛋白丢失多见, 但与Kaur等[17]报道不同MMR蛋白丢失可能具有相应的组织学亚型相比, 并无统计学意义, 与Shia等[16]研究结果比较, 本组MSI-H肿瘤发生频率较低. IHC方法能直接显示缺失表达的特殊MMR基因, 可针对目标基因做有效的突变分析, 同时IHC鉴别突变基因的能力也可对一些标准方法检测失败的患者进行补充. 同时本组实验联合使用4种MMR蛋白, 可提高预测肿瘤MSI状态的敏感性和特异性. 但是我们必须认识到: 虽然目前常见的4种MMR抗体能检测到大多数MMR蛋白缺失病例, 但仍可能存在潜在致病的假定基因, 因此可能会漏掉一些新的MMR蛋白丢失表达的情况, 而MSI的分子检测能检测任何异常致病的MMR基因, 在条件允许的情况下, 临床实践工作中在有MSI-H形态学基础上, 应尽量选择两种方法同时使用.
因此为进一步验证肿瘤MSI状态, 本组对免疫组织化学方法检测的18例MSI-H肿瘤进行了MSI分子检测, MSI-H肿瘤7例; MSI-L肿瘤1例; MSS肿瘤6例; LOH肿瘤4例. 其中D2S123变异7例(38.9%)、D17S250变异7例(38.9%)、D5S346变异5例(27.8%), BAT-25变异4例(22.2%)、BAT-26变异4例(22.2%)、5个标志之间无显著性差异(P>0.0005). 文献报道HNPCC中单碱基重复序列BAT-26, BAT-25不稳定发生率较高, BAT-26在HNPCC肿瘤中阳性率高达100%, 单纯检测BAT-26即可判断家系成员的MSI状态, 散发性MSI结直肠癌中双碱基重复序列不稳定发生率较高[20], 本组资料显示BAT-26阳性率为22.2%, 明显低于在 HNPCC肿瘤中的检出率. 为什么在HNPCC中单碱基重复序列不稳定发生率高, 而在散发性MSI结直肠癌中双碱基重复序列不稳定发生率高, 目前尚无定论. 有趣的是: 对本组免疫组织化学检测的18例MSI-H肿瘤组织进行MSI分子检测, 意外发现4例MSS结直肠癌中存在LOH, 其中4例均检出DS123基因的LOH, 3例检出D17S250基因的LOH, 1例检出D5S346基因的LOH. 但是我们没有发现肿瘤组织LOH与MSI共存的现象, 与文献报道一致[21]. 是否提示MMR基因通过等位基因杂合性缺失是散发性结直肠癌发生的重要分子遗传途径之一? 有待大样本进一步研究.
微卫星不稳定检测和免疫组织化学检测是目前已被证明最有效的两种HNPCC综合征初筛手段. 既往研究发现, 免疫组织化学检测与MSI检测有很好的一致性, Shia统计了1999-2006年的16篇文献, 发现使用免疫组织化学预测hMLH 1和hMSH2胚系突变的总敏感性为85%, 略低于MSI检测的93%, 但在具体的数值上还是具有较好的符合度[16]. 最近一项研究对这两种方法进行了Meta分析: 发现免疫组织化学法的综合敏感性为82.6%, 诊断优势比为22.537; MSI法的综合敏感性为85.2%, 诊断优势比为33.115; 两种筛查方法效果均较好, 诊断效果无明显差异, 均对HNPCC筛查具有理想的诊断价值[18]. 我们的研究也显示免疫组织化学作为初筛手段优于MSI检测之处在于其只需常规病理实验室就可进行, 并可应用于大规模的人群筛查; 而MSI检测常需要使用分子生物学实验室, 影响其临床应用. 由于散发性大肠癌发生hMLH1蛋白缺失的病例大部分是由hMLH1基因启动子甲基化引起[22-24], 而且这样的患者也常发生BRAF基因突变, 因此对免疫组织化学检测到hMLH1蛋白缺失的病例进行hMLH1基因启动子甲基化和BRAF基因突变的检测可以帮助剔除那些非HNPCC病例; 对于未检测到突变的患者, 还可行hMSH6和hPMS2基因的检测及检测大片段缺失的情况, 我们也将在以后的筛查策略中加入这些检测帮助筛选HNPCC.
本研究对MSI-H肿瘤系统分析了临床病理学特征, 发现分化差、黏液分化、绒毛乳头状结构、肿瘤间质Crohn反应和肿瘤上皮内淋巴细胞浸润是MSI-H相对独特的形态学特征. 多数研究证明, 无家族史MSI-H大肠癌主要通过DNA甲基化和BRAF基因突变的锯齿状腺瘤-癌路径[23,24], 而家族性MSI-H大肠癌是通过MMR基因种系突变及APC、β-catenin和K-ras频繁突变的传统腺瘤-癌路径. 两者相比, 无家族史MSI-H大肠癌更多地具有女性多见、诊断年龄偏大、低分化、黏液分化、组织学异质性及癌周锯齿状腺瘤多见等特点; 本组检测的18例MSI-H肿瘤形态上符合上述特点. 家族性MSI-H大肠癌更多地具有类Crohn反应、TILs及癌组织周围传统腺瘤多见等特点. 值得注意的是, 家族性MSI-H大肠癌更像普通型大肠癌, 而无家族史MSI-H大肠癌则具有特殊的形态学特征. 虽然对患者进行MLH1启动子甲基化和BRAF基因突变检测有助于辨别两者, 但本组研究和前期研究均认为对于有遗传倾向肿瘤患者第一步应选择简便、易行、互补、快速的方法, 对有遗传倾向的家系不能仅以阿姆斯特丹标准进行选择, 而应作相对广泛的初筛, 以减少漏诊; 对联合形态学及免疫组织化学方法筛选的MSI-H肿瘤再进行突变基因检测, 即首先检测肿瘤组织中MMR蛋白包括hMSH2、PMS2、hMLH1、MSH6蛋白是否缺失, 对MSI-H或者蛋白表达丢失者再进行hMSH2或hMLH1种系突变检测, 这样不仅可以提高突变检出率, 提高效率, 减少种系突变基因检测的数目, 而且可以减轻患者的经济负担.
结直肠癌MSI检测不仅是筛选HNPCC肿瘤的重要指标, 而且可以使10%-15%的MSI-H表型肿瘤的治疗和预后策略发生改变, 即5-氟尿嘧啶(5-fluorouracil, 5-Fu)是结直肠癌的基础一线化疗药物, MMR-缺陷肿瘤对5-Fu不敏感, 患者无法从5-Fu的化疗药中获益或提高生存率[25-30]. 因此, 判断结直肠癌MSI状态对提高结直肠癌的预防、诊断和治疗水平, 对降低结直肠癌的发病率和死亡率有着重要意义.
高度微卫星不稳定性(high level of microsatellite instability, MSI-H)结直肠癌患者具有独特临床特征及生物学行为, 识别MSI-H结直肠癌对患者选择个体化治疗方案及制定规范化随访制度具有重要临床意义.
王娅兰, 教授, 重庆医科大学基础医学院病理教研室
微卫星不稳定检测和免疫组织化学检测是目前已被证明最有效的两种遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)综合征初筛手段. 如何提高免疫组织化学方法检测MSI状态的敏感性和特异性是今后的研究重点.
本文初次报道应用免疫组织化学方法联合4种MMR蛋白检测散发性结直肠癌的MMR-d, 评估肿瘤MSI状态, 同时意外发现4例MSS结直肠癌中存在等位基因杂合性缺失(allele of heterozygosity, LOH), 但我们没有发现肿瘤组织LOH与MSI共存的现象.
建立经济、高效、实用、快速的免疫组织化学方法评估结直肠癌的MSI状态, 为患者早期预防、早期诊断及早期治疗起重要作用, 该方法可在基层病理科广泛开展, 有利于结直肠癌患者的大宗病例的筛查.
本文首次在国内应用免疫组织化学方法联合4种常见的MMR蛋白对400例散发性结直肠癌进行了DNA错配修复蛋白的检测, 具有一定的推广应用价值. 同时发现了4例MSS肿瘤存在LOH, 为今后进一步阐述肿瘤的分子发生机制奠定了基础.
编辑: 田滢 电编:闫晋利
| 1. | Iacopetta B, Grieu F, Amanuel B. Microsatellite instability in colorectal cancer. Asia Pac J Clin Oncol. 2010;6:260-269. [DOI] |
| 2. | Jacob S, Praz F. DNA mismatch repair defects: role in colorectal carcinogenesis. Biochimie. 2002;84:27-47. [PubMed] [DOI] |
| 3. | Douillard JY. Microsatellite instability and mismatch repair genes in colorectal cancer: useful tools for managing patients and counseling their relatives. Clin Colorectal Cancer. 2010;9:193-194. [PubMed] [DOI] |
| 4. | Merok MA, Ahlquist T, Røyrvik EC, Tufteland KF, Hektoen M, Sjo OH, Mala T, Svindland A, Lothe RA, Nesbakken A. Microsatellite instability has a positive prognostic impact on stage II colorectal cancer after complete resection: results from a large, consecutive Norwegian series. Ann Oncol. 2012; Dec 12. [Epub ahead of print]. [PubMed] |
| 5. | Jung SB, Lee HI, Oh HK, Shin IH, Jeon CH. Clinico-pathologic Parameters for Prediction of Microsatellite Instability in Colorectal Cancer. Cancer Res Treat. 2012;44:179-186. [PubMed] [DOI] |
| 6. | Hyde A, Fontaine D, Stuckless S, Green R, Pollett A, Simms M, Sipahimalani P, Parfrey P, Younghusband B. A histology-based model for predicting microsatellite instability in colorectal cancers. Am J Surg Pathol. 2010;34:1820-1829. [PubMed] [DOI] |
| 7. | de la Chapelle A, Hampel H. Clinical relevance of microsatellite instability in colorectal cancer. J Clin Oncol. 2010;28:3380-3387. [PubMed] [DOI] |
| 8. | Des Guetz G, Schischmanoff O, Nicolas P, Perret GY, Morere JF, Uzzan B. Does microsatellite instability predict the efficacy of adjuvant chemotherapy in colorectal cancer? A systematic review with meta-analysis. Eur J Cancer. 2009;45:1890-1896. [PubMed] [DOI] |
| 9. | Greenson JK, Huang SC, Herron C, Moreno V, Bonner JD, Tomsho LP, Ben-Izhak O, Cohen HI, Trougouboff P, Bejhar J. Pathologic predictors of microsatellite instability in colorectal cancer. Am J Surg Pathol. 2009;33:126-133. [PubMed] [DOI] |
| 13. | 孟 晓明, 金 鹏, 盛 剑秋, 陆 晓娟, 付 蕾, 范 如英, 李 恕军, 李 世荣. 散发性大肠癌患者中错配修复基因胚系突变筛查策略. 胃肠病学和肝病学杂志. 2010;19:604-607. |
| 14. | Greenson JK, Bonner JD, Ben-Yzhak O, Cohen HI, Miselevich I, Resnick MB, Trougouboff P, Tomsho LD, Kim E, Low M. Phenotype of microsatellite unstable colorectal carcinomas: Well-differentiated and focally mucinous tumors and the absence of dirty necrosis correlate with microsatellite instability. Am J Surg Pathol. 2003;27:563-570. [PubMed] [DOI] |
| 15. | Hornick JL, Farraye FA, Odze RD. Clinicopathologic and immunohistochemical study of small apparently "de novo" colorectal adenocarcinomas. Am J Surg Pathol. 2007;31:207-215. [PubMed] [DOI] |
| 16. | Shia J, Tang LH, Vakiani E, Guillem JG, Stadler ZK, Soslow RA, Katabi N, Weiser MR, Paty PB, Temple LK. Immunohistochemistry as first-line screening for detecting colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome: a 2-antibody panel may be as predictive as a 4-antibody panel. Am J Surg Pathol. 2009;33:1639-1645. [PubMed] [DOI] |
| 17. | Kaur G, Masoud A, Raihan N, Radzi M, Khamizar W, Kam LS. Mismatch repair genes expression defects & amp; association with clinicopathological characteristics in colorectal carcinoma. Indian J Med Res. 2011;134:186-192. [PubMed] |
| 19. | Alkhalidi H, Kfoury H. Status of mismatch repair genes hMSH2 and hMSH6 in colorectal cancer in Saudi patients: an immunohistochemical analysis. East Mediterr Health J. 2012;18:1114-1117. [PubMed] |
| 20. | Kria Ben Mahmoud L, Arfaoui A, Khiari M, Chaar I, Lounis A, Sammoud S, Ben Hmida AM, Gharbi L, Mzabi SR, Bouraoui S. Evaluation of microsatellite instability, MLH1 expression and hMLH1 promoter hypermethylation in colorectal carcinomas among Tunisians patients. Tunis Med. 2012;90:646-653. [PubMed] |
| 21. | Dietmaier W, Riedlinger W, Kohler A, Wegele1 P, Beyser K, Sagner G, Wartbichler R, Ruschoff J. Detection of Microsatellite Instability (MSI) and Loss of Heterozygosity (LOH) in Colorectal Tumors by Fluorescence-based Multiplex Microsatellite PCR. Biochemica. 1999;2:43-46. |
| 22. | Suehiro Y, Hinoda Y. [Genetic and epigenetic changes in colorectal cancer and genetic testing for personalized medicine]. Rinsho Byori. 2012;60:976-981. [PubMed] |
| 23. | van Roon EH, Boot A, Dihal AA, Ernst RF, van Wezel T, Morreau H, Boer JM. BRAF mutation-specific promoter methylation of FOX genes in colorectal cancer. Clin Epigenetics. 2013;5:2. [PubMed] [DOI] |
| 24. | Vlaykova T, Mitkova A, Stancheva G, Kadiyska T, Gulubova M, Yovchev Y, Cirovski G, Chilingirov P, Damyanov D, Kremensky I. Microsatellite instability and promoter hypermethylation of MLH1 and MSH2 in patients with sporadic colorectal cancer. J BUON. 2011;16:265-273. [PubMed] |
| 25. | Jover R, Zapater P, Castells A, Llor X, Andreu M, Cubiella J, Balaguer F, Sempere L, Xicola RM, Bujanda L. The efficacy of adjuvant chemotherapy with 5-fluorouracil in colorectal cancer depends on the mismatch repair status. Eur J Cancer. 2009;45:365-373. [PubMed] [DOI] |
| 26. | Min BH, Bae JM, Lee EJ, Yu HS, Kim YH, Chang DK, Kim HC, Park CK, Lee SH, Kim KM. The CpG island methylator phenotype may confer a survival benefit in patients with stage II or III colorectal carcinomas receiving fluoropyrimidine-based adjuvant chemotherapy. BMC Cancer. 2011;11:344. [PubMed] [DOI] |
| 27. | Van Cutsem E, Tabernero J, Lakomy R, Prenen H, Prausová J, Macarulla T, Ruff P, van Hazel GA, Moiseyenko V, Ferry D. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol. 2012;30:3499-3506. [PubMed] [DOI] |
| 28. | Nukatsuka M, Saito H, Sakamoto K, Nakagawa F, Uchida J, Kobunai T, Shiraishi K, Takechi T. Efficacy of combination chemotherapy using oral fluoropyrimidine S-1 with oxaliplatin (SOX) against colorectal cancer in vivo. Anticancer Res. 2012;32:2807-2812. [PubMed] |
| 29. | Bao F, Panarelli NC, Rennert H, Sherr DL, Yantiss RK. Neoadjuvant therapy induces loss of MSH6 expression in colorectal carcinoma. Am J Surg Pathol. 2010;34:1798-1804. [PubMed] [DOI] |
| 30. | Hosokawa A, Ogawa K, Ando T, Suzuki N, Ueda A, Kajiura S, Kobayashi Y, Tsukioka Y, Horikawa N, Yabushita K. Preventive effect of traditional Japanese medicine on neurotoxicity of FOLFOX for metastatic colorectal cancer: a multicenter retrospective study. Anticancer Res. 2012;32:2545-2550. [PubMed] |