修回日期: 2013-03-20
接受日期: 2013-04-07
在线出版日期: 2013-04-28
目的: 探讨RacGTP酶激活蛋白1(Rac GTPase activating protein1, Rac1)对胰腺癌细胞增殖的影响及其机制.
方法: 分别采用EDU和CCK-8(cell counting kit-8)方法检测Rac1对胰腺癌细胞增殖的影响; 采用Western blot、免疫荧光等试验探讨Rac1影响胰腺癌增殖的具体机制.
结果: Rac1可以促进胰腺癌细胞的增殖, 沉默Rac1或者Rac1特异性阻滞剂NSC23766可以抑制胰腺癌的增殖, 且进一步的机制研究发现Rac1通过促进β-Catenin进入细胞核, 上调wnt-β-Catenin信号通路靶基因c-myc、c-jun和Cyclin D1的表达, 进而促进胰腺癌细胞的增殖.
结论: Rac1通过wnt-β-Catenin信号通路促进胰腺癌细胞的增殖.
核心提示: RacGTP酶激活蛋白1(Rac GTPase activating protein1)通过促进β-Catenin进入细胞核, 上调wnt-β-Catenin信号通路靶基因c-myc、c-jun和Cyclin D1的表达, 进而促进胰腺癌细胞的增殖.
引文著录: 田锐, 郭兴军, 江建新, 王敏, 石程剑, 徐盟, 彭丰, 李旭, 秦仁义. Rac1对胰腺癌增殖的影响及其机制. 世界华人消化杂志 2013; 21(12): 1070-1074
Revised: March 20, 2013
Accepted: April 7, 2013
Published online: April 28, 2013
AIM: To investigate the role of rac1 in the proliferation of pancreatic carcinoma cells and to explore the possible mechanisms involved.
METHODS: The influence of rac1 on the proliferation of pancreatic carcinoma cells was detected by cell counting kit-8 (CCK-8) assay and EDU assay. Real-time PCR was employed to measure the expression of target genes of wnt-β-Catenin signaling pathway. Western blot and immunofluorescence were employed to measure the expression of β-Catenin in the cytoplasm and nucleus.
RESULTS: Disruption of rac1 activity by transfection with si-Rac1 or treatment with NSC23766 inhibited cell proliferation. Suppression of rac1 markedly down-regulated the mRNA expression of c-myc and Cyclin D1 and slightly decreased the mRNA expression of c-jun. Rac1 knockdown did not affect β-Catenin stability in the cytoplasm but markedly reduced β-Catenin accumulation in the nucleus. Similar result was also obtained in immunofluorescence experiments.
CONCLUSION: Rac1 amplifies the wnt signaling pathway activity possibly by promoting β-Catenin accumulation in the nucleus and augments wnt target gene transcription in pancreatic carcinoma cells.
- Citation: Tian R, Guo XJ, Jiang JX, Wang M, Shi CJ, Xu M, Peng F, Li X, Qin RY. Role of rac1 in the proliferation of pancreatic carcinoma cells and possible mechanisms involved. Shijie Huaren Xiaohua Zazhi 2013; 21(12): 1070-1074
- URL: https://www.wjgnet.com/1009-3079/full/v21/i12/1070.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i12.1070
胰腺癌是消化系常见的恶性肿瘤之一. 胰腺癌也是根治性切除机会最少、预后最差的恶性肿瘤之一: 85%的患者在确诊时已属中晚期, 多伴有其他脏器肿瘤转移, 其中位生存期仅3-4 mo[1,2], 而且即使是接受胰腺癌根治性手术的患者, 其总体术后的5年生存率仅为5%左右. RacGTP酶激活蛋白1(Rac GTPase activating protein1, Racl)的被证实在多种肿瘤细胞系中表达且在肿瘤的发生发展中起到重要作用[3-6], 并已经成为药物开发的热点, 但Rac1与胰腺癌的关系尚不明确. 本研究将着重探讨Rac1在胰腺癌增殖中的作用.
RPMI 1640培养基购自HyCone公司; 新生牛血清购自HyClone公司; TRIzol试剂购自Invitrogen公司; Reverse Transcription System试剂盒、SYBR Green Realtime PCR Master Mix购自TOYOBO公司; Cyclin D1、c-jun和c-myc引物由Invitrogen公司合成; 浓缩型兔抗人Rac1和β-Catenin多克隆抗体购自CST公司; Western blot相关试剂购自武汉博士德公司; ECL显色试剂盒购自碧云天公司; 全细胞蛋白提取试剂盒、BCA法测蛋白浓度试剂盒购自碧云天公司; EDU试剂盒购自锐博公司; CCK-8试剂盒购自碧云天公司; Rac1特异性siRNA由锐博公司合成; 转染试剂Lipofectamine 2000购自Invitrogen公司.
1.2.1 细胞培养: 人胰腺癌细胞系BxPC-3为本实验室长期冷冻保存; 采用含10%新生牛血清的RPMI 1640培养基, 至37 ℃、50 mL/L CO2培养箱内培养.
1.2.2 针对Rac1特异性siRNA转染: 接种适量细胞至六孔板, 确保第2天细胞约30%铺满, 采用Lipofectamine 2000转染, 24 h后更换新鲜培养基, 48 h检测细胞增殖情况, 72 h检测细胞蛋白水平的变化. siRNA靶向Rac1的序列是5'-TGAAGAAGAGGAAGAGAAA-3', siRNA上链序列是5'-UGAAGAAGAGGAAGAGAAAdTdT-3', 下链序列是3'-dTdTACUUCUUCUCCUUCUCUUU-5'.
1.2.3 细胞增殖检测: 细胞增殖采用EDU和CCK-8两种实验方法检测, 具体操作步骤按照试剂盒说明书.
1.2.4 Real-time PCR检测胰腺癌细胞系中Tiam1 mRNA的表达: 参照说明书, 用TRIzol试剂常规提取细胞总RNA. 按照逆转录试剂盒操作程序进行逆转录反应. 反应总体系为20 μL, 其中样品总RNA 2 μg、primer mix 1 μL、5×buffer 4 μL、enzyme 1 μL, 加DEPC水至20 μL, 37 ℃反应15 min, 98 ℃灭活5 min. 管家基因GAPDH为内对照. 通过相对荧光定量PCR方法, 对Tiam1和GAPDH进行检测, 计算出不同样本的目的基因相对表达量. 运用Primer 5.0设计引物, Cyclin D1的上游引物为5'-CCGTCCATGCGGAAGATC-3', 下游引物为5'-ATGGCCAGCGGGAAGAC-3'; c-jun上游引物5'-CCAGCCAGGTCGGCAGTAT-3', 下游引物5'-GGCAGTTAGAAGGTGAA-3'; c-myc上游引物5'-ATCACAGCCCTCACTCAC-3', 下游引物5'-ACAGATTCCACAAGGTGC-3'. 应用BIO-RAD定量PCR仪进行Real-time PCR实验, 反应条件为95 ℃ 5 s, 60 ℃ 15 s, 72 ℃ 15 s, 40个循环. 以Folds = 2-△△Ct表示实验组与对照组目的基因表达的倍数比关系, 重复3次实验, 计算平均值.
1.2.5 Western blot检测胰腺癌细胞系中Rac1和β-Catenin蛋白水平的表达: 细胞膜蛋白、细胞浆蛋白、细胞核蛋白提取采用上海生工全蛋白提取试剂盒(BSP003), 按照试剂盒说明书操作, BCA法测蛋白浓度. 样本加入10%SDS-PAGE凝胶进行电泳, 转膜至硝酸纤维素膜. Rac1一抗浓度为1:1 000, β-Catenin一抗浓度为1:1 000, 4 ℃孵育摇床过夜, 二抗(1:2 000)37 ℃孵育1 h. ECL化学发光试剂盒显色、曝光、显影、定影.
1.2.6 免疫荧光化学方法检测胰腺癌细胞中的β-Catenin: 细胞爬片固定, 穿孔封闭, 孵育一抗过夜, β-Catenin抗体工作浓度为1:100, 二抗的工作浓度为1:100, 荧光显微镜照相分析.
统计学处理 采用SPSS21.0软件包进行处理, PCR实验结果和CCK-8实验结果采用t检验, P<0.05具有统计学意义.
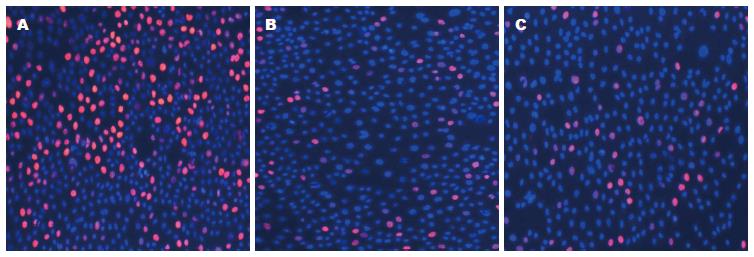
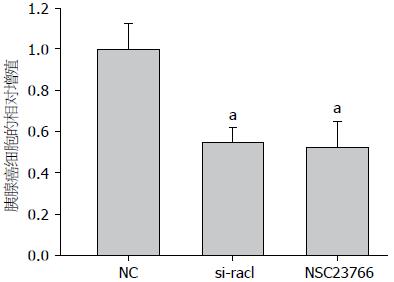
EDU实验示在siRNA沉默Rac1或者Rac1特异性阻滞剂作用后, 胰腺癌细胞系BxPC-3增殖变慢. CCK-8实验示在siRNA沉默Rac1或者Rac1特异性阻滞剂作用后, 胰腺癌细胞系BxPC-3增殖变慢(P<0.05). 由此可见, Rac1在胰腺癌细胞中活性水平与胰腺癌的增殖能力呈正相关(图1, 2).
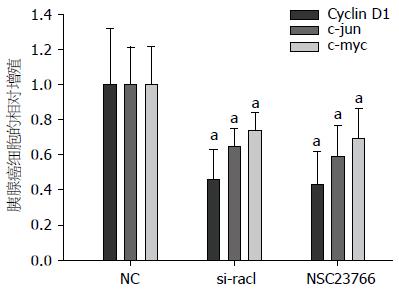
有文献报道Rac1在多种肿瘤中通过wnt-β-Catenin信号通路影响细胞的增殖[7,8], 于是我们首先检测在siRNA沉默Rac1或者运用Rac1特异性阻滞剂后, wnt-β-Catenin信号通路的靶基因Cyclin D1、c-myc和c-jun. 结果示在沉默Rac1或者Rac1特异性阻滞剂NSC23766作用后, wnt-β-Catenin信号通路的靶基因Cyclin D1(P<0.01)、c-myc(P<0.05)和c-jun(P<0.05)表达明显下降, 尤其以Cyclin D1最为明显, 所以我们推测在胰腺癌中Rac1通过wnt-β-Catenin信号通路而影响胰腺癌细胞的增殖(图3).
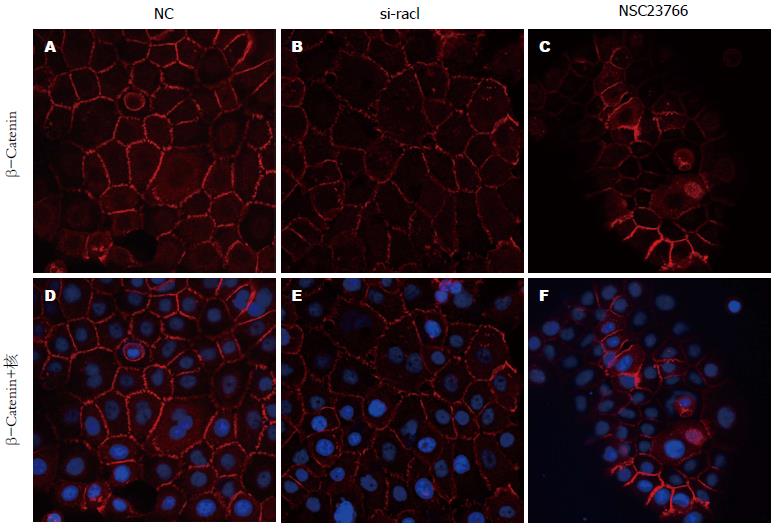
β-Catenin进入细胞核是wnt-β-Catenin信号通路关键调节步骤, 且有文献报道Rac1可以协助β-Catenin进入细胞核[9,10]. 所以我们运用Western blot检测在siRNA沉默Rac1或者Rac1特异性阻滞剂作用后细胞浆和细胞核内β-Catenin的表达量, 结果示在siRNA沉默Rac1或者Rac1特异性阻滞剂作用后, 细胞浆内β-Catenin表达量没有明显的变化, 但细胞核内β-Catenin的表达量明显下降. 接着我们用免疫荧光实验进一步检测在siRNA沉默Rac1或者Rac1特异性阻滞剂作用后细胞膜、细胞浆和细胞核内β-Catenin的表达量, 结果示细胞浆内和细胞膜β-Catenin表达量没有明显的变化, 但细胞核内β-Catenin的表达量明显下降(图4, 5).
Rac1基因全长29 kb, 包含7个外显子, 位于人染色体7p22. Rac1基因的转录产物有1.2 kb和2.5 kb两种. Rac1具有Rho类型的鸟苷三磷酸酶结合区, 与二磷酸鸟嘌呤核苷GDP和三磷酸鸟嘌呤核苷GTP具有高度的亲和性, 与GDP结合时失活, 与GTP结合时激活, Rac1的生物学功能发挥依赖于此两种活性形式间的转换[11-17]. Rac1蛋白在人类大部分肿瘤中没有发现突变体, 但在许多肿瘤中发现有活性增高、高表达现象. 在肺癌、结肠癌、胃癌、头颈部肿瘤等报道有Rac1蛋白表达的异常增高. 吴况鹏等[16]和高丹丹等[17]发现Rac1可以协同β-Catenin进入细胞核, 促进wnt-β-Catenin信号通路靶基因转录, 进而促进细胞的增殖. Rac1还可以通过PAK1等信号分子影响细胞的黏附特性.
本研究发现在胰腺癌细胞系中, Rac1蛋白有促进胰腺癌细胞增殖的作用, 沉默Rac1或者运用Rac1特异性阻滞剂均可以抑制胰腺癌的细胞的增殖. 目前研究证实Rac1可以调节细胞的增殖, Rac1在结肠癌、乳腺癌、胃癌的发生发展中起到重要作用, 与肝癌、前列腺癌等肿瘤的预后有明确关系[18,19], 在Rac1高表达的病例中, 患者的预后明显较差. 这都说明Rac1在各种肿瘤的发生发展的各个时期都起到重要的作用. 本实验研究提示, 沉默Rac1或者Rac1特异性阻滞剂NSC23766可以抑制胰腺癌的增殖, 与文献报道的结果一致.
我们进一步研究发现Rac1是通过促进β-Catenin进入细胞核, 激活wnt-β-Catenin信号通路, 促进wnt-β-Catenin信号通路靶基因的转录, 进而促进胰腺癌细胞的增殖. 既往在结肠癌和乳癌中都有报道, 活化的Rac1可以协同β-Catenin进入细胞核, 促进wnt信号通路靶基因的转录, 进而促进肿瘤的发生发展[14]. wnt-β-Catenin信号通路是当wnt蛋白于细胞表面Frizzled受体家族结合后的一系列反应, 包括Dishevelled受体家族蛋白质的激活及最终细胞核内β-Catenin水平的变化. 当"β-Catenin降解复合物"被抑制后, 胞浆内的β-Catenin得以稳定存在, 部分β-Catenin进入细胞核与TCF/LEF转录因子家族作用并促进特定基因的表达. 本研究进一步地证明了Rac1在胰腺癌中也是通过wnt-β-Catenin信号通路作用, 促进胰腺癌的增殖[8,20-22].
胰腺癌的早期诊断对改善患者的预后非常关键, 但目前缺乏能有效早期辅助诊断的指标. Rac1可以促进胰腺癌细胞的增殖, 很有可能在胰腺癌的发生发展过程中发挥重要的作用. 本实验研究提示, 沉默Rac1或者Rac1特异性阻滞剂NSC23766可以抑制胰腺癌的增殖, 为下一步治疗胰腺癌药物的开发奠定了一定的基础.
RacGTP酶激活蛋白1(Rac GTPase activating protein1, Racl)被证实在多种肿瘤细胞系中表达且在肿瘤的发生发展中起到重要作用, 并已经成为药物开发的热点.
巩鹏, 教授, 大连医科大学附属第一医院普外二科; 赵刚, 副教授, 协和医院胰腺病研究所
巩鹏, 教授, 大连医科大学附属第一医院普外二科; 赵刚, 副教授, 协和医院胰腺病研究所
Bunogiomo发现Rac1可以协同β-Catenin进入细胞核, 促进wnt-β-Catenin信号通路靶基因转录, 进而促进细胞的增殖.
本文首次证明了Rac1有促进胰腺癌细胞增殖的作用, 并初步证明Rac1通过经典的wnt信号通路促进胰腺癌的增殖.
本文对进一步阐述Rac1促进肿瘤的增殖起到积极的作用, 为进一步的药物开发提供了一定的理论依据.
本文首次阐述了Rac1在胰腺癌发病中的作用, 并初步探讨了其机制, 有一定的创新性和实用性.
编辑: 田滢 电编:闫晋利
| 2. | Cui Y, Andersen DK. Diabetes and pancreatic cancer. Endocr Relat Cancer. 2012;19:F9-F26. [PubMed] [DOI] |
| 6. | Goc A, Abdalla M, Al-Azayzih A, Somanath PR. Rac1 activation driven by 14-3-3ζ dimerization promotes prostate cancer cell-matrix interactions, motility and transendothelial migration. PLoS One. 2012;7:e40594. [PubMed] [DOI] |
| 7. | Wu X, Tu X, Joeng KS, Hilton MJ, Williams DA, Long F. Rac1 activation controls nuclear localization of beta-catenin during canonical Wnt signaling. Cell. 2008;133:340-353. [PubMed] [DOI] |
| 8. | Buongiorno P, Pethe VV, Charames GS, Esufali S, Bapat B. Rac1 GTPase and the Rac1 exchange factor Tiam1 associate with Wnt-responsive promoters to enhance beta-catenin/TCF-dependent transcription in colorectal cancer cells. Mol Cancer. 2008;7:73. [PubMed] [DOI] |
| 9. | Esufali S, Bapat B. Cross-talk between Rac1 GTPase and dysregulated Wnt signaling pathway leads to cellular redistribution of beta-catenin and TCF/LEF-mediated transcriptional activation. Oncogene. 2004;23:8260-8271. [PubMed] [DOI] |
| 10. | Esufali S, Charames GS, Bapat B. Suppression of nuclear Wnt signaling leads to stabilization of Rac1 isoforms. FEBS Lett. 2007;581:4850-4856. [PubMed] [DOI] |
| 11. | Durán RV, Hall MN. Regulation of TOR by small GTPases. EMBO Rep. 2012;13:121-128. [PubMed] [DOI] |
| 12. | Wertheimer E, Gutierrez-Uzquiza A, Rosemblit C, Lopez-Haber C, Sosa MS, Kazanietz MG. Rac signaling in breast cancer: a tale of GEFs and GAPs. Cell Signal. 2012;24:353-362. [PubMed] [DOI] |
| 14. | 顾 颖, 韩 素萍, 张 晔. RhoA、RAC1在宫颈癌组织中的表达及其临床意义. 苏州大学学报(医学版). 2008;28:115-118. |
| 16. | 吴 况明, 蒋 良友. Rac1和Pak1在胃癌中的表达及意义. 国际病理科学与临床杂志. 2010;30:469-472. |
| 18. | 黄 娟, 郎 楠, 刘 明, 陈 济, 周 继陶, 朱 亚杰, 刘 素蕊, 唐 秋琳, 陈 向征, 毕 锋. Rac1小干扰RNA对胃肠道肿瘤细胞恶性生物学行为的影响. 四川大学学报(医学版). 2009;40:588-592. |
| 20. | 王 燕忠, 王继英 唐克晶, 王 敏, 邢 海燕, 田 征, 饶 青. Rac1介导E-cadherin下调引起的白血病细胞行为改变. 中国病理生理杂志. 2010;26:1670-1673. |
| 21. | 陈 保东, 高 永中, 蒋 太鹏, 丁 建军, 姜 晓丹, 徐 如祥. Rac1在垂体腺瘤组织中的表达及意义. 中国微侵袭神经外科杂志. 2010;15:268-270. |