修回日期: 2013-03-06
接受日期: 2013-04-07
在线出版日期: 2013-04-28
目的: 观察小分子RNA沉默HMGA2在胃癌细胞株MKN-45的表达, 研究HMGA2对Wnt/β-Catenin通路中主要分子β-Catenin以及下游靶分子c-myc、Cyclin D1的表达量及转录活性的影响, 探讨HMGA2对Wnt/β-Catenin信号转导通路的影响.
方法: 构建针对人HMGA2基因的shRNA真核表达载体, 瞬时转染人胃癌细胞株MKN-45, 用RT-PCR、Western blot分别检测转染后shHMGA2组、scrambled组和空白对照组细胞中HMGA2 mRNA和蛋白的表达情况, 评估抑制效应; 分别检测转染后3组细胞中的β-Catenin、c-myc、Cyclin D1 mRNA和蛋白的表达水平.
结果: 转染48 h后shHMGA2-1组的HMGA2 mRNA相对表达量(0.58±0.07), 与shHMGA2-2组(0.92±0.13)、shHMGA2-3组(0.90±0.16)、scrambled组(1.07±0.14)及空白对照组(1.19±0.09)相比有统计学意义(P<0.05), 其他4组相比无统计学意义(P>0.05); 转染48 h后shHMGA2-1组的HMGA2沉默效果最好, HMGA2 mRNA表达明显下降,抑制率51.3%; 故选用质粒shHMGA2-1继续后续实验; Western blot结果显示转染72 h后shHMGA2-1组HMGA2蛋白相对表达量为(0.11±0.03), 与scrambled组(0.48±0.12)及空白对照组(0.55±0.08)相比有统计学意义(P<0.05), HMGA2蛋白表达明显下降, 抑制率80%; 沉默干扰HMGA2 48 h和72 h后, β-Catenin mRNA和蛋白表达水平在空白对照组(1.07±0.02, 0.69±0.04)与scrambled组(0.91±0.02, 0.67±0.10)中无明显差异(P>0.05), 而shHMGA2-1组(0.53±0.04, 0.44±0.05)较之两组有明显的下降(P<0.05); shHMGA2-1组中c-myc mRNA和蛋白相对表达量为(0.39±0.04, 0.25±0.07)较之空白对照组(0.88±0.05, 0.75±0.09)、scrambled组(0.84±0.03, 0.66±0.10)有明显下降(P<0.05), 后两组相比较无统计学意义(P>0.05); shHMGA2-1组中Cyclin D1 mRNA和蛋白相对表达量为(0.31±0.02, 0.12±0.01)较之空白对照组(0.52±0.03, 0.73±0.12)、scrambled组(0.51±0.01, 0.63±0.07)有明显下降(P<0.05), 后两组相比较无统计学意义(P>0.05).
结论: RNAi载体能有效地抑制HMGA2在胃癌细胞株MKN-45中的表达, 沉默干扰HMGA2抑制了Wnt/β-Catenin通路中的主要分子β-Catenin以及下游靶分子c-myc、Cyclin D1的表达, HMGA2基因可能是通过调控Wnt/β-Catenin通路对胃癌细胞生长和凋亡发挥作用的.
核心提示: HMGA2在胃癌组织中高表达, 而在正常胃组织中几乎不表达. 沉默干扰HMGA2基因后, β-Catenin mRNA和蛋白的表达水平受到抑制, 使得β-Catenin在胞质中降解, Wnt/β-Catenin信号转导通路下游的靶分子c-myc、Cyclin D1 mRNA和蛋白的表达水平也受到抑制, 从而抑制细胞的生长增殖和促进细胞的凋亡. HMGA家族可能通过Wnt/β-Catenin信号转导通路最终导致胃癌的发生.
引文著录: 姜丹, 赖铭裕, 陈家庄, 韦丽秀. 沉默干扰HMGA2对胃癌细胞Wnt/β-Catenin信号转导通路的影响. 世界华人消化杂志 2013; 21(12): 1062-1069
Revised: March 6, 2013
Accepted: April 7, 2013
Published online: April 28, 2013
AIM: To induce HMGA2 gene silencing with shRNAs in gastric cancer cell line MKN-45 and to study the interaction between HMGA2 and the Wnt/β-Catenin signaling pathway.
METHODS: A shRNA eukaryotic expression vector that expresses shRNAs of HMGA2 was constructed and transfected into gastric cancer cell line MKN-45. The mRNA and protein expression of HMGA2 was measured by RT-PCR and Western blot 48 h and 72 h after transfection to evaluate the effect of RNA interference. The mRNA and protein expression of β-Catenin, c-myc and cyclin D1 were also measured by RT-PCR and Western blot.
RESULTS: The expression of HMGA2 mRNA 48 h after transfection was significantly lower in the shHMG-A2-1 group than in the shHMGA2-2 group, shHMGA2-3 group, scrambled group and blank control group (0.58 ± 0.07 vs 0.92 ± 0.13, 0.90 ± 0.16, 1.07 ± 0.14, 1.19 ± 0.09, all P < 0.05), but showed no significant difference among the latter four groups (all P > 0.05). Since HMGA2 expression was most significantly silenced in the shHMGA2-1 group (51.3% at 48 h), the plasmid pLLU2G-shHMGA2-1 was chosen for use in subsequent experiments. The expression of HMGA2 protein 72 h after transfection in the shHMGA2-1 group was significantly lower than that in the scrambled group and blank group (0.11 ± 0.03 vs 0.48 ± 0.12, 0.55 ± 0.08, both P < 0.05). The silencing efficiency of transfection of shHMGA2-1 was 80% at 72 h. After silencing the HMGA2 gene, the expression of β-Catenin, c-myc and cyclin D1 mRNAs and proteins was significantly inhibited in the shHMGA2-1 group compared to the blank control group and the scrambled group (β-Catenin mRNA: 0.53 ± 0.04 vs 1.07 ± 0.02, 0.91 ± 0.02; β-Catenin protein: 0.44 ± 0.05 vs 0.69 ± 0.04, 0.67 ± 0.10; c-myc mRNA: 0.39 ± 0.04 vs 0.88 ± 0.05, 0.84 ± 0.03; c-myc protein: 0.25 ± 0.07 vs 0.75 ± 0.09, 0.66 ± 0.10; cyclin D1 mRNA: 0.31 ± 0.02 vs 0.52 ± 0.03, 0.51 ± 0.01; cyclin D1 protein: 0.12 ± 0.01 vs 0.73 ± 0.12, 0.61 ± 0.07; all P < 0.05).
CONCLUSION: The recombinant plasmid PLLU2G-shHMGA2 could effectively inhibit the expression of HMGA2 gene in gastric cancer cell line MKN-45. Silencing of the HMGA2 gene restrained the expression of β-Catenin and its downstream target genes c-myc and cyclin D1. HMGA2 controls the growth and apoptosis of gastric cancer cells possibly via the Wnt/β-Catenin signal pathway.
- Citation: Jiang D, Lai MY, Chen JZ, Wei LX. Effect of HMGA2 gene silencing on Wnt/β-Catenin signaling pathway in gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(12): 1062-1069
- URL: https://www.wjgnet.com/1009-3079/full/v21/i12/1062.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i12.1062
胃癌是我国最常见的恶性肿瘤之一, 其死亡率仅次于肺癌、肝癌, 全球每年新发胃癌病例愈百万, 其中41%发生在中国. 全球每年因胃癌死亡80万人, 中国占35%[1]. 胃癌的发生、发展与原癌基因的激活、抑癌基因的失活以及凋亡相关基因的异常表达等均有密切的关系. 尽管近年来对胃癌的研究取得了进展, 但大多数患者有临床症状时都已处于晚期并出现远处转移. 高迁移率蛋白(high mobility group protein, HMG)是广泛存在真核生物中的一系列染色质相关蛋白, 由于其在聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis, PAGE)中迁移能力较强而得名. HMG包括3个家族: HMGA、HMGB、HMGN. HMGA家族由HMGA1a、HMGA1b、HMGA1c、HMGA2 4种蛋白组成. 前3种蛋白由同一基因编码, 转录后被剪接成不同长度的蛋白质. HMGA2则由一个断裂基因编码. 高迁移率蛋白A家族每种蛋白都含有3个AT-钩结构与和1个酸性C末端. HMGA2基因定位于人类第12号染色体的q15区, 由4个内显子及5个外显子组成, 1-3号外显子负责编码AT-钩结构, 4号外显子负责编码AT-钩结构与酸性C末端的间隔区, 5号外显子则负责编码酸性C末端. HMGA2基因的表达产物, 是一种非组蛋白染色体蛋白, 本身缺乏转录活性, 但能通过AT-钩与DNA结合而改变染色质的结构, 或者直接与相关蛋白结合发生作用, 调节其他基因的转录, 从而影响胚胎形成、组织发育和肿瘤发生等多个过程, 又被称为"构架转录因子". HMGA2在胚胎期以及不成熟组织中大量表达, 而在分化成熟的组织中几乎不表达[2]. 研究表明HMGA2蛋白的表达参与人类多种肿瘤的发生, 如肺癌[3]、卵巢癌[4]、直肠癌[5]、胰腺癌[6]、脂肪瘤[7]等. 这些肿瘤的发生、发展均与HMGA2基因表达异常有关, 并发现其表达增强与预后有关, 是一个潜在肿瘤标志物. Motoyama等[8]对110例胃癌患者的HMGA2 mRNA的表达研究发现, HMGA2 mRNA的高表达. 但是有关HMGA2对胃癌细胞的增殖生长和凋亡的影响以及在胃癌的发生机制中尤其是在信号转导通路及其分子机制的研究报道较少. Wnt/β-Catenin信号通路, 是经典Wnt信号途径, 当Wnt信号存在时, Wnt蛋白与卷曲蛋白胞外区结合, 在辅助受体低密度脂蛋白受体相关蛋白5和6协同作用下, 胞质中Dsh蛋白被募集至胞膜下, 使糖原合酶激酶3β磷酸化失活并从轴蛋白上脱落, 则β连环蛋白不能被降解, 大量游离的β连环蛋白在胞质中聚集并进入胞核内与转录因子T细胞因子/淋巴细胞增强因子结合, 启动一系列下游靶分子如c-myc、Cyclin D1的表达. 下游靶分子大多数是参与细胞的增殖与凋亡. β-Catenin作为Wnt信号通路的核心分子, 他在细胞质中的累积是信号激活的关键. 近年国内外研究, Wnt/β-Catenin信号通路的异常激活与人类多种恶性肿瘤有关, 如: 胃癌、直肠癌、肝癌、乳腺癌、卵巢癌、前列腺癌、恶性黑色素瘤等. Cheng等[9]在胃癌组织(包括弥漫型和肠型胃癌)中检测到β-Catenin异常的核内积聚, 而且与淋巴结远处转移及肿瘤分期呈正相关. Ebert等[10]在部分胃癌组织中发现β-Catenin表达增高, 并检测到β-Catenin基因突变. HMGA2与Wnt/β-Catenin信号通路都是肿瘤发生的研究热点, 特别在胃癌中都有异常的激活. β-Catenin进入细胞核内与TCF/LEF结合, 激活下游一系列的下游靶分子发生效应. HMGA2作为构架转录因子, 与含有HMG的DNA结合框的TCFs家族TCF/LEF[11]有一定的相似结构域. 我们大胆猜测HMGA2的异常表达可能会激活Wnt/β-Catenin信号通路, 进而促进肿瘤的发生. 本研究为观察shRNA沉默HMGA2基因在胃癌细胞株MKN-45的表达, 研究HMGA2对Wnt/β-Catenin信号转导通路中主要分子β-Catenin以及下游靶分子c-myc、Cyclin D1的表达量及转录活性的影响, 为HMGA2基因的在胃癌的作用机制做初步探讨, 从而给胃癌的HMGA2靶向基因治疗提供依据.
人胃癌细胞株MKN-45购自ATCC细胞库; DMEM培养基、PVDF膜购自Solarbio公司; 胎牛血清购自杭州四季青公司; LipofectamineTM2000购自美国Invitrogen公司; 质粒PLL2G-shHMGA2、PLL2G-scrambled均由赛业(广州)生物科技有限公司设计合成; TRIzol抽提试剂购自上海生工生物工程有限公司; M-MLV逆转录试剂盒、Dream Taq Green PCR Master Mix购自Fermentas公司; DNA Marker-B(100-600 bp)购自美国Bio Basic Inc公司; RIPA裂解液(强)、苯甲基磺酰氟、超敏ECL化学发光试剂盒、SDS-PAGE蛋白上样缓冲液(5×)购自碧云天生物科技有限公司; 鼠抗人HMGI-C单克隆抗体、鼠抗人β-Catenin单克隆抗体、鼠抗人c-myc单克隆抗体、鼠抗人Cyclin D1单克隆抗体均购自美国Santa Cruz公司; HRP标记山羊抗鼠二抗、鼠抗人β-Cactin单克隆抗体购自北京中杉金桥有限公司; 预染蛋白Marker购自美国BBI公司; 琼脂糖粉购自西班牙BIOWEST; 丙烯酰胺、N,N-亚甲双丙烯酰胺、过硫酸铵(AP)、Tris碱、甘氨酸、SDS、TEMED、Tween-20、NaCl、显影粉、定影粉、甲醇、氯仿、异丙醇、无水乙醇、DEPC处理水、核酸染料均购自上海生工生物工程有限公司.
1.2.1 shRNA表达载体的构建和鉴定: 根据NCBI GenBank上登录的人类HMGA2基因mRNA序列资料(登录号: NM-003483), 由赛业(广州)生物科技有限公司设计合成设计、合成并鉴定4对shRNAoligo, 构建的重组质粒分别命名为PLL2G-shHMGA2-1、PLL2G-shHMGA2-2, PLL2G-shHMGA2-3、PLL2G-scrambled(阴性对照).
1.2.2 细胞培养及瞬时转染: 人胃癌细胞MKN-45培养在含10%胎牛血清的DMEM培养基, 置于37 ℃、50 mL/L CO2培养箱中培养. 转染前1 d, 用0.25%胰酶+EDTA消化细胞并计数, 以4×105/孔的密度种在6孔板, 用含血清、无双抗的DMEM培养基放在CO2培养箱培养过夜. 使其在转染当天细胞密度达80%-90%. 分别用250 μL的DMEM稀释4 μg质粒、4 μL LipofectamineTM2000, 5 min后将两者混合, 室温放置20 min后将混合物加入到6孔板中, 用无血清的DMEM培养基继续培养, 6 h后换液. 实验分组: 空白对照组(只加脂质体)、scrambled组(转染阴性质粒)、shHMGA2-1组、shHMGA2-2组、shHMGA2-1组(转染HMGA2的阳性质粒).
1.2.3 逆转录聚合酶链反应RT-PCR检测各组细胞的HMGA2、β-Catenin、c-myc、Cyclin D1的mRNA表达: TRIzol抽提试剂提取细胞总RNA, 测定其浓度及纯度(A260-280为1.8-2.0) 根据GenBank中人类HMGA2(登录号: NM_003483)、β-Catenin(登录号: NM_001904)、c-myc(登录号: NM_002467)、Cyclin D1(登录号: NM_053056)基因序列, 以GAPDH为内参照, 利用引物设计软件Primer5设计引物序列. 引物由上海生工生物工程有限公司合成: HMGA2上游序列: AAGCAGCAGCAAGAACCAAC, 下游序列: AGTCCTCTTCGGCAGACTCTT, 扩增产物大小为230 bp, 退火温度为58 ℃; β-Catenin上游序列: CCATCATCGTGAGGGCTTAC, 下游序列: TGCTTTCTTGGTTGCCATAAG, 扩增产物大小为269 bp, 退火温度为62 ℃; c-myc上游序列: GAACTTACAACACCCGAGCAAG, 下游序列: TTCTCCTCCTCGTCGCAGTA, 扩增产物大小为264 bp, 退火温度为60 ℃; Cyclin D1上游序列: ATGCCAACCTCCTCAACGACC, 下游序列: TCAGGGGGATGGTCTCCTTCA, 扩增产物大小为303 bp, 退火温度为60 ℃; GAPDH上游序列: GAAGGTGAAGGTCGGAGTC, 下游序列: TCACACCCATGACGAACAT, 扩增产物大小为401 bp, 退火温度为58 ℃; 以反应总体积25 μL进行PCR扩增反应. 反应条件: 95 ℃变性5 min, 94 ℃变性40 s, 58 ℃退火40 s, 72 ℃延伸40 s, 共30个循环, 72 ℃终末延伸10 min. 取终末产物进行琼脂糖凝胶电泳, 采用Bio-Rad Gel doc2000凝胶成像分析系统扫描, 保存电泳图并分析实验结果. 对电泳结果图像进行条带灰度测定, 最终以目的基因条带与内参基因条带的灰度值的比值作为该目的基因的表达值.
1.2.4 Western blot检测转染后各组HMGA2、β-Catenin、c-myc、Cyclin D1蛋白的表达: 用RIPA裂解液裂解细胞, 离心, 得到的上清与上样缓冲液4:1混合, 经变性, 即得蛋白质样品, 将样品加入凝胶孔道中进行电泳, 100 mA稳流状态下转膜, 将蛋白转至PVDF膜, 用5%脱脂牛奶封闭, 再把膜置于一抗(1:500)稀释液中摇床冰上孵育过夜, 次日用TBST洗膜后置于二抗(1:10 000)稀释液中室温孵育1 h, 洗膜, 显影, 定影, 以β-actin为内参照经凝胶分析软件分析其灰度值, 计算HMGA2、β-Catenin、c-myc、Cyclin D1和β-actin蛋白在各组表达条带的灰度值, 两者灰度值的比值反映各组蛋白的表达.
统计学处理 应用SPSS13.0软件包进行统计学处理, 所有实验数据均以mean±SD表示, 对各指标进行单因素方差分析(one-way ANOVA), 两组均数间的比较用SNK检验, P<0.05为差异有统计学意义.
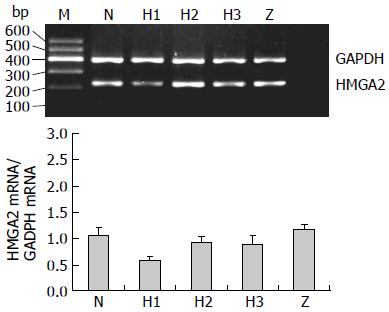
5组实验组均有HMGA2 mRNA的表达, shHMGA2-2组、shHMGA2-3组以及scrambled组较之于空白对照组没有明显改变(P>0.05), shHMGA2-1组的HMGA2 mRNA的表达显著下调(P<0.05), 说明质粒PLL2G-shHMGA2-1转染MKN-45细胞成功, 其沉默干扰效果较质粒PLL2G-shHMGA2-2、质粒PLL2G-shHMGA2-3的明显, 其沉默干扰HMGA2 mRNA沉默表达率为51.26%. 后续实验研究即选择质粒PLL2G-shHMGA2-1作为阳性对照组(表1, 图1).
| 分组 | HMGA2的平均灰度值 |
| scrambled组 | 1.07±0.14 |
| shHMGA2-1组 | 0.58±0.07a |
| shHMGA2-2组 | 0.92±0.13 |
| shHMGA2-3组 | 0.90±0.16 |
| 空白对照组 | 1.19±0.09 |
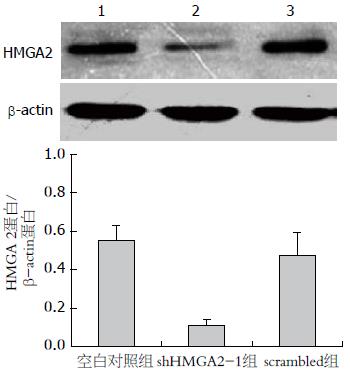
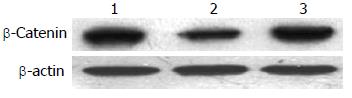
Western blot结果显示: 与空白对照组相比, scrambled组蛋白的表达相对于空白对照组无明显差异(P>0.05), 而shHMGA2-1组的蛋白表达明显下降(P<0.05), 其沉默表达下降80%(图2, 表2).
| 分组 | HMGA2的平均灰度值 |
| scrambled组 | 0.48±0.12 |
| shHMGA2-1组 | 0.11±0.03a |
| 空白对照组 | 0.55±0.08 |
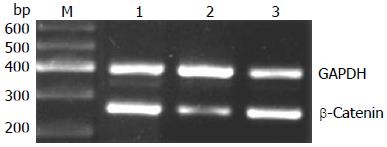
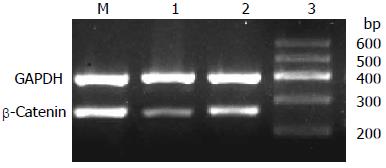
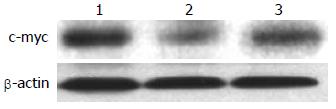
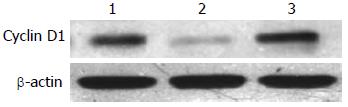
沉默干扰HMGA2 48 h后, β-Catenin mRNA表达水平在空白对照组(1.07±0.02)与scrambled组(0.91±0.02)中无明显差异(P>0.05), 而shHMGA2-1组(0.53±0.04)较之两组有明显的下降(P<0.05); c-myc mRNA相对表达量在shHMGA2-1组中为(0.39±0.04)较之空白对照组(0.88±0.05)、scrambled组(0.84±0.03)有明显下降(P<0.05), 后两组相比较无统计学意义(P>0.05); Cyclin D1 mRNA相对表达量在shHMGA2-1组中为(0.31±0.02)较之空白对照组(0.52±0.03)、scrambled组(0.51±0.01)有明显下降(P<0.05), 后两组相比较无统计学意义(P>0.05)(图3-5).
shHMGA2-1组; 3: scrambled组; M: Marker.
沉默干扰HMGA2 72 h后, β-Catenin蛋白的表达水平在空白对照组(0.69±0.04)与scrambled组(0.67±0.10)中无明显差异(P>0.05), 而shHMGA2-1组(0.44±0.05)较之两组有明显的下降(P<0.05); c-myc蛋白相对表达量在shHMGA2-1组中为(0.25±0.07)较之空白对照组(0.75±0.09)、scrambled组(0.66±0.10)有明显下降(P<0.05), 后两组相比较无统计学意义(P>0.05); Cyclin D1蛋白相对表达量在shHMGA2-1组中为(0.12±0.01)较之空白对照组(0.73±0.12)、scrambled组(0.61±0.07)有明显下降(P<0.05), 后两组相比较无统计学意义(P>0.05)(图6-8).
胃癌是我国最常见的恶性肿瘤之一, 其死亡率仅次于肺癌、肝癌. 全球每年新发胃癌病例愈百万, 其中41%发生在中国. 全球每年因胃癌死亡80万人, 中国占35%[1]. 胃癌的治疗要采用个体化、规范化的综合治疗模式, 目前治疗手段主要以手术为主, 辅助以放化、疗结合免疫治疗、分子生物的靶向治疗和营养支持等.
基因治疗是20世纪80年代发展起来的人类医学分子遗传学中的新领域, 发展非常迅速, 而安全有效的基因载体是成功进行基因治疗的先决条件, 也是目前主要的技术路线. RNAi是近年来发展起来的一项新技术, 是由内源性或外源的双链RNA导入细胞而引起同源的mRNA降解, 进而抑制其相应的基因表达[12]. RNAi技术在子宫颈癌、乳腺癌、肝癌等人类肿瘤细胞株体外抑制实验中获得了成功[13-15]. 陈鹏等[16]应用RNAi技术构建Livin的siRNA载体转染至胃癌细胞, 并使用RT-PCR检测胃癌细胞mRNA水平变化, MTT检测细胞增殖, 流式细胞仪检测细胞凋亡, 结果显示转染siRNA组Livin mRNA表达显著低于对照组, 并且胃癌细胞生长明显抑制, 凋亡率显著增加. 他具有特异、高效等突出优点, 现已被广泛用于胃癌基因治疗方面的研究与探索.
本研究通过构建3个针对HMGA2基因的RNAi载体PLLU2G-shHMGA2以及1个阴性序列的载体, 经限制性酶切及基因测序证实, 通过细胞内GFP荧光表达, 证实转染效率. 转染胃癌细胞MKN-45成功, 为下一步研究奠定基础.
HMGA2是一种非组蛋白染色体蛋白, 本身缺乏转录活性, 但能通过AT-钩与DNA结合而改变染色质的结构, 或者直接与相关蛋白结合发生作用, 调节其他基因的转录, 从而影响胚胎形成、组织发育和肿瘤发生等多个过程, 又被称为"构架转录因子"[17-19]. 研究表明HMGA2基因在一些恶性肿瘤中可以作为诊断的分子标志物判断预后的独立因素. Hristov等[6]认为HMGA2在胰腺导管腺癌中表达量增加, 与淋巴结转移和肿瘤分级呈正相关, 可能是胰腺癌的一个重要的生物标志. Wang等[20]研究发现HMGA2是大肠癌的重要生物标志物. Meyer等[21]对34例非小细胞肺癌及相应的正常组织(其中17例腺癌、17例鳞癌)通过定量RT-PCR及免疫组织化学研究发现, HMGA2蛋白明显高于正常组, HMGA2的过表达见于所有的肺癌组织, 因此认为HMGA2是肺癌检测的潜在肿瘤标志物. Malek等[4]通过基因沉默技术研究HMGA2对卵巢癌细胞株Ovcar-3和OAW-42(都有HMGA2的过表达)生存、增殖及细胞周期的影响, 结果显示细胞的增长受到抑制, 凋亡增减, 进入S期的细胞明显减少, 认为HMGA2基因可能为卵巢癌治疗的潜在靶点. Sarhadi等[22]通过对152例NSCLC患者组织中HMGA1和HMGA2的表达的研究, 评估HMGA作为肺癌标记的可行性. 发现肺癌组织较正常肺组织中HMGA1和HMGA2明显高表达.
研究表明HMGA2在胃癌组织中高表达, 而在正常胃组织中几乎不表达. Motoyama等[8]对110例胃癌患者的HMGA2 mRNA的表达研究发现, HMGA2 mRNA的高表达与胃癌患者的浆膜浸润淋巴结转移及静脉的浸润成正相关, 但与性别、肿块大小和组织病理的类型无明显相关性. 本研究转染重组质粒后, 用RT-PCR、Western blot检测其各组细胞的沉默效果, 结果显示转染48 h后shHMGA2-1组HMGA2 mRNA的抑制率为51.3%, 而转染72 h后shHMGA2-1组HMGA2蛋白抑制率为80%, 表明沉默效果已经在基因和在蛋白的层面上发挥作用.
在胃癌发生发展中, HMGA2的作用的分子机制不是非常清楚, 以往研究认为HMGA2的表达可能与胃癌临床转移和进展能力有关, 而其主要机制可能是HMGA2促进胃癌细胞EMT的发生[23-25]. Ohshima等[26]认为HMGA2与let-7家族负向调控, 与胃癌的侵袭性相关. HMGA2通过转化一些分子信号通路, 如: 生长因子β信号通路和Ras信号通路来完成的肿瘤的发生. Watanabe等[27]认为HMGA2表达上调激活Ras信号通路, 从而导致胰腺癌的发生.
Wnt/β-Catenin通路是经典Wnt信号途径, 越来越多的研究表明, Wnt信号通路不仅在调控胚胎发育中起关键作用, 而且他与人类多种恶性肿瘤的发生和发展也是密切相关. 目前, Wnt信号通路与人类肿瘤的关系备受关注, 是国际前沿的一个研究热点. 在早期的Wnt信号通路的缺陷可导致多种生物发育缺陷, 而癌基因、抑癌基因或Wnt信号通路成分(如APC、β-Catenin、Axin等)的突变致其不恰当的激活与肿瘤的发生、发展有关, 尤其与消化系肿瘤关系密切[28]. Hörig等[29]的实验显示: 特异地阻断裸鼠体内人APC突变的CRC细胞系β-Catenin表达后, 明显抑制裸鼠体内肿瘤生长, 部分肿瘤可消失.
研究表明当Wnt信号存在时, β-Catenin不能被降解, 大量游离的β-Catenin在胞质中聚集并进入胞核内与转录因子T细胞因子/淋巴细胞增强因子结合, 启动一系列下游靶分子如c-myc、Cyclin D1的表达. 下游靶分子大多数是参与细胞的增殖与凋亡. 本研究表明沉默干扰HMGA2基因后, β-Catenin mRNA和蛋白的表达水平受到抑制, Wnt/β-Catenin信号转导通路下游的靶分子c-myc、Cyclin D1 mRNA和蛋白的表达水平也受到抑制. 抑制HMGA2的表达, 使得β-Catenin在胞质中降解, 抑制Wnt/β-Catenin信号转导通路下游的靶分子, 从而抑制细胞的生长增殖和促进细胞的凋亡. 而与Akaboshi等[30]研究发现在胃癌细胞中沉默干扰HMGA1能抑制Wnt/β-Catenin通路的激活Wnt/β-Catenin信号转导通路, 最终导致胃癌的发生, 抑制细胞的生长增值和促进细胞的凋亡. 表明HMGA家族可能通过Wnt/β-Catenin信号转导通路, 最终导致胃癌的发生结果相一致.
但本实验只是针对主要基因β-Catenin及下游的靶分子c-myc、Cyclin D1进行检测, 而Wnt/β-Catenin通路中还有许多的基因和下游靶基因没有做相关的检测, 还有HMGA2是通过什么机制导致β-Catenin异常累积等方面没有做相关的研究. 总之探索并阐明这一机制将为临床预测肿瘤患者的诊断、预后、转移等提供参考指标, 同时也能为肿瘤分子靶向治疗和开发新药物提供一个突破点.
HMGA2与Wnt/β-Catenin信号通路都是肿瘤发生的研究热点, 他们的表达产物可以调节其他基因的转录, 参与细胞的增殖与凋亡, 有研究表明两者在胃癌中都有异常的激活, 但是有关HMGA2对胃癌细胞的增殖生长和凋亡的影响以及在胃癌的发生机制中尤其是在信号转导通路及其分子机制的研究报道相对较少.
樊晓明, 教授, 主任医师, 复旦大学附属金山医院消化科
Wnt/β-Catenin信号通路中β-Catenin进入细胞核内与TCF/LEF结合, 激活下游一系列的靶分子发生效应. HMGA2作为构架转录因子, 与含有HMG的DNA结合框的TCFs家族TCF/LEF有部分相似结构域. HMGA2可能通过Wnt/β-Catenin 信号转导通路最终导致胃癌的发生.
Akaboshi等研究发现在胃癌细胞中沉默干扰HMGA1能抑制Wnt/β-Catenin通路激活Wnt/β-Catenin信号转导通路, 最终导致胃癌的发生.
本研究通过构建shRNA沉默HMGA2基因在胃癌细胞株MKN-45的表达, 研究HMGA2对Wnt/β-Catenin信号转导通路中主要分子β-Catenin以及下游靶分子c-myc、Cyclin D1的表达量及转录活性的影响, 为HMGA2与Wnt/β-Catenin信号通路在胃癌的相互作用机制作初步探讨, 从而给胃癌的HMGA2靶向基因治疗提供依据.
本文通过构建针对人HMGA2基因的shRNA真核表达载体, 瞬时转染人胃癌细胞株MKN-45, 用RT-PCR、Western blot分别检测转染后HMGA2 mRNA和蛋白的表达情况及细胞中的β-Catenin、c-myc、Cyclin D1 mRNA和蛋白的表达水平, 以研究HMGA2对Wnt/β-Catenin信号转导通路中主要分子β-Catenin以及下游靶分子c-myc、Cyclin D1的表达量及转录活性的影响, 从而给胃癌的HMGA2靶向基因治疗提供依据.
本文探讨了沉默干扰HMGA2对Wnt/β-Catenin信号转导通路的影响, 对HMGA2基因在胃癌发病中的作用及可能的作用机制提供了理论依据.
编辑: 田滢 电编:闫晋利
| 2. | Cleynen I, Van de Ven WJ. The HMGA proteins: a myriad of functions (Review). Int J Oncol. 2008;32:289-305. [PubMed] |
| 3. | Di Cello F, Hillion J, Hristov A, Wood LJ, Mukherjee M, Schuldenfrei A, Kowalski J, Bhattacharya R, Ashfaq R, Resar LM. HMGA2 participates in transformation in human lung cancer. Mol Cancer Res. 2008;6:743-750. [PubMed] [DOI] |
| 4. | Malek A, Bakhidze E, Noske A, Sers C, Aigner A, Schäfer R, Tchernitsa O. HMGA2 gene is a promising target for ovarian cancer silencing therapy. Int J Cancer. 2008;123:348-356. [PubMed] [DOI] |
| 5. | Huang ML, Chen CC, Chang LC. Gene expressions of HMGI-C and HMGI(Y) are associated with stage and metastasis in colorectal cancer. Int J Colorectal Dis. 2009;24:1281-1286. [PubMed] [DOI] |
| 6. | Hristov AC, Cope L, Reyes MD, Singh M, Iacobuzio-Donahue C, Maitra A, Resar LM. HMGA2 protein expression correlates with lymph node metastasis and increased tumor grade in pancreatic ductal adenocarcinoma. Mod Pathol. 2009;22:43-49. [PubMed] [DOI] |
| 7. | Bartuma H, Panagopoulos I, Collin A, Trombetta D, Domanski HA, Mandahl N, Mertens F. Expression levels of HMGA2 in adipocytic tumors correlate with morphologic and cytogenetic subgroups. Mol Cancer. 2009;8:36. [PubMed] [DOI] |
| 8. | Motoyama K, Inoue H, Nakamura Y, Uetake H, Sugihara K, Mori M. Clinical significance of high mobility group A2 in human gastric cancer and its relationship to let-7 microRNA family. Clin Cancer Res. 2008;14:2334-2340. [PubMed] [DOI] |
| 9. | Cheng XX, Wang ZC, Chen XY, Sun Y, Kong QY, Liu J, Li H. Correlation of Wnt-2 expression and beta-catenin intracellular accumulation in Chinese gastric cancers: relevance with tumour dissemination. Cancer Lett. 2005;223:339-347. [PubMed] [DOI] |
| 10. | Ebert MP, Fei G, Kahmann S, Müller O, Yu J, Sung JJ, Malfertheiner P. Increased beta-catenin mRNA levels and mutational alterations of the APC and beta-catenin gene are present in intestinal-type gastric cancer. Carcinogenesis. 2002;23:87-91. [PubMed] [DOI] |
| 11. | Watanabe K, Dai X. A WNTer revisit: new faces of β-catenin and TCFs in pluripotency. Sci Signal. 2011;4:pe41. [PubMed] [DOI] |
| 13. | Gao Y, Shan ZY, Wang H, Zhang HM, Teng WP. Inhibitory effect of shRNA targeting GPR48 on invasion and metastasis of human cervical carcinoma cell line HeLa. Ai Zheng. 2009;28:104-107. [PubMed] |
| 14. | Bluff JE, Amarzguioui M, Slattery J, Reed MW, Brown NJ, Staton CA. Anti-tissue factor short hairpin RNA inhibits breast cancer growth in vivo. Breast Cancer Res Treat. 2011;128:691-701. [PubMed] [DOI] |
| 15. | Zhang D, Liu J, Wang Y, Chen J, Chen T. shRNA-mediated silencing of Gli2 gene inhibits proliferation and sensitizes human hepatocellular carcinoma cells towards TRAIL-induced apoptosis. J Cell Biochem. 2011;112:3140-3150. [PubMed] [DOI] |
| 17. | Young AR, Narita M. Oncogenic HMGA2: short or small? Genes Dev. 2007;21:1005-1009. [PubMed] [DOI] |
| 18. | Meza-Zepeda LA, Berner JM, Henriksen J, South AP, Pedeutour F, Dahlberg AB, Godager LH, Nizetic D, Forus A, Myklebost O. Ectopic sequences from truncated HMGIC in liposarcomas are derived from various amplified chromosomal regions. Genes Chromosomes Cancer. 2001;31:264-273. [PubMed] [DOI] |
| 19. | Odero MD, Grand FH, Iqbal S, Ross F, Roman JP, Vizmanos JL, Andrieux J, Laï JL, Calasanz MJ, Cross NC. Disruption and aberrant expression of HMGA2 as a consequence of diverse chromosomal translocations in myeloid malignancies. Leukemia. 2005;19:245-252. [PubMed] [DOI] |
| 20. | Wang X, Liu X, Li AY, Chen L, Lai L, Lin HH, Hu S, Yao L, Peng J, Loera S. Overexpression of HMGA2 promotes metastasis and impacts survival of colorectal cancers. Clin Cancer Res. 2011;17:2570-2580. [PubMed] [DOI] |
| 21. | Meyer B, Loeschke S, Schultze A, Weigel T, Sandkamp M, Goldmann T, Vollmer E, Bullerdiek J. HMGA2 overexpression in non-small cell lung cancer. Mol Carcinog. 2007;46:503-511. [PubMed] [DOI] |
| 22. | Sarhadi VK, Wikman H, Salmenkivi K, Kuosma E, Sioris T, Salo J, Karjalainen A, Knuutila S, Anttila S. Increased expression of high mobility group A proteins in lung cancer. J Pathol. 2006;209:206-212. [PubMed] [DOI] |
| 23. | Thuault S, Valcourt U, Petersen M, Manfioletti G, Heldin CH, Moustakas A. Transforming growth factor-beta employs HMGA2 to elicit epithelial-mesenchymal transition. J Cell Biol. 2006;174:175-183. [PubMed] [DOI] |
| 25. | Zha L, Wang Z, Tang W, Zhang N, Liao G, Huang Z. Genome-wide analysis of HMGA2 transcription factor binding sites by ChIP on chip in gastric carcinoma cells. Mol Cell Biochem. 2012;364:243-251. [PubMed] [DOI] |
| 26. | Ohshima K, Inoue K, Fujiwara A, Hatakeyama K, Kanto K, Watanabe Y, Muramatsu K, Fukuda Y, Ogura S, Yamaguchi K. Let-7 microRNA family is selectively secreted into the extracellular environment via exosomes in a metastatic gastric cancer cell line. PLoS One. 2010;5:e13247. [PubMed] [DOI] |
| 27. | Watanabe S, Ueda Y, Akaboshi S, Hino Y, Sekita Y, Nakao M. HMGA2 maintains oncogenic RAS-induced epithelial-mesenchymal transition in human pancreatic cancer cells. Am J Pathol. 2009;174:854-868. [PubMed] [DOI] |
| 28. | McMillan M, Kahn M. Investigating Wnt signaling: a chemogenomic safari. Drug Discov Today. 2005;10:1467-1474. [PubMed] [DOI] |
| 29. | Hörig H, Wainstein A, Long L, Kahn D, Soni S, Marcus A, Edelmann W, Kucherlapati R, Kaufman HL. A new mouse model for evaluating the immunotherapy of human colorectal cancer. Cancer Res. 2001;61:8520-8526. [PubMed] |
| 30. | Akaboshi S, Watanabe S, Hino Y, Sekita Y, Xi Y, Araki K, Yamamura K, Oshima M, Ito T, Baba H. HMGA1 is induced by Wnt/beta-catenin pathway and maintains cell proliferation in gastric cancer. Am J Pathol. 2009;175:1675-1685. [PubMed] [DOI] |