修回日期: 2013-02-27
接受日期: 2013-03-14
在线出版日期: 2013-04-08
目的: 研究叉状头/翅膀状螺旋转录因子(Foxp3)在乙型肝炎病毒相关性肾炎(HBV-GN)肾组织中的表达及其意义.
方法: 所有病例经肾组织活检病理诊断. 分组: A组为乙型肝炎相关性肾炎组(n = 58例); B组为非乙型肝炎肾炎组(n = 52例); C组为HBV感染对照组(n = 24例), 患者血清HBsAg阳性、肾组织中HBsAg阴性, 血清肌酐轻度升高经肾组织活检排除肾炎. 利用免疫组织化学法检测3组患者肾组织Foxp3、CD4、CD25蛋白表达情况.
结果: (1)A、B、C 3组患者在年龄(F = 1.02, P = 0.36)、性别(χ2 = 1.09, P = 0.57)、民族构成(χ2 = 0.04, P = 0.98)、血清肌酐(F = 0.05, P = 0.61)、谷丙转氨酶(F = 0.06, P = 0.76)等方面差异均无统计学意义; 但A组与B组尿蛋白(>0.3 g/24 h)差异有统计学意义(P<0.05); (2)A组和B组病理类型构成比较差异无统计学意义(χ2 = 1.08, P = 0.99), 但肾小管间质损伤程度比较差异有统计学意义(χ2 = 9.15, P = 0.027), 且A组肾小管间质损伤程度较B组重; (3)Foxp3、CD4、CD25蛋白主要表达于肾小管间质; 在A组与B组肾小管间质中, 每高倍镜视野下Foxp3+淋巴细胞、CD4+ T细胞、CD25+ T细胞数分别为(3.41±1.16) vs (3.52±1.27); (2.78±0.15 ) vs (3.12±0.17); (2.90±0.20) vs (3.09±0.18), 均明显低于C组Foxp3+淋巴细胞数、CD4+ T细胞、CD25+ T细胞数(均P<0.05); A组与B组比较, 差异有统计学意义(P<0.05), A组中, Foxp3、CD4、CD25的表达低于B组.
结论: 调节性T细胞Foxp3表达水平的下调可能与乙型肝炎病毒相关性肾炎的发生发展有关.
核心提示: 乙型肝炎病毒(hepatitis B virus, HBV)感染的肝外表现日益备受重视, 并且这种肝外表现的范围在不断扩大. 乙型肝炎相关性肾炎(HBV-GN)是其中最常见的疾病, 然而至今为止, 对HBV-GN的发病机制尚未取得共识. 对此, 我们进行了一项临床研究, 结果显示Foxp3主要表达于HBV-GN的肾小管间质, 半定量分析结果表明, 每高倍镜视野下的平均Foxp3+淋巴细胞计数. 显著低于对照组, 因此, 我们推测HBV-GN的发生发展可能与Foxp3的表达下调有关.
引文著录: 詹欣宇, 肖琳, 张泽高, 银皓, 鲁晓擘, 张跃新. Foxp3在乙型肝炎病毒相关性肾炎肾组织中的表达及其意义. 世界华人消化杂志 2013; 21(10): 851-857
Revised: February 27, 2013
Accepted: March 14, 2013
Published online: April 8, 2013
AIM: To investigate the expression and possible role of forkhead/winged helix transcription factor (Foxp3) in the kidney tissue of patients with hepatitis B virus-associated glomerulonephritis (HBV-GN).
METHODS: Patients who were pathologically diagnosed by renal biopsy were divided into three groups. Group A had HBV-GN (n = 58), group B had HBsAg-negative nephritis (n = 52), and group C consisted of HBV controls (n = 24), whose serum was HBsAg-positive, renal tissue HBsAg-negative and creatinine slightly elevated but without renal lesion. Immunohistochemistry was utilized to detect the expression of Foxp3 protein in kidney tissue of patients.
RESULTS: (1) There was no significant difference in age (F = 1.02, P = 0.36), gender (χ2 = 1.09, P = 0.57), ethnicity composition (χ2 = 0.04, P = 0.98), serum creatinine (F = 0.05, P = 0.61), or alanineaminotransferase (F = 0.06, P = 0.76) among the three groups. However, there was a statistical difference between group A and group B in urine protein (> 0.3 g/24 h); (2) There was no significant difference in pathological type between groups A and B (χ2 = 1.08, P = 0.99); however, the extent of tubular interstitial injury (χ2 = 9.15, P = 0.027) was more serious in group A; (3) Foxp3, CD4, and CD25 proteins were expressed mainly in the tubulointerstitial tissue. There were significant differences in the number of Foxp3+ lymphocyte, CD4+ T cells and CD25+ T cells per high-power field between group A and group B (3.41 ± 1.16 vs 3.52 ± 1.27; 3.12 ± 0.17 vs 2.78 ± 0.15; 2.9 ± 0.2 vs 3.09 ± 0.18, all P < 0.05). The numbers of Foxp3+ lymphocyte, CD4+ T cells, and CD25+ T cells per high-power field in groups A and B were significantly lower than those in group C (all P < 0.05).
CONCLUSION: The occurrence and development of HBV-GN may be related to reduced expression of Foxp3 in regulatory T cells.
- Citation: Zhan XY, Xiao L, Zhang ZG, Yin H, Lu XB, Zhang YX. Significance of expression of forkhead/winged helix transcription factor in HBV-associated glomerulonephrititis. Shijie Huaren Xiaohua Zazhi 2013; 21(10): 851-857
- URL: https://www.wjgnet.com/1009-3079/full/v21/i10/851.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i10.851
乙型肝炎病毒相关性肾炎是乙型肝炎病毒(hepatitis B virus, HBV)感染引起的肾脏损伤, 发病隐匿, 常为临床医师和患者所忽视, 目前其发病机制仍不清楚, HBV感染导致机体免疫功能失衡、诱发自身免疫损伤被认为可能是其发病机制之一. 调节性T细胞(regulatory T cell, Treg)是确定的一类具有免疫调节功能的T细胞亚群, 他的发育和功能维持构成了周围淋巴器官中形成免疫耐受的重要机制, 若其发育和功能失调, 则会导致一系列疾病的发生, 包括自身免疫性疾病、炎症反应、急慢性传染性疾病、肿瘤免疫耐受、移植排斥以及过敏性疾病[1,2]. Treg细胞有很多亚群, 其中CD4+CD25+ Treg细胞是目前研究最多的, 具有明确的免疫抑制功能, 在抑制自身反应性T细胞增殖, 维持免疫稳定方面起着重要亚群的作用. 该细胞数量的减少, 表面分子表达的缺陷, 抑制功能的受损, 都可能导致自身免疫性疾病、爆发性肝炎或移植排斥反应等的发生[3]. Foxp3又称叉状头/翅膀状螺旋转录因子, 是目前确定为最特异的Treg细胞分子标记而用于当前研究, 亦是其发育和功能的关键分子[4,5]. 研究表明[6], Foxp3+CD4+CD25+ Treg细胞是自然免疫中调节自身耐受的关键细胞, 与多种免疫损伤性疾病的发病有关. Brunkow等[7]在2001年的研究中报道通过高通量基因组序列分析的方法发现Foxp3基因是决定CD4+CD25+ Treg的重要转录因子. Onishi等[8]报道当Foxp3缺失、表达的下调或者Foxp3基因发生突变时, 人和动物都会产生严重的自身免疫性疾病. 本研究旨在通过观察Foxp3+淋巴细胞、CD4+ T细胞、CD25+ T细胞在肾组织中的表达, 揭示Treg在乙型肝炎病毒相关性肾炎发病机制中的作用.
选择2009-01/2011-11在新疆医科大学第一附属医院行肾组织活检、病例资料完整的患者134例为研究对象, 根据病理诊断分为3组: A组58例患者肾组织活检诊断为乙型肝炎病毒相关性肾炎, 为乙型肝炎相关性肾炎组; B组52例患者肾组织活检证实为肾炎但血清及肾组织中HBsAg均阴性, 为非乙型肝炎肾炎组, C组24例患者血清HBsAg阳性、肾组织中HBsAg阴性, 血清肌酐轻度升高经肾组织活检排除肾炎, 为HBV感染对照组. HBV-GN诊断标准参照1989年在北京座谈会上制定的诊断意见. 所有入选患者排除狼疮性肾炎、糖尿病肾病、肿瘤相关性肾病等继发性肾损伤. 试剂: 浓缩型鼠抗人Foxp3单克隆抗体(236A/E7)、鼠抗人CD4单克隆抗体、鼠抗人CD25单克隆抗体均购自美国eBionscience公司, 工作液滴度1:100.
1.2.1 临床资料: 临床资料包括姓名、性别、民族、年龄、谷丙转氨酶、血肌酐、24 h尿蛋白定量、临床类型等一般资料, 以及肾穿刺病理报告资料. 石蜡标本进行4 μm连续切片, 病理常规染色, Foxp3、CD4、CD25免疫组织化学染色. 病理分型参照1995年WHO修订的肾小球病理分型标准, 包括膜性肾病(membranous nephropathy, MN), 膜增殖性肾小球肾炎(membrano-proliferativeglomerulonephritis, MPGN), IgA肾病(IgA nephropathy, IgAN), 系膜增生性肾小球肾炎(mesangialproliferativeglomerulonephritis, MsPGN), 肾小球微小病变(minimal change disease, MCD), 局灶节段硬化性肾炎(primary focal segmental glomerulosclerosis, FsGs), 局灶系膜增生性肾小球肾炎, 增生硬化性肾病. 肾小管损伤程度参照肾小管-间质各项病理参数的半定量积分Katafuchi积分法: 包括间质性炎性细胞浸润(0-3分)、间质纤维化(0-3分)、肾小管萎缩(0-3分), 轻度损伤(1-3分), 中度损伤(4-6分), 重度损伤(7-9分).
1.2.2 方法: 免疫组织化学二步法Envision system, 即用型二抗购自上海长岛生物技术有限公司. 免疫组织化学染色: 采用Envision二步法进行免疫组织化学染色. 常规脱蜡, 柠檬酸钠缓冲液热抗原、H2O2阻断过氧化物酶、DAB显色剂显色、镜下观察、至棕色阳性结果出现即用水洗、苏木素复染、水洗、吹干、树胶封片、显微镜下观察结果. 计数光镜下观察阳性细胞呈棕黄色, 染色明显高于背景. 细胞核染色成黄色或棕黄色颗粒为Foxp3、CD4、CD25阳性染色. Foxp3+、CD4+、CD25+淋巴细胞计数: 每个样本随机计数5个高倍(×400)视野的阳性细胞数, 根据阳性细胞显色的比例及染色的强度做半定量判断.
统计学处理 所有数据使用SPSS17.0软件进行统计学处理. 两样本均数之间的比较采用t检验; 多样本均数之间的比较采用单因素方差分析; 计数资料采用χ2检验和Fisher's精确检验.
A组男40例, 女18例, 汉族50例, 维吾尔族8例, 平均年龄26.7岁±10.3岁, 临床上以肾病综合征为主要表现者有27例(46.6%), 以肾炎综合征为主要表现者有24例(41.4%); B组男32例, 女20例, 汉族45例, 维吾尔族7例, 平均年龄为24.5岁±5.5岁, 以肾病综合征为主要表现者占26例(50%), 肾炎综合征者21例(40.4%); C组女10例, 男14例, 汉族21例, 维吾尔族3例, 平均年龄为27.8岁±17.1岁, 3组患者年龄、性别、民族构成比较差异均无统计学意义(F = 1.02, P = 0.36; χ2 = 1.09, P = 0.57; χ2 = 0.04, P = 0.98, 表1).
| A组 | B组 | C组 | F值/χ2值 | P值 | |
| n | 58 | 52 | 24 | ||
| 年龄(岁) | 26.7±10.3 | 24.5±5.5 | 27.8±17.1 | 1.02 | 0.36 |
| 男n(%) | 40(68.9) | 32(61.6) | 14(58.3) | 1.09 | 0.57 |
| 汉族n(%) | 50(86.2) | 45(86.5) | 21(87.5) | 0.04 | 0.98 |
| 谷丙转氨酶(U/L) | 31.23±12.12 | 34.37±10.23 | 28.17±9.14 | 0.06 | 0.76 |
| 尿蛋白>0.3 g/24 h | 53(91.4%) | 40(78.1%)a | - | 6.108 | 0.017 |
| 血清肌酐(μmol/L) | 38.9±16.2 | 41.3±14.4 | 37.7±19.8 | 0.50 | 0.61 |
3组患者血清肌酐比较差异无统计学意义(F = 0.05, P = 0.61). 但A组与B组尿蛋白(>0.3 g/24 h)比较差异有统计学意义(P<0.05, 表1).
A组和B组在病理类型构成上差异无统计学意义(χ2 = 1.086, P = 0.99), 但其肾小管间质损伤程度上差异有统计学意义(χ2 = 9.15, P = 0.027, 表2).
| A组 | B组 | χ2值 | P值 | |
| 病理类型 | 1.086 | 0.99 | ||
| 膜性肾病 | 20(34.48) | 18(34.62) | ||
| 膜增殖性肾小球肾炎 | 9(15.52) | 8(15.38) | ||
| IGA肾病 | 6(10.34) | 7(13.46) | ||
| 系膜增生性肾小球肾炎 | 13(22.42) | 10(19.23) | ||
| 肾小球微小病变 | 5(8.62) | 4(7.69) | ||
| 局灶节段硬化性肾炎 | 1(1.72) | 2(3.85) | ||
| 局灶系膜增生性肾小球肾炎 | 2(3.45) | 1(1.92) | ||
| 增生硬化性肾病 | 2(3.45) | 2(3.85) | ||
| 肾小管间质损伤程度 | 9.15 | 0.027 | ||
| 轻度损伤 | 22(37.93) | 20(38.46) | ||
| 中度损伤 | 23(39.66) | 11(21.15) | ||
| 重度损伤 | 4(6.89) | 1(1.92) | ||
| 无肾小管损伤 | 9(15.52) | 20(38.47) |
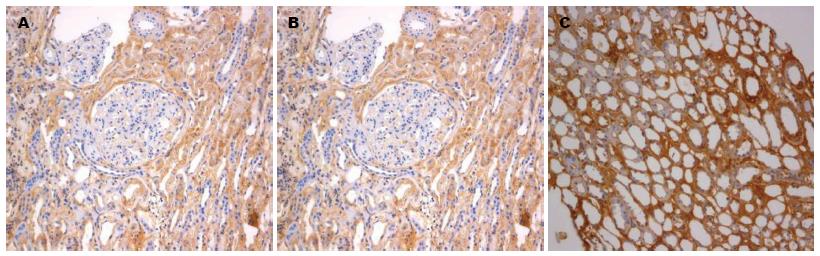
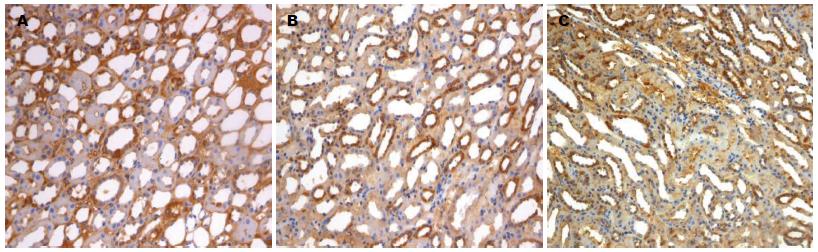
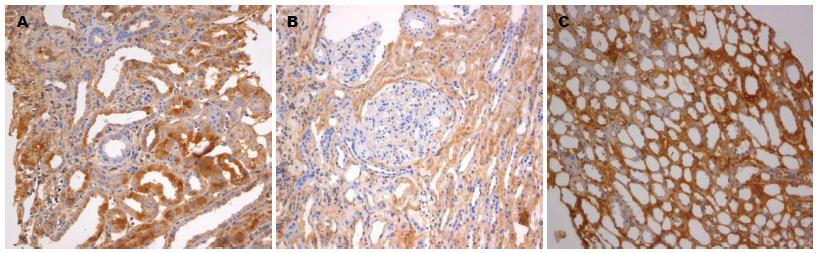
Foxp3+淋巴细胞、CD4+ T细胞、CD25+ T细胞主要在肾小管间质中表达, 乙型肝炎相关性肾炎组(A组)、非乙型肝炎肾炎组(B组)、HBV感染对照组(C组)均可见阳性表达细胞(图1-3).
对Foxp3+淋巴细胞、CD4+ T细胞、CD25+ T细胞免疫组织化学染色切片进行半定量统计分析, 400倍光学显微镜下随机取5个视野进行阳性细胞计数和细胞总数计数, 取其平均数用于统计分析. Foxp3、CD4、CD25在3组患者肾组织中表达差异有统计学意义(F = 23.00, P = 0.00), 乙型肝炎相关性肾炎组、非乙型肝炎肾炎组表达明显低于HBV感染对照组(P<0.01); Foxp3、CD4、CD25在乙型肝炎相关性肾炎组和非乙型肝炎肾炎组间比较, 差异均有统计学意义(P<0.05), 乙型肝炎相关性肾炎组中, 其表达低于非乙型肝炎肾炎组(表3).
CD4+CD25+ Treg细胞主要在机体免疫系统中发挥负向调节作用, 对效应细胞的增殖, 免疫活性的发挥起抑制作用. 转录因子Foxp3特异性地高表达于CD4+CD25+ Treg细胞内, Foxp3为CD4+CD25+ Treg细胞特异性分子标志[9], 是Treg细胞发育和功能所必需[10], 能反映Treg的水平和功能活性, 目前被作为证实Treg的金标准. 有研究表明[11], Foxp3是人天然Treg维持其抑制性功能的核心细胞内标志, 主要通过基因转录水平下调促炎因子的表达, 上调免疫抑制因子的表达, 从而抑制机体免疫功能. 据报道, Foxp3+ Treg调节免疫抑制的机制是通过对效应性T细胞及抗原提呈细胞的抑制作用而体现. 有学者研究[12]显示, Treg细胞通过与效应性T细胞竞争消耗IL-2从而达到抑制Foxp3-效应性T细胞的增殖, 并通过前凋亡因子Bim介导的途径诱导效应性T细胞的凋亡. 此外, Treg细胞表面还可表达细胞毒性T淋巴细胞相关抗原(cytotoxic T lymphocyte-associated antigen-4, CTLA-4), 该分子是Treg表达的重要分子标记, 高水平表达CTLA-4的Treg 可以通过CTLA-4和CD80以及CD86的相互作用促使DC表达吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase, IDO). IDO能降解色氨酸, 色氨酸缺失会抑制T细胞活化, 从而导致T细胞凋亡[13]. 研究报道[14]Treg细胞还可分泌纤维蛋白原样蛋白2, 该分子可通过与低亲和力的FCγRⅡB受体结合抑制DC的成熟, 诱导B细胞的凋亡[15], 从而起到免疫抑制的效果. 当机体内Foxp3表达下降时, 提示CD4+CD25+ Treg细胞数量的减少或功能的减弱, 从而导致自身免疫性疾病的发生. 王玮玮等[16]在BXSB狼疮小鼠动物实验中发现, Treg细胞数量的减少与狼疮肾炎肾小管间质损害相关. 机体内百分之一的Treg细胞水平的下降会导致自身免疫性疾病的发生发展[17]. 有研究[18]表明, 诱导SWR×NZBF1(SNF1)小鼠黏膜免疫耐受后, 小鼠的CD4+CD25+ Treg细胞数目可恢复至正常水平, 且随之肾小球肾炎的症状与病理改变可得到显著的改善. 认为Treg细胞的减少可能是疾病活动导致HBV-GN肾小管损害的原因之一.
本研究发现, 乙型肝炎相关性肾炎组和非乙型肝炎肾炎组肾组织Foxp3的表达明显低于无肾炎的HBV感染对照组, 同时CD4、CD25的表达亦明显低于无肾炎的HBV感染对照组, 此研究结果支持Foxp3表达水平的下降与CD4+CD25+ Treg细胞数量的减少有关这一观点, 也表明Treg细胞的减少可能是肾炎的发病机制之一, 支持免疫功能失调参与乙型肝炎相关性肾炎的发生, 通过诱导Foxp3表达水平的下调, 导致自身免疫损伤. 本研究中Foxp3 、CD4、CD25在乙型肝炎相关性肾炎组中肾小管间质中的表达低于非乙型肝炎肾炎组, 结合两者病理资料: 乙型肝炎相关性肾炎组肾小管间质损伤程度较非乙型肝炎肾炎组为重, 24 h尿蛋白比较, 亦支持这一结果, 分析原因考虑乙型肝炎相关性肾炎肾损伤有多种致病机制共同作用, 除了经典的抗原抗体复合物沉积于肾小球毛细血管基底膜导致肾脏损伤、乙型肝炎病毒直接损伤, 还存在自身免疫性损伤. 因此乙型肝炎相关性肾炎的早期诊断非常重要, 抗乙型肝炎病毒治疗是不可忽视的方案之一. 在HBV感染对照组中Foxp3表达水平无下降, 也未发生乙型肝炎相关性肾炎, 认为其可能与遗传易感性有关.
在HBV-GN的发病过程中, 大量的研究表明, CD8+CTL介导的穿孔素途径, 可能在引起肾脏损害中起一定的作用. 穿孔素是免疫活化细胞杀伤靶细胞的主要介质, 是存在于CTL和NK细胞胞浆颗粒中的细胞毒素, 可介导CD8+CTL特异的细胞毒效应, 引起感染细胞损伤和死亡[19]. 有研究表明[20], 穿孔素主要在HBV-GN患者的肾小管间质中表达, Treg可抑制CD4+、CD8+ T细胞活性及其增殖能力[21], 本研究显示Foxp3在HBV-GN肾小管间质中表达下降, 认为可能削弱了对CD8+CTL T细胞的抑制功能, 进一步通过CD8+CTL介导的穿孔素途径造成肾小管间质的损伤, 有待于后续实验的进一步证实.
本研究结果表明Treg Foxp3的表达下调可能与乙型肝炎病毒相关性肾炎的发生发展有关, HBV-GN可能是由于HBV感染引起T细胞免疫耐受调节功能失衡所致的免疫系统紊乱性疾病.
CD4+CD25+调节性T细胞(Treg)是一群能抑制其他免疫细胞活化、增殖的T淋巴细胞, 其在维持自身内环境稳定, 防止自身免疫性疾病的发生、抑制移植排斥反应等疾病中发挥重要的保护作用, 其数量和功能的降低与多种自身免疫性疾病有关. Foxp3又称叉状头/翅膀状螺旋转录因子, 是目前确定为最特异的Treg细胞分子标记而用于当前研究, 亦是其发育和功能的关键分子.
郭炜, 教授, 河北医科大学第四医院, 河北省肿瘤研究所病理研究室
关于Foxp3, 最近研究的热点是Foxp3在恶性肿瘤、自身免疫性疾病、感染性疾病、移植排斥反应的发生、发展中的作用及通过抑制或增加其表达等手段达到可能的免疫治疗效果.
Luo等报道, 通过在体外特异性扩增Foxp3+ Treg, 然后重新输回患者体内也可以实现免疫内环境的重建, 从而达到治疗自身免疫性疾病的目的.
本研究首次应用免疫组织化学法检测乙型肝炎肾组织中Foxp3、CD4、CD25的表达, 以探讨Foxp3在乙型肝炎相关性肾炎发生过程中的作用, 发现Foxp3表达水平的下调与乙型肝炎相关性肾炎的发生发展有关.
Foxp3可能在乙型肝炎相关性肾炎的发生过程中起重要的作用, 可能对其诊断及早期治疗具有重要的临床意义.
本文选题新颖, 方法科学, 结果可靠, 论据充分, 对乙型肝炎相关性肾炎发病机制的研究有重要的参考价值.
编辑: 李军亮 电编:闫晋利
| 1. | Sakaguchi S, Yamaguchi T, Nomura T, Ono M. Regulatory T cells and immune tolerance. Cell. 2008;133:775-787. [PubMed] [DOI] |
| 2. | Littman DR, Rudensky AY. Th17 and regulatory T cells in mediating and restraining inflammation. Cell. 2010;140:845-858. [PubMed] [DOI] |
| 3. | Fiocco U, Sfriso P, Oliviero F, Pagnin E, Scagliori E, Campana C, Dainese S, Cozzi L, Punzi L. Co-stimulatory modulation in rheumatoid arthritis: the role of (CTLA4-Ig) abatacept. Autoimmun Rev. 2008;8:76-82. [PubMed] [DOI] |
| 4. | Sakaguchi S. Naturally arising Foxp3-expressing CD25+CD4+ regulatory T cells in immunological tolerance to self and non-self. Nat Immunol. 2005;6:345-352. [PubMed] [DOI] |
| 5. | Fontenot JD, Rudensky AY. A well adapted regulatory contrivance: regulatory T cell development and the forkhead family transcription factor Foxp3. Nat Immunol. 2005;6:331-337. [PubMed] [DOI] |
| 6. | Lai FM, To KF, Wang AY, Choi PC, Szeto CC, Li PK, Leung CB, Lai KN. Hepatitis B virus-related nephropathy and lupus nephritis: morphologic similarities of two clinical entities. Mod Pathol. 2000;13:166-172. [PubMed] [DOI] |
| 7. | Brunkow ME, Jeffery EW, Hjerrild KA, Paeper B, Clark LB, Yasayko SA, Wilkinson JE, Galas D, Ziegler SF, Ramsdell F. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nat Genet. 2001;27:68-73. [PubMed] [DOI] |
| 8. | Onishi Y, Fehervari Z, Yamaguchi T, Sakaguchi S. Foxp3+ natural regulatory T cells preferentially form aggregates on dendritic cells in vitro and actively inhibit their maturation. Proc Natl Acad Sci U S A. 2008;105:10113-10118. [PubMed] [DOI] |
| 9. | Brunkow ME, Jeffery EW, Hjerrild KA, Paeper B, Clark LB, Yasayko SA, Wilkinson JE, Galas D, Ziegler SF, Ramsdell F. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nat Genet. 2001;27:68-73. [PubMed] [DOI] |
| 10. | 福 军亮, 徐 东平, 施 明, 张 辉, 金 辉, 汤 紫荣, 王 福生. 乙型肝炎患者外周血CD4+CD25+调节性T细胞表型与功能分析. 中华内科杂志. 2006;45:642-645. |
| 12. | Pandiyan P, Zheng L, Ishihara S, Reed J, Lenardo MJ. CD4+CD25+Foxp3+ regulatory T cells induce cytokine deprivation-mediated apoptosis of effector CD4+ T cells. Nat Immunol. 2007;8:1353-1362. [PubMed] [DOI] |
| 13. | Fallarino F, Grohmann U, Hwang KW, Orabona C, Vacca C, Bianchi R, Belladonna ML, Fioretti MC, Alegre ML, Puccetti P. Modulation of tryptophan catabolism by regulatory T cells. Nat Immunol. 2003;4:1206-1212. [PubMed] [DOI] |
| 14. | Borsellino G, Kleinewietfeld M, Di Mitri D, Sternjak A, Diamantini A, Giometto R, Höpner S, Centonze D, Bernardi G, Dell'Acqua ML. Expression of ectonucleotidase CD39 by Foxp3+ Treg cells: hydrolysis of extracellular ATP and immune suppression. Blood. 2007;110:1225-1232. [PubMed] [DOI] |
| 15. | Shalev I, Liu H, Koscik C, Bartczak A, Javadi M, Wong KM, Maknojia A, He W, Liu MF, Diao J. Targeted deletion of fgl2 leads to impaired regulatory T cell activity and development of autoimmune glomerulonephritis. J Immunol. 2008;180:249-260. [PubMed] |
| 16. | 王 玮炜, 黄 安斌, 杜 戎, 刘 宇宏, 宋 优, 沈 凌汛, 余 立凯. 叉状头/翅膀状螺旋转录因子在BXSB狼疮小鼠肾脏中的表达. 华中科技大学学报(医学版). 2011;40:567-570. |
| 17. | Lan RY, Cheng C, Lian ZX, Tsuneyama K, Yang GX, Moritoki Y, Chuang YH, Nakamura T, Saito S, Shimoda S. Liver-targeted and peripheral blood alterations of regulatory T cells in primary biliary cirrhosis. Hepatology. 2006;43:729-737. [PubMed] [DOI] |
| 18. | Wu HY, Staines NA. A deficiency of CD4+CD25+ T cells permits the development of spontaneous lupus-like disease in mice, and can be reversed by induction of mucosal tolerance to histone peptide autoantigen. Lupus. 2004;13:192-200. [PubMed] [DOI] |
| 21. | Stoop JN, van der Molen RG, Baan CC, van der Laan LJ, Kuipers EJ, Kusters JG, Janssen HL. Regulatory T cells contribute to the impaired immune response in patients with chronic hepatitis B virus infection. Hepatology. 2005;41:771-778. [PubMed] [DOI] |