修回日期: 2012-12-20
接受日期: 2013-01-05
在线出版日期: 2013-01-08
轮状病毒是引起多种幼龄动物以及婴幼儿腹泻的重要病原体. 轮状病毒感染常为隐性, 但环境因素改变或机体免疫力下降则可引起该病的爆发与流行. 此外, 轮状病毒也是一种引起人畜共患病的病原体, 对其进行深入研究具有重要的公共卫生学意义. 轮状病毒感染机制和防治研究有重要实践价值. 本文综述了轮状病毒病原学、临床表现以及药物和疫苗方面的研究进展, 为轮状病毒病防治提供参考.
引文著录: 赵高伟, 任晓峰. 轮状病毒感染机制及防治的研究进展. 世界华人消化杂志 2013; 21(1): 60-65
Revised: December 20, 2012
Accepted: January 5, 2013
Published online: January 8, 2013
Rotavirus is an important gastrointestinal pathogen which can cause severe diarrhea in young animals and infants. Although rotavirus infections are usually latent, large-scale outbreak may occur if environmental factors change or the immune defense of hosts decreases. As rotavirus is a pathogen of zoonotic diseases, studies on rotavirus infections are of great importance in public health and clinical application. This article provides an overview of the progress in research on viral pathogen, clinical manifestations, as well as drug and vaccine research, with an aim to provide a reference for the prevention and treatment of rotavirus infections.
- Citation: Zhao GW, Ren XF. Rotavirus infections: mechanisms, prevention and treatment. Shijie Huaren Xiaohua Zazhi 2013; 21(1): 60-65
- URL: https://www.wjgnet.com/1009-3079/full/v21/i1/60.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i1.60
1969年, Mebus最早从犊牛中发现轮状病毒, 之后澳大利亚科学家(Bishop)在患有严重腹泻婴儿的胃肠道内也发现了同类病毒[1]. Thomas Henry Flewett使用电子显微镜观察该类病毒后, 根据其形态特征建议将其命名为轮状病毒[2]. 轮状病毒是引起幼儿及各种幼龄动物非细菌型腹泻的主要病原体[3,4]. 该病毒还可以通过人与人之间的接触传播, 感染者的粪便或呕吐物中的病毒颗粒如>1012个/g, 也会是轮状病毒的主要传染源[5]. 据调查, 在撒哈拉以南的非洲和亚洲地区, 超过三分之一的婴幼儿腹泻及胃肠炎疾病是由轮状病毒引起的, 每年导致50万到60万婴幼儿死亡[6,7]. 欧洲和美国预防和治疗该类疾病的直接和间接的医疗费用高达数10亿美元[8]. 轮状病毒在不同地区感染的普遍性表明, 提高的生活卫生水平并不能降低轮状病毒的感染率和发病率[9]. 另外, 尽管有一些药物可缓解轮状病毒感染引起的临床症状, 但目前还没有治疗轮状病毒感染的特效药物[10]. 轮状病毒的血清型与疾病的严重性通常无直接相关性, 各种轮状病毒的交叉免疫保护免疫机制还不明确[11]. 因此加强对轮状病毒感染机制的研究, 开发安全有效的疫苗对预防轮状病毒感染显得非常重要.
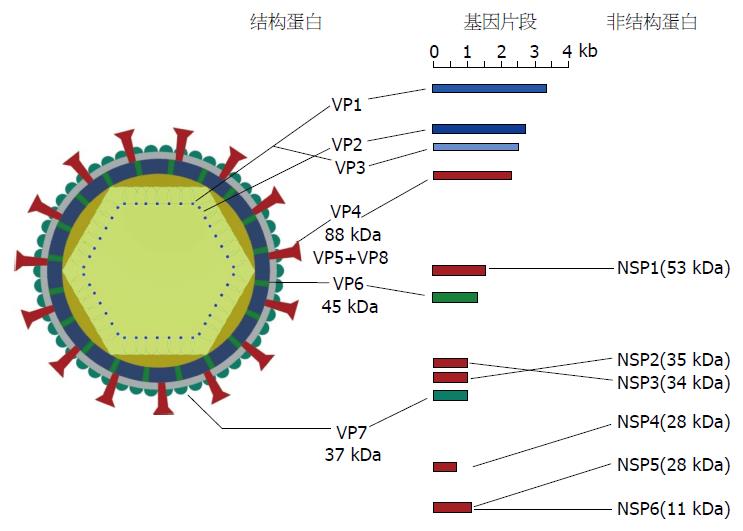
轮状病毒无囊膜, 呈二十面体, 直径约为70 nm. 电子显微镜观察, 轮状病毒是带有短纤突且外缘光滑近似轮状的粒子. 该病毒粒子由3层蛋白衣壳组成: 外层衣壳(VP7和VP4)、中间层衣壳(VP6)和内层衣壳(VP2)(图1). 通常只有包裹3层衣壳蛋白的粒子才具有传染性[12]. 病毒基因组被内层衣壳、RNA依赖性RNA聚合酶(VP1)及修饰酶(VP3)包裹, 并由11个不连续的dsRNA组成, 编码6个结构蛋白(VP1-VP4/VP6/VP7)和6个非结构蛋白(NSP1-NSP6), 除第11个节段含有两个开放阅读框并编码NSP5和NSP6外, 其他每节段分别编码一种蛋白[13]. 在宿主体内, 不同株轮状病毒的共感染可能会造成11个基因节段发生重配, 产生新型的轮状病毒.
轮状病毒编码的位于中间衣壳的VP6蛋白具有高度保守性, 常称之为群抗原或诊断抗原, 根据其抗原性的不同可以将轮状病毒分为A-G 7个种群, 感染人的轮状病毒大多属于A群, 进一步可以将轮状病毒分为2个亚群为23个G(G1-G23)血清型(取决于VP7中和抗原)和31个P(P[1]-P[13])血清型(取决于VP4血凝素抗原)[14]. G-P组合血清型由病毒的VP7和VP4共同决定, 目前, G1P[8]、G2P[4]、G3P[8]、G4P[8]和G9P[8] 5种血清型的轮状病毒是危害人类健康最为重要的毒株[15], 其中G1P[8]和G3P[8]型在我国最为常见.
轮状病毒感染性疾病多发于秋冬季节, 引起婴幼儿及幼龄动物严重的胃肠炎、腹泻、脱水、 电解质紊乱、休克甚至死亡. 病理剖检常见肠绒毛变短, 胃内有未消化的乳汁等. 有报道指出轮状病毒感染小肠上皮细胞后, 能够通过胃肠屏障进入血液, 进而对其他内脏造成损伤[16,17]. 轮状病毒的融合素蛋白VP4在肠道胰液的作用下裂解为带氨基末端的VP8和带羧基末端的VP5, 这两个片段在病毒入侵宿主细胞的初期起着重要的作用. 轮状病毒感染肠道上皮细胞后, 所编码的非结构蛋白NSP4糖基化使宿主细胞膜对钙离子的通透性增加, 胞内钙离子水平升高, 氯离子的分泌增加[18]. 加之NSP3能够阻止宿主细胞蛋白质的合成, 加重肠道内水电解质的失衡, 导致分泌性腹泻的发生[19]. 近来研究结果表明轮状病毒感染的前几个小时内, 病毒NSP1可通过体内各种调节途径抑制感染细胞的过早凋亡, 有助于逃避抗原递呈细胞的识别, 进而促进病毒增殖[20]. Barro等[21]的研究表明轮状病毒NSP1能够通过各种途径阻止干扰素的生成, 导致干扰素及相关细胞因子介导的炎症反应受阻, 使宿主抗轮状病毒感染能力下降. 轮状病毒各基因所编码的蛋白都与胃肠炎的发生有着一定的相关性, 且在病毒感染的病毒血症期, 人与动物的发病机制几乎相同[22].
尽管目前还没有针对轮状病毒的特效药物, 但在药物抗轮状病毒感染方面的研究还是取得了一定的进展. 近来的报道指出, 微生态制剂鼠李糖乳杆菌以及嗜酸乳杆菌对感染轮状病毒的乳鼠空肠黏膜上皮细胞有一定的保护作用, 并且在感染前灌服的保护效果要好于感染后灌服, 这对于预防轮状病毒感染具有一定的意义[23,24]. 激素活性形式的25-羟基维生素D3能够提高机体内抗体水平并促进抗炎症细胞因子的生成, 进而可以提高机体抵抗轮状病毒感染的能力[25]. 中药治疗轮状病毒感染也有一定的效果. 由黄芪、党参所制成参芪扶正注射液在小鼠体内能够抑制轮状病毒的复制[26]. 马蹄香提取物一方面通过激活CD3+、CD4+细胞, 增加抗体的分泌; 另一方面, 调节CD4+/CD8+比值, 抑制CD19+水平的升高, 调节一些细胞因子的释放, 从而改善机体免疫功能[27]. 白头翁素通过减少肠道黏膜损伤加速肠道黏膜修复从而减弱轮状病毒致病性[28]. 但上述药物的应用效果主要来自动物实验, 如其效果和安全性能在人体实验中得到验证, 将会对临床用药提供一定的参考. 有报道指出感染轮状病毒后幼儿血清内的锌含量会降低, 在常规的治疗基础上补充葡萄糖酸锌可以提高疗效[29]. 比较而言, 西药的药用成分单一, 抗病毒作用机制明确, 但是对于幼儿的肝功能、肾功能的损害较大; 中药制剂的不良反应较小, 但是抗病毒的机制较为复杂. 微生态制剂作为一种新型预防性药物具有优越性, 但是相关的一些技术指标如定植特性和稳定性等方面还有待进一步的完善. 目前临床上部分常用抗轮状病毒腹泻的药物性质及其作用机制见表1.
| 药物名称 | 药用成分的性质 | 作用机理 |
| 喜炎平, 炎琥宁 | 穿心莲提取物 | 改善局部毛细血管循环, 提高抗原递呈细胞的吞噬能力 |
| 消旋卡多曲 | 脑啡肽抑制剂 | 保护内源性脑啡肽免受降解, 降低c-AMP在肠黏膜的水平 |
| 百贝宁 | 抗轮状病毒鸡卵黄免疫球蛋白(IgG) | 特异性地中和轮状病毒, 激活补体系统 |
| 运德素 | 注射用重组人干扰素α1b | 诱导宿主细胞产生抗病毒蛋白, 干扰病毒的复制, 增强机体T细胞、B细胞功能, 活化NK细胞、巨噬细胞 |
| 枯草杆菌二联 活菌颗粒 | 微生态制剂 | 维持肠道菌群的平衡, 促进肠道上皮细胞的修复, 提供菌酶抵制病毒入侵, 补充维生素 |
预防接种是从根本上控制轮状病毒的传播和流行的有效手段. 临床研究发现, 婴幼儿再次感染轮状病毒后表现的临床症状的严重性要远低于初次感染, 并且两次感染轮状病毒后, 几乎不会再发生轮状病毒所引起的腹泻, 这一现象表明重复抗原刺激可诱导长久性的免疫保护[30,31], 证明开发和应用疫苗预防轮状病毒感染是有效和可行的.
3.2.1 单价及重组弱毒疫苗: 1984年Vesikari报道利用轮状病毒RIT 4237株制备的首个口服轮状病毒活疫苗对儿童能够起到针对轮状病毒保护作用. 但后来证明该疫苗并不能对异型血清型的轮状病毒起到免疫保护的作用, 同时在一些发展中国家应用后, 并没有起到很好的免疫保护效果, 现已停止对该疫苗的进一步研究[32,33]. 后来由美国国立卫生研究院Kapikian等研制的G3型恒河猴轮状病毒MMV18006疫苗株及美国费城Wister研究所和法国Meneux研究所联合研制的G6型牛轮状病毒WC3疫苗株, 在不同国家和地区免疫保护效果相差很大, 且病毒的排出率也较高, 相应研究也先后终止[34]. 这些证据表明单价疫苗不能起到有效的免疫保护, 不同血清型轮状病毒间的交叉免疫保护效果较差, 有必要开发能预防多种血清型轮状病毒感染的包括多价重配疫苗在内的新型疫苗. 多价重配疫苗是指轮状病毒在自然状态下或人为地使轮状病毒RNA重新组合, 进而使重组的病毒株失去反应原性而保留免疫原性. 1998年美国正式批准了一种由人-恒河猴轮状病毒重配的四价疫苗(Rota shield)上市, 虽然该疫苗在各地区的保护率达50%以上, 但是后来流行病学协会发现他能增加部分儿童出现肠套叠的机率, 于是Rota shield上市一年后被停用[35].
目前为大多数国家所认可的轮状病毒疫苗分别是由比利时GlaxoSmithKline公司研制的人源轮状病毒单价疫苗(Rotarix)以及由美国Merck公司研制的人-牛轮状病毒重配活疫苗(Rotateq). 他们已经通过Ⅲ期临床试验, 并证明了该两种疫苗不会增加儿童肠套叠发生的机率, 对重症腹泻的保护率都达到80%以上[36-39]. 虽然这两类疫苗现都已经被猪环形病毒(porcine circovirus, PCV)污染, 但由于PCV对人无致病性以及这两类疫苗存在极大的社会效益, 因此这两种疫苗仍在市场上使用[40-42]. 我国学者研究指出, 部分儿童服用Rotarix后排毒率超过50%, 并且该疫苗没有对免疫缺陷的患者进行安全评估[43]. 另外由于这两类疫苗价格昂贵, 因此许多发展中国家倾向于利用当地分离的弱毒株开发疫苗[44]. 这两类疫苗目前还没有在我国获得批准上市.
在国内, 单价羔羊P[12]G10血清型轮状病毒疫苗LLR由兰州生物制品研究所研制成功并于2000年获得中国药品监督管理局正式批准[45]. 小范围的应用表明该疫苗的保护率可达70%, 并且有良好的安全性. G2型轮状病毒基因重配株LD9已经重组构建完成, 并且该疫苗候选株可以在vero细胞系(vero细胞是WHO推荐的生产人用疫苗细胞系)上获得高表达量以及稳定传代培养, 但是该重组的疫苗候选株还处于实验室研究阶段[46]. 叶丽萍等[47]成功构建了猪A组轮状病毒PW425et-VP4基因工程乳酸菌, 其表达的蛋白具有与猪轮状病毒多克隆抗体的反应原性, 为开放微生态制剂疫苗提供了一定的参考.
3.2.2 转基因植物口服疫苗: 实验表明转基因植物生产的疫苗可以诱导机体产生特异性和非特异性的免疫应答[48]. Matsumura等[49]成功地将A组牛轮状病毒的VP6基因转移到马铃薯中, 并在花椰菜花叶病毒(CaMV)35S启动子控制下, 表达了VP6蛋白, 经浓缩后免疫小鼠可在其体内检测到抗VP6蛋白抗体. Chung等[50]将牛轮状病毒INDVP6插入到植物表达载体plLTAP357构成重组质粒, 通过三亲杂交的方法将VP6基因导入到悬浮培养的番茄细胞中并成功表达了VP6抗原. Yu等[51]用转VP6基因马铃薯组织块饲喂小鼠后发现能够提高小鼠血清中特异性IgG抗体和肠内IgA抗体的滴度. 轮状病毒VP6蛋白在植物体内成功得以表达并具有一定的免疫原性, 极大降低了轮状病毒诊断试剂的生产成本, 也为开发口服食用型轮状病毒疫苗开辟了新的思路. 费蕾等[52,53]也分别利用转基因技术将人源轮状病毒和鼠源的VP7蛋白基因导入到马铃薯内并成功得以表达. Wu等[54]研究发现, 小鼠食用表达VP7蛋白转基因马铃薯后可以在黏膜中检测到高滴度的能够中和轮状病毒的IgA抗体. Kim等[55]将鼠源轮状病毒非结构蛋白NSP4基因和霍乱肠毒素基因在马铃薯体内共表达获得了轮状病毒NSP4蛋白和霍乱毒素B亚基蛋白的低聚体, 实验证明他们具有相应的生物活性, 抗原与免疫增强剂在植物体内的共表达为提高黏膜免疫反应提供了可能. 21世纪以来, 植物性疫苗引起了人们广泛的关注, 也得到了飞速发展. 虽然还存在目的蛋白在植物体内表达量低、表达不稳定、选择可以生食植物作为受体植物以及在胃肠道内被消化等瓶颈问题, 但科学家正在筛选和优化转基因植物目的蛋白的启动子、增强子以及密码子以增加目的蛋白的表达量, 并通过在目的基因中添加一些修饰基因以避免其在发挥免疫作用前被消化. 相信不久的将来安全可靠且价格廉价的植物性疫苗会被开发出来, 并在预防轮状病毒感染方面起到重要作用.
3.2.3 亚单位疫苗: 1986年Streckert等[56]合成了轮状病毒外壳蛋白VP7上的一段氨基酸序列SAAFYYRV并接种小鼠, 发现小鼠获得了一定的免疫保护, 这为开发新型轮状病毒抗原肽疫苗提供了参考. 将轮状病毒RF株VP2蛋白基因与猴轮状病毒SA11株VP4 、VP6和VP7蛋白基因重组到杆状病毒并同时感染昆虫细胞, 发现昆虫细胞内能够产生VP6/7、VP2/6/7和VP2/4/6 3种自我装配的病毒样粒子; 注射免疫小鼠和家兔后, 均能诱导产生特异中和抗体, 能阻止同血清型病毒的侵袭[57]. 非复制型载体病毒样粒子(VLPS)携带VP2/6(双离子型)或VP2/6/7(三粒子型)已经被证实具有免疫原性[8]. 有证据表明轮状病毒VP2/6双粒子型病毒样粒子已经可以与减毒疫苗联合使用[58]. 张群等[59]将人轮状病毒VP2、VP6、VP4(P8血清型)和VP7(G1血清型)重组到巴斯德毕赤酵母并成功构建了能够表达相应蛋白的轮状病毒3层病毒样粒子(virus-like particles, VLP) 并用透射电镜观察到了病毒样粒子. 这些结果为开发轮状VLP候选疫苗奠定了基础. 另有报道指出给动物肌肉注射轮状病毒灭活苗后动物机体可产生针对通过黏膜途径侵入的轮状病毒免疫保护效应[60], 为开发非口服型轮状病毒疫苗提供了理论依据.
尽管目前在预防和治疗轮状病毒感染相关疾病方面已经取得了显著进展, 但对轮状病毒的致病机制以及机体免疫保护机制方面的研究还不够完善, 在一定程度上限制了安全、有效、廉价、易于生产和保存的轮状病毒疫苗的开发. 随着科学理论的发展和新技术的出现, 植物性疫苗、病毒样粒子以及传统的重组轮状病毒候选疫苗将会被不断地开发与改进. 由于轮状病毒在人和动物之间以及动物与动物之间可以相互传播, 且不同血清型的轮状病毒同时感染动物时可产生新的重组毒株, 因此预防轮状病毒时建议对同一地区的人和动物同时免疫, 并且尽量利用当地分离疫苗株制备, 甄别针对不同轮状病毒血清型疫苗, 以提高疫苗免疫保护效果.
轮状病毒是导致婴幼儿及幼龄动物腹泻重要的人兽共患病原体之一, 危害极为严重. 现如今对其的致病机制研究还不够深入, 还未有针对该病原体的特效治疗药物问世, WHO也将轮状病毒疫苗作为优先开发的疫苗项目之一. 开发安全、有效的药物以及轮状病毒疫苗迫在眉睫.
王建明, 副教授, 南京医科大学公共卫生学院流行病与卫生统计学系
张振等证明了微生态制剂鼠李糖乳杆菌以及嗜酸乳杆菌对感染轮状病毒的乳鼠空肠黏膜上皮细胞有一定的保护作用. Crawford等证明非复制型载体病毒样粒子(VLPS)携带VP2/6(双离子型) 或VP2/6/7(三粒子型)已经被证实具有免疫原性.
本文提出预防轮状病毒时建议对同一地区的人和动物同时免疫, 并且尽量利用当地分离疫苗株制备, 甄别针对不同轮状病毒血清型疫苗, 以提高疫苗免疫保护效果.
本文搜集了近几年国内外关于轮状病毒感染机制及防治的研究进展, 并加以总结, 为读者获取相关资料提供了捷径.
编辑: 李军亮 电编: 闫晋利
| 1. | Bishop RF, Davidson GP, Holmes IH, Ruck BJ. Virus particles in epithelial cells of duodenal mucosa from children with acute non-bacterial gastroenteritis. Lancet. 1973;2:1281-1283. [PubMed] [DOI] |
| 3. | De Grazia S, Ramirez S, Giammanco GM, Colomba C, Martella V, Lo Biundo C, Mazzola R, Arista S. Diversity of human rotaviruses detected in Sicily, Italy, over a 5-year period (2001-2005). Arch Virol. 2007;152:833-837. [PubMed] [DOI] |
| 5. | World Health Organization. Rotavirus vaccines. Wkly Epidemiol Rec. 2007;82:285-295. [PubMed] |
| 6. | Parashar UD, Gibson CJ, Bresee JS, Glass RI. Rotavirus and severe childhood diarrhea. Emerg Infect Dis. 2006;12:304-306. [PubMed] [DOI] |
| 7. | Parashar UD, Burton A, Lanata C, Boschi-Pinto C, Shibuya K, Steele D, Birmingham M, Glass RI. Global mortality associated with rotavirus disease among children in 2004. J Infect Dis. 2009;200 Suppl 1:S9-S15. [PubMed] [DOI] |
| 8. | Desselberger U, Huppertz HI. Immune responses to rotavirus infection and vaccination and associated correlates of protection. J Infect Dis. 2011;203:188-195. [PubMed] [DOI] |
| 9. | American Academy of Pediatrics Committee on Infectious Diseases. Prevention of rotavirus disease: guidelines for use of rotavirus vaccine. Pediatrics. 2007;119:171-182. [PubMed] [DOI] |
| 12. | Estes MK, Kang G, Zeng CQ, Crawford SE, Ciarlet M. Pathogenesis of rotavirus gastroenteritis. Novartis Found Symp. 2001;238:82-96; discussion 96-100. [PubMed] [DOI] |
| 13. | Nakagomi T, Nakagomi O. A critical review on a globally-licensed, live, orally-administrable, monovalent human rotavirus vaccine: Rotarix. Expert Opin Biol Ther. 2009;9:1073-1086. [PubMed] [DOI] |
| 14. | Matthijnssens J, Ciarlet M, Heiman E, Arijs I, Delbeke T, McDonald SM, Palombo EA, Iturriza-Gómara M, Maes P, Patton JT. Full genome-based classification of rotaviruses reveals a common origin between human Wa-Like and porcine rotavirus strains and human DS-1-like and bovine rotavirus strains. J Virol. 2008;82:3204-3219. [PubMed] [DOI] |
| 18. | Díaz Y, Chemello ME, Peña F, Aristimuño OC, Zambrano JL, Rojas H, Bartoli F, Salazar L, Chwetzoff S, Sapin C. Expression of nonstructural rotavirus protein NSP4 mimics Ca2+ homeostasis changes induced by rotavirus infection in cultured cells. J Virol. 2008;82:11331-11343. [PubMed] [DOI] |
| 19. | Montero H, Arias CF, Lopez S. Rotavirus Nonstructural Protein NSP3 is not required for viral protein synthesis. J Virol. 2006;80:9031-9038. [PubMed] |
| 20. | Bagchi P, Dutta D, Chattopadhyay S, Mukherjee A, Halder UC, Sarkar S, Kobayashi N, Komoto S, Taniguchi K, Chawla-Sarkar M. Rotavirus nonstructural protein 1 suppresses virus-induced cellular apoptosis to facilitate viral growth by activating the cell survival pathways during early stages of infection. J Virol. 2010;84:6834-6845. [PubMed] [DOI] |
| 21. | Barro M, Patton JT. Rotavirus NSP1 inhibits expression of type I interferon by antagonizing the function of interferon regulatory factors IRF3, IRF5, and IRF7. J Virol. 2007;81:4473-4481. [PubMed] [DOI] |
| 22. | Blutt SE, Matson DO, Crawford SE, Staat MA, Azimi P, Bennett BL, Piedra PA, Conner ME. Rotavirus antigenemia in children is associated with viremia. PLoS Med. 2007;4:e121. [PubMed] [DOI] |
| 25. | 廖 波, 张 克英, 丁 雪梅, 徐 志文, 白 世平. 饲粮添加25-羟基维生素D3对轮状病毒攻毒和未攻毒断奶仔猪血清和肠内容物抗体和细胞因子水平的影响. 动物营养学报. 2011;23:34-42. |
| 28. | 徐 倩倩, 马 利芹, 张 晓利, 王 丽叶, 霍 晓青, 褚 军, 薛 晓阳, 陈 立功, 秦 建华, 董 世山. 白头翁素对PRV、E.coli混合感染性腹泻肠道超微结构的影响. 中国农学通报. 2010;26:13-17. |
| 30. | Offit PA, Hoffenberg EJ, Santos N, Gouvea V. Rotavirus-specific humoral and cellular immune response after primary, symptomatic infection. J Infect Dis. 1993;167:1436-1440. [PubMed] [DOI] |
| 31. | Velázquez FR, Matson DO, Calva JJ, Guerrero L, Morrow AL, Carter-Campbell S, Glass RI, Estes MK, Pickering LK, Ruiz-Palacios GM. Rotavirus infections in infants as protection against subsequent infections. N Engl J Med. 1996;335:1022-1028. [PubMed] [DOI] |
| 32. | Vesikari T, Isolauri E, D'Hondt E, Delem A, André FE, Zissis G. Protection of infants against rotavirus diarrhoea by RIT 4237 attenuated bovine rotavirus strain vaccine. Lancet. 1984;1:977-981. [PubMed] [DOI] |
| 34. | Perez-Schael I, Garcia D, Gonzalez M, Gonzalez R, Daoud N, Perez M, Cunto W, Kapikian AZ, Flores J. Prospective study of diarrheal diseases in Venezuelan children to evaluate the efficacy of rhesus rotavirus vaccine. J Med Virol. 1990;30:219-229. [PubMed] [DOI] |
| 35. | From the Centers for Disease Control and Prevention. Intussusception among recipients of rotavirus vaccine--United States, 1998-1999. JAMA. 1999;282:520-521. [PubMed] [DOI] |
| 36. | Richardson V, Hernandez-Pichardo J, Quintanar-Solares M, Esparza-Aguilar M, Johnson B, Gomez-Altamirano CM, Parashar U, Patel M. Effect of rotavirus vaccination on death from childhood diarrhea in Mexico. N Engl J Med. 2010;362:299-305. [PubMed] [DOI] |
| 37. | Goveia MG, Rodriguez ZM, Dallas MJ, Itzler RF, Boslego JW, Heaton PM, DiNubile MJ. Safety and efficacy of the pentavalent human-bovine (WC3) reassortant rotavirus vaccine in healthy premature infants. Pediatr Infect Dis J. 2007;26:1099-1104. [PubMed] [DOI] |
| 38. | Buttery JP, Lambert SB, Grimwood K, Nissen MD, Field EJ, Macartney KK, Akikusa JD, Kelly JJ, Kirkwood CD. Reduction in rotavirus-associated acute gastroenteritis following introduction of rotavirus vaccine into Australia's National Childhood vaccine schedule. Pediatr Infect Dis J. 2011;30:S25-S29. [PubMed] [DOI] |
| 39. | Tate JE, Mutuc JD, Panozzo CA, Payne DC, Cortese MM, Cortes JE, Yen C, Esposito DH, Lopman BA, Patel MM. Sustained decline in rotavirus detections in the United States following the introduction of rotavirus vaccine in 2006. Pediatr Infect Dis J. 2011;30:S30-S34. [PubMed] [DOI] |
| 40. | McClenahan SD, Krause PR, Uhlenhaut C. Molecular and infectivity studies of porcine circovirus in vaccines. Vaccine. 2011;29:4745-4753. [PubMed] [DOI] |
| 41. | Victoria JG, Wang C, Jones MS, Jaing C, McLoughlin K, Gardner S, Delwart EL. Viral nucleic acids in live-attenuated vaccines: detection of minority variants and an adventitious virus. J Virol. 2010;84:6033-6040. [PubMed] [DOI] |
| 42. | Willoughby RE. Use of Rotarix temporarily suspended, no health risks seen. AAP News. 2010;10:1542. |
| 45. | Fu C, Wang M, Liang J, He T, Wang D, Xu J. Effectiveness of Lanzhou lamb rotavirus vaccine against rotavirus gastroenteritis requiring hospitalization: a matched case-control study. Vaccine. 2007;25:8756-8761. [PubMed] [DOI] |
| 46. | 寇 桂英, 胡 广宏, 包 红, 王 名强, 陈 汉泉, 汪 洲, 周 旭. 轮状病毒基因重配株LD9(G2型)vero细胞适应株的选育及其生物学特性. 中国生物制品学杂志. 2011;23:857-860. |
| 48. | Tacket CO, Mason HS. A review of oral vaccination with transgenic vegetables. Microbes Infect. 1999;1:777-783. [PubMed] [DOI] |
| 49. | Matsumura T, Itchoda N, Tsunemitsu H. Production of immunogenic VP6 protein of bovine group A rotavirus in transgenic potato plants. Arch Virol. 2002;147:1263-1270. [PubMed] [DOI] |
| 50. | Chung IS, Kim CH, Kim K Il, Hong S H, Park J H, Kim J K , Kim W Y. Production of recombinant rotavirus VP6 from a suspension culture of transgenic tomato (Lycopersicon esculentum Mill.) cells. Biotechnology Letters. 2000;22:25l-255. [DOI] |
| 51. | Yu J, Langridge W. Expression of rotavirus capsid protein VP6 in transgenic potato and its oral immunogenicity in mice. Transgenic Res. 2003;12:163-169. [PubMed] [DOI] |
| 54. | Wu YZ, Li JT, Mou ZR, Fei L, Ni B, Geng M, Jia ZC, Zhou W, Zou LY, Tang Y. Oral immunization with rotavirus VP7 expressed in transgenic potatoes induced high titers of mucosal neutralizing IgA. Virology. 2003;313:337-342. [PubMed] [DOI] |
| 55. | Kim TG, Langridge WH. Assembly of cholera toxin B subunit full-length rotavirus NSP4 fusion protein oligomers in transgenic potato. Plant Cell Rep. 2003;21:884-890. [PubMed] |
| 56. | Streckert HJ, Grunert B, Werchau H. Antibodies specific for the carboxy-terminal region of the major surface glycoprotein of simian rotavirus (SA11) and human rotavirus (Wa). J Cell Biochem. 1986;30:41-49. [PubMed] [DOI] |
| 57. | Conner ME, Zarley CD, Hu B, Parsons S, Drabinski D, Greiner S, Smith R, Jiang B, Corsaro B, Barniak V. Virus-like particles as a rotavirus subunit vaccine. J Infect Dis. 1996;174 Suppl 1:S88-S92. [PubMed] |