修回日期: 2012-11-23
接受日期: 2012-12-03
在线出版日期: 2013-01-08
肿瘤的发生与癌基因的过表达或者抑癌基因的低表达密切相关. Ⅲ型组蛋白脱乙酰酶SIRT1的基因表达和脱乙酰酶活性在肿瘤细胞中均发生上调, 由此推测这些也许导致了肿瘤的发生. SIRT1也能够引起肿瘤抑制因子的脱乙酰化从而促进肿瘤发生. 在肿瘤的发生、发展、各种特性维持中, SIRT1因其能够促进肿瘤细胞增殖、抑制凋亡、衰老等活性很可能扮演着重要角色. 然而, 另一方面, SIRT1也能够脱乙酰化肿瘤促进因子而起到抑制肿瘤作用. SIRT1在肿瘤的发生过程中扮演的角色存在争议. 因此, 对SIRT1进行进一步研究就显得尤为重要, 而其作为肿瘤治疗靶点的可能性使得研究更具临床意义.
引文著录: 张广, 吴俊华. SIRT1与肿瘤的研究进展. 世界华人消化杂志 2013; 21(1): 6-12
Revised: November 23, 2012
Accepted: December 3, 2012
Published online: January 8, 2013
Tumorigenesis is closely related to overexpression of oncogenes and/or down-expression of tumor suppressor genes. Gene expression and deacetylase activity of SIRT1, a class Ⅲhistone deacetylase, are up-regulated in tumor cells, which suggests that SIRT1 may be involved in tumorigenesis. SIRT1 may induce deacetylation of tumor suppressor proteins to promote tumorgenesis. SIRT1 promotes tumor occurrence, development, and maintenance of various characteristics possibly by promoting cell proliferation, inhibiting apoptosis, and preventing senescence. On the other hand, SIRT1 can also deacetylase tumor inducers to inhibit tumorigenesis. Therefore, further investigation of the role of SIRT1 in tumorigenesis is of great importance, and SIRT1 may be used as a therapeutic target for tumors.
- Citation: Zhang G, Wu JH. Relationship between SIRT1 and tumors. Shijie Huaren Xiaohua Zazhi 2013; 21(1): 6-12
- URL: https://www.wjgnet.com/1009-3079/full/v21/i1/6.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i1.6
肿瘤的形成是一个复杂的过程, 在这一过程中, 正常细胞转变成为肿瘤细胞, 即所谓的恶变. 在细胞恶变过程中, 在细胞水平及基因水平逐渐发生变化, 并最终演变成为生长及分化都不可控制的肿瘤细胞[1,2]. 通常能够编码那些在肿瘤形成中起到促进作用蛋白的基因被称之为癌基因, 而抑癌基因则是那些能够编码抑制肿瘤蛋白的基因. 癌基因与抑癌基因都因其在肿瘤形成过程中扮演重要角色而被人们广泛研究. 在所有肿瘤中, 消化系肿瘤以其高发生率、易转移、发现晚、预后差等为人们重视. 其中, 胃癌、肝癌、肠癌发生率分别占我国人群肿瘤发生的第1、3、4位, 胰腺癌、胆囊癌等虽然发生率较低, 但预后极差, 因此从癌基因与抑癌基因角度对消化系统肿瘤的深入研究显得愈发重要.
在过去的十余年间, SIRT1因其在肿瘤形成过程中扮演的重要角色而被人们不断研究[3-6]. SIRT1是sirtuin家族中组蛋白3的脱乙酰基酶, 他是酵母沉默信号调节因子2(silencing information regulator 2, sir2)在人体中的类似物. sirtuin蛋白广泛分布于细胞内外, 对诸多正常的生理学过程起到调节作用. 这些生理学过程包括: 细胞增殖、炎症反应、新陈代谢(包括ATP生成、胰岛素分泌和尿素循环)等[7-11]. 关于SIRT蛋白在细胞中的分布和功能的详细信息见图1[7-11]. 在SIRT的7个成员当中, SIRT1在总的DNA及氨基酸序列方面是最大的, 同时针对SIRT1的研究也最多. SIRT1在肿瘤形成过程中既有癌基因也有抑癌基因的作用, 可以说SIRT1对癌基因与抑癌基因的平衡关系是起到重要作用的. 随着对SIRT1研究的不断深入, 其在消化系肿瘤中所扮演的角色也逐渐被人们认识并争论, 以SIRT1作为靶点, 为消化系肿瘤的治疗提供了新的途径, 并且正逐渐成为研究热点. 因此, 本文综述了SIRT1在肿瘤发生、发展等过程中的争议性角色, 并着重探讨了SIRT1在消化系肿瘤中的作用, 以期为以SIRT1作为消化系肿瘤治疗靶点的研究做好铺垫.
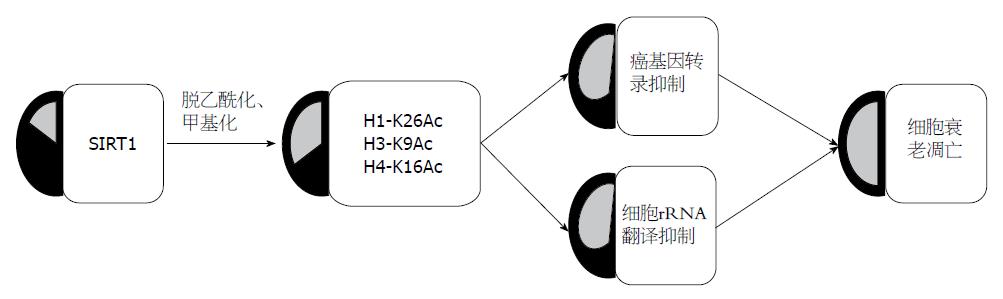
SIRT1通过与转录因子、共调节子相互作用而被募集到染色体周围. 在细胞核中, SIRT1对相关组蛋白特定部位额氨基酸起脱乙酰基作用, 这些组蛋白包括: H1组蛋白26位点赖氨酸(H1-K26Ac)、H3组蛋白9位点赖氨酸(H3-K9Ac)和H4组蛋白16位点赖氨酸(H4-K16Ac)[12,13]. 同时SIRT1还是组蛋白修饰酶的调控因子. SIRT1能够通过与组蛋白乙酰转移酶P300的结合而对其起抑制作用, 进而间接促进组蛋白的低乙酰化.
SIRT1对组蛋白的脱乙酰基作用与其促进组蛋白甲基化作用相辅相成. SIRT1能够募集组蛋白甲基转移酶SUV39H1并对其起到脱乙酰作用, 进而增进其甲基转移酶的活性, 这样一来, 增加了SIRT1的靶向位点-H3K9me3[14]. 另外, 通过与另一组蛋白甲基转移酶(Ezh2)的局部化作用, SIRT1间接的调控了H3K27和H1K26的甲基化[15,16].
肿瘤组织及肿瘤细胞中甚至在鼠类的肿瘤中SIRT1的过表达, 自然而然让人们猜测SIRT1是肿瘤促进因子[21-23]. 有研究报道, SIRT1在人前列腺癌、人原发性结肠癌、急性髓细胞性白血病中均明显过表达[24-26]. 此外, SIRT1在人鳞状上皮细胞癌、基底细胞癌中也高表达[27]. Ford等[28]通过沉默SIRT1, 能够导致人上皮细胞癌细胞的生长停滞与凋亡. 相比之下, 正常的人上皮细胞及二倍体成纤维细胞对SIRT1的沉默表现出良好的抗性. Heltweg等[18]报道在基因毒性应激期间使用cambinol抑制SIRT1的活性, 能够导致关键应激反应蛋白的超乙酰化, 进而导致细胞周期停滞. 使用cambinol作用于BCL6表达的Brukitt淋巴瘤细胞能够导致细胞凋亡, 这一凋亡过程被认为与BCL6及P53的超乙酰化相关. Liang等[30]报道通过使用一种siRNA降低SIRT1水平, 能够将一种肝癌顺铂耐药细胞的药物敏感程度提高20倍. 通过cDNA转染能够在普通肝癌顺铂敏感细胞中增加顺铂耐药程度达2-3倍. Chen等[30]通过研究多例肝癌标本发现, SIRT1表达水平与肝癌化疗耐药呈正相关, 另外通过统计学分析, 还得出结论, SIRT1在肝癌中表达情况与肝癌的预后呈正相关. 因此, 过表达SIRT1进而上调SIRT1功能能够阻止肿瘤细胞的凋亡并降低肿瘤细胞对一些抗肿瘤药物的敏感性. 相对地, 降低SIRT1功能能够得到相反的作用. 此外, SIRT1能够使P53、FOXO脱乙酰基, 进而阻断了P53、FOXO依赖的转录及凋亡作用[30,31].
诸多临床病理研究与细胞系SIRT1水平的研究表明, SIRT1水平往往与肿瘤转移、侵袭及其他生物学特性相关, 并最终与患者的预后相关. Lee等[32]通过统计多例乳癌患者的SIRT1与DBC1水平与患者预后发现, SIRT1与DBC1水平与患者手术术后的预后密切相关. 同样的, Elangovan等[33]的研究也表明, SIRT1在乳癌形成中起到了重要作用. 在胃癌中, 同样的方法也显示SIRT1与肿瘤分期、患者预后密切相关[34]. Chen等[30]研究发现, 在肝癌中SIRT1也同样扮演相同的角色, 而且SIRT1促进了化疗耐药. 另外Wang等[35]还发现, SIRT1是通过P13K/PTEN/AKT途径促进肝癌的发生. 此外, 在胰腺癌、前列腺癌、神经胶质瘤中均发现, SIRT1与肿瘤的发生关系密切, 通过不同手段影响SIRT1水平与功能, 显著影响了肿瘤细胞的凋亡、转移、侵袭.
SIRT1对肿瘤的生物学特性有一定影响. 抑制SIRT1除了能够影响肿瘤细胞的凋亡, 还影响了肿瘤细胞的增殖、转移、侵袭等特性. Nakane等[36]在使用siRNA敲除前列腺癌细胞中SIRT1后发现, 肿瘤的转移、侵袭能力明显受到影响. Liu等[13]研究miR-520与miR-373对纤维母细胞瘤的转移、侵袭能力影响, 发现miR-520与miR-373时通过影响SIRT1进而影响了Ras/Raf/MEK/Erk通路与NF-kB来影响的肿瘤转移、侵袭.
遗传工程小鼠为评价基因体内功能提供了有力的途径. 然而由于SIRT1阴性胚胎的致死率较高, SIRT1在肿形成中的作用并不能通过这一方法来检验[37,38]. 由于DNA损伤修复及组蛋白修饰功能受到抑制, SIRT1阴性的鼠胚胎成纤维细胞表现出了明显的染色体不稳定性. 因此, 这些数据表明SIRT1在肿瘤形成过程中能够作为肿瘤促进因子.
SIRT1可以作为肿瘤促进因子. 然而, 其他的研究同时表明, SIRT1还能够作为肿瘤抑制因子(图2).
在过表达SIRT1的转基因鼠中, 没有任何肿瘤形成[39,40]. 敲除或者使用其他方法抑制SIRT1也并不能够活化P53的功能[41,42]. Firestein等[43]报道, 在结肠腺瘤息肉突变转基因小鼠中, 过表达SIRT1可以通过其脱乙酰基作用失活β-catenin, 进而降低结肠癌的发生率. 他们进一步研究发现, 过表达SIRT1能够显著抑制结肠癌细胞的增殖. 另外, 有研究表明, 在小鼠转移瘤模型中, 敲除SIRT1增加了HCT116结肠癌细胞的增殖[44].
Wang等[45]发现, SIRT1的表达在BRCA1相关的乳癌中表达高于非BRCA1相关的乳癌. 他们进一步研究表明, 使用SIRT1激活剂resveratrol能够促进这些细胞的凋亡. Howitz等[46]的研究也表明, 当恢复BRCA1突变癌细胞中SIRT1水平时, 肿瘤细胞的增殖被明显抑制. 这些表明, SIRT1抑制了BRCA1相关乳癌细胞的Suvivin, Suvivin是多种肿瘤细胞中上调的一种抗凋亡蛋白[47]. Pazienza等[48]研究了19例结直肠癌标本, 发现肿瘤组织中SIRT1水平并非高表达, 同时他还研究了结肠癌细胞系CaCo2与SW480细胞, 发现两种细胞系中SIRT1水平表现出了明显的差异性.
SIRT1作为肿瘤抑制因子的另一证据来源于对小鼠p53杂合子的研究. P53+/-在被照射后因丢失p53杂合子而表现出肿瘤加速形成的现象[49]. 因为SIRT1能够减低培养细胞中的P53水平, 那么SIRT1+/-P53+/-则应该不易形成肿瘤. 然而结果却并非如同想象, 从5月龄开始SIRT1+/-P53+/-小鼠在诸多器官中均形成了自然发生的肿瘤. 到20月龄, 76%的小鼠发生肿瘤. 其中21只SIRT1+/-小鼠中2只及22只P53+/-小鼠中3只形成肿瘤. 有趣的是, 使用resveratrol药物可以显著减低肿瘤的形成[50].
NF-以显与上调控制细胞存活的基因产物相关. Yeung等[51]的研究表明, SIRT1能够通过对NF-kB过对的亚单位RelA/p65脱乙酰化, 进而促进TNF-, 导致的凋亡. c-Myc在细胞增殖、凋亡、干细胞更新换代中起着重要作用. SIRT1能够通过脱乙酰化降低c-Myc的稳定性, 进而抑制c-Myc的活性. 最后, 在LNCaP前列腺癌细胞中, SIRT1通过同时脱乙酰化雄激素受体和组蛋白抑制抑制了双氢睾酮依赖的细胞生长[52,53]. 综上所述, 多种证据表明, SIRT1作为潜在的肿瘤抑制因子, 显著抑制了肿瘤的发生.
从上文可以看出, SIRT1作为癌基因/抑癌基因被人们所广泛研究, 而在消化系肿瘤(包括肝癌、胃癌、结直肠癌、胰腺癌等)中亦被重视, 或者说, SIRT1在消化系肿瘤中的研究相比其在其他肿瘤的研究似乎更为广泛与深入. 与其他肿瘤中的角色类似, SIRT1在消化系肿瘤中的角色也被人们所争论.
首先, SIRT1在肝癌中所扮演的角色具有两面性. Chen等[30]的研究发现, SIRT1表达水平与肝癌化疗耐药呈正相关, 还得出结论, SIRT1在肝癌中表达情况与肝癌的预后呈正相关. 此外Liang等[30]报道使用siRNA降低SIRT1水平, 能够将一种肝癌顺铂耐药细胞的药物敏感程度提高20倍. 通过cDNA转染能够在普通肝癌顺铂敏感细胞中增加顺铂耐药程度达2-3倍. 这些研究都表明, SIRT1在肝癌的发生、侵袭、耐药等过程中起到了重要的作用. 另一方面, 在代谢相关的肝癌中, SIRT1又被认为扮演着抑癌基因的角色. Herranz等[54]发现, 通过过表达SIRT1或是去除SIRT1抑制剂DBC1达到上调SIRT1水平, 能够明显改善代谢相关肝癌小鼠模型的肝癌发生率, 而且上调SIRT1水平后, 正常肝脏遭受的高脂损伤明显降低.
在结肠癌的发生过程中, SIRT1更多充当抑癌基因的角色. Stünkel等[26]研究了不同的结肠癌细胞系及结肠癌组织标本, 发现在结肠癌细胞系及结肠癌组织标本中SIRT1水平均明显高表达. Akao等[55]通过沉默SIRT1改善了结肠癌耐药细胞系DLD-1对5-Fu的药物敏感性, 进而证实了SIRT1在结肠癌耐药中起到作用. 但是随后的研究发现, SIRT1在结肠癌的发生、发展中更多的扮演着抑癌基因的角色. Firestein与Kabra等[43,44]的研究发现, 在25%的Ⅰ/Ⅱ/Ⅲ期结肠癌组织中SIRT1水平高表达, 但是在Ⅳ肿瘤中并未发现SIRT1水平的上调, 同时, 在所有结肠癌组织中, 尚有30%检测到SIRT1水平低于正常. 此外, 他们还发现, 通过siRNA敲除SIRT1增加了小鼠模型中的结肠癌发生率, 而用白藜芦醇上调SIRT1明显减低了其发生率.
胰腺肿瘤中, SIRT1的作用同样存在争议. Zhao等[56]研究了胰腺癌组织及细胞系, 发现HIC1/SIRT1途径在胰腺癌组织及细胞系中均明显上调, 得出结论, SIRT1很可能在胰腺癌的发生、发展过程中起到重要作用. 同时, Cho等[57]的研究发现, 在过表达胰腺癌上调因子的胰腺癌细胞系中, SIRT1能够通过抑制β-catenin进而起到抑制细胞增殖的作用.
在胃癌中, SIRT1的研究更加倾向于与胃癌的发生、发展正相关. Cha等[58]通过研究胃癌组织标本发现胃癌中DBC1与SIRT1的水平与胃癌的预后明显相关, 胃癌组织中DBC1与SIRT1明显高表达, 而且DBC1与SIRT1的水平和肿瘤分期、淋巴结转移、肿瘤侵袭、P53水平均明显相关.
综上, SIRT1在消化系肿瘤中的角色同其他肿瘤类似, 大都存在争议, 而争论最多的肝癌、结肠癌中, SIRT1到底是作为促进肿瘤发生的癌基因还是抑制肿瘤形成的抑癌基因仍存在明显争议. 而在胃癌中, SIRT1因其在肿瘤组织中高表达及与肿瘤分期等的正相关性而被认为是癌基因, 但在胃癌中的进一步研究结论是否与其他肿瘤类似需要进一步证实.
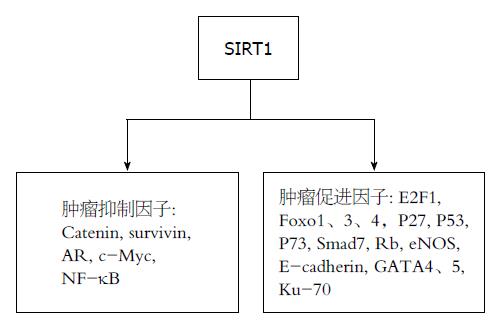
通过甲基化组蛋白, 脱乙酰化组蛋白与非组蛋白、甲基化DNA等作用, SIRT1调控着众多细胞内因子, 这些细胞内因子在细胞增殖、衰老、凋亡及血管发生中起到了重要的作用. 肿瘤抑制因子与促进因子平衡关系的打破最终导致了肿瘤的发生. SIRT1促进肿瘤发生的机制包括: (1)SIRT1通过改变E2F1、FOXO1、FOXO3、FOXO4、P27、P53、P73、SMAD7、Rb、Bcl-6, Ku-70、E-cadherin、GATA4与GATA5的功能抑制了细胞的凋亡; (2)SIRT1通过修饰E2F1、P53、FOXO1/3/4、Rb和P16抑制细胞衰老与分化; (3)SIRT1通过促进肿瘤血管发生促进肿瘤生长. SIRT1去乙酰化FOXO1, 抑制了细胞衰老, 进而促进内皮细胞增殖与血管发生, 而肿瘤血管的发生与肿瘤的营养供应又密切相关. 此外, SIRT1能够通过增加eNOS的功能导致氮氧化合物水平的增高, 而氮氧化合物水平增高则导致了肿瘤血管数目增加及营养增加. 相反地, SIRT1有可能通过抑制肿瘤促进因子如: catenin、survivin、c-Myc、NF-κB和AR来抑制肿瘤形成. 诸多的SIRT1上游调控因子则对SIRT1水平起到调控作用. 例如: E2F1、AROS、HuR和resveratrol能够上调SIRT1水平或者功能, 而p53、HIC1、DBC1和cycline B/CDK1能够下调SIRT1水平或其功能. 有趣的是, 很多SIRT1上游调控因子同时是SIRT1下游调控因子, 当然这很可能是SIRT1的负反馈调节.
在消化系肿瘤中, 多方面的研究得到了不同的结果. 在肝癌、结肠癌、胰腺癌中人们存在广泛争论, SIRT1能够在同一肿瘤中同时作为癌基因与抑癌基因, 肝癌、结肠癌、胰腺癌细胞系/组织中均检测到SIRT1水平高表达, 而通过不同途径上调SIRT1水平降低了小鼠模型的肿瘤发生率, 这一矛盾的现象为人们多不解. 在胃癌中, 大都倾向于SIRT1促进了肿瘤的发生、发展、耐药, 原因类似于其他肿瘤中的SIRT1水平高表达, 所以, 胃癌中的SIRT1深入研究是否同其他肿瘤类似将会非常有趣.
SIRT1在肿瘤发生中的作用仍具有争议性, 而SIRT1在肿瘤发生过程中到底起到抑制作用还是促进作用可能依赖于时间点不同及上下游调控因子的不同. 显而易见的是, SIRT1是调控细胞增殖、凋亡、衰老和血管发生等过程的众多细胞因子中最具典型的一种. 事实上, 在肿瘤抑制因子与促进因子之间的平衡关系才是在肿瘤发生中起到决定性作用的. 因此, 对于SIRT1在特定肿瘤环境中的特别作用的进一步研究是非常有必要的. 然而, 虽然目前技术不断进步, 但是SIRT1的活性如何检测仍没有确切的办法. SIRT1蛋白水平、NAD+浓度和SIRT1甲基化片段都被用来替代检测SIRT1功能. 然而用这些指标来替代却并不能确切衡量, 因为许多蛋白都可能调节SIRT1的功能. 所有研究的终极目的都在研究药物能够于上调或者下调SIRT1功能. 虽然已经有大量关于SIRT1的研究, 但是进一步的深入研究无疑可以增加我们对于SIRT1在不同肿瘤中扮演的不同角色的认识. 在未来不久, 我们期望对SIRT1的靶向治疗能够转变成为肿瘤治疗的新方法.
关于肿瘤起源、发展、侵袭、耐药等方面的问题一直是研究的热点. 多种肿瘤细胞中的长寿基因SIRT1过表达引起人们的关注, 认为这一与长寿关系密切的脱乙酰基酶在肿瘤的各种特性中起到至关重要的作用.
陈洪, 主任医师, 副教授, 东南大学附属中大医院消化科
有报道SIRT1在胃癌、前列腺癌、肝癌、血液肿瘤中均明显上调, 并且SIRT1水平与肿瘤分期、预后密切相关, 后期的进一步研究发现, SIRT1还通过其脱乙酰基作用调控着诸多与肿瘤关系密切的信号因子, 进而影响着肿瘤的各种特性.
本文以一种全新的思维, 即列举多种消化系肿瘤中SIRT1作为癌基因/抑癌基因被研究并争论, 进而发现SIRT1的研究、应用价值.
本文着重从消化系肿瘤方面探讨SIRT1在诸如胃癌、肝癌、胰腺癌、结肠癌等中的关键性作用、存在的争议以及需要进一步解决的问题.
本文选题具有新颖性, 对肿瘤分子学的研究有一定参考意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Croce CM. Oncogenes and cancer. N Engl J Med. 2008;358:502-511. [PubMed] [DOI] |
| 2. | Knudson AG. Two genetic hits (more or less) to cancer. Nat Rev Cancer. 2001;1:157-162. [PubMed] [DOI] |
| 3. | Herranz D, Serrano M. SIRT1: recent lessons from mouse models. Nat Rev Cancer. 2010;10:819-823. [PubMed] [DOI] |
| 4. | Chung S, Yao H, Caito S, Hwang JW, Arunachalam G, Rahman I. Regulation of SIRT1 in cellular functions: role of polyphenols. Arch Biochem Biophys. 2010;501:79-90. [PubMed] [DOI] |
| 5. | Yi J, Luo J. SIRT1 and p53, effect on cancer, senescence and beyond. Biochim Biophys Acta. 2010;1804:1684-1689. [PubMed] [DOI] |
| 6. | Haigis MC, Sinclair DA. Mammalian sirtuins: biological insights and disease relevance. Annu Rev Pathol. 2010;5:253-295. [PubMed] [DOI] |
| 7. | de Boer VC, de Goffau MC, Arts IC, Hollman PC, Keijer J. SIRT1 stimulation by polyphenols is affected by their stability and metabolism. Mech Ageing Dev. 2006;127:618-627. [PubMed] [DOI] |
| 8. | Baur JA, Pearson KJ, Price NL, Jamieson HA, Lerin C, Kalra A, Prabhu VV, Allard JS, Lopez-Lluch G, Lewis K. Resveratrol improves health and survival of mice on a high-calorie diet. Nature. 2006;444:337-342. [PubMed] [DOI] |
| 9. | Argmann C, Auwerx J. Insulin secretion: SIRT4 gets in on the act. Cell. 2006;126:837-839. [PubMed] [DOI] |
| 10. | Nakagawa T, Lomb DJ, Haigis MC, Guarente L. SIRT5 Deacetylates carbamoyl phosphate synthetase 1 and regulates the urea cycle. Cell. 2009;137:560-570. [PubMed] |
| 11. | Michishita E, McCord RA, Berber E, Kioi M, Padilla-Nash H, Damian M, Cheung P, Kusumoto R, Kawahara TL, Barrett JC. SIRT6 is a histone H3 lysine 9 deacetylase that modulates telomeric chromatin. Nature. 2008;452:492-496. [PubMed] [DOI] |
| 12. | Vaquero A, Scher M, Lee D, Erdjument-Bromage H, Tempst P, Reinberg D. Human SirT1 interacts with histone H1 and promotes formation of facultative heterochromatin. Mol Cell. 2004;16:93-105. [PubMed] [DOI] |
| 13. | Liu T, Liu PY, Marshall GM. The critical role of the class III histone deacetylase SIRT1 in cancer. Cancer Res. 2009;69:1702-1705. [PubMed] [DOI] |
| 14. | Vaquero A, Scher M, Erdjument-Bromage H, Tempst P, Serrano L, Reinberg D. SIRT1 regulates the histone methyl-transferase SUV39H1 during heterochromatin formation. Nature. 2007;450:440-444. [PubMed] [DOI] |
| 15. | Kuzmichev A, Margueron R, Vaquero A, Preissner TS, Scher M, Kirmizis A, Ouyang X, Brockdorff N, Abate-Shen C, Farnham P. Composition and histone substrates of polycomb repressive group complexes change during cellular differentiation. Proc Natl Acad Sci USA. 2005;102:1859-1864. [PubMed] [DOI] |
| 16. | Zhang T, Kraus WL. SIRT1-dependent regulation of chromatin and transcription: linking NAD(+) metabolism and signaling to the control of cellular functions. Biochim Biophys Acta. 2010;1804:1666-1675. [PubMed] [DOI] |
| 17. | Wang C, Chen L, Hou X, Li Z, Kabra N, Ma Y, Nemoto S, Finkel T, Gu W, Cress WD. Interactions between E2F1 and SirT1 regulate apoptotic response to DNA damage. Nat Cell Biol. 2006;8:1025-1031. [PubMed] [DOI] |
| 18. | Heltweg B, Gatbonton T, Schuler AD, Posakony J, Li H, Goehle S, Kollipara R, Depinho RA, Gu Y, Simon JA. Antitumor activity of a small-molecule inhibitor of human silent information regulator 2 enzymes. Cancer Res. 2006;66:4368-4377. [PubMed] [DOI] |
| 19. | Luo J, Nikolaev AY, Imai S, Chen D, Su F, Shiloh A, Guarente L, Gu W. Negative control of p53 by Sir2alpha promotes cell survival under stress. Cell. 2001;107:137-148. [PubMed] [DOI] |
| 20. | Pruitt K, Zinn RL, Ohm JE, McGarvey KM, Kang SH, Watkins DN, Herman JG, Baylin SB. Inhibition of SIRT1 reactivates silenced cancer genes without loss of promoter DNA hypermethylation. PLoS Genet. 2006;2:e40. [PubMed] [DOI] |
| 21. | Chen WY, Wang DH, Yen RC, Luo J, Gu W, Baylin SB. Tumor suppressor HIC1 directly regulates SIRT1 to modulate p53-dependent DNA-damage responses. Cell. 2005;123:437-448. [PubMed] [DOI] |
| 22. | Ford J, Ahmed S, Allison S, Jiang M, Milner J. JNK2-dependent regulation of SIRT1 protein stability. Cell Cycle. 2008;7:3091-3097. [PubMed] [DOI] |
| 23. | Jung-Hynes B, Nihal M, Zhong W, Ahmad N. Role of sirtuin histone deacetylase SIRT1 in prostate cancer. A target for prostate cancer management via its inhibition? J Biol Chem. 2009;284:3823-3832. [PubMed] [DOI] |
| 24. | Huffman DM, Grizzle WE, Bamman MM, Kim JS, Eltoum IA, Elgavish A, Nagy TR. SIRT1 is significantly elevated in mouse and human prostate cancer. Cancer Res. 2007;67:6612-6618. [PubMed] [DOI] |
| 25. | Bradbury CA, Khanim FL, Hayden R, Bunce CM, White DA, Drayson MT, Craddock C, Turner BM. Histone deacetylases in acute myeloid leukaemia show a distinctive pattern of expression that changes selectively in response to deacetylase inhibitors. Leukemia. 2005;19:1751-1759. [PubMed] [DOI] |
| 26. | Stünkel W, Peh BK, Tan YC, Nayagam VM, Wang X, Salto-Tellez M, Ni B, Entzeroth M, Wood J. Function of the SIRT1 protein deacetylase in cancer. Biotechnol J. 2007;2:1360-1368. [PubMed] |
| 27. | Lim CS. SIRT1: tumor promoter or tumor suppressor? Med Hypotheses. 2006;67:341-344. [PubMed] [DOI] |
| 28. | Ford J, Jiang M, Milner J. Cancer-specific functions of SIRT1 enable human epithelial cancer cell growth and survival. Cancer Res. 2005;65:10457-10463. [PubMed] [DOI] |
| 29. | Liang XJ, Finkel T, Shen DW, Yin JJ, Aszalos A, Gottesman MM. SIRT1 contributes in part to cisplatin resistance in cancer cells by altering mitochondrial metabolism. Mol Cancer Res. 2008;6:1499-1506. [PubMed] [DOI] |
| 30. | Chen HC, Jeng YM, Yuan RH, Hsu HC, Chen YL. SIRT1 promotes tumorigenesis and resistance to chemotherapy in hepatocellular carcinoma and its expression predicts poor prognosis. Ann Surg Oncol. 2012;19:2011-2019. [PubMed] |
| 31. | Brunet A, Sweeney LB, Sturgill JF, Chua KF, Greer PL, Lin Y, Tran H, Ross SE, Mostoslavsky R, Cohen HY. Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase. Science. 2004;303:2011-2015. [PubMed] [DOI] |
| 32. | Lee H, Kim KR, Noh SJ, Park HS, Kwon KS, Park BH, Jung SH, Youn HJ, Lee BK, Chung MJ. Expression of DBC1 and SIRT1 is associated with poor prognosis for breast carcinoma. Hum Pathol. 2011;42:204-213. [PubMed] |
| 33. | Elangovan S, Ramachandran S, Venkatesan N, Ananth S, Gnana-Prakasam JP, Martin PM, Browning DD, Schoenlein PV, Prasad PD, Ganapathy V. SIRT1 is essential for oncogenic signaling by estrogen/estrogen receptor α in breast cancer. Cancer Res. 2011;71:6654-6664. [PubMed] |
| 34. | Feng AN, Zhang LH, Fan XS, Huang Q, Ye Q, Wu HY, Yang J. Expression of SIRT1 in gastric cardiac cancer and its clinicopathologic significance. Int J Surg Pathol. 2011;19:743-750. [PubMed] |
| 35. | Wang H, Liu H, Chen K, Xiao J, He K, Zhang J, Xiang G. SIRT1 promotes tumorigenesis of hepatocellular carcinoma through PI3K/PTEN/AKT signaling. Oncol Rep. 2012;28:311-318. [PubMed] |
| 36. | Nakane K, Fujita Y, Terazawa R, Atsumi Y, Kato T, Nozawa Y, Deguchi T, Ito M. Inhibition of cortactin and SIRT1 expression attenuates migration and invasion of prostate cancer DU145 cells. Int J Urol. 2012;19:71-79. [PubMed] |
| 37. | Cardiff RD, Anver MR, Gusterson BA, Hennighausen L, Jensen RA, Merino MJ, Rehm S, Russo J, Tavassoli FA, Wakefield LM. The mammary pathology of genetically engineered mice: the consensus report and recommendations from the Annapolis meeting. Oncogene. 2000;19:968-988. [PubMed] [DOI] |
| 38. | McBurney MW, Yang X, Jardine K, Bieman M, Th'ng J, Lemieux M. The absence of SIR2alpha protein has no effect on global gene silencing in mouse embryonic stem cells. Mol Cancer Res. 2003;1:402-409. [PubMed] |
| 39. | Cheng HL, Mostoslavsky R, Saito S, Manis JP, Gu Y, Patel P, Bronson R, Appella E, Alt FW, Chua KF. Developmental defects and p53 hyperacetylation in Sir2 homolog (SIRT1)-deficient mice. Proc Natl Acad Sci USA. 2003;100:10794-10799. [PubMed] |
| 40. | Banks AS, Kon N, Knight C, Matsumoto M, Gutiérrez-Juárez R, Rossetti L, Gu W, Accili D. SirT1 gain of function increases energy efficiency and prevents diabetes in mice. Cell Metab. 2008;8:333-341. [PubMed] [DOI] |
| 41. | Pfluger PT, Herranz D, Velasco-Miguel S, Serrano M, Tschöp MH. Sirt1 protects against high-fat diet-induced metabolic damage. Proc Natl Acad Sci USA. 2008;105:9793-9798. [PubMed] [DOI] |
| 42. | Solomon JM, Pasupuleti R, Xu L, McDonagh T, Curtis R, DiStefano PS, Huber LJ. Inhibition of SIRT1 catalytic activity increases p53 acetylation but does not alter cell survival following DNA damage. Mol Cell Biol. 2006;26:28-38. [PubMed] |
| 43. | Firestein R, Blander G, Michan S, Oberdoerffer P, Ogino S, Campbell J, Bhimavarapu A, Luikenhuis S, de Cabo R, Fuchs C. The SIRT1 deacetylase suppresses intestinal tumorigenesis and colon cancer growth. PLoS One. 2008;3:e2020. [PubMed] [DOI] |
| 44. | Kabra N, Li Z, Chen L, Li B, Zhang X, Wang C, Yeatman T, Coppola D, Chen J. SirT1 is an inhibitor of proliferation and tumor formation in colon cancer. J Biol Chem. 2009;284:18210-18217. [PubMed] [DOI] |
| 45. | Wang RH, Zheng Y, Kim HS, Xu X, Cao L, Luhasen T, Lee MH, Xiao C, Vassilopoulos A, Chen W. Interplay among BRCA1, SIRT1, and Survivin during BRCA1-associated tumorigenesis. Mol Cell. 2008;32:11-20. [PubMed] [DOI] |
| 46. | Howitz KT, Bitterman KJ, Cohen HY, Lamming DW, Lavu S, Wood JG, Zipkin RE, Chung P, Kisielewski A, Zhang LL. Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan. Nature. 2003;425:191-196. [PubMed] [DOI] |
| 47. | Altieri DC. Survivin, cancer networks and pathway-directed drug discovery. Nat Rev Cancer. 2008;8:61-70. [PubMed] [DOI] |
| 48. | Pazienza V, Piepoli A, Panza A, Valvano MR, Benegiamo G, Vinciguerra M, Andriulli A, Mazzoccoli G. SIRT1 and the clock gene machinery in colorectal cancer. Cancer Invest. 2012;30:98-105. [PubMed] |
| 49. | Yuan J, Pu M, Zhang Z, Lou Z. Histone H3-K56 acetylation is important for genomic stability in mammals. Cell Cycle. 2009;8:1747-1753. [PubMed] [DOI] |
| 50. | Yuan J, Minter-Dykhouse K, Lou Z. A c-Myc-SIRT1 feedback loop regulates cell growth and transformation. J Cell Biol. 2009;185:203-211. [PubMed] [DOI] |
| 51. | Yeung F, Hoberg JE, Ramsey CS, Keller MD, Jones DR, Frye RA, Mayo MW. Modulation of NF-kappaB-dependent transcription and cell survival by the SIRT1 deacetylase. EMBO J. 2004;23:2369-2380. [PubMed] [DOI] |
| 52. | Dai Y, Ngo D, Forman LW, Qin DC, Jacob J, Faller DV. Sirtuin 1 is required for antagonist-induced transcriptional repression of androgen-responsive genes by the androgen receptor. Mol Endocrinol. 2007;21:1807-1821. [PubMed] [DOI] |
| 53. | Fu M, Liu M, Sauve AA, Jiao X, Zhang X, Wu X, Powell MJ, Yang T, Gu W, Avantaggiati ML. Hormonal control of androgen receptor function through SIRT1. Mol Cell Biol. 2006;26:8122-8135. [PubMed] [DOI] |
| 54. | Herranz D, Muñoz-Martin M, Cañamero M, Mulero F, Martinez-Pastor B, Fernandez-Capetillo O, Serrano M. Sirt1 improves healthy ageing and protects from metabolic syndrome-associated cancer. Nat Commun. 2010;1:3. [PubMed] |
| 55. | Akao Y, Noguchi S, Iio A, Kojima K, Takagi T, Naoe T. Dysregulation of microRNA-34a expression causes drug-resistance to 5-FU in human colon cancer DLD-1 cells. Cancer Lett. 2011;300:197-204. [PubMed] |
| 56. | Zhao G, Qin Q, Zhang J, Liu Y, Deng S, Liu L, Wang B, Tian K, Wang C. Hypermethylation of HIC1 Promoter and Aberrant Expression of HIC1/SIRT1 Might Contribute to the Carcinogenesis of Pancreatic Cancer. Ann Surg Oncol. 2012; May 3. [Epub ahead of print]. [PubMed] |
| 57. | Cho IR, Koh SS, Malilas W, Srisuttee R, Moon J, Choi YW, Horio Y, Oh S, Chung YH. SIRT1 inhibits proliferation of pancreatic cancer cells expressing pancreatic adenocarcinoma up-regulated factor (PAUF), a novel oncogene, by suppression of β-catenin. Biochem Biophys Res Commun. 2012;423:270-275. [PubMed] |
| 58. | Cha EJ, Noh SJ, Kwon KS, Kim CY, Park BH, Park HS, Lee H, Chung MJ, Kang MJ, Lee DG. Expression of DBC1 and SIRT1 is associated with poor prognosis of gastric carcinoma. Clin Cancer Res. 2009;15:4453-4459. [PubMed] [DOI] |