修回日期: 2012-12-16
接受日期: 2012-12-28
在线出版日期: 2013-01-08
目的: 检测Th17细胞及其相关因子白介素17(interleukin-17, IL-17)、IL-21在活动期溃疡性结肠炎(ulcerative colitis, UC)患者中的分布与表达, 并分析其与疾病活动度、C-反应蛋白(C-reactive protein, CRP)、血沉(erythrocyte sedimentation rate, ESR)、内镜下活动度分级以及组织病理分级的关系.
方法: 免疫荧光双标法检测40例活动期UC患者及20例健康对照者肠黏膜组织中Th17细胞的分布, 免疫组织化学SP法检测上述患者肠黏膜组织中IL-17、IL-21的表达与分布, 酶联免疫吸附法检测血清IL-17、IL-21水平.
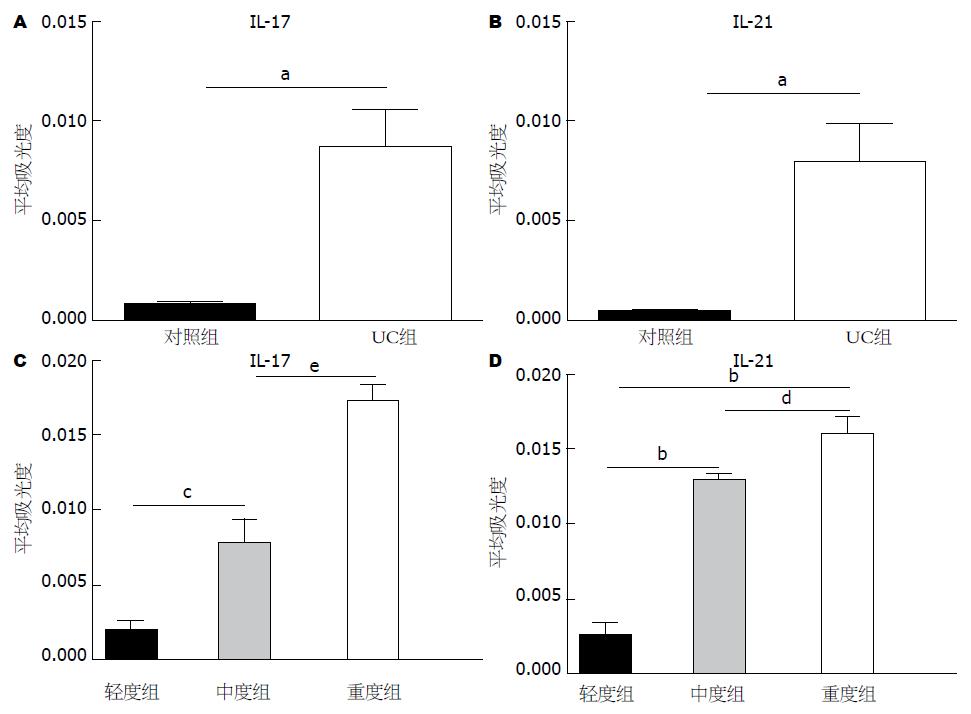
结果: 活动期UC患者肠黏膜固有层中Th17细胞数明显增多. 活动期UC患者肠黏膜组织及血清中IL-17、IL-21的表达均明显高于对照组(分别为: 0.0087±0.0019 vs 0.0008±0.0001, P<0.05; 0.0082±0.0017 vs 0.0005±0.0001, P<0.01), 且IL-17、IL-21的表达在轻、中、重度患者间均有显著性差异(分别为: 0.0020±0.0004 vs 0.0079±0.0016 vs 0.0173±0.0011; 0.0020±0.0004 vs 0.0097±0.0002 vs 0.0120±0.0006), 随疾病活动度增加而逐渐增强. IL-17、IL-21的表达与活动期UC患者CRP水平、内镜下活动度分级、组织病理分级均显著正相关(P<0.05), IL-17的表达与活动期UC患者的ESR水平显著正相关(P<0.05).
结论: Th17细胞及其相关因子IL-17、IL-21在活动期UC患者高表达, 且随疾病活动程度增加而逐渐增强. Th17细胞及其相关因子与UC的疾病活动与黏膜损伤有关.
引文著录: 张晓斐, 蒋文瑜, 于鹏丽, 李文杰, 张红杰. Th17细胞及其相关因子在活动期溃疡性结肠炎患者中的表达及意义. 世界华人消化杂志 2013; 21(1): 19-26
Revised: December 16, 2012
Accepted: December 28, 2012
Published online: January 8, 2013
AIM: To investigate the association of number of Th17 cells and expression of Th17-related cytokines (IL-17 and IL-21) with disease activity, C-reactive protein (CRP), erythrocyte sedimentation rate (ESR), endoscopic stage, and histological grade in patients with active ulcerative colitis (UC).
METHODS: Forty patients with active UC and 20 healthy controls were recruited. The infiltration of Th17 cells in colonic mucosa was assessed by immunofluorescence. The expression of IL-17 and IL-21 was detected by immunohistochemistry. Serum levels of IL-17 and L-21 were determined by ELISA.
RESULTS: Compared to healthy controls, the number of Th17 cells increased mainly in the lamina propria of active UC patients. The expression of IL-17 and IL-21 in the colonic mucosa and serum levels of these two cytokines in active UC patients were significantly higher than those in normal controls (0.0087 ± 0.0019 vs 0.0008 ± 0.0001, P < 0.05; 0.0082 ± 0.0017 vs 0.0005 ± 0.0001, P < 0.01). The expression of IL-17 and IL-21 was higher in severe UC than in moderate or mild UC (0.0020 ± 0.0004 vs 0.0079 ± 0.0016 vs 0.0173 ± 0.0011; 0.0020 ± 0.0004 vs 0.0097 ± 0.0002 vs 0.0120 ± 0.0006). IL-17 and IL-21 expression was positively correlated with CRP, endoscopic stage, and histological grade in patients with active UC (all P < 0.05). The expression of IL-17 was also positively correlated with ESR (P < 0.05).
CONCLUSION: The number of Th17 cells and expression of Th17-related cytokines (IL-17 and IL-21) increase in the colonic mucosa of patients with active UC. Th17 cells and Th17-related cytokines may play an important role in disease activity and mucosal damage in patients with active UC.
- Citation: Zhang XF, Jiang WY, Yu PL, Li WJ, Zhang HJ. Significance of number of Th17 cells and expression of Th17-related cytokines in patients with active ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2013; 21(1): 19-26
- URL: https://www.wjgnet.com/1009-3079/full/v21/i1/19.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i1.19
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性结肠炎症性疾病[1], 其病因及发病机制至今尚未完全阐明, 与遗传、免疫、微生物及环境等多种因素的相互作用有关[2], 其中免疫异常在UC的发生发展中起重要作用. 近年研究发现, 辅助性T细胞17(T helper 17 cells, Th17)及其分泌的细胞因子如白介素17(interleukin-17, IL-17)、白细胞介素-21(IL-21)等, 能够通过对适应性及先天性免疫系统的调节来诱导炎症反应的发生及肠道黏膜的损伤, 从而参与UC的发生发展[3-5].
目前, 国外已有研究证实Th17细胞及其相关因子IL-17、IL-21在UC患者肠道中高表达[6-8], 但Th17细胞及其相关因子的增多与UC疾病活动程度以及黏膜损伤程度间的关系尚不明确. 本研究通过检测Th17细胞及其相关因子IL-17、IL-21在活动期UC患者肠黏膜组织中的分布与表达以及血清中IL-17、IL-21的水平, 分析Th17细胞及其相关因子IL-17、IL-21的变化与UC疾病活动度、内镜下活动度分级、病理组织学分级以及血沉(erythrocyte sedimentation rate, ESR)、C反应蛋白(C reactive protein, CRP)间的关系.
本研究共纳入研究对象60例(UC组40例, 健康对照组20例). UC组为2009-01/2011-12在南京医科大学第一附属医院消化科诊断为活动期UC患者, 对照组为肠息肉治疗后复查结肠镜, 无异常者. 活动期UC患者及健康对照者临床特征见表1, UC患者性别、年龄组成与健康对照组间无明显差异(P>0.05). 其中UC疾病活动度评分按照Southerland疾病活动指数[9], 内镜下UC 活动度分级按照改进的Baron内镜下UC活动度分级标准[10], UC病理组织学分级按照病理组织学分级标准[11]. UC诊断依据2007年中华医学会消化病学分会IBD协作组"对我国炎症性肠病诊断治疗规范的共识意见". 此项研究已获我院伦理委员会批准, 所有患者及健康对照者标本留取前均签署知情同意书.
| 病例特征 | 对照组(n = 20) | UC组(n = 40) |
| 性别(男/女) | 11/9 | 24/16 |
| 平均年龄±标准差 (岁, 年龄范围) | 41.2±12.4(25-64) | 34.95±11.1(21-59) |
| 疾病活动度n(%) | ||
| 轻度 | 12(30.0) | |
| 中度 | 20(50.0) | |
| 重度 | 8(20.0) | |
| 内镜下UC活动度分级n(%) | ||
| Ⅰ级 | 8(20.0) | |
| Ⅱ级 | 10(25.0) | |
| Ⅲ级 | 14(35.0) | |
| Ⅳ级 | 8(20.0) | |
| 病理组织学分级n(%) | ||
| Ⅰ级 | 8(20.0) | |
| Ⅱ级 | 12(30.0) | |
| Ⅲ级 | 12(30.0) | |
| Ⅳ级 | 8(20.0) | |
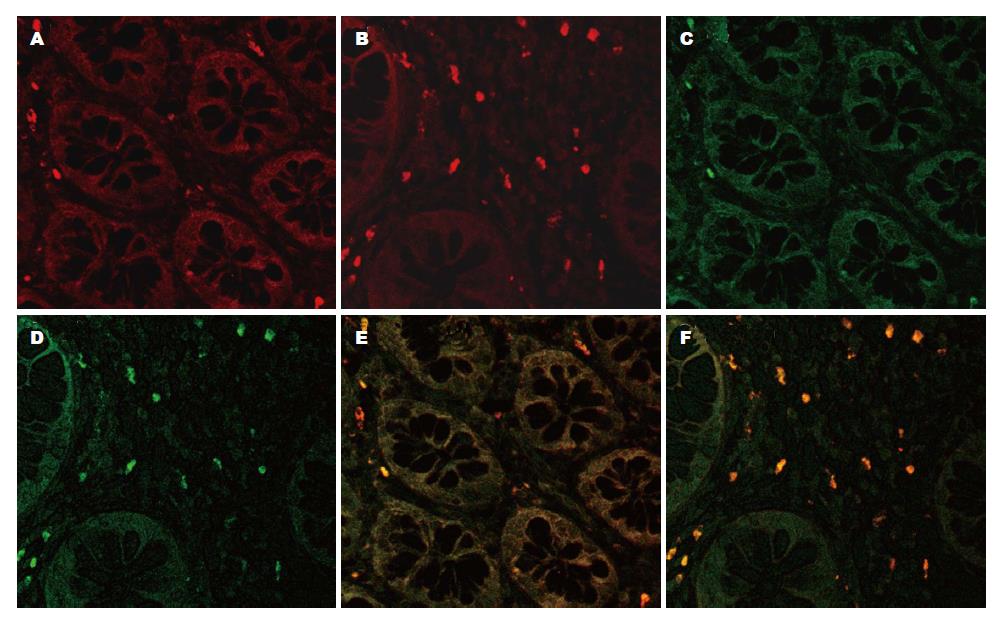
1.2.1 免疫荧光双标染色: 石蜡切片常规脱蜡至水, 微波抗原修复, 切片滴加CD4抗体(小鼠抗人, Abcam, 英国, 浓度1:100)、IL-17抗体(兔抗人, Abcam, 英国, 浓度1:100)4 ℃孵育过夜, 滴加TRITC标记山羊抗小鼠IgG(Jackson ImmunoResearch, 美国, 浓度1:100)和FITC标记山羊抗兔IgG(Jackson ImmunoResearch, 美国, 浓度1:100)室温下孵育2 h后显色. 以磷酸盐缓冲液(phosphate buffered saline, PBS)代替一抗作为阴性对照. 采用Leica激光共聚焦扫描显微镜观察免疫荧光双标结果并采集图片.
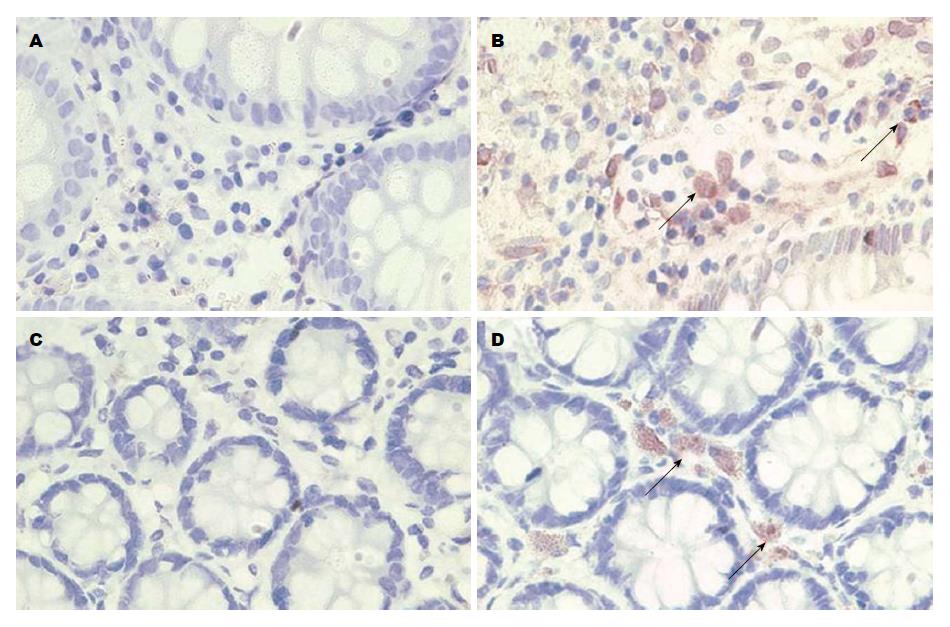
1.2.2 免疫组织化学染色: 石蜡切片常规脱蜡至水, 用30 mL/L H2O2灭活内源性酶10 min. 微波炉枸橼酸盐缓冲液抗原修复后, 免疫组织化学染色方法参照SP试剂盒产品说明书操作流程依次进行, 以PBS替代一抗作阴性对照. DAB显色后, 苏木素复染、脱水、透明、封片, 显微镜下观察. 免疫组织化学试剂分别为IL-17抗体(兔抗人, Abcam, 浓度1:100)、IL-21抗体(兔抗人, Millipore, 美国, 浓度1:100)、SP免疫组织化学试剂盒(福建迈新公司). 结果判断及评估: 胞质染色呈棕黄色为阳性细胞. 参照文献提供的方法对免疫组织化学结果进行评估[12-14]: (1)阳性细胞百分比: 每个样本随机选取5个高倍镜视野(×400), 计数肠黏膜固有层中细胞总数/阳性细胞数, 取均值; (2)平均光密度: 每个样本随机选取5个高倍镜视野(×400), 采用Image-Pro Plus图像分析软件(Version 6.0, Media Cybernetics, 美国), 计算平均光密度并取均值, 对各细胞因子在活动期UC患者肠黏膜组织中的蛋白表达程度进行半定量.
1.2.3 酶联免疫吸附(ELISA)法: UC组及对照组均于肠镜检查次日清晨空腹抽取肘静脉血, 离心后分离血清, 于-80 ℃冰箱中保存备检. 分别使用IL-17、IL-21 ELISA试剂盒(eBioscience, 美国)检测血清中IL-17、IL-21的水平. 操作过程严格按照试剂盒说明进行, 采用EXCEL软件绘制标准曲线, 计算血清中IL-17、IL-21的含量.
统计学处理 采用SPSS17.0统计软件进行统计学分析, 计量资料以mean±SD表示, 用两独立样本均数的t检验(Student's t-test)进行活动期UC与对照组肠黏膜组织及血清IL-17、IL-21表达水平的比较; 用单因素方差分析(one way ANOVA)进行活动期UC轻、中、重3组间的比较; CRP、 ESR分别与肠黏膜组织及血清IL-17、IL-21表达水平相关性的分析采用Pearson相关分析; 活动期UC内镜下活动度分级、病理组织学分级分别与肠黏膜组织及血清IL-17、IL-21表达水平相关性的分析采用Spearman相关分析, 所有的检验均以P<0.05为差异有统计学意义.
免疫荧光双标记结果显示, CD4+IL-17+细胞(Th17细胞)主要分布于黏膜固有层, 活动期UC患者肠黏膜组织中的CD4+IL-17+细胞数明显增多, 而对照组中CD4+IL-17+细胞数极少(图1).
免疫组织化学染色结果显示, IL-17、IL-21阳性颗粒主要分布于黏膜固有层单个核细胞胞质中, 颗粒呈棕黄色; 活动期UC患者肠黏膜组织中IL-17、IL-21的阳性表达明显高于对照组(图2).
活动期UC患者肠黏膜组织中IL-17、IL-21阳性细胞百分比均明显高于对照组(P<0.01). 活动期UC轻、中、重度3组IL-17及IL-21阳性细胞百分比均随疾病活动度增加而明显增加, 且组间比较均有显著性差异(P<0.01, 表2).
IL-17、IL-21在活动期UC患者肠黏膜组织中表达的平均吸光度明显高于对照组(分别为: 0.0087±0.0019 vs 0.0008±0.0001, P<0.05; 0.0082±0.0017 vs 0.0005±0.0001, P<0.01, 图3A, B). IL-17和IL-21在活动期UC轻、中、重度3组表达的平均吸光度随疾病活动度增加而明显增加(分别为: 0.0020±0.0004 vs 0.0079±0.0016 vs 0.0173±0.0011; 0.0020±0.0004 vs 0.0097±0.0002 vs 0.0120±0.0006), 且组间比较均有显著性差异(P<0.05, 图3C, D).
活动期UC患者血清中IL-17、IL-21水平均明显高于对照组(P<0.01). 活动期UC轻、中、重度3组血清IL-17、IL-21水平随疾病活动度增加而明显增加, 组间比较均有显著性差异(P<0.05), 其中, 轻度组IL-17、IL-21水平虽高于对照组, 但两者间差异无统计学意义(P>0.05, 表3).
以平均光密度表示活动期UC患者肠黏膜组织中IL-17、IL-21的表达, 发现活动期UC患者肠黏膜组织中IL-17平均光密度与CRP和ESR水平均显著正相关(P<0.05); IL-21平均光密度与CRP水平也呈显著正相关(P<0.01), 但与ESR间无显著相关性(P>0.05, 表4).
| CRP | ESR | |||
| Pearson相关系数(r) | P | Pearson相关系数(r) | P | |
| 组织水平(平均吸光度) | ||||
| IL-17 | 0.912 | 0.000 | 0.642 | 0.033 |
| IL-21 | 0.751 | 0.008 | 0.359 | 0.278 |
| 血清水平(Elisa) | ||||
| IL-17 | 0.978 | 0.000 | 0.788 | 0.004 |
| IL-21 | 0.827 | 0.002 | 0.600 | 0.051 |
活动期UC患者血清IL-17水平也与CRP和 ESR水平均显著正相关(P<0.05); 血清IL-21水平与CRP水平也呈显著正相关(P<0.01), 与ESR间仍无显著相关性(P>0.05, 表4).
活动期UC患者肠黏膜组织中IL-17、IL-21表达的平均光密度, 与内镜下活动度分级、病理组织学分级均显著正相关(P<0.01, 表5); 活动期UC患者血清IL-17、IL-21水平, 与内镜下活动度分级、病理组织学分级亦呈显著正相关(P<0.01, 表5).
| 内镜下活动度分级 | 病理组织学分级 | |||
| Spearman相关系数(r) | P | Spearman相关系数(r) | P | |
| 组织水平(平均吸光度) | ||||
| IL-17 | 0.902 | 0.000 | 0.906 | 0.000 |
| IL-21 | 0.864 | 0.001 | 0.812 | 0.002 |
| 血清水平(Elisa) | ||||
| IL-17 | 0.935 | 0.000 | 0.878 | 0.000 |
| IL-21 | 0.864 | 0.001 | 0.751 | 0.008 |
Th17细胞是近来发现的一种不同于Th1、Th2细胞的新的辅助性T细胞亚群, 因其能够特异性分泌IL-17而命名, Th17尚能分泌IL-6、IL-21、IL-22、肿瘤坏死因子(tumor necrosis factor α, TNF-α)等多种细胞因子[15]. 研究证实[16-18], Th17细胞及其相关因子与多发性硬化症、类风湿性关节炎等多种炎症反应及自身免疫相关性疾病的发生发展有关. 其中, IL-17可诱导与炎症相关的多个基因的表达(包括IL6、粒细胞/巨噬细胞集落刺激因子、细胞间黏附分子1等)[19-21], 增强白介素-1β(IL-1β)及TNF-α诱导的炎症反应, 还可通过诱导巨噬细胞产生促炎症细胞因子, 建立适应性与先天性免疫的联系[3,22,23], 在各种组织的炎症反应中发挥重要的调节作用. IL-21能够调节T细胞的分化和功能, 增加抗原激活的CD4+和CD8+T细胞的扩增, 诱导白细胞介素-12受体(IL-12R), 白介素-18受体(IL-18R), 干扰素γ(IFN-γ), 白介素-2受体α(IL-2Rα)的基因编码[4], 还可介导T细胞向肠道炎症部位聚集以及引起肠道成纤维细胞分泌基质降解酶[24]. Th17细胞通过分泌IL-17、IL-21等相关因子所产生的对免疫系统的调节作用及其对促炎因子的诱导作用, 介导了肠道炎症反应的发生及黏膜的损伤.
有研究结果显示, 活动期UC患者外周血中Th17细胞数量明显增多[25,26]. 本研究通过免疫荧光双标记的方法, 发现与对照组相比, 活动期UC患者肠黏膜组织中CD4+IL-17+细胞(即Th17细胞)明显增多, 提示Th17细胞可能参与UC患者肠黏膜的免疫炎性反应过程.
Fujino等[6]研究显示, IL-17阳性细胞主要分布于活动期UC患者肠黏膜组织中, 其数量显著多于缓解期UC患者, 并且在缺血性肠病、感染性结肠炎及健康对照组中无阳性表达; 同时, 活动期UC患者血清IL-17水平明显高于健康对照组. Yamamoto-Furusho等[27]在对活动期UC患者直肠黏膜组织标本中IL-6、IL-21 mRNA表达水平的检测中发现, 与对照组及缓解期UC患者相比, IL-21的mRNA表达量显著增高, 且与组织学水平的疾病活动有关, 但并没有对IL-21蛋白表达在肠黏膜组织中的分布, 以及与疾病活动情况的相关性进行研究. 这两种细胞因子在UC患者均呈高表达, 但他们表达水平的变化与UC疾病活动程度以及黏膜损伤程度是否有关, 尚无明确阐述. 本研究发现, IL-17、IL-21不仅在活动期UC患者肠黏膜组织及血清中表达显著高于健康对照组, 而且随疾病活动度增加而逐渐增强.
UC的发病是一种慢性炎症过程, 但其急性活动期的表现类似于急性时相反应, CRP及ESR的水平均会在此炎症过程中发生改变, 可在一定程度上反应UC的疾病活动程度[28,29]. 我们在对Th17细胞相关因子的表达水平与活动期UC患者CRP及ESR水平的相关性分析中发现, IL-17、IL-21的表达随CRP水平的增高而逐渐增高. 可见, Th17相关因子与疾病的活动密切相关.
UC内镜下活动度分级及病理组织学分级能够有效反映疾病活动程度及黏膜损伤程度. 活动性UC患者肠黏膜组织中Th17细胞增多, 其相关细胞因子IL-17及IL-21表达增加与内镜下黏膜损伤及组织学表现间有着怎样的关系?我们在对Th17细胞相关因子的表达水平与活动期UC患者内镜下活动度分级及病理组织学分级的相关性分析中发现, 活动期UC患者肠黏膜组织以及血清中IL-17、IL-21的表达随内镜下活动度分级、病理组织学分级的升高而逐渐增加, 与疾病活动及黏膜损伤有关.
总之, Th17细胞相关因子在活动期UC患者肠黏膜及血清中高表达, 且随疾病活动度、CRP、ESR水平以及内镜下活动度分级、病理组织学分级的增加而逐渐增强. Th17细胞及其相关因子与UC疾病活动程度、肠道黏膜损伤程度密切相关, 在UC的发生发展中可能具有重要作用, 其具体机制有待进一步研究.
溃疡性结肠炎(UC)的发病与遗传、免疫、微生物及环境等多种因素的相互作用有关, 其中免疫异常在UC的发生发展中起重要作用. 近年研究发现, Th17细胞及其相关因子IL-17、IL-21在UC患者肠道中高表达, 但Th17细胞及其相关因子的增多与UC疾病活动程度以及黏膜损伤程度间的关系尚不明确.
田字彬, 教授, 青岛大学医学院附属医院
本研究通过检测Th17细胞及其相关因子IL-17、IL-21在活动期UC患者肠黏膜组织中的分布与表达以及血清中IL-17、IL-21的水平, 分析Th17细胞及其相关因子IL-17、IL-21的变化与UC疾病活动度、内镜下活动度分级、病理组织学分级以及血沉(ESR)、C反应蛋白(CRP)间的关系.
Fujino等研究显示, IL-17+细胞主要分布于活动期UC患者肠黏膜组织中, 其数量显著多于缓解期UC患者. 同时, 活动期UC患者血清IL-17水平明显高于健康对照组. Yamamoto-Furusho等在对活动期UC患者直肠黏膜组织标本中IL-6、IL-21 mRNA表达水平的检测中发现, 与对照组及缓解期UC患者相比, IL-21的mRNA表达量显著增高, 且与组织学水平的疾病活动有关.
已有研究显示IL-17、IL-21这两种细胞因子在UC患者均呈高表达, 但他们表达水平的变化与UC疾病活动程度以及黏膜损伤程度是否有关, 尚无明确阐述. 本研究发现, IL-17、IL-21不仅在活动期UC患者肠黏膜组织及血清中表达显著高于健康对照组, 而且随疾病活动度增加而逐渐增强.
活动期UC患者肠黏膜组织以及血清中IL-17、IL-21的表达随内镜下活动度分级、病理组织学分级的升高而逐渐增加, 与疾病活动及黏膜损伤有关, 在UC的发生发展中可能具有重要作用, 其具体机制有待进一步研究.
本文有一定的先进性和科学性.
编辑: 田滢 电编: 鲁亚静
| 1. | Danese S, Fiocchi C. Ulcerative colitis. N Engl J Med. 2011;365:1713-1725. [PubMed] [DOI] |
| 2. | Kaser A, Zeissig S, Blumberg RS. Inflammatory bowel disease. Annu Rev Immunol. 2010;28:573-621. [PubMed] [DOI] |
| 3. | Kolls JK, Lindén A. Interleukin-17 family members and inflammation. Immunity. 2004;21:467-476. [PubMed] |
| 4. | Strengell M, Sareneva T, Foster D, Julkunen I, Matikainen S. IL-21 up-regulates the expression of genes associated with innate immunity and Th1 response. J Immunol. 2002;169:3600-3605. [PubMed] |
| 5. | Strober W, Fuss IJ. Proinflammatory cytokines in the pathogenesis of inflammatory bowel diseases. Gastroenterology. 2011;140:1756-1767. [PubMed] [DOI] |
| 6. | Fujino S, Andoh A, Bamba S, Ogawa A, Hata K, Araki Y, Bamba T, Fujiyama Y. Increased expression of interleukin 17 in inflammatory bowel disease. Gut. 2003;52:65-70. [PubMed] |
| 7. | Fantini MC, Monteleone G, MacDonald TT. IL-21 comes of age as a regulator of effector T cells in the gut. Mucosal Immunol. 2008;1:110-115. [PubMed] [DOI] |
| 8. | Andoh A, Zhang Z, Inatomi O, Fujino S, Deguchi Y, Araki Y, Tsujikawa T, Kitoh K, Kim-Mitsuyama S, Takayanagi A. Interleukin-22, a member of the IL-10 subfamily, induces inflammatory responses in colonic subepithelial myofibroblasts. Gastroenterology. 2005;129:969-984. [PubMed] |
| 9. | Sutherland LR, Martin F. 5-Aminosalicylic acid enemas in treatment of distal ulcerative colitis and proctitis in Canada. Dig Dis Sci. 1987;32:64S-66S. [PubMed] |
| 10. | Jun S, Hua RZ, Lu TJ, Xiang C, Dong XS. Are endoscopic grading and scoring systems in inflammatory bowel disease the same? Saudi Med J. 2008;29:1432-1437. [PubMed] |
| 11. | Pullan RD, Rhodes J, Ganesh S, Mani V, Morris JS, Williams GT, Newcombe RG, Russell MA, Feyerabend C, Thomas GA. Transdermal nicotine for active ulcerative colitis. N Engl J Med. 1994;330:811-815. [PubMed] |
| 12. | Sun Y, Zhang D, Wang CF, Hu SW, Lan Z. [The expression and significance of TGF-beta 1 and its receptors in infertile women's fimbriae tubes with adhesions and atresias]. Sichuan Daxue Xuebao Yi xueban. 2009;40:435-438. [PubMed] |
| 13. | Prasad K, Prabhu GK. Image analysis tools for evaluation of microscopic views of immunohistochemically stained specimen in medical research-a review. J Med Syst. 2012;36:2621-2631. [PubMed] [DOI] |
| 14. | Bai A, Lu N, Guo Y, Liu Z, Chen J, Peng Z. All-trans retinoic acid down-regulates inflammatory responses by shifting the Treg/Th17 profile in human ulcerative and murine colitis. J Leukoc Biol. 2009;86:959-969. [PubMed] [DOI] |
| 15. | Miossec P. IL-17 and Th17 cells in human inflammatory diseases. Microbes Infect. 2009;11:625-630. [PubMed] [DOI] |
| 16. | Raza A, Yousaf W, Giannella R, Shata MT. Th17 cells: interactions with predisposing factors in the immunopathogenesis of inflammatory bowel disease. Expert Rev Clin Immunol. 2012;8:161-168. [PubMed] [DOI] |
| 17. | Niu Q, Cai B, Huang ZC, Shi YY, Wang LL. Disturbed Th17/Treg balance in patients with rheumatoid arthritis. Rheumatol Int. 2012;32:2731-2736. [PubMed] [DOI] |
| 18. | Becher B, Segal BM. T(H)17 cytokines in autoimmune neuro-inflammation. Curr Opin Immunol. 2011;23:707-712. [PubMed] [DOI] |
| 19. | Fossiez F, Djossou O, Chomarat P, Flores-Romo L, Ait-Yahia S, Maat C, Pin JJ, Garrone P, Garcia E, Saeland S. T cell interleukin-17 induces stromal cells to produce proinflammatory and hematopoietic cytokines. J Exp Med. 1996;183:2593-2603. [PubMed] |
| 20. | Chabaud M, Fossiez F, Taupin JL, Miossec P. Enhancing effect of IL-17 on IL-1-induced IL-6 and leukemia inhibitory factor production by rheumatoid arthritis synoviocytes and its regulation by Th2 cytokines. J Immunol. 1998;161:409-414. [PubMed] |
| 21. | Cai XY, Gommoll CP, Justice L, Narula SK, Fine JS. Regulation of granulocyte colony-stimulating factor gene expression by interleukin-17. Immunol Lett. 1998;62:51-58. [PubMed] |
| 22. | Katz Y, Nadiv O, Beer Y. Interleukin-17 enhances tumor necrosis factor alpha-induced synthesis of interleukins 1,6, and 8 in skin and synovial fibroblasts: a possible role as a "fine-tuning cytokine" in inflammation processes. Arthritis Rheum. 2001;44:2176-2184. [PubMed] |
| 23. | LeGrand A, Fermor B, Fink C, Pisetsky DS, Weinberg JB, Vail TP, Guilak F. Interleukin-1, tumor necrosis factor alpha, and interleukin-17 synergistically up-regulate nitric oxide and prostaglandin E2 production in explants of human osteoarthritic knee menisci. Arthritis Rheum. 2001;44:2078-2083. [PubMed] |
| 24. | Yang L, Anderson DE, Baecher-Allan C, Hastings WD, Bettelli E, Oukka M, Kuchroo VK, Hafler DA. IL-21 and TGF-beta are required for differentiation of human T(H)17 cells. Nature. 2008;454:350-352. [PubMed] [DOI] |
| 25. | Eastaff-Leung N, Mabarrack N, Barbour A, Cummins A, Barry S. Foxp3+ regulatory T cells, Th17 effector cells, and cytokine environment in inflammatory bowel disease. J Clin Immunol. 2010;30:80-89. [PubMed] [DOI] |
| 26. | Beltrán CJ, Candia E, Erranz B, Figueroa C, Gonzalez MJ, Quera R, Hermoso MA. Peripheral cytokine profile in Chilean patients with Crohn's disease and ulcerative colitis. Eur Cytokine Netw. 2009;20:33-38. [PubMed] [DOI] |
| 27. | Yamamoto-Furusho JK, Miranda-Pérez E, Fonseca-Camarillo G, Sánchez-Muñoz F, Barreto-Zuñiga R, Dominguez-Lopez A. Interleukin 21 expression is increased in rectal biopsies from patients with ulcerative colitis. Inflamm Bowel Dis. 2010;16:1090. [PubMed] [DOI] |
| 28. | Solem CA, Loftus EV, Tremaine WJ, Harmsen WS, Zinsmeister AR, Sandborn WJ. Correlation of C-reactive protein with clinical, endoscopic, histologic, and radiographic activity in inflammatory bowel disease. Inflamm Bowel Dis. 2005;11:707-712. [PubMed] |
| 29. | Cabrera-Abreu JC, Davies P, Matek Z, Murphy MS. Performance of blood tests in diagnosis of inflammatory bowel disease in a specialist clinic. Arch Dis Child. 2004;89:69-71. [PubMed] |