修回日期: 2012-02-03
接受日期: 2012-02-27
在线出版日期: 2012-03-28
目的: 探讨食管炎性纤维性息肉(inflammatory fibroid polyp, IFP)的临床病理学特征、诊断、鉴别诊断、治疗方法和预后.
方法: 报道1例罕见的食管IFP, 对其进行光镜观察、免疫组织化学染色, 并结合文献探讨该病的临床病理学特征.
结果: 患者为71岁的男性, 因进行性吞咽困难3 mo余入院, 内镜检查发现食管黏膜距门齿约35 cm处可见一大小约2.5 cm半球状黏膜隆起, 超声内镜见一起源于黏膜层大小约13.2 mm×11 mm低回声团块, 回声欠均匀, 其间可见无回声影, 边界尚清晰. 入院完善相关检查后在全麻下行食管占位切除术, 术后病理显示肿瘤位于黏膜下层, 向食管管腔内隆起生长, 肿瘤主要由3种成分构成: 明显增生的梭形细胞、大量的炎症细胞和血管网, 最后诊断为炎性纤维性息肉.
结论: 食管IFP是一种罕见的间叶源性肿瘤, 术前诊断困难, 确诊依靠术后病理检查. 以外科手术或内镜下肿物完整切除为主要治疗方法, 预后良好.
引文著录: 谢飞来, 姚丽青, 余英豪. 食管炎性纤维性息肉的临床病理特征. 世界华人消化杂志 2012; 20(9): 776-780
Revised: February 3, 2012
Accepted: February 27, 2012
Published online: March 28, 2012
AIM: To explore the clinical and pathological features of inflammatory fibroid polyp (IFP) of the esophagus and to discuss its diagnosis, differential diagnosis, treatment and prognosis.
METHODS: A case of IFP of the esophagus was investigated by light microscopy and immunohistochemistry. A literature review was then performed to summarize the clinical and pathological features of the disease.
RESULTS: A 71-year-old man presented with epigastric/retrosternal pain and dysphagia for 3 months. Endoscopy revealed a hemispheric lesion, 2.5 cm in size, in the esophageal mucosa about 35 cm from incisors. On EUS, the lesion (13.2 mm x 11 mm) was hypoechogenic and inhomogeneous, and was located under the mucosa of the esophagus, with a clear boundary. Surgical resection of the esophageal mass was performed, and the final pathologic diagnosis was IFP of the esophagus.
CONCLUSION: IFP of the esophagus is an extremely rare mesenchymal tumor with benign behavior and good prognosis. A correct preoperative diagnosis is difficult and relies on postoperative pathological examination. Surgical excision is the preferred treatment for IFP.
- Citation: Xie FL, Yao LQ, Yu YH. Clinicopathologic features of inflammatory fibroid polyp of the esophagus. Shijie Huaren Xiaohua Zazhi 2012; 20(9): 776-780
- URL: https://www.wjgnet.com/1009-3079/full/v20/i9/776.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i9.776
炎性纤维性息肉(inflammatory fibroid polyp, IFP)是胃肠道中一种非常少见的良性间叶性肿瘤[1], 可发生于消化系任何部位, 最常发生于胃, 其次为小肠, 发生于食管的极为罕见[2], 国外仅见少数个案报道[3-6], 国内尚未见文献报道. 现报道中国人民解放军南京军区福州总医院近期诊治的1例食管IFP, 并复习文献探讨该病的临床病理学特征、诊断、鉴别诊断、治疗方法和预后, 旨在提高对该病的认识.
患者, 男, 71岁, 因"进行性吞咽困难3 mo余"于2011-07-25入院. 缘于3 mo前无明显诱因出现进食梗阻感和吞咽困难, 无恶心、呕吐、腹痛、腹泻, 无咳嗽、胸痛、呼吸困难. 门诊以"食管占位"收入院, 自患病以来, 精神、睡眠尚可, 饮食、二便正常, 体质量略有减轻.
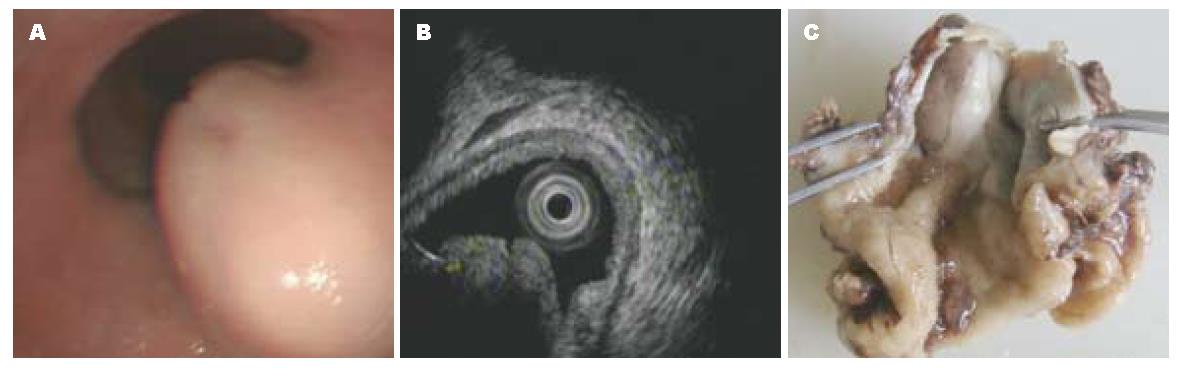
1.2.1 疾病诊断: (1)入院查体: T: 36.5 ℃, P: 76次/min, R: 18次/min, BP: 111/70 mmHg. 发育正常, 营养中等, 神志清楚, 步入病房, 查体合作, 对答切题. 皮肤、黏膜无黄染, 无皮下出血点, 全身浅表淋巴结不肿大. 头颅大小正常, 无畸形及压痛. 双眼睑无水肿, 瞳孔等大等圆, 对光反射灵敏. 外耳廓无畸形, 外耳道未见异常脓血性分泌物, 乳突无压痛. 无鼻塞, 副鼻窦区无压痛. 口腔黏膜正常, 无出血点, 腮腺导管开口未见脓性分泌物, 伸舌居中, 无咽部充血及扁桃体肿大, 咽无红肿. 颈软, 无抵抗, 颈动脉搏动正常, 颈静脉无怒张, 气管居中, 肝颈静脉回流征(-) , 甲状腺无肿大, 对称, 无压痛, 无结节. 胸廓无畸形, 呼吸运动对称, 无胸膜摩擦感及皮下捻发感. 叩呈清音. 双肺呼吸清晰, 未闻及干湿性罗音及异常呼吸音, 未闻及胸膜摩擦音. 心前区无隆起, 心尖搏动位于左锁骨中线第5肋间内0.5 cm, 未及心包摩擦感. 相对浊音正常. 心率76次/分, 律齐, 各瓣膜听诊区未闻及心杂音及病理性心音, 未闻及心包摩擦音. 无异常血管征. 腹平软, 腹壁静脉无曲张, 未见胃肠型及蠕动波. 全腹软, 无压痛及反跳痛, 未触及包块, 肝、脾肋下未及, 莫菲氏征(-) , 移动性浊音(-) . 肠鸣音正常. 肛门及外生殖器未见异常. 脊柱、四肢无畸形, 脊柱四肢无畸形. 生理反射正常, 病理反射未引出. (2)辅助检查: 内镜于食管黏膜距门齿约35 cm处可见一大小约2.5 cm半球状黏膜隆起, 上可见裂隙, 表面尚光滑, 贲门通过顺利, 胃底未见异常, 胃体、胃角、胃窦黏膜红白相间, 可见血管网显现及结节状增生, 以胃窦部为明显, 幽门圆, 十二指肠未见异常. 超声内镜: 超声于该病变处可见一起源于黏膜层大小约13.2 mm×11 mm低回声团块, 回声欠均匀, 其间可见无回声影, 边界尚清晰. 入院给予完善相关检查, 排除手术禁忌证后, 于2011-07-31在全麻下行食管占位切除+胃食管吻合术, 术后标本送病理检查.
1.2.2 HE和免疫组织化学染色: 手术标本经40 g/L甲醛溶液固定, 常规石蜡包埋, 4 μm厚切片, HE染色; 采用EliVision法分别进行Vimentin、SMA、Actin、CD34、CD117、Dog-1、Desmin、ALK、Colponin、Ki-67等免疫组织化学染色. 光镜观察. 所用一抗和EliVision试剂盒均购自福州迈新生物技术开发有限公司.
辅助检查和超声内镜检查的结果见图1A, B.
食管及部分胃切除标本一件, 食管长2.5 cm, 上切缘直径0.8 cm, 下切缘周径6 cm, 紧邻上切缘见一肿物, 大小4 cm×2.5 cm×1.5 cm, 切面灰白灰褐色, 质地中等(图1C).
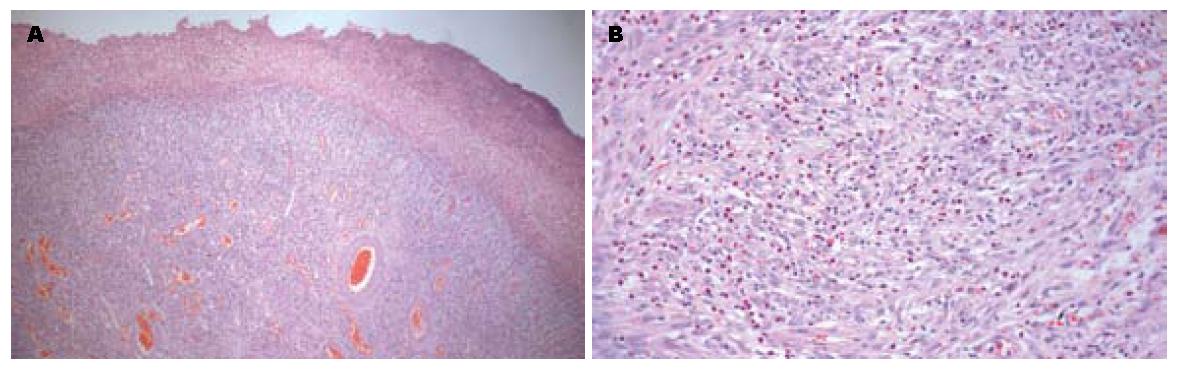
低倍镜下见肿瘤位于黏膜下层, 向食管管腔内隆起生长, 表面黏膜糜烂; 高倍镜下见肿瘤主要由3种成分构成: 明显增生的梭形细胞、大量的炎症细胞和血管网, 梭形细胞为卵圆形至梭形, 类似纤维母样的细胞, 胞浆嗜酸性, 细胞核呈空泡状, 圆形或梭形, 无异型性, 核分裂象罕见; 炎症细胞含有大量的嗜酸性粒细胞、少量的淋巴细胞及浆细胞; 局部区域见梭形细胞排列成同心圆状, 类似洋葱皮样结构(图2A, B).
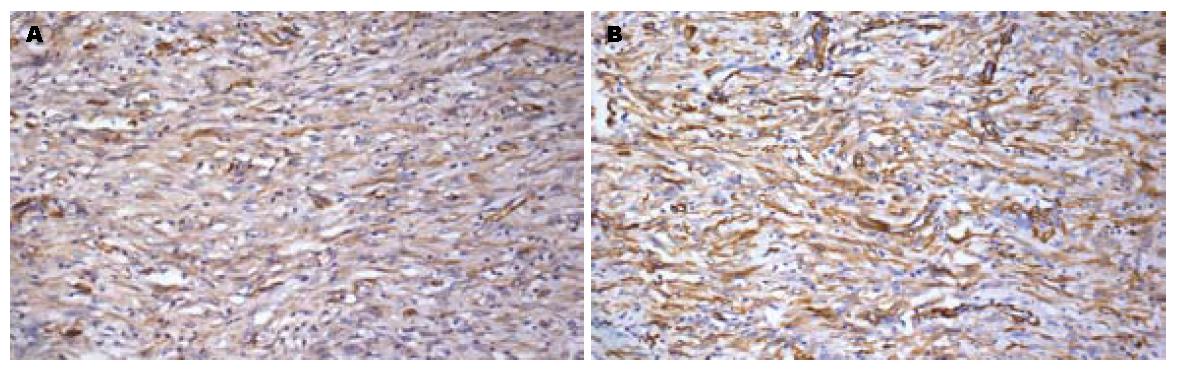
肿瘤细胞CD34(图3A)、Vimentin(图3B)、SMA弥漫强阳性, Actin呈弱阳性表达, CD117、Dog-1、Desmin、ALK、Calponin均阴性, Ki-67约10%阳性.
食管炎性纤维性息肉. 术后随访5 mo无瘤生存.
IFP最早由HELWIG等[7]于1953年提出, 但VANEK等[8]更早于1949年首次对其进行了描述, 他们在报道6例胃息肉样肉芽肿病变时将其命名为"胃黏膜下层肉芽肿伴有嗜酸性粒细胞浸润". 在随后的文献中出现了多种不同的命名, 如嗜酸性肉芽肿、炎性假瘤、神经纤维瘤、血管外皮瘤、纤维性息肉、伴有嗜酸性粒细胞浸润的胃纤维瘤等[9]. 最新的2010年《WHO消化系统肿瘤病理学和遗传学》第4版分类中采用了IFP的命名, 并将其归为肠道间叶源性肿瘤[1].
IFP好发于50-70岁的老年人, 儿童罕见, 男女发病率均等. 可发生于消化系任何部位, 最常发生于胃(70%), 其次为小肠(23%)、结肠和直肠(4%)、胆囊(1%)、十二指肠(1%)、食管(1%)、阑尾(<1%). 临床症状取决于发病部位, 可表现为非特异的腹痛、消化系出血或者梗阻症状, 有的偶然发现. 大部分文献报道肿瘤直径<2 cm, 常有黏膜溃疡, 可有蒂并突向腔内. 肿瘤灰白色, 切面有光泽[2].
关于IFP的组织起源及发病机制迄今尚不十分清楚. Pantanowitz等[10]研究显示肿瘤细胞表达CD35、CD34、Calponin、SMA和CyclinD1, 据此提出IFP可能起源于树突细胞并向肌纤维母细胞分化. 最近一项研究发现IFP的发生与血小板衍生生长因子受体A (platelet-derived growth factor receptor, PDGFRA)基因激活突变有关, 免疫组织化学染色显示IFP表达PDGFRA, 分子生物学检测证实IFP存在PDGFRA基因突变, 这一成果提示IFP是由PDGFRA基因激活突变引起的肿瘤[11].
IFP的诊断需临床病史、内镜检查、影像学检查和病理检查相结合, 术前诊断较困难, 确诊需依靠术后病理组织学和免疫组织化学检查, 但也有文献报道通过内镜、超声内镜和CT扫描检查可在术前取得明确诊断[12]. 上消化系IFP通过内镜检查可发现, 常形成一突向管腔、表面光滑的肿块, 并伴表面黏膜糜烂, 结直肠IFP可在结肠镜下观察到, 小肠IFP常因肠梗阻而在手术时发现, 大体上IFP需与胃肠道间质瘤和黏膜下脂肪瘤相鉴别[13]. 内镜检查对IFP的明确诊断没有帮助, 仅有10%的胃IFP可在术前取得明确诊断[14]. 超声内镜检查作为一项有希望的诊断工具已用于胃IFP的诊断. IFP在超声内镜下显示为低回声的、均质状、边界不清的肿物, 常位于胃壁的第2到第3层之间, 内部回声可能与IFP富含血管有关, 这些特征可与GIST和脂肪瘤鉴别[15,16].
IFP组织学上主要由明显增生的梭形细胞、大量的炎症细胞和弥漫的大小不等的血管网组成, 其中炎症细胞含大量嗜酸性粒细胞. 少数IFP可见梭形细胞排列成同心圆状, 类似洋葱皮样结构. 肿物位于黏膜固有层下, 表面溃疡常见, 可有蒂, 在平滑肌间穿插生长, 可致正常平滑肌萎缩[17-19]. 应该注意的是嗜酸性粒细胞浸润并不是IFP所特有的特征, 在其他病变中也可以出现[20]. 电子显微镜观察发现胃肠的IFP有4个重要特征: (1)间充质细胞、纤维母样的细胞、星状细胞和梭形细胞均含有多量的粗面内质网; (2)毛细血管腔内和间质均含炎症细胞(嗜酸性粒细胞、浆细胞、淋巴细胞); (3)富含分枝状的血管网和闭塞的毛细血管; (4)细胞外间质由疏松的颗粒状纤维丝状物组成[21]. 免疫组织化学染色显示IFP中的梭形细胞几乎100%表达Vimentin和CD34, 不同程度表达平滑肌标记, 如HHF-35、SMA等, 但NSE、S-100、FⅧ、Dog-1和CD117均阴性[22,23].
本例的诊断依据有: (1)患者为老年男性, 临床表现为无明显诱因的进食梗阻感和吞咽困难3 mo余; (2)内镜于食管黏膜距门齿约35 cm处可见一大小约2.5 cm半球状黏膜隆起, 上可见裂隙, 表面尚光滑. 超声内镜: 超声于该病变处可见一起源于黏膜层大小约13.2 mm×11 mm低回声团块, 回声欠均匀, 其间可见无回声影, 边界尚清晰; (3)组织学形态: 肿瘤位于黏膜下层, 由疏松的或透明变性的纤维结缔组织构成, 其内有嗜酸性粒细胞及浆细胞浸润. 溃疡表面由肉芽组织覆盖. 特征性的改变是, 病变内的星状或梭形纤维母细胞围绕着小动脉呈同心圆性排列; (4)免疫组织化学染色肿瘤细胞SMA、Vimentin、CD34弥漫强阳性, Actin呈弱阳性表达, CD117、Dog-1、Desmin、ALK、Calponin均阴性.
食管IFP需与以下肿瘤和瘤样病变鉴别: (1)平滑肌瘤: 是最常见的食管间叶性肿瘤, 由交织排列的平滑肌细胞束构成, 其间混有多少不等的胶原, 细胞具有两端圆钝雪茄形的细胞核和含有肌原纤维的嗜酸性胞浆, 组织学易与IFP鉴别[24,25]; (2)胃肠道间质瘤(GIST): 发生于食管的GISTs并不常见, 组织学表现范围较宽, 免疫组织化学显示CD117、CD34和Dog-1阳性可与IFP鉴别[26-28]; (3)梭形细胞癌: 又称息肉样癌、癌肉瘤和假肉瘤样癌, 常为息肉状向管腔内生长, 肿瘤由2种成分构成, 一种是恶性梭形细胞肉瘤样成分, 另一种是原位或浸润性癌成分, 这种特征性组织学表现容易与IFP鉴别[29]; (4)纤维血管性息肉: 最常见于食管上1/3, 在环状软骨水平, 常有一长蒂, 由水肿的黏膜、黏膜下层纤维或纤维脂肪组织和血管轴心构成, 而IFP更常见于中段或下段食管, 不常有蒂, 由疏松水肿的肉芽样组织构成, 含有数量不等的单核细胞、浆细胞、中性粒细胞、嗜酸性粒细胞、肥大细胞以及肥胖的梭形纤维母细胞, 两者鉴别不难[30,31]. 此外, 食管IFP还需与炎症性息肉、增生性息肉等鉴别.
总之, IFP的治疗首选手术, 将肿物完整切除, 既能有效缓解症状, 又能取得明确诊断. 内镜下息肉摘除术是一种理想的方式, 但有并发穿孔和切除不完整、术后局部复发的可能. IFP为良性的间叶性肿瘤, 完整切除后不复发不转移, 预后良好[2,32].
炎性纤维性息肉(inflammatory fibroid polyp, IFP)是胃肠道中一种非常少见的良性间叶性肿瘤, 可发生于消化系任何部位, 最常发生于胃, 其次为小肠, 发生于食管的极为罕见.
肖恩华, 教授, 中南大学湘雅二医院影像诊断与介入放射学
分子生物学研究发现, IFP存在PDGFRA基因突变, 这一成果提示IFP是由PDGFRA基因激活突变引起的肿瘤.
本文主要对1例食管IFP的临床诊疗经过、病理形态学特征及免疫表型进行总结分析, 并复习相关文献, 探讨食管IFP的临床及病理形态学特征.
食管炎性纤维性息肉少见, 本病例报道有助于医师提高对其认识, 有临床意义.
编辑: 张珊珊 电编: 闫晋利
| 1. | 周 晓军, 樊 祥山. 解读2010年消化系统肿瘤WHO分类(Ⅰ). 临床与实验病理学杂志. 2011;27:341-346. |
| 2. | Wysocki AP, Taylor G, Windsor JA. Inflammatory fibroid polyps of the duodenum: a review of the literature. Dig Surg. 2007;24:162-168. [PubMed] [DOI] |
| 3. | LiVolsi VA, Perzin KH. Inflammatory pseudotumors (inflammatory fibrous polyps) of the esophagus. A clinicopathologic study. Am J Dig Dis. 1975;20:475-481. [PubMed] [DOI] |
| 4. | Simmons MZ, Cho KC, Houghton JM, Levine CD, Javors BR. Inflammatory fibroid polyp of the esophagus in an HIV-infected individual: case study. Dysphagia. 1995;10:59-61. [PubMed] [DOI] |
| 5. | Costa PM, Marques A, Távora E, Diaz M. Inflammatory fibroid polyp of the esophagus. Dis Esophagus. 2000;13:75-79. [PubMed] [DOI] |
| 6. | Godey SK, Diggory RT. Inflammatory fibroid polyp of the oesophagus. World J Surg Oncol. 2005;3:30. [PubMed] [DOI] |
| 7. | HELWIG EB, RANIER A. Inflammatory fibroid polyps of the stomach. Surg Gynecol Obstet. 1953;96:335-367. [PubMed] |
| 8. | VANEK J. Gastric submucosal granuloma with eosinophilic infiltration. Am J Pathol. 1949;25:397-411. [PubMed] |
| 9. | Lasota J, Wang ZF, Sobin LH, Miettinen M. Gain-of-function PDGFRA mutations, earlier reported in gastrointestinal stromal tumors, are common in small intestinal inflammatory fibroid polyps. A study of 60 cases. Mod Pathol. 2009;22:1049-1056. [PubMed] [DOI] |
| 10. | Pantanowitz L, Antonioli DA, Pinkus GS, Shahsafaei A, Odze RD. Inflammatory fibroid polyps of the gastrointestinal tract: evidence for a dendritic cell origin. Am J Surg Pathol. 2004;28:107-114. [PubMed] [DOI] |
| 11. | Schildhaus HU, Cavlar T, Binot E, Büttner R, Wardelmann E, Merkelbach-Bruse S. Inflammatory fibroid polyps harbour mutations in the platelet-derived growth factor receptor alpha (PDGFRA) gene. J Pathol. 2008;216:176-182. [PubMed] [DOI] |
| 12. | Fuke H, Hashimoto A, Shimizu A, Yoshimura H, Nakano T, Shiraki K. Computed tomographic image of an inflammatory fibroid polyp of the stomach. Clin Imaging. 2003;27:400-402. [PubMed] [DOI] |
| 13. | Gastrointestinal: gastric inflammatory fibroid polyp. J Gastroenterol Hepatol. 2001;16:1069. [PubMed] [DOI] |
| 14. | Stolte M, Sticht T, Eidt S, Ebert D, Finkenzeller G. Frequency, location, and age and sex distribution of various types of gastric polyp. Endoscopy. 1994;26:659-665. [PubMed] [DOI] |
| 15. | Matsushita M, Hajiro K, Okazaki K, Takakuwa H. Gastric inflammatory fibroid polyps: endoscopic ultrasonographic analysis in comparison with the histology. Gastrointest Endosc. 1997;46:53-57. [PubMed] [DOI] |
| 16. | Chan JK. Images in pathology. GIST versus inflammatory fibroid polyp. Int J Surg Pathol. 2001;9:147. [PubMed] [DOI] |
| 17. | Johnstone JM, Morson BC. Inflammatory fibroid polyp of the gastrointestinal tract. Histopathology. 1978;2:349-361. [PubMed] [DOI] |
| 18. | Benjamin SP, Hawk WA, Turnbull RB. Fibrous inflammatory polyps of the ileum and cecum: review of five cases with emphasis on differentiation from mesenchymal neoplasm. Cancer. 1977;39:1300-1305. [PubMed] [DOI] |
| 19. | Trillo AA, Rowden G. The histogenesis of inflammatory fibroid polyps of the gastrointestinal tract. Histopathology. 1991;19:431-436. [PubMed] [DOI] |
| 20. | Harned RK, Buck JL, Shekitka KM. Inflammatory fibroid polyps of the gastrointestinal tract: radiologic evaluation. Radiology. 1992;182:863-866. [PubMed] [DOI] |
| 21. | Navas-Palacios JJ, Colina-Ruizdelgado F, Sanchez-Larrea MD, Cortes-Cansino J. Inflammatory fibroid polyps of the gastrointestinal tract. An immunohistochemical and electron microscopic study. Cancer. 1983;51:1682-1690. [PubMed] [DOI] |
| 22. | Kuestermann SA, Saleeb SF, Teplick SK. General case of the day. Jejunal intussusception caused by an inflammatory fibroid polyp (IFP). Radiographics. 1999;19:539-541. [PubMed] [DOI] |
| 23. | Wille P, Borchard F. Fibroid polyps of intestinal tract are inflammatory-reactive proliferations of CD34-positive perivascular cells. Histopathology. 1998;32:498-502. [PubMed] [DOI] |
| 24. | Linde EM, DiMaio DJ. Solitary esophageal leiomyoma with eosinophilic infiltrate: case report and review of the literature. Dis Esophagus. 2011;24:E5-E7. [PubMed] [DOI] |
| 25. | Jaroszewski DE, Lam-Himlin D, Gruden J, Lidner TK, Etxebarria AA, De Petris G. Plexiform leiomyoma of the esophagus: a complex radiographic, pathologic and endoscopic diagnosis. Ann Diagn Pathol. 2011;15:342-346. [PubMed] [DOI] |
| 26. | Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med. 2006;130:1466-1478. [PubMed] |
| 27. | Liegl-Atzwanger B, Fletcher JA, Fletcher CD. Gastrointestinal stromal tumors. Virchows Arch. 2010;456:111-127. [PubMed] [DOI] |
| 28. | Novelli M, Rossi S, Rodriguez-Justo M, Taniere P, Seddon B, Toffolatti L, Sartor C, Hogendoorn PC, Sciot R, Van Glabbeke M. DOG1 and CD117 are the antibodies of choice in the diagnosis of gastrointestinal stromal tumours. Histopathology. 2010;57:259-270. [PubMed] [DOI] |
| 29. | Battifora H. Spindle cell carcinoma: ultrastructural evidence of squamous origin and collagen production by the tumor cells. Cancer. 1976;37:2275-2282. [PubMed] [DOI] |
| 30. | McLean JN, DelGaudio JM. Endoscopic resection of a giant esophageal polyp: case report and review of the literature. Am J Otolaryngol. 2007;28:115-117. [PubMed] [DOI] |
| 32. | Park YB, Cheung DY, Kim JI, Park SH, Cho SH, Han JY, Kim JK, Choi KY. A large inflammatory fibroid polyp in the sigmoid colon treated by endoscopic resection. Intern Med. 2007;46:1647-1649. [PubMed] [DOI] |