修回日期: 2012-02-12
接受日期: 2012-03-06
在线出版日期: 2012-03-28
目的: 研究大黄素(Emodin)对脱氧胆酸(deoxy-cholic acid, DCA)诱导的胰腺腺泡细胞损伤的调节作用.
方法: 以大鼠AR42J胰腺腺泡系为研究对象, 分为5组, 分别为CON组、0.4 mmol/L DCA刺激组、0.4 mmol/L DCA刺激+Emodin(20 mg/L)干预组、0.8 mmol/L DCA刺激组、0.8 mmol/L DCA刺激+Emodin(20 mg/L)干预组. 利用流式细胞术AV/PI双染法检测各组细胞凋亡/坏死率, 提取细胞浆蛋白, 并分别检测各组细胞培养液上清与细胞浆淀粉酶的活性.
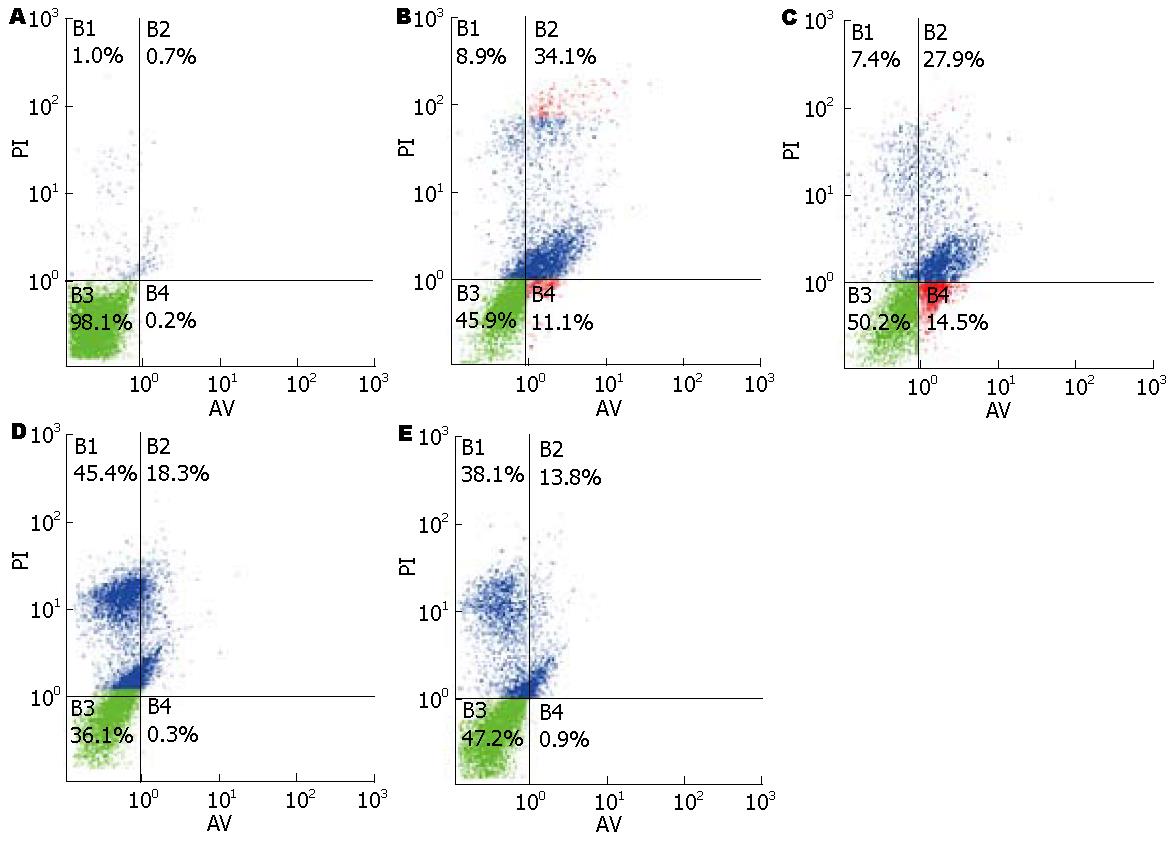
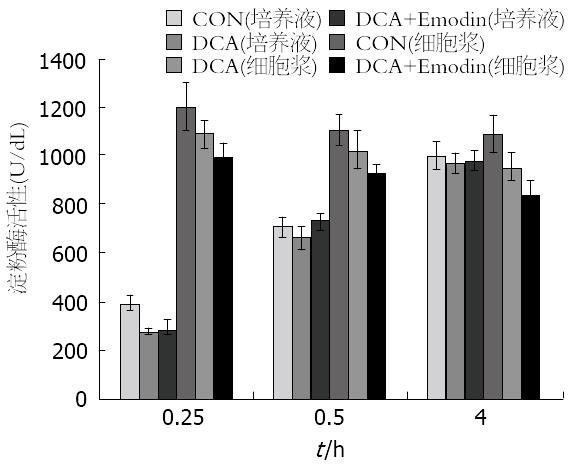
结果: 0.4 mmol/L DCA诱导AR42J胰腺腺泡细胞损伤以凋亡为主, 0.8 mmol/L DCA诱导AR42J细胞损伤则以坏死为主. 20 μmol/L Emodin可以明显减少0.4 mmol/L DCA诱导的AR42J胰腺腺泡细胞的晚期凋亡(27.9% vs 34.1%), 并明显降低0.8 mmol/L DCA诱导的AR42J细胞坏死(38.1% vs 45.4%). 大黄素对DCA诱导下AR42J胰腺腺泡细胞培养液上清及细胞浆淀粉酶活性均没有明显变化.
结论: Emodin对胆汁酸诱导的胰腺腺泡细胞损伤有一定的保护性作用, 对细胞淀粉酶的合成与分泌功能没有明显影响.
引文著录: 张桂信, 陈海龙, 纪军, 吴圆圆, 尚东, 张利. 大黄素对脱氧胆酸诱导的AR42J细胞损伤的调节. 世界华人消化杂志 2012; 20(9): 771-775
Revised: February 12, 2012
Accepted: March 6, 2012
Published online: March 28, 2012
AIM: To investigate whether emodin exerts a protect effect against deoxycholic acid (DCA)-induced cell damage in rat pancreatic acinar cell line AR42J.
METHODS: AR42J cells were divided into five groups: normal control cells, cells treated with 0.4 or 0.8 mmol/L DCA, and those treated with 0.4 or 0.8 mmol/L DCA plus emodin (20 mg/L). The rates of apoptosis and necrosis were detected by flow cytometry and AV/PI double staining. The activity of amylase in the medium and cytoplasm was determined.
RESULTS: DCA at a dose of 0.4 mmol/L mainly induced the apoptosis of AR42J cells, while 0.8 mmol/L of DCA induced the necrosis of AR42J cells. Emodin significantly reduced DCA-induced late apoptosis (27.9% vs 34.1%) and necrosis (38.1% vs 45.4%), but did not significantly change the activity of amylase in the medium and cytoplasm of AR42J cells.
CONCLUSION: Emodin has some protective effects against DCA-induced AR42J cell damage, but does not influence amylase synthesis and secretion by acinar cells.
- Citation: Zhang GX, Chen HL, Ji J, Wu YY, Shang D, Zhang L. Emodin protects from deoxycholic acid-induced AR42J cell damage. Shijie Huaren Xiaohua Zazhi 2012; 20(9): 771-775
- URL: https://www.wjgnet.com/1009-3079/full/v20/i9/771.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i9.771
近十几年来对于急性胰腺炎(acute pancreatitis, AP)发病机制的研究大多围绕胰腺腺泡细胞展开, 胰腺腺泡细胞的损伤方式和机制成为研究的热点. 随胆汁异常反流入胰管的胆汁酸, 造成胰腺腺泡细胞功能与结构损害是大多数急性胆源性胰腺炎发病的一个关键性因素. 我们先前的研究已证实人胆汁中7种主要胆汁酸成分对胰腺腺泡细胞的损伤作用不同, 其中脱氧胆酸(deoxycholic acid, DCA)的作用较强, 主要表现为凋亡和坏死[1]. 近年有研究认为大黄素具有抗炎作用[2,3], 并对由酒精和CCl4诱导的肝细胞损害具有保护功效[4,5]. 动物实验研究表明大黄素对重症急性胰腺炎(severe acute pancreatitis, SAP)多脏器功能衰竭具有保护作用, 可减轻过度炎症反应, 保护肠道屏障功能[6,7]. 本研究通过体外实验, 探讨大黄素对DCA诱导的胰腺腺泡细胞损伤的调节作用.
AR42J大鼠胰腺腺泡细胞系购自中科院上海细胞库; Ham's F12K培养基购自美国Sigma-Aldrich公司; FBS购自美国Gibco公司; DCA购自美国Alfa Aesar公司; MTT购自美国Sigma-Aldrich公司; 碘-淀粉法淀粉酶活性检测试剂盒购自南京建成生物工程研究所; Annexin V-FITC/PI细胞凋亡检测试剂盒购自北京创根胜泰科技有限公司; Procarta TF Nuclear Extraction Kit购自美国Fremont公司.
1.2.1 细胞培养: 大鼠胰腺腺泡细胞系AR42J细胞于含200 mL/L的胎牛血清、100 kU/L青霉素、100 mg/L链霉素的Ham's F12K培养液中, 在37 ℃、50 mL/L CO2及饱和湿度的培养箱中培养. 细胞每3-4 d换液1次, 用0.125%胰酶+0.02%EDTA消化, 以1:3-1:5传代1次.
1.2.2 流式细胞术检测细胞凋亡/坏死率: 取对数生长期的1×106/mL AR42J细胞, 分为5组, 分别为对照组(CON)、0.4 mmol/L DCA处理组、0.4 mmol/L DCA+20 mg/L Emodin处理组、0.8 mmol/L DCA处理组和0.8 mmol/L DCA+20 mg/L Emodin处理组. 消化收集细胞成单细胞悬液, 通过流式细胞仪采用Annexin-V/PI双染法对其进行凋亡率和坏死率检测, 按照试剂盒说明书进行操作.
1.2.3 细胞浆蛋白的提取: 取对数生长期的AR42J细胞, 使其浓度为1×106/mL接种12个6 cm皿. 分为CON组、0.4 mmol/L DCA处理组和0.4 mmol/L DCA+20 mg/L Emodin处理组, 每组按照不同的培养时间分为4组, 即15 min、30 min、1 h和4 h. 于相应时间点收集细胞培养液上清, -20 ℃保存待测淀粉酶活性; 应用Procarta TF Nuclear Extraction Kit提取细胞核蛋白和细胞浆蛋白, 参照文献[8]方法执行操作. 弃掉细胞培养液上清, 用预冷的PBS洗2次; 加入1 mL工作液A(1 mL缓冲液A, 10 μL二硫苏糖醇, 10 μL蛋白酶抑制剂, 10 μL磷酸酶抑制剂Ⅰ, 10 μL磷酸酶抑制剂Ⅱ); 放入冰盒中, 200 r/min摇床上放置10 min; 将细胞收集到1.5 mL离心管中, 14 000 g, 4 ℃离心3 min; 收集上清至新的EP管中, 即为细胞浆蛋白. 测定蛋白浓度, -80 ℃保存, 待测淀粉酶活性.
1.2.4 淀粉酶活性测定: 采用南京建成生物工程研究所的碘-淀粉比色法试剂盒, 按照说明书操作步骤进行测定. 计算公式为: 培养液上清淀粉酶AMS(U/dl) = (空白管吸光度-测定管吸光度)/空白管吸光度×800; 细胞提取蛋白淀粉酶AMS(U/mgprot) = (空白管吸光度-测定管吸光度)/空白管吸光度×50.
统计学处理 采用SPSS12.0统计软件进行单因素方差分析, 组间比较采用LSD法.
同0.4 mmol/L DCA组相比, 0.4 mmol/L DCA+Emodin处理组细胞早期凋亡率有所升高(14.5% vs 11.1%), 凋亡晚期及死细胞百分率则明显下降(27.9% vs 34.1%), 坏死率有所下降(7.4% vs 8.9%); 同0.8 mmol/L DCA组相比, 0.8 mmol/L DCA+Emodin处理组细胞早期凋亡率无明显变化(0.9% vs 0.3%), 凋亡晚期及死细胞百分率有所下降(13.8% vs 18.3%), 坏死率下降较明显(38.1% vs 45.4%, 图1).
随着培养时间的延长, 培养液内淀粉酶活性逐渐增高, 至4 h时接近细胞浆内淀粉酶活性. 同CON组比较, 0.4 mmol/L DCA和0.4 mmol/L DCA+20 mg/L Emodin处理组的培养液和胞浆淀粉酶水平均无明显改变(图2).
胰腺腺泡细胞损伤是AP的一个重要特征, 而且在AP发病机制中处于关键性角色. 普遍认为, AP时最早期改变发生在腺泡细胞内并导致了腺泡细胞的损害, 其后才发生了炎症细胞的聚集及炎症介质的释放等反应, 进一步影响了疾病的严重程度. 最近的研究表明, 腺泡细胞对损害的反应本身是影响疾病严重性的重要决定因素. 在这些研究中发现, 轻度AP时腺泡细胞损伤主要表现为凋亡, SAP则发生广泛的腺泡细胞坏死而凋亡很少[9,10]. 我们在之前的研究中, 通过体外实验, 证实了胆汁酸对胰腺腺泡细胞损伤的作用特点符合以上动物实验的结论[1].
掌叶大黄是祖国医学中一种常用的中草药[11], 已经被广泛地应用于临床胰腺炎、胆囊炎、急腹症及其他炎症性疾病的救治过程中[12]. Emodin化学名为1, 3, 8-三羟基-6甲基蒽醌(1, 3, 8-trihydroxy-6methy lanthraquinone), 分子量为270.23 Da, 其化学结构属于羟基蒽醌类. 大黄素是中药大黄的主要有效成分, 并且在正品大黄中的游离蒽醌中占的比例较大[13]. 其药理作用与大黄有许多相似之处, 国内外文献有关大黄素的报道很多, 作用极其广泛. 具有抗炎作用, 能显著抑制角叉菜胶致小鼠足趾肿胀[14], 调节机体免疫功能[15,16], 增强肠道蠕动而具有泻下作用[17], 并具有诱导癌细胞凋亡, 抑制肿瘤转移等功能而发挥抗癌功效[18-22]; 此外, 他还具有肝肾保护功能, 对CCl4损伤的原代培养大鼠肝细胞有显著保护作用[23]. 有研究表明, 大黄素对胰腺激肽释放酶、胰蛋白酶、胰脂肪酶均有很强的抑制作用, IC50分别为31.5 mg/L、40.5 mg/L、46.5 mg/L. 用大黄素治疗胰腺炎后, 胰腺组织转化生长因子表达明显增强, 高峰前移, 且胰腺总蛋白质、DNA合成物明显增加, 参与胰腺组织的再生和修复[24,25]. 在AP大鼠模型中, 大黄素还可通过保护肠道屏障损伤、诱导中性粒细胞凋亡起到治疗作用[26-28].
大黄素在AP时对胰腺腺泡细胞损伤的保护性意义尚不明确. 大鼠AR42J胰腺腺泡细胞系具有胰腺腺泡细胞的绝大多数功能, 而成为进行AP体外实验研究的标准胰腺腺泡细胞系[1,29]. 本实验通过脱氧胆酸刺激大鼠AR42J胰腺腺泡细胞损伤为体外模型, 研究大黄素对AP时胰腺腺泡细胞损伤的调节作用. 发现大黄素对胆汁酸诱导的胰腺腺泡细胞损伤具有一定的保护性作用, 可减少晚期凋亡和坏死, 而对细胞淀粉酶的合成与分泌功能均无明显影响, 其分子机制有待于进一步深入研究.
胰腺腺泡细胞损伤是胆源性急性胰腺炎发病过程中的重要病理机制, 研究腺泡细胞损伤的分子机制, 特别是关于凋亡-坏死"转换开关"是当前研究的热点.
白雪巍, 副主任医师, 哈尔滨医科大学
大黄素是治疗急性胰腺炎(acute pancreatitis, AP)的有效中药成分, AP时大黄素可通过抑制肠黏膜细胞凋亡、保护肠道屏障功能损伤、诱导延迟凋亡的中性粒细胞凋亡减轻炎症反应等发挥治疗作用.
随胰胆管反流的胆汁酸造成胰腺腺泡细胞损伤是胆源性AP发病机制的始动因素和关键因子. 大黄素可通过减轻腺泡细胞损伤而发挥治疗作用, 为临床应用提供了进一步的理论指导.
该课题立题尚可, 设计科学合理, 结果可靠, 为临床应用提供了理论指导.
编辑: 张珊珊 电编: 闫晋利
| 2. | Gao Q, Wang F, Guo S, Li J, Zhu B, Cheng J, Jin Y, Li B, Wang H, Shi S. Sonodynamic effect of an anti-inflammatory agent--emodin on macrophages. Ultrasound Med Biol. 2011;37:1478-1485. [PubMed] [DOI] |
| 3. | Ha MK, Song YH, Jeong SJ, Lee HJ, Jung JH, Kim B, Song HS, Huh JE, Kim SH. Emodin inhibits proinflammatory responses and inactivates histone deacetylase 1 in hypoxic rheumatoid synoviocytes. Biol Pharm Bull. 2011;34:1432-1437. [PubMed] [DOI] |
| 4. | Qian ZJ, Zhang C, Li YX, Je JY, Kim SK, Jung WK. Protective Effects of Emodin and Chrysophanol Isolated from Marine Fungus Aspergillus sp. on Ethanol-Induced Toxicity in HepG2/CYP2E1 Cells. Evid Based Complement Alternat Med. 2011;2011:452621. [PubMed] |
| 5. | Lee BH, Huang YY, Duh PD, Wu SC. Hepatoprotection of emodin and Polygonum multiflorum against CCl(4)-induced liver injury. Pharm Biol. 2012;50:351-359. [PubMed] [DOI] |
| 6. | Wan L, Wang Z, Zhou L. Protecting effects of emodin on multiorgan failure of rats with severe acute pancreatitis. Pancreas. 2009;38:835-836. [PubMed] [DOI] |
| 7. | Wang G, Sun B, Zhu H, Gao Y, Li X, Xue D, Jiang H. Protective effects of emodin combined with danshensu on experimental severe acute pancreatitis. Inflamm Res. 2010;59:479-488. [PubMed] [DOI] |
| 8. | Brahmachary M, Schönbach C, Yang L, Huang E, Tan SL, Chowdhary R, Krishnan SP, Lin CY, Hume DA, Kai C. Computational promoter analysis of mouse, rat and human antimicrobial peptide-coding genes. BMC Bioinformatics. 2006;7 Suppl 5:S8. [PubMed] [DOI] |
| 10. | Laukkarinen JM, Van Acker GJ, Weiss ER, Steer ML, Perides G. A mouse model of acute biliary pancreatitis induced by retrograde pancreatic duct infusion of Na-taurocholate. Gut. 2007;56:1590-1598. [PubMed] [DOI] |
| 11. | Yang DY, Fushimi H, Cai SQ, Komatsu K. Molecular analysis of Rheum species used as Rhei Rhizoma based on the chloroplast matK gene sequence and its application for identification. Biol Pharm Bull. 2004;27:375-383. [PubMed] [DOI] |
| 12. | Cuéllar MJ, Giner RM, Recio MC, Máñez S, Ríos JL. Topical anti-inflammatory activity of some Asian medicinal plants used in dermatological disorders. Fitoterapia. 2001;72:221-229. [PubMed] [DOI] |
| 14. | Wang CC, Lai JE, Chen LG, Yen KY, Yang LL. Inducible nitric oxide synthase inhibitors of Chinese herbs. Part 2: naturally occurring furanocoumarins. Bioorg Med Chem. 2000;8:2701-2707. [PubMed] [DOI] |
| 18. | Wang W, Sun YP, Huang XZ, He M, Chen YY, Shi GY, Li H, Yi J, Wang J. Emodin enhances sensitivity of gallbladder cancer cells to platinum drugs via glutathion depletion and MRP1 downregulation. Biochem Pharmacol. 2010;79:1134-1140. [PubMed] [DOI] |
| 19. | Su YJ, Tsai MS, Kuo YH, Chiu YF, Cheng CM, Lin ST, Lin YW. Role of Rad51 down-regulation and extracellular signal-regulated kinases 1 and 2 inactivation in emodin and mitomycin C-induced synergistic cytotoxicity in human non-small-cell lung cancer cells. Mol Pharmacol. 2010;77:633-643. [PubMed] [DOI] |
| 20. | Lin ML, Lu YC, Su HL, Lin HT, Lee CC, Kang SE, Lai TC, Chung JG, Chen SS. Destabilization of CARP mRNAs by aloe-emodin contributes to caspase-8-mediated p53-independent apoptosis of human carcinoma cells. J Cell Biochem. 2011;112:1176-1191. [PubMed] [DOI] |
| 25. | 陈 德昌, 景 炳文, 杨 兴易, 宋 志芳, 严 鸣, 赵 良, 单 红卫, 余 康龙, 张 翔宇, 马 钧. 大黄对危重症患者胃肠道的保护作用. 中国危重病急救医学. 2000;12:87-90. |
| 26. | 李 永红, 何 馥倩, 黄 宗文, 薛 平, 夏 庆. 大黄素对急性坏死性胰腺炎大鼠肠道损伤的保护作用. 四川大学学报(医学版). 2010;41:1012-1015. |
| 29. | Twait E, Williard DE, Samuel I. Dominant negative p38 mitogen-activated protein kinase expression inhibits NF-kappaB activation in AR42J cells. Pancreatology. 2010;10:119-128. [PubMed] [DOI] |