修回日期: 2012-02-20
接受日期: 2012-03-06
在线出版日期: 2012-03-28
腹泻作为全球性发病率和致死率较高的疾病之一, 全世界每年有几百万的人因腹泻而死, 其中绝大部分是婴幼儿童. 腹泻按病程的长短可分为急性腹泻和慢性腹泻两类, 而根据病因学又可分为感染性腹泻和非感染性腹泻, 其本质上是肠道中水、电解质吸收和分泌功能的紊乱, 这其中就与肠道离子的异常转运密切相关. 本文从腹泻的发病原因, 腹泻症状的产生与肠道不同离子转运的关系以及不同类型腹泻中的各种离子的转运过程进行了综述, 以期为更全面地了解不同类型腹泻的相关发生发病机制, 并为腹泻的病理生理学研究及相关肠道病症的治疗提供一定的依据.
引文著录: 张志博, 韩雪峰, 谭支良, 肖文军. 腹泻与肠道离子转运关系的研究进展. 世界华人消化杂志 2012; 20(9): 743-748
Revised: February 20, 2012
Accepted: March 6, 2012
Published online: March 28, 2012
Diarrhea is a major cause of morbidity and mortality in the world. There are millions of people dying of diarrhea, and most of them are children. Diarrhea can be divided into acute diarrhea and chronic diarrhea based on the length of the course, and into infectious diarrhea and noninfectious diarrhea according to the etiology. Diarrhea is an imbalance in absorption and secretion of water and electrolytes in the intestine, which involves abnormal ion transport. This paper reviews recent advances in understanding the causes of diarrhea, the relationship between intestinal ion transport and diarrhea, and ion transport in different kinds of diarrhea, with an aim to providing a reference and some new ideas on the comprehensive understanding of the pathogenesis, pathophysiology and treatment of diarrhea.
- Citation: Zhang ZB, Han XF, Tan ZL, Xiao WJ. Progress in understanding the relationship between diarrhea and intestinal ion transport. Shijie Huaren Xiaohua Zazhi 2012; 20(9): 743-748
- URL: https://www.wjgnet.com/1009-3079/full/v20/i9/743.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i9.743
肠道腹泻是指正常人排便次数明显超过平日习惯的频率, 粪质稀薄, 水分增加, 每日排便量超过200 g, 或粪便含未消化食物或脓血、黏液的一种常见症状[1-3]. 腹泻每年可造成世界上数以万计人的死亡, 也是阻碍畜禽类动物快速生长及影响畜禽健康的主要病害之一, 是造成畜禽类生长缓慢与幼仔死亡的主要原因[4]. 但腹泻病因是多方面的, 其发病机制也较为复杂, 因此, 研究腹泻的病理生理机制对于腹泻疾病的防治就显得十分重要. Argenzio[5]认为不论何种因素导致的腹泻, 都会引起机体内环境的改变, 其本质是胃肠道水电解质吸收和分泌功能的紊乱, 即异常的渗透、异常的运动、异常的离子转运和异常的微生物消化作用. 其中, 肠道异常的离子转运与腹泻的发生密切相关[6]. 本文对近年来有关腹泻与肠道离子转运关系的研究进行了综述, 以期为腹泻的病理生理研究以及腹泻疾病的防治提供一定的参考.
腹泻产生的原因根据病因学可分为感染性腹泻和非感染性腹泻. 感染性腹泻主要是由病原微生物及其产物或寄生虫所引发的, 包括细菌(大肠杆菌、沙门氏杆菌、痢疾杆菌、金黄色葡萄球菌)、病毒(轮状病毒、Norwalk病毒、肠道腺病毒)和寄生虫(球虫、梨形鞭毛虫)等[7-11]; 非感染性腹泻主要由气候、环境变化等外界应激和饲料成分及饲养管理不科学等因素引起的.
腹泻按病程长短分为急性和慢性两类. 全世界约有近70%的急性腹泻由食源性引起的, 细菌、病毒、寄生虫引发的肠道感染及旅途中被感染均可引起急性腹泻[12-15]. 而肠道炎症、肠消化和吸收功能障碍以及药物作用则引发慢性腹泻[16-20]. 慢性腹泻是许多药物常见的不良反应之一, 据统计7%的药物不良反应以及700多种药物均能引起不同程度的腹泻[21].
在肠道细胞表面存在着钠钾泵[22,23]、钙离子通道[24]、氯离子通道[25,26]、钠氢交换体等不同类型的离子通道, 在这些离子通道正常工作的状况下, 可保证离子和有机物质在肠道的正常运转. 当肠黏膜吸收功能受损或面积减少时, 大量水分和电解质未被吸收而留在肠腔中引起肠腔渗透压的升高而发生渗透性腹泻; 当肠黏膜隐窝细胞水和电解质的分泌量超过了肠绒毛上皮细胞的吸收能力时, 肠道中水和电解质发生过度分泌也会引起腹泻[27,28].
环磷酸腺苷(cyclic adenosine monophosphate, cAMP)作为细胞内的第二信使, 在肠道离子转运过程中发挥着重要作用. Tabcharani等[29]研究表明cAMP能够使低电导的氯离子通道开放的概率增加, 间接造成顶端氯离子通道打开使细胞内氯离子含量减少, 从而促使更多的氯离子转运到胞外; 同时在肠道组织中cAMP还能够增强基底膜的钠钾二氯离子协同转运蛋白的活性, 促进更多钠钾泵、钾离子通道等离子转运体进入至肠上皮细胞顶膜, 随着顶膜中转运蛋白的数量增加, 选择性吸收的电解质的转运量增加, 使肠上皮细胞对电解质的吸收平衡破坏, 造成吸收不良而产生腹泻. 而Kunzelmann等[30]对大鼠结肠上皮细胞钾离子通道的功能研究后证明基底膜上cAMP激活的钾离子通道的开放能促使细胞的再极化, 抵消了基底膜氯离子通道开放引起的去极化效应, 从而维持了氯离子渗出进入内腔的电驱动力, 并使氯离子分泌到肠腔中, 氯离子含量的增加促使肠道电解质分泌增加而引起腹泻.
在肠道刷状缘上的钠氢交换过程的研究中发现[31]人和兔子小肠、结肠刷状缘膜上存在一类蛋白质-钠氢交换体(Na/H exchangers, NHEs), 包括NHE1、NHE2和NHE3三种类型. 首先在大鼠远端结肠隐窝中发现了具有氯离子依赖性的NHE1, 其仅存在于结肠上皮细胞的基底膜上且与碳酸氢根离子的分泌密切相关; 而NHE2、NHE3在小肠和结肠中均有发现[32-34]. Moeser等[35,36]的研究表明敲除NHE2的小鼠更容易发生胃功能紊乱, 但肠道功能不受影响, 而敲除NHE3的小鼠却易患上慢性腹泻, 从而证明NHE3在从黏膜到浆膜的钠离子转运中发挥了更重要的作用; Yun等[37]发现2种cAMP依赖的调节蛋白-NHE3激酶调节蛋白(E3KARP)和钠氢交换体调节因子(NHERF)[38], 他们可以影响cAMP依赖性蛋白激酶PKA的活性, PKA通过对NHE3的磷酸化而介导或加强NHE3的抑制效应, 进而使cAMP对NHE3抑制, 使NHE3失活, 从而使肠上皮细胞刷状缘膜上的钠离子吸收和分泌的失衡而产生腹泻.
按照腹泻的病理生理机制, 可将腹泻分为渗透性腹泻、分泌性腹泻、渗出性腹泻、运动性腹泻等. 但并不是所有类型的腹泻都与离子转运相关, 现将不同的腹泻类型中的离子转运分述如下.
渗透性腹泻是指大量高渗性或难吸收的溶质进入肠腔, 其导致血浆与肠腔之间的渗透压差增大, 水分透过肠黏膜由血浆向肠腔返流, 直到肠内容物被稀释成等张为止, 从而使肠腔内存留大量液体刺激肠运动而引起腹泻.
Hammer等[39]对正常人摄入聚乙二醇和果糖而产生的渗透性腹泻进行了研究. 在聚乙二醇引起的腹泻中, 肠道细胞中的钠、钾、氯离子被大量保留下来; 而在果糖诱发的腹泻中, 未被吸收的有机酸使无机阳离子在腹泻分泌液中积累, 积累量顺序为钠最多, 依次为钙、钾, 镁的积累最少. Hammer等[40]随后又研究了碳水化合物吸收不良对腹泻的影响, 发现腹泻的一个原因是碳水化合物在粪便中排出的增加, 可通过增加还原糖、有机酸和有用的阳离子来调节碳水化合物吸收不良造成的渗透腹泻. 这些研究显示了肠道离子在渗透性腹泻发生和防治中的作用, 但其具体作用机制仍待进一步研究.
Wapnir等[41]对口服再水化方法治疗幼龄小鼠腹泻过程中钠离子的吸收进行了研究, 当腹泻小鼠被喂食适量钠盐以及含有适量L-丙氨酸的葡萄糖水化液时, 其水分和钠离子的吸收有明显提高, 说明口服水化方案能通过钠离子吸收状况的改善来辅助治疗婴幼儿腹泻. Go等[42]通过小鼠的急性渗透模型研究了口服补液中添加羧甲基纤维素(carboxymethyl cellulose, CMC)对水和钠离子吸收的作用, 发现CMC的补充可能增加肠道细胞表面的渗透活性物质(谷氨酸和电解质)的量, 导致水分的吸收; 另外一种可能是CMC导致肠上皮表面静水层的局部变化, 这些相互作用可能发生在绒毛和隐窝黏膜的刷状缘膜上, 在绒毛上可能表现为促进钠离子吸收, 在隐窝表现为抑制钠离子分泌, 说明口服补液可改善水分和钠的吸收来减轻腹泻.
分泌性腹泻是指肠黏膜隐窝细胞水和电解质的分泌量超出了肠绒毛上皮细胞的吸收能力, 引起肠道中水和电解质过度分泌而产生的腹泻[43]. 细胞中的第二信使如cAMP、环磷酸鸟苷(cGMP)以及钙离子相关运输通道的改变、内分泌肿瘤的激素分泌、胆盐和长链脂肪酸及炎症介质都可能刺激黏膜细胞, 导致分泌性腹泻[44].
目前已知至少有10余种能产生促进肠道分泌的肠毒素的细菌, 其中最典型的是霍乱弧菌[45], 当霍乱弧菌进入小肠后, 依靠其黏附分子贴于小肠上皮细胞表面, 大量繁殖并产生霍乱毒素(CT). CT包括A、B两个亚基, 其借助于B亚基与细胞膜表面的神经节苷脂(GM1)结合, 促使A亚基进入细胞膜, 而A亚基具有二磷酸腺苷(ADP)-核糖转移酶的活性, 刺激ADP核糖, 使其转移到具有控制腺苷环化酶(AC)活性的三磷酸鸟呤核苷(GTP)结合蛋白中, 使GTP酶活性受到抑制, GTP不能水解成GDP, 使AC活性相对增强, 使细胞内的ATP转化为cAMP. cAMP的含量增加, 抑制小肠黏膜细胞对钠离子的正常吸收, 并刺激隐窝细胞分泌氯离子和水分, 导致肠腔水分和电解质大量聚集, 超出其吸收限度而产生剧烈的腹泻[46].
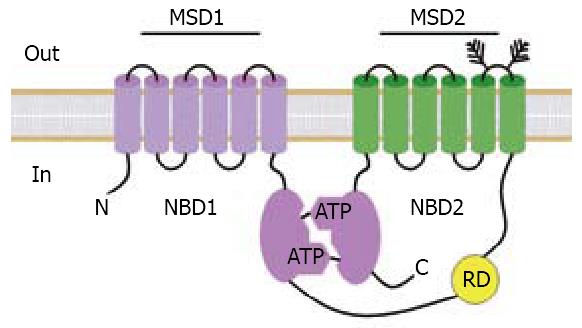
在大多数的组织中都存在一种囊性纤维化跨膜转运调节体(cystic fibrosis transmembrane conductance regulator, CFTR), 他是ATP结合转运体超家族的一员, 由5个功能结构域组成: 2个跨膜结构域(membrance-spanning domain, MSD), 2个核苷酸结合的结构域(nucleotide-binding domain, NBD)以及1个调节结构域(regulatory domain, RD)[47,48]. 其中MSDs组成一低电导的阴离子选择性孔道, 2个NBDs组成头尾相对的二聚体, 在二聚体之间的接触面上有2个与ATP的结合位点(位点1和2)(图1)[49]. CFTR的调控机制是: ATP分子与位点l和2相互作用促使NBD二聚体的结合与解离, 从而引起MSDs的构象发生变化进而使通道孔打开和关闭. 而RD含有多个磷酸化位点, 这些位点可被蛋白激酶A(protein kinase A, PKA)和蛋白激酶C(PKC)磷酸化, RD的磷酸化促进NBDs与ATP的结合, 使CFTR得以激活, 使氯离子的跨上皮分泌增加引起腹泻[50,51].
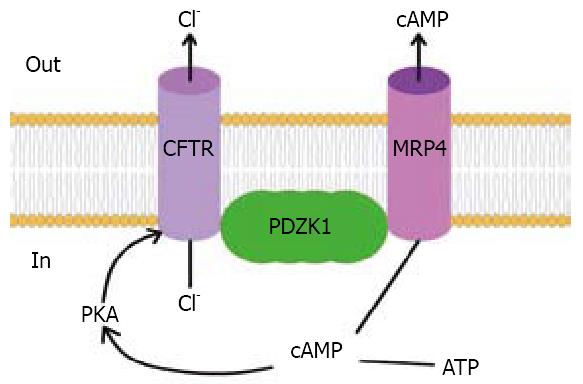
但CFTR也可能通过与其他分子的结合而使自身的结构或功能变化而最终引起腹泻的发生. Li等[52]研究发现溶血磷脂酸(lysophosphatidic acid, LPA)受体的一种亚型LPA2能抑制CFTR依赖的碘化物的外流, 具体过程是LPA2与另一钠氢交换体调节因子(NHERF2)结合, 随后与CFTR结合形成一种大分子复合物(LPA2-NHERF2-CFTR), 从而抑制CFTR调节的短路电流, 进而抑制CT诱导的CFTR依赖型肠流体的分泌, 而当其过量分泌时会发生腹泻. 推知CFTR依赖的蛋白质相互作用可抑制CT诱导的分泌性腹泻. 随后其又报道了一种cAMP转运体(MRP4), 可以在肠上皮细胞顶膜表面与一种PDZ骨架蛋白(PDZK1)结合形成复杂的大分子, 其中PDZK1与CFTR的活性和功能有关. cAMP经由MRP4的转运增加可调节MRP4与CFTR的耦合, 进而影响CFTR的功能, 使氯离子的分泌增加从而产生肠道腹泻; cAMP也可直接影响PKA的活性来影响CFTR介导的氯离子分泌(图2), 有实验表明敲除MRP4的小鼠更易患CFTR介导的分泌性腹泻[53].
Sandle等[54]对人体结肠顶膜上高电导的钾通道(BK)研究后发现这是一种cAMP依赖的钾通道, 他在小肠氯离子和水分分泌的同时能增加结肠钾离子的分泌, 在分泌性腹泻发生时与结肠中的钾流失有关. 但这并不是分泌性腹泻有关的唯一的钾通道, 人体结肠细胞基底膜钙离子敏感的中电导的钾通道(KCNN4)和cAMP敏感的低电导的钾通道(KCNQ1/KCNE3)都可能与不同病因引起的分泌性腹泻有关[55-57]. 后者可能的机制是KCNQ1/KCNE3能通过上皮细胞基底膜钾离子的重复利用而增加顶端氯离子外排的电化学驱动, 从而使跨上皮的氯离子分泌变的容易, 而氯离子的过量分泌会引起分泌性腹泻[58].
van Dinter等[59]研究发现结肠假性梗阻患者粪便中高浓度的钾是由于结肠自主神经系统的激活和结肠假性梗阻, 引起结肠扩张而使结肠中钾的大量分泌随粪便排出, 但粪便中钠含量维持在较低水平, 说明钠的主动吸收未受影响. Blondon等[60]在随后对与结肠假性梗阻有关的新型腹泻的研究中证实以上观点, 并指出伴随着钠的被动分泌或抑制钠吸收的氯离子主动分泌也是分泌性腹泻的原因. 由此推测, 钾的主动分泌可能是引起分泌性腹泻的一个新机制, 但尚未发现有具体机制性的报道.
另外, 体内与水分和离子转运有关转运体的先天性缺乏也是造成分泌性腹泻的一个原因. Murayama等[61]发现一个日本男孩缺乏肠上皮细胞线粒体呼吸链复合物Ⅰ, 而这种复合物缺乏可阻断维持跨膜离子梯度运输的ATP的供应, 进而抑制NHEs的活性, 使体内水分和离子的转运发生异常, 最终导致肠道分泌性腹泻.
渗出性腹泻是指肠黏膜受到感染或其他因素的破坏, 炎性渗出物使肠道渗透压升高, 发生炎症或渗出而引起的腹泻. 肠炎性疾病是造成炎症腹泻的最常见的原因之一[62]. 产毒性生物体(如肠道聚集性大肠杆菌、肠道出血性大肠杆菌)[63,64]和入侵肠道的生物体(如沙门氏菌、痢疾杆菌、弯曲杆菌、产气单胞菌)等均可诱发肠道炎症[65,66], 激活细胞因子和炎症介质而引起渗出腹泻.
溃疡性结肠炎患者的肠黏膜上钠离子的吸收显著降低, 上皮组织的通透性增强, 基底膜外侧的钠钾泵活性降低, 钠离子和氯离子的渗出减少, 钾离子的分泌增加, 并伴有明显的肠功能受损[67,68], 还可能与离子通道的损伤有关[69]. Amasheh等[70]对溃疡性结肠炎时上皮细胞钠离子通道(ENaC)进行了研究, 表明在溃疡性结肠炎时促炎细胞因子的增加可有选择的减少ENaC上β、γ亚基mRNA的表达, 使该钠离子通道的功能受阻, 通过ENaC的电中性的氯化钠的吸收量减少. 随着远端结肠钠离子的吸收降低, 进而产生更为严重的肠道炎症, 从而导致肠炎性腹泻的发生. Sugi等[71]研究发现干扰素γ可抑制钠钾泵的活性, 引起胞内钠离子浓度和细胞体积的上升, 这也是肠上皮损伤相关的慢性肠炎的显著标志, 也说明肠道黏膜功能下降导致肠腔内水分、电解质等积累而引起肠炎相关性腹泻.
腹泻的发病机制比较复杂, 是很多因素综合作用的结果, 总的来说就是胃肠道分泌、吸收、消化和运动等功能发生障碍, 以致分泌量增加、吸收量减少、消化不完全和运动能力加速, 最终导致腹泻的发生. 肠道离子浓度变化及离子通道的功能性改变是各种不同类型腹泻发生过程中的一种重要现象, 也是一种重要的致泻原因或途径. 肠道离子的异常转运是在各种外因和内因作用下发生的, 目前, 对腹泻疾病中的离子转运变化的研究还不够深入, 许多复杂的机制还未能阐明. 通过进一步加强分子生物学、药理学、遗传学、病理学的多学科交叉研究, 深入探讨腹泻疾病中的离子通道及离子转运变化发生和发展的过程和机制, 将可为特异性离子通道的协同或拮抗药品的开发利用以及腹泻疾病的预防和治疗提供一定的科学依据.
腹泻作为全球性发病率和致死率较高的疾病之一, 其发病是多方面因素综合作用的结果, 其本质上是肠道中水和电解质吸收和分泌功能的紊乱, 这其中就与肠道离子的异常转运密切相关. 近年来对肠道离子转运及离子通道的研究已成为一个热点.
高泽立, 副教授, 上海浦东新区周浦医院消化科, 上海交大医学院九院周浦分院
由于腹泻的发病是多方面综合的结果, 肠道离子的异常转运只是一种重要的致泻途径. 目前对腹泻疾病中的离子转运变化的许多复杂机制还未能阐明, 有待于更进一步的研究和探索.
本文从近年来对不同类型腹泻与肠道离子转运关系的研究出发, 搜集了相关的详细资料进行综述, 在选题和研究思路上有所创新.
本文系统阐述了肠道离子转运与腹泻的研究, 可对腹泻的病理生理学研究和相关肠道疾病的治疗提供一定的依据.
CFTR: 是一种独特的氯离子通道, 主要为氯离子的跨上皮转运提供选择性通道, 对跨上皮的盐类运输、液体流动和离子浓度的调节都有很重要的作用.
本文选题为临床常见病, 特别值得基础研究者和消化临床医师阅读.
编辑: 李军亮 电编: 闫晋利
| 1. | Guerrant RL, Van Gilder T, Steiner TS, Thielman NM, Slutsker L, Tauxe RV, Hennessy T, Griffin PM, DuPont H, Sack RB. Practice guidelines for the management of infectious diarrhea. Clin Infect Dis. 2001;32:331-351. [PubMed] [DOI] |
| 2. | Talley NJ, Weaver AL, Zinsmeister AR, Melton LJ. Self-reported diarrhea: what does it mean? Am J Gastroenterol. 1994;89:1160-1164. [PubMed] |
| 3. | Pawlowski SW, Warren CA, Guerrant R. Diagnosis and treatment of acute or persistent diarrhea. Gastroenterology. 2009;136:1874-1886. [PubMed] [DOI] |
| 4. | Fairbrother JM, Nadeau E, Gyles CL. Escherichia coli in postweaning diarrhea in pigs: an update on bacterial types, pathogenesis, and prevention strategies. Anim Health Res Rev. 2005;6:17-39. [PubMed] [DOI] |
| 5. | Argenzio RA. Physiology of diarrhea--large intestine. J Am Vet Med Assoc. 1978;173:667-672. [PubMed] |
| 6. | Coté GA, Buchman AL. Antibiotic-associated diarrhoea. Expert Opin Drug Saf. 2006;5:361-372. [PubMed] [DOI] |
| 7. | Stephen J. Pathogenesis of infectious diarrhea. Can J Gastroenterol. 2001;15:669-683. [PubMed] [DOI] |
| 8. | Navaneethan U, Giannella RA. Mechanisms of infectious diarrhea. Nat Clin Pract Gastroenterol Hepatol. 2008;5:637-647. [PubMed] [DOI] |
| 10. | 聂 青和. 感染性腹泻的发病机制研究进展及治疗指导. 中华实验和临床感染病杂志(电子版). 2007;1:188-191. |
| 11. | Cantey JR. Infectious diarrhea. Pathogenesis and risk factors. Am J Med. 1985;78:65-75. [PubMed] [DOI] |
| 12. | Navaneethan U, Giannella RA. Definition, Epidemiology, Pathophysiology, Clinical Classification, and Differential Diagnosis of Diarrhea. Clinical Gastroenterology. 2011;1-31. |
| 13. | Butler T. Loperamide for the treatment of traveler's diarrhea: broad or narrow usefulness? Clin Infect Dis. 2008;47:1015-1016. [PubMed] [DOI] |
| 14. | Diemert DJ. Prevention and self-treatment of traveler's diarrhea. Clin Microbiol Rev. 2006;19:583-594. [PubMed] [DOI] |
| 15. | Schiller LR. Chronic Idiopathic Diarrhea. Clinical Gastroenterology. 2011;311-324. |
| 16. | Schiller LR. Chronic diarrhea. Gastroenterology. 2004;127:287-293. [PubMed] [DOI] |
| 17. | Juckett G, Trivedi R. Evaluation of chronic diarrhea. Am Fam Physician. 2011;84:1119-1126. [PubMed] |
| 18. | Al-Bayatti SM. Etiology of chronic diarrhea. Saudi Med J. 2002;23:675-679. [PubMed] |
| 19. | Camilleri M. Chronic diarrhea: a review on pathophysiology and management for the clinical gastroenterologist. Clin Gastroenterol Hepatol. 2004;2:198-206. [PubMed] [DOI] |
| 20. | Guarino A, Buccigrossi V, Armellino C. Colon in acute intestinal infection. J Pediatr Gastroenterol Nutr. 2009;48 Suppl 2:S58-S62. [PubMed] [DOI] |
| 21. | Chassany O, Michaux A, Bergmann JF. Drug-induced diarrhoea. Drug Saf. 2000;22:53-72. [PubMed] [DOI] |
| 26. | Jentsch TJ, Stein V, Weinreich F, Zdebik AA. Molecular structure and physiological function of chloride channels. Physiol Rev. 2002;82:503-568. [PubMed] [DOI] |
| 29. | Tabcharani JA, Chang XB, Riordan JR, Hanrahan JW. Phosphorylation-regulated Cl- channel in CHO cells stably expressing the cystic fibrosis gene. Nature. 1991;352:628-631. [PubMed] [DOI] |
| 30. | Kunzelmann K, Hübner M, Schreiber R, Levy-Holzman R, Garty H, Bleich M, Warth R, Slavik M, von Hahn T, Greger R. Cloning and function of the rat colonic epithelial K+ channel KVLQT1. J Membr Biol. 2001;179:155-164. [PubMed] [DOI] |
| 31. | Hoogerwerf WA, Tsao SC, Devuyst O, Levine SA, Yun CH, Yip JW, Cohen ME, Wilson PD, Lazenby AJ, Tse CM. NHE2 and NHE3 are human and rabbit intestinal brush-border proteins. Am J Physiol. 1996;270:G29-G41. [PubMed] |
| 32. | Wormmeester L, Sanchez de Medina F, Kokke F, Tse CM, Khurana S, Bowser J, Cohen ME, Donowitz M. Quantitative contribution of NHE2 and NHE3 to rabbit ileal brush-border Na+/H+ exchange. Am J Physiol. 1998;274:C1261-C1272. [PubMed] |
| 34. | Yun CH, Lamprecht G, Forster DV, Sidor A. NHE3 kinase A regulatory protein E3KARP binds the epithelial brush border Na+/H+ exchanger NHE3 and the cytoskeletal protein ezrin. J Biol Chem. 1998;273:25856-25863. [PubMed] [DOI] |
| 35. | Moeser AJ, Nighot PK, Ryan KA, Simpson JE, Clarke LL, Blikslager AT. Mice lacking the Na+/H+ exchanger 2 have impaired recovery of intestinal barrier function. Am J Physiol Gastrointest Liver Physiol. 2008;295:G791-G797. [PubMed] [DOI] |
| 36. | Ledoussal C, Lorenz JN, Nieman ML, Soleimani M, Schultheis PJ, Shull GE. Renal salt wasting in mice lacking NHE3 Na+/H+ exchanger but not in mice lacking NHE2. Am J Physiol Renal Physiol. 2001;281:F718-F727. [PubMed] |
| 37. | Yun CH, Oh S, Zizak M, Steplock D, Tsao S, Tse CM, Weinman EJ, Donowitz M. cAMP-mediated inhibition of the epithelial brush border Na+/H+ exchanger, NHE3, requires an associated regulatory protein. Proc Natl Acad Sci U S A. 1997;94:3010-3015. [PubMed] [DOI] |
| 38. | 王 世农. 钠氢交换调控因子1(NHERF1)的结构与功能. 吉林师范大学学报(自然科学版). 2011;33:39-43. |
| 39. | Hammer HF, Santa Ana CA, Schiller LR, Fordtran JS. Studies of osmotic diarrhea induced in normal subjects by ingestion of polyethylene glycol and lactulose. J Clin Invest. 1989;84:1056-1062. [PubMed] [DOI] |
| 40. | Hammer HF, Fine KD, Santa Ana CA, Porter JL, Schiller LR, Fordtran JS. Carbohydrate malabsorption. Its measurement and its contribution to diarrhea. J Clin Invest. 1990;86:1936-1944. [PubMed] [DOI] |
| 41. | Wapnir RA, Zdanowicz MM, Teichberg S, Lifshitz F. Oral hydration solutions in experimental osmotic diarrhea: enhancement by alanine and other amino acids and oligopeptides. Am J Clin Nutr. 1988;48:84-90. [PubMed] |
| 42. | Go JT, Harper RG, Sia CG, Teichberg S, Wapnir RA. Oral rehydration solutions: increased water and sodium absorption by addition of a viscosity-enhancing agent in a rat model of chronic osmotic diarrhea. J Pediatr Gastroenterol Nutr. 1994;19:410-416. [PubMed] [DOI] |
| 43. | Schiller LR. Secretory diarrhea. Curr Gastroenterol Rep. 1999;1:389-397. [PubMed] [DOI] |
| 44. | Field M. Intestinal ion transport and the pathophysiology of diarrhea. J Clin Invest. 2003;111:931-943. [PubMed] [DOI] |
| 45. | Terrin G, Canani RB. Diarrhea from Enterotoxins. Clinical gastroenterology. 2011;281-298. |
| 48. | Sheppard DN, Welsh MJ. Structure and function of the CFTR chloride channel. Physiol Rev. 1999;79:S23-S45. [PubMed] |
| 49. | Schultz BD, Singh AK, Devor DC, Bridges RJ. Pharmacology of CFTR chloride channel activity. Physiol Rev. 1999;79:S109-S144. [PubMed] |
| 50. | Li H, Cai Z, Chen JH, Ju M, Xu Z, Sheppard DN. The cystic fibrosis transmembrane conductance regulator Cl⁻ channel: a versatile engine for transepithelial ion transport. Sheng Li Xue Bao. 2007;59:416-430. [PubMed] |
| 51. | Berger AL, Ikuma M, Welsh MJ. Normal gating of CFTR requires ATP binding to both nucleotide-binding domains and hydrolysis at the second nucleotide-binding domain. Proc Natl Acad Sci U S A. 2005;102:455-460. [PubMed] [DOI] |
| 52. | Li C, Dandridge KS, Di A, Marrs KL, Harris EL, Roy K, Jackson JS, Makarova NV, Fujiwara Y, Farrar PL. Lysophosphatidic acid inhibits cholera toxin-induced secretory diarrhea through CFTR-dependent protein interactions. J Exp Med. 2005;202:975-986. [PubMed] [DOI] |
| 53. | Li C, Krishnamurthy PC, Penmatsa H, Marrs KL, Wang XQ, Zaccolo M, Jalink K, Li M, Nelson DJ, Schuetz JD. Spatiotemporal coupling of cAMP transporter to CFTR chloride channel function in the gut epithelia. Cell. 2007;131:940-951. [PubMed] [DOI] |
| 54. | Sandle GI, Hunter M. Apical potassium (BK) channels and enhanced potassium secretion in human colon. QJM. 2010;103:85-89. [PubMed] [DOI] |
| 55. | Lomax RB, Warhurst G, Sandle GI. Characteristics of two basolateral potassium channel populations in human colonic crypts. Gut. 1996;38:243-247. [PubMed] [DOI] |
| 56. | Warth R, Barhanin J. Function of K+ channels in the intestinal epithelium. J Membr Biol. 2003;193:67-78. [PubMed] [DOI] |
| 57. | Jespersen T, Grunnet M, Olesen SP. The KCNQ1 potassium channel: from gene to physiological function. Physiology (Bethesda). 2005;20:408-416. [PubMed] [DOI] |
| 58. | Preston P, Wartosch L, Günzel D, Fromm M, Kongsuphol P, Ousingsawat J, Kunzelmann K, Barhanin J, Warth R, Jentsch TJ. Disruption of the K+ channel beta-subunit KCNE3 reveals an important role in intestinal and tracheal Cl- transport. J Biol Chem. 2010;285:7165-7175. [PubMed] [DOI] |
| 59. | van Dinter TG, Fuerst FC, Richardson CT, Ana CA, Polter DE, Fordtran JS, Binder HJ. Stimulated active potassium secretion in a patient with colonic pseudo-obstruction: a new mechanism of secretory diarrhea. Gastroenterology. 2005;129:1268-1273. [PubMed] [DOI] |
| 60. | Blondon H, Béchade D, Desramé J, Algayres JP. Secretory diarrhoea with high faecal potassium concentrations: a new mechanism of diarrhoea associated with colonic pseudo-obstruction? Report of five patients. Gastroenterol Clin Biol. 2008;32:401-404. [PubMed] [DOI] |
| 61. | Murayama K, Nagasaka H, Tsuruoka T, Omata Y, Horie H, Tregoning S, Thorburn DR, Takayanagi M, Ohtake A. Intractable secretory diarrhea in a Japanese boy with mitochondrial respiratory chain complex I deficiency. Eur J Pediatr. 2009;168:297-302. [PubMed] [DOI] |
| 63. | 张 冬梅. 肠致病性大肠杆菌致病机制的研究进展. 国际流行病学传染病学杂志. 2001;28:27-30. |
| 64. | 史 云, 计 融. 肠致病性大肠杆菌的致病因子及致病机制的研究进展. 国外医学·卫生学分册. 2003;30:205-211. |
| 66. | 沈 峰. 小肠细菌过度生长在肠易激综合征发病机制中的作用. 上海交通大学学报(医学版). 2010;30:852-855. |
| 67. | 孙 贵张, 卜 平, 孔 桂美. 溃疡性结肠炎免疫学发病机制进展. 胃肠病学和肝病学杂志. 2008;17:266-269. |
| 69. | Urayama S, Chang EB. Mechanisms and treatment of diarrhea in inflammatory bowel diseases. Inflamm Bowel Dis. 1997;3:114-131. [PubMed] |
| 70. | Amasheh S, Barmeyer C, Koch CS, Tavalali S, Mankertz J, Epple HJ, Gehring MM, Florian P, Kroesen AJ, Zeitz M. Cytokine-dependent transcriptional down-regulation of epithelial sodium channel in ulcerative colitis. Gastroenterology. 2004;126:1711-1720. [PubMed] [DOI] |
| 71. | Sugi K, Musch MW, Field M, Chang EB. Inhibition of Na+,K+-ATPase by interferon gamma down-regulates intestinal epithelial transport and barrier function. Gastroenterology. 2001;120:1393-1403. [PubMed] [DOI] |