修回日期: 2012-01-18
接受日期: 2012-02-21
在线出版日期: 2012-03-08
目的: 评价CT引导下射频消融治疗肝内血管(直径>3 mm)旁转移瘤的疗效及安全性.
方法: 24例单发肝转移瘤患者行RFA治疗(年龄范围: 36-95岁, 男女比例18:6), 所有病灶均在肝内直径>3 mm的血管旁. 肿瘤直径为: 1.7-5.1 cm. 对照组选择同期行RFA的单发肝脏转移瘤患者, 且病灶远离血管或者胆囊等, 共25例. 术后1、3、6、12、24 mo分别行影像学检查随访.
结果: 24例患者共24个病灶接受了治疗. 20例患者(83%)获得了完全的肿瘤坏死. 4例患者出现了病灶周边不规则的强化, 接受了再次治疗. 2年随访肿瘤局部控制率为50%. 试验组仅1例患者出现肝内小血肿, 其余患者均未发生血管相关并发症.
结论: 即使紧邻肝内大血管的转移瘤, 行RFA仍然安全、有效, 并发症少, 肿瘤进展率低.
引文著录: 赵健, 畅智慧, 马羽佳, 单明, 刘兆玉. 射频消融治疗肝内血管旁转移瘤24例. 世界华人消化杂志 2012; 20(7): 615-618
Revised: January 18, 2012
Accepted: February 21, 2012
Published online: March 8, 2012
AIM: To evaluate the efficacy and safety of computed tomography (CT)-guided radiofrequency thermal ablation (RFA) for liver metastases that were in contact with blood vessels.
METHODS: RFA was performed in 24 patients with liver metastases that were in contact with blood vessels (>3 mm in diameter). Tumor diameter ranged from 1.7 to 5.1 cm. Twenty-five patients with liver metastases that were not in contact with blood vessels or cholecyst also underwent RFA and were used as controls. Imaging follow-up was performed at 1, 3, 6, and 12 months post RFA, and every year thereafter.
RESULTS: All of 24 patients were treated for a total of 24 sessions. Complete ablation of the tumor was achieved in 20 (83%) patients, and the remaining 4 (17%) patients showed irregular peripheral enhancement and underwent a second session. At 1-year follow-up, one patient showed a recurrent lesion and a new ablation was performed. The local tumor progression rate at 2-year follow-up was 50%. Complications occurred in only one patient, and he developed a small subcapsular hematoma.
CONCLUSION: RFA is safe and effective even in patients with high risk liver metastases adjacent to large blood vessels and can lead to good results with minimal complications and a low rate of tumor progression.
- Citation: Zhao J, Chang ZH, Ma YJ, Shan M, Liu ZY. Radiofrequency ablation for liver metastases in contact with blood vessels: an analysis of 24 cases. Shijie Huaren Xiaohua Zazhi 2012; 20(7): 615-618
- URL: https://www.wjgnet.com/1009-3079/full/v20/i7/615.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i7.615
肝脏是恶性肿瘤最常见的好发脏器之一[1]. 虽然外科切除仍然是治疗肝癌及肝转移瘤的最佳手段, 但受到肿瘤的大小、位置、患者的身体状况等因素的影响, 事实上仅有5%-20%的肝脏恶性肿瘤患者可行外科手术[2,3]. 近年来, 射频消融(radiofrequency ablation, RFA)治疗肝脏恶性肿瘤以其创伤小、患者痛苦少、安全有效、操作简便等优点在临床应用越来越普遍[4,5]. 目前普遍认为紧靠大血管的病灶不适合射频治疗, 因为血管中血液的流动将会带走部分热量, 热量的散失必将影响疗效. 同时, 这样的病灶在治疗过程中, 电极针的直接损伤以及肿瘤内的热效应间接损伤, 都可以损伤临近的血管. 不过, 已有动物实验表明[6], RFA治疗大血管旁病灶仍有较好的安全性. 2007-12/2010-12共有24例肝内血管旁的转移瘤患者于我科接受射频消融治疗, 本文旨在回顾性分析其疗效及报道其安全性.
2007-12/2010-12, 共有24例肝内血管旁转移瘤患者(共24个病灶)行RFA治疗. 所有患者均不适合或不愿意接受外科手术治疗. 其中男18例、女6例, 年龄范围: 36-95岁, 所有患者均经临床或病理结果证实, 其中原发癌为结直肠癌18例, 胃癌4例, 胰腺癌1例, 子宫内膜癌1例. 病灶最大径为1.7-5.1 cm. 每个病灶均临近肝内直径>3 mm的血管(CT显示肿瘤同血管壁之间无肝实质), 其中6例病灶紧邻下腔静脉, 4例紧邻门脉左支, 2例紧邻门脉右支, 12例病灶紧邻肝静脉. 对照组选择同期行RFA的单发肝转移瘤患者, 且病灶远离血管或者胆囊等, 共25例.
1.2.1 治疗: 所有患者均在CT引导下行RFA治疗, 术前常规进行呼吸训练, CT扫描层厚2.5 mm, 必要性行MPR重建, 将针尖定位于病灶中心, 逐渐展开针, 展开的电极头紧靠血管腔以达到更好的消融效果. 为了防止病灶周边血流的造成热量散失的影响, 我们依据病变情况, 对病灶一次烧灼完成后, 适当调整针尖位置行重复消融, 术闭电凝针道. 对于术前增强CT示血供丰富的病灶, 先行肝动脉化疗栓塞术, 术后1-2 wk内行RFA治疗.
1.2.2 术中及术后观察: 记录患者术中、术后近期及远期的与RFA相关的并发症. 常规随访时间点为术后1 mo、3 mo、6 mo、1年及2年. 随访内容主要为肿瘤标志物及影像学检查.
统计学处理 数据统一采用SPSS13.0进行处理分析. 病例组同对照组进行t检验, 以P<0.05为差异有显著性.
所有患者均能安全平稳完成治疗, 病灶的穿刺次数为1-5次, 其中16例患者为1次穿刺成功. 没有因超出患者的耐受性而终止治疗的病例.
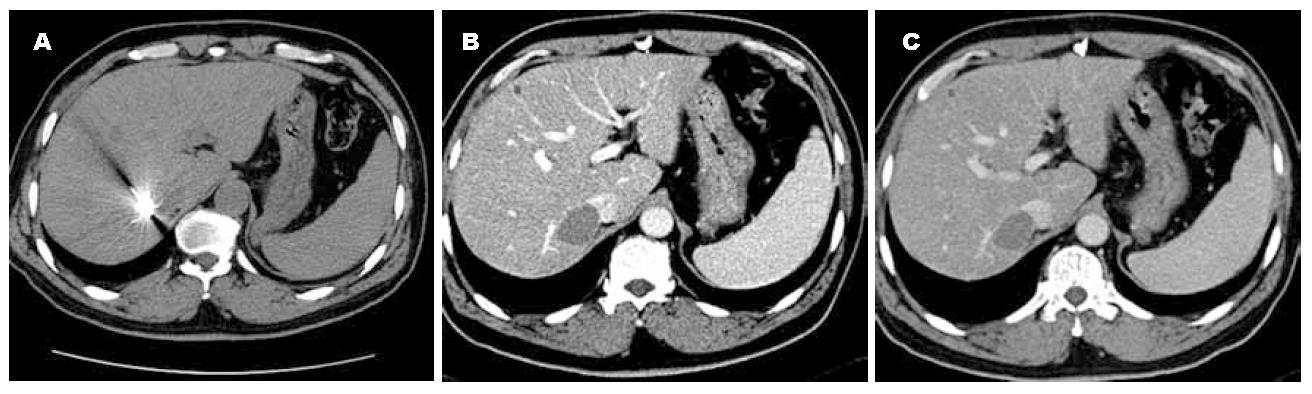
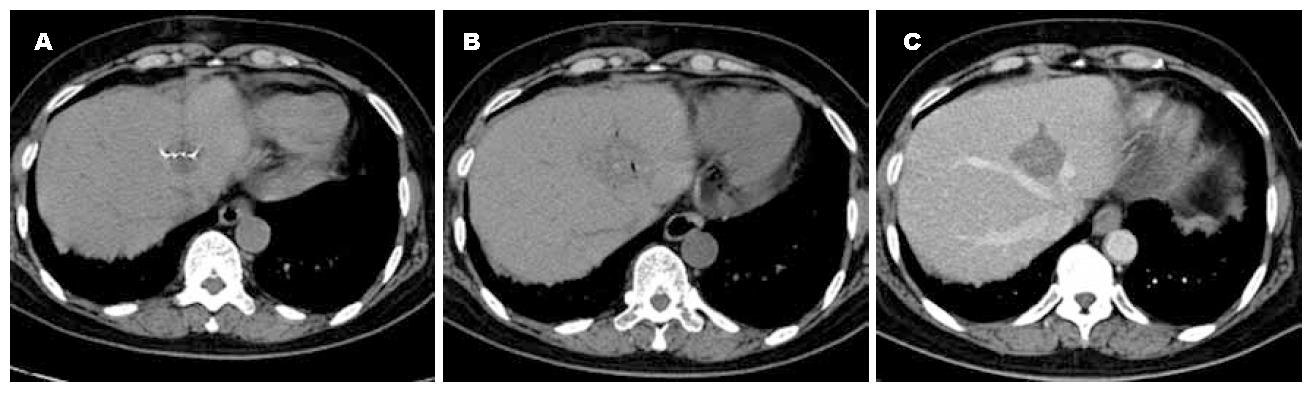
术后即刻CT平扫显示病灶部分或完全的低密度影以及少许气体影, 均未出现血管内的并发症(破裂、血栓形成等). 最终肿瘤坏死的结果依据1 mo时的复查. 20/24患者没有强化, 呈完全坏死, 其余4例可见残留瘤组织, 残留肿瘤强化方式同术前病灶. 这些病灶再次接受RFA治疗(图1, 图2).
24例肝转移瘤患者至今有6例出现肝内多发转移, 2例失访, 8例死亡, 仅8例病情稳定, 未见复发及新发. 病例组与对照组在不同随访时间点, 局部肿瘤控制率上均无差异(表1).
| 随访时间 | 病例组(%) | 对照组(%) | P值 |
| 1 mo | 83.3 | 82.7 | 0.12 |
| 3 mo | 83.3 | 80.0 | 0.08 |
| 6 mo | 79.2 | 77.3 | 0.08 |
| 1年 | 79.2 | 74.7 | 0.06 |
| 2年 | 50.0 | 53.3 | 0.09 |
外科切除是治愈肝脏恶性肿瘤最有效的方法, 20%-35%的患者通过手术能够获得长期生存, 然而, 受到肿瘤位置、数量、肝功能等的影响, 仅有20%左右的患者能够行外科手术[7]. 在过去的20多年里, 射频消融这种微创技术得到了深入发展, 并经受住了临床考验. 其原理为射频发生器能够产生高频射频波, 通过插入肿瘤组织中的电极针发出射频电流, 再经辅助电极形成回路, 通过周围组织中的分子摩擦和离子逸散而产热, 局部温度可达90 ℃-100 ℃, 使得病灶变为一个热凝固体, 其大小应该等于或者大于原病灶[8,9].
许多患者不适合行外科切除就是因为病灶临近重要的血管结构[10], RFA能克服病灶周围血管的影响, 彻底毁损血管旁的病灶吗? 已有研究表明, 受到病灶周围大血管内血流冷却效应的影响, 肿瘤的彻底毁损率较低. Wood等[11]的研究认为肿瘤临近血管使肿瘤无法得到彻底坏死, 局部肿瘤进展率高. Lu等[12]的研究表明, 肿瘤临近直径>3 mm的血管, 是肿瘤无法彻底坏死的重要因素.
彻底消融依靠高的能量凝聚以及高的组织加热. 除了肿瘤接近大血管会导致热量散失外, 肿瘤本身的血管多少也影响热量的凝聚. 血供丰富的转移瘤和肝细胞癌由于本身血管的冷却作用也将导致射频过程中的温度降低[9]. 只有增加消融过程中的热量, 才能克服血管的冷却作用. 对于病灶小于3 cm的, 消融持续10 min后再重复1次, 对于3.1-5.0 cm的, 第1次持续10 min后重复1次, 然后适当调整针尖位置后再次消融, 并再重复1次.
一些研究采用门静脉或肝动脉或两者临时阻断来减少热量的散失, 减少血液流到能够增加消融后的凝固性坏死区域. 不少研究报道了关于单独动脉阻断与动、静脉联合阻断对坏死面积的区别. 临时的血管阻断是一个有创的过程, 在RFA前增加了手术了复杂程度、费用、患者的痛苦[13,14]. 近几年来, TAE联合RFA的报道较多[15-17], 这种方法虽然无法改变肿瘤周围大血管的血流影响, 但可以减少肿瘤内部血流, 并可缩小肿瘤范围.
为了观察肿瘤旁血管对RFA疗效的影响, 我们设立同期行RFA的单发肝脏转移瘤为对照组, 主要比较血管相关并发症发生率及局部肿瘤控制率. 结果表明, 无论在疗效上, 还是在血管相关并发症上, 实验组及对照组均无差异. 这同之前部分研究结果不符, 分析原因主要考虑为, 对于部分原发性肝癌及富血供的肝转移瘤, 我们先行TAE治疗, 减少了肿瘤本身的血供, 也可以缩小肿瘤范围; 其次, 本研究中, 大部分肿瘤最大径<3 cm, 也减少了因肿瘤过大影响肿瘤效果. 另外, 我们还采取了重复消融, 调整针尖位置后再次消融等策略.
总之, RFA治疗肝脏恶性肿瘤是一个安全、有效的方法, 即使对于临近血管的病灶, 仍然可以得到满意的治疗效果. 重复消融、延长消融时间能够避免热量散失而导致的消融不彻底, 且没有严重的血管相关并发症. 对于血供丰富的肿瘤, RFA前可行TAE栓塞血管, 减少肿瘤内部血供. 对每一个病灶进行仔细评估, 认真筛选, 采用个体化的RFA方案, 同样可以有效地治疗血管旁的肝转移瘤, 改善患者预后, 延长患者生存时间.
肝脏是恶性肿瘤最常见的好发脏器之一. 虽然外科切除仍然是治疗肝转移瘤的最佳手段, 但受到肿瘤的大小、位置、患者的身体状况等因素的影响, 事实上仅有5%-20%的肝转移瘤患者可行外科手术.
杜顺达, 副主任医师, 北京协和医院肝胆外科
射频消融治疗肝脏恶性肿瘤以其创伤小、患者痛苦少、安全有效、操作简便等优点在临床应用越来越普遍. 已有动物实验表明, RFA治疗大血管旁病灶仍有较好的安全性.
Lu等的研究表明, 肿瘤临近直径>3 mm的血管, 是肿瘤无法彻底坏死的重要因素.
本研究通过多次加热、多点加热的手段, 有效地提高了射频消融治疗血管旁肿瘤疗效.
本文通过射频消融治疗紧邻大血管的病灶来探讨治疗的可能性, 紧密结合临床前沿, 具有重要的临床指导价值.
编辑: 张姗姗 电编: 何基才
| 2. | Bruinvels DJ, Stiggelbout AM, Kievit J, van Houwelingen HC, Habbema JD, van de Velde CJ. Follow-up of patients with colorectal cancer. A meta-analysis. Ann Surg. 1994;219:174-182. [PubMed] [DOI] |
| 3. | Fong Y, Cohen AM, Fortner JG, Enker WE, Turnbull AD, Coit DG, Marrero AM, Prasad M, Blumgart LH, Brennan MF. Liver resection for colorectal metastases. J Clin Oncol. 1997;15:938-946. [PubMed] |
| 4. | Wong SL, Edwards MJ, Chao C, Simpson D, McMasters KM. Radiofrequency ablation for unresectable hepatic tumors. Am J Surg. 2001;182:552-557. [PubMed] [DOI] |
| 5. | Frericks BB, Ritz JP, Roggan A, Wolf KJ, Albrecht T. Multipolar radiofrequency ablation of hepatic tumors: initial experience. Radiology. 2005;237:1056-1062. [PubMed] [DOI] |
| 7. | Curley SA, Izzo F, Delrio P, Ellis LM, Granchi J, Vallone P, Fiore F, Pignata S, Daniele B, Cremona F. Radiofrequency ablation of unresectable primary and metastatic hepatic malignancies: results in 123 patients. Ann Surg. 1999;230:1-8. [PubMed] [DOI] |
| 8. | Nakazawa T, Kokubu S, Shibuya A, Ono K, Watanabe M, Hidaka H, Tsuchihashi T, Saigenji K. Radiofrequency ablation of hepatocellular carcinoma: correlation between local tumor progression after ablation and ablative margin. AJR Am J Roentgenol. 2007;188:480-488. [PubMed] [DOI] |
| 9. | Thanos L, Mylona S, Galani P, Pomoni M, Pomoni A, Koskinas I. Overcoming the heat-sink phenomenon: successful radiofrequency thermal ablation of liver tumors in contact with blood vessels. Diagn Interv Radiol. 2008;14:51-56. [PubMed] |
| 10. | Wu MC, Shen F. Progress in research of liver surgery in China. World J Gastroenterol. 2000;6:773-776. [PubMed] [DOI] |
| 11. | Wood TF, Rose DM, Chung M, Allegra DP, Foshag LJ, Bilchik AJ. Radiofrequency ablation of 231 unresectable hepatic tumors: indications, limitations, and complications. Ann Surg Oncol. 2000;7:593-600. [PubMed] [DOI] |
| 12. | Lu DS, Raman SS, Limanond P, Aziz D, Economou J, Busuttil R, Sayre J. Influence of large peritumoral vessels on outcome of radiofrequency ablation of liver tumors. J Vasc Interv Radiol. 2003;14:1267-1274. [PubMed] [DOI] |
| 13. | de Baere T, Bessoud B, Dromain C, Ducreux M, Boige V, Lassau N, Smayra T, Girish BV, Roche A, Elias D. Percutaneous radiofrequency ablation of hepatic tumors during temporary venous occlusion. AJR Am J Roentgenol. 2002;178:53-59. [PubMed] [DOI] |
| 14. | Rossi S, Garbagnati F, Lencioni R, Allgaier HP, Marchianò A, Fornari F, Quaretti P, Tolla GD, Ambrosi C, Mazzaferro V. Percutaneous radio-frequency thermal ablation of nonresectable hepatocellular carcinoma after occlusion of tumor blood supply. Radiology. 2000;217:119-126. [PubMed] [DOI] |
| 16. | Veltri A, Moretto P, Doriguzzi A, Pagano E, Carrara G, Gandini G. Radiofrequency thermal ablation (RFA) after transarterial chemoembolization (TACE) as a combined therapy for unresectable non-early hepatocellular carcinoma (HCC). Eur Radiol. 2006;16:661-669. [PubMed] [DOI] |