修回日期: 2012-01-19
接受日期: 2012-02-24
在线出版日期: 2012-03-08
目的: 探讨SOCS2和STAT3蛋白在胃癌组织中的表达及其与胃癌生物学行为的关系.
方法: 应用免疫组织化学方法检测55例胃癌组织和55例正常胃组织中SOCS2和STAT3蛋白的表达情况, 并分析二者与胃癌分化程度、淋巴结转移、浸润深度和临床分期及患者性别、年龄之间的关系, 同时分析二者的相关性.
结果: SOCS2在胃癌组织中的阳性表达率为25.5%, 明显低于正常胃组织中的91.1%(P<0.05), 且表达与分化程度、淋巴结转移、临床分期相关(P<0.05); STAT3在胃癌组织中的阳性表达率为72.7%, 明显高于正常组织的18.2%(P<0.05), 且表达与分化程度、淋巴结转移、浸润深度和临床分期相关(P<0.05), SOCS2与STAT3的表达呈负相关(r = -0.486, P<0.01).
结论: SOCS2在胃癌组织中低表达, STAT3异常活化可促进细胞的过度增殖, 促进胃癌的发展, 二者的相互调节在胃癌发生发展中起重要作用.
引文著录: 闫斌斌, 褚燕君, 李芳芳. SOCS2和STAT3蛋白的表达及其与胃癌生物学行为的关系. 世界华人消化杂志 2012; 20(7): 563-567
Revised: January 19, 2012
Accepted: February 24, 2012
Published online: March 8, 2012
AIM: To investigate the relationship between expression of suppressor of cytokine signaling 2 (SOCS2) and signal transducer and activator of transcription 3 (STAT3) and biological behaviors of gastric carcinoma.
METHODS: The expression of SOCS2 and STAT3 in 55 cases of gastric carcinoma and 55 cases of normal gastric tissue was detected by immunohistochemistry. The correlation of SOCS2 and STAT3 expression with tumor differentiation grade, lymph node metastasis, depth of invasion, clinical stage and patients' gender and age was analyzed.
RESULTS: The positive rate of SOCS2 expression in gastric carcinoma was significantly lower than that in normal gastric tissues (25.5% vs 91.1%, P < 0.05). SOCS2 expression in gastric carcinoma was significantly associated with tumor differentiation grade, lymph node metastasis and clinical stage (all P < 0.05). The positive rate of STAT3 expression in gastric carcinoma was significantly higher than that in normal gastric tissue (72.7% vs 18.2%, P < 0.05). STAT3 expression in gastric carcinoma was significantly associated with tumor differentiation grade, lymph node metastasis, depth of invasion, and clinical stage (all P < 0.05). There was a significant negative relation between the expression of SOCS2 and that of STAT3 in gastric carcinoma (r = -0.486, P < 0.01).
CONCLUSION: SOCS2 is lowly expressed in gastric carcinoma, while STAT3 is highly expressed in gastric carcinoma. Interaction between SOCS2 and STAT3 may contribute to gastric carcinogenesis.
- Citation: Yan BB, Chu YJ, Li FF. Relationship between expression of SOCS2 and STAT3 and biologic behaviors of gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(7): 563-567
- URL: https://www.wjgnet.com/1009-3079/full/v20/i7/563.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i7.563
胃癌是目前全球范围内发病率和死亡率均较高的恶性肿瘤之一, 但其确切的发病机制仍不明确. 细胞信号通路的异常在胃癌发生中起着至关重要的作用, 细胞因子信号转导抑制因子2(suppressor of cytokine signaling, SOCS2)是JAK-STAT通路中重要的抑制子, 但在肿瘤发生、发展中是促进还是抑制作用仍不明确[1,2], 且在胃癌中研究罕见. 信号转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)被认为是一种癌基因, 其持续激活导致细胞异常增殖和恶性转化[3-5]. 本研究通过免疫组织化学方法检测胃癌组织中SOCS2和STAT3的表达, 并研究两者在胃癌发生中的相互作用, 期望为胃癌的发生发展提供理论依据.
参照"全国胃癌诊治规范", 选取2010-01/2011-04郑州大学第一附属医院胃肠外科行胃癌根治术并均经术后病理检查证实为胃癌标本55例, 相应的癌旁正常组织(距肿瘤边缘≥5 cm)55例. 所有患者术前均未予放化疗, 其中男35例, 女20例; 年龄27-69(中位年龄51)岁; 中高分化腺癌24例, 低分化腺癌31例; 浸润深度T1/T2者16例, T3/T4者39例; 无淋巴结转移者25例, 有淋巴结转移者30例; 胃癌的临床分期按国际抗癌联盟新TNM分期: Ⅰ期+Ⅱ期28例, Ⅲ期27例. SOCS2抗体、STAT3抗体和免疫组织化学SP试剂盒均购自北京博奥森生物技术有限公司; DAB染色剂试剂盒购自北京中杉金桥生物技术有限公司; 所有标本均做苏木素染色.
1.2.1 免疫组织化学染色: 采用免疫组织化学SP法, 一抗选用SOCS2兔抗人多克隆抗体(稀释度为1:100)和STAT3兔抗人多克隆抗体(稀释度为1:100). 用SP法免疫组织化学检测试剂盒操作, 操作步骤根据试剂盒说明进行, 每组试验均以PBS代替一抗作为阴性对照.
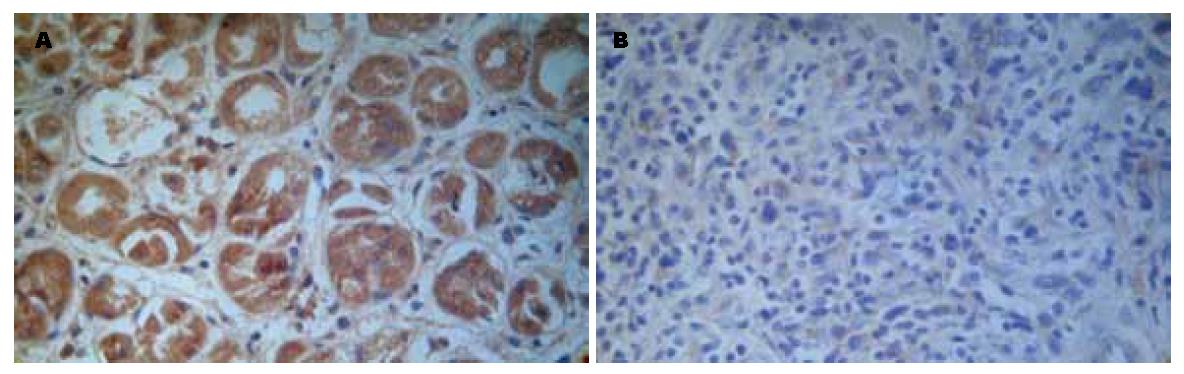
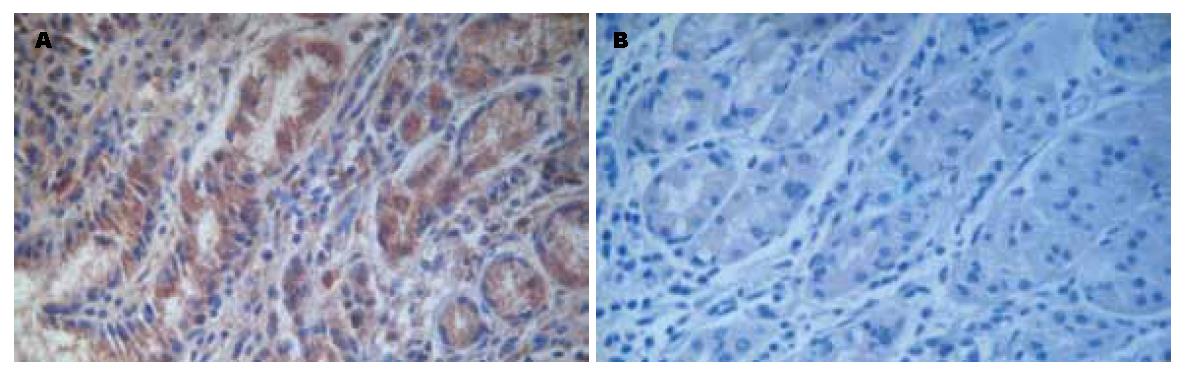
1.2.2 实验结果判定: SOCS2蛋白以细胞质染棕黄色为阳性细胞, STAT3蛋白以细胞质或细胞核染棕黄色为阳性细胞. 首先在低倍镜下选取具有代表意义的视野, 然后高倍镜下进行计数, 每例计数5个高倍视野, 至少1 000个细胞, 然后计算阳性细胞占总细胞数的百分率, 以阳性细胞数大于5%为阳性标准.
统计学处理 采用SPSS17.0统计软件包进行统计学分析, 计数资料采用四格表c2检验, 相关性采用Spearman相关分析, 检验水准为a = 0.05.
SOCS2定位于细胞质中(图1), SOCS2在胃癌组织中的阳性表达率为25.5%, 明显低于正常胃组织中的91.1%, 差异有统计学意义(c2 = 49.230, P<0.05, 表1). SOCS2在不同年龄组、性别组、浸润深度组的表达差异无统计学意义(P>0.05), 中高分化组的表达明显高于低分化组, 无淋巴结转移组明显高于有淋巴结转移组, TNM分期Ⅰ期+Ⅱ期的表达明显高于Ⅲ期, 差异有统计学意义(P<0.05, 表2).
| 分组 | SOCS2阳性表达 | STAT3阳性表达 | ||||||
| n | 表达率% | χ2值 | P值 | n | 表达率% | χ2值 | P值 | |
| 胃癌组织 | 14 | 25.5 | 49.230 | <0.05 | 40 | 72.7 | 33.000 | <0.05 |
| 正常组织 | 51 | 91.1 | 10 | 18.2 | ||||
| 临床病理因素 | n | SOCS2阳性表达 | STAT3阳性表达 | ||||||
| n | 表达率% | χ2值 | P值 | n | 表达率% | χ2值 | P值 | ||
| 性别 | |||||||||
| 男 | 35 | 8 | 22.9 | 0.342 | 0.559 | 26 | 74.2 | 0.118 | 0.731 |
| 女 | 20 | 6 | 30.0 | 14 | 70.0 | ||||
| 年龄(岁) | |||||||||
| ≤50 | 17 | 5 | 29.4 | 0.203 | 0.652 | 11 | 64.7 | 0.320 | 0.572 |
| >50 | 38 | 9 | 23.7 | 29 | 76.3 | ||||
| 分化程度 | |||||||||
| 中、高分化 | 24 | 10 | 41.7 | 5.898 | 0.015 | 13 | 54.2 | 7.396 | 0.007 |
| 低分化 | 31 | 4 | 12.9 | 27 | 87.1 | ||||
| 浸润深度 | |||||||||
| T1/T2 | 16 | 3 | 18.8 | 0.535 | 0.465 | 8 | 50.0 | 4.371 | 0.037 |
| T3/T4 | 39 | 11 | 28.2 | 32 | 82.1 | ||||
| 淋巴结转移 | |||||||||
| 无 | 25 | 10 | 40.0 | 5.110 | 0.024 | 14 | 56.0 | 6.464 | 0.011 |
| 有 | 30 | 4 | 13.3 | 26 | 86.7 | ||||
| TNM分期 | |||||||||
| Ⅰ-Ⅱ期 | 28 | 12 | 42.9 | 9.103 | 0.003 | 17 | 60.7 | 4.150 | 0.042 |
| Ⅲ期 | 27 | 2 | 7.4 | 23 | 85.2 | ||||
STAT3主要定位于细胞质中, 部分在细胞核中有表达(图2), STAT3在胃癌组织中的阳性表达率为72.7%, 明显高于正常组织的18.2%, 差异有统计学意义(c2 = 33.000, P<0.05, 表1). STAT3在不同性别和年龄组的表达差异无统计学意义(P>0.05), 中高分化组的表达明显低于低分化组, 浸润深度T1/T2组的表达明显低于T3/T4组, 无淋巴结转移组的表达明显低于有淋巴结转移组, TNM分期Ⅰ期+Ⅱ期的表达明显低于Ⅲ期, 差异均有统计学意义(P<0.05, 表2).
SOCS蛋白在JAK-STAT信号通路活化过程中起着重要的负性调控作用, SOCS2是SOCS家族中重要的成员之一. 目前SOCS1和SOCS3在多种肿瘤中的作用已得到一定证实[6,7], SOCS2在肿瘤发生发展中起促进作用还是抑制作用不十分明确. Raccurl等[2]通过对乳腺癌细胞和乳腺肿瘤组织的研究发现, SOCS2是高表达的, 可能与肿瘤的发生有关; 而Sutherland等[8]发现SOCS2在乳腺癌细胞中表现为生长抑制作用; 原发性卵巢癌中同样有SOCS2基因的甲基化而沉默. Farabegoli等[9]运用免疫组织化学和免疫荧光原位杂交的方法分析50例术前未行新辅助化疗的乳腺癌患者的临床病理标本后发现: SOCS2的丢失与乳腺癌细胞的生长、扩增相关, 但SOCS2在胃癌组织中研究罕见, 本研究显示SOCS2蛋白在胃癌组织中的表达明显低于正常组织, 起抑癌作用.
SOCS2基因定位于12q21.3-q23区, 编码198个氨基酸. SOCS2的负性调节角色与生长激素(growth hormone, GH)、类胰岛素生长因子1受体(insulin like growth factors-1 receptor, IGF-1R)等密切相关[10-12], 其激活可能有潜在抑癌作用. 另外研究发现, 体内有益菌可通过激活SOCS2蛋白, 抑制JAK2的表达, 发挥其抗幽门螺杆菌(Helicobacter pylori, H. pylori)作用[13,14], 提示SOCS2的激活可能存在抑制H. pylori的作用, 而H. pylori被公认为一种致癌因子, 是胃癌的发病因素之一, SOCS2起抑癌作用可能与其抑制H. pylori有关. 但研究显示, SOCS2对GH信号转导可能有双重作用, 失活和过表达能增加生长信号, 促进生长; 生理情况下则抑制GH[15], 加之该通路中STAT3的激活部分负反馈激活SOCS2的表达, 可能与其在肿瘤组织中有强阳性表达有关, 本研究显示在胃癌组织中有SOCS2的强阳性表达. 研究发现, SOCS2在雌二醇的作用下抑制GH的作用可能更强[16], 但本研究显示女性胃癌患者中SOCS2的表达并不高于男性组, 推测雌激素在胃癌的发生中并不起主要作用, 亦可能与胃癌组织中雌激素受体表达率低有关[17,18], 因此针对雌激素的内分泌治疗有待进一步探讨[19,20].
STAT3是一类关键性的核转录因子, 研究已证实STAT3的持续激活、表达水平升高以及核异位与许多恶性肿瘤的发生、发展相关, 其作为一种癌基因的观点也得到了广泛的支持[21-24]. 多项研究已证实, STAT3在胃癌组织中的同样高表达[25-29]. 本研究结果也证实胃癌组织中存在STAT3高表达, 并且与胃癌的TNM分期、浸润深度、淋巴结转移及肿瘤分级密切相关, 与以往研究结果一致.
本研究还显示, 胃癌组织中SOC2的表达与STAT3的表达呈负相关, 研究表明, SOCS2基因和STAT3基因分别位于JAK-STAT信号转导通路的上下游[30], SOCS2可抑制细胞因子与相应受体的结合, 抑制与STAT3相应的JAK的激活, 从而起到抑制STAT3的作用[31]; 而STAT3的激活同样可以通过负反馈机制激活SOCS2, 这可能与胃癌组织中同样有SOCS2的激活有关. 因此研究某些药物针对STAT3诱导或增强SOCS2蛋白的表达, 可能会阻止信号分子的转导, 起到抑制肿瘤发生、发展的作用.
感谢郭迎迎、杜兰霞同志在本实验中给予的大力帮助.
胃癌是目前全球范围内发病率和死亡率均较高的恶性肿瘤之一, 确切的发病机制仍不明确, 进一步研究胃癌的发生机制, 将为胃癌的诊断治疗提供理论依据.
傅春彬, 吉化集团公司总医院消化内科
SOCS2是JAK-STAT通路中重要的抑制子, 但是在肿瘤发生、发展中是促进还是抑制作用仍不明确, 且在胃癌中研究罕见. STAT3被认为是一种癌基因, 其持续激活导致细胞异常增殖和恶性转化.
Haffner等采用RT-PCT、免疫印迹、免疫组织化学方法对乳腺癌组织进行研究, 发现SOCS2在乳腺正常组织的表达高于乳腺癌组织.
SOCS2蛋白在胃癌中的研究罕见, 本研究联合检测SOCS2及STAT3蛋白在胃癌组织中的表达, 从而在蛋白水平探讨二者与胃癌临床病理因素之间的关系, 为判断胃癌的生物学行为提供理论依据.
本研究对SOCS2及STAT3蛋白在胃癌中的表达及二者相关性研究, 发现二者在胃癌的发生发展中所起的作用, 从而对胃癌的临床病理诊断提供理论依据.
本研究学术价值好, 可指导临床病理检查诊断胃癌的可靠性.
编辑: 张姗姗 电编: 何基才
| 1. | Haffner MC, Petridou B, Peyrat JP, Révillion F, Müller-Holzner E, Daxenbichler G, Marth C, Doppler W. Favorable prognostic value of SOCS2 and IGF-I in breast cancer. BMC Cancer. 2007;7:136. [PubMed] [DOI] |
| 2. | Raccurt M, Tam SP, Lau P, Mertani HC, Lambert A, Garcia-Caballero T, Li H, Brown RJ, McGuckin MA, Morel G. Suppressor of cytokine signalling gene expression is elevated in breast carcinoma. Br J Cancer. 2003;89:524-532. [PubMed] [DOI] |
| 3. | Gao L, Zhang L, Hu J, Li F, Shao Y, Zhao D, Kalvakolanu DV, Kopecko DJ, Zhao X, Xu DQ. Down-regulation of signal transducer and activator of transcription 3 expression using vector-based small interfering RNAs suppresses growth of human prostate tumor in vivo. Clin Cancer Res. 2005;11:6333-6341. [PubMed] [DOI] |
| 4. | Snyder M, Huang XY, Zhang JJ. Signal transducers and activators of transcription 3 (STAT3) directly regulates cytokine-induced fascin expression and is required for breast cancer cell migration. J Biol Chem. 2011;286:38886-38893. [PubMed] [DOI] |
| 5. | Bromberg JF, Wrzeszczynska MH, Devgan G, Zhao Y, Pestell RG, Albanese C, Darnell JE. Stat3 as an oncogene. Cell. 1999;98:295-303. [PubMed] [DOI] |
| 6. | Mallette FA, Calabrese V, Ilangumaran S, Ferbeyre G. SOCS1, a novel interaction partner of p53 controlling oncogene-induced senescence. Aging (Albany NY). 2010;2:445-452. [PubMed] [DOI] |
| 7. | Pierconti F, Martini M, Pinto F, Cenci T, Capodimonti S, Calarco A, Bassi PF, Larocca LM. Epigenetic silencing of SOCS3 identifies a subset of prostate cancer with an aggressive behavior. Prostate. 2011;71:318-325. [PubMed] [DOI] |
| 8. | Sutherland KD, Lindeman GJ, Choong DY, Wittlin S, Brentzell L, Phillips W, Campbell IG, Visvader JE. Differential hypermethylation of SOCS genes in ovarian and breast carcinomas. Oncogene. 2004;23:7726-7733. [PubMed] [DOI] |
| 9. | Farabegoli F, Ceccarelli C, Santini D, Taffurelli M. Suppressor of cytokine signalling 2 (SOCS-2) expression in breast carcinoma. J Clin Pathol. 2005;58:1046-1050. [PubMed] [DOI] |
| 10. | Metcalf D, Greenhalgh CJ, Viney E, Willson TA, Starr R, Nicola NA, Hilton DJ, Alexander WS. Gigantism in mice lacking suppressor of cytokine signalling-2. Nature. 2000;405:1069-1073. [PubMed] [DOI] |
| 11. | Vesterlund M, Zadjali F, Persson T, Nielsen ML, Kessler BM, Norstedt G, Flores-Morales A. The SOCS2 ubiquitin ligase complex regulates growth hormone receptor levels. PLoS One. 2011;6:e25358. [PubMed] [DOI] |
| 12. | Isshiki K, He Z, Maeno Y, Ma RC, Yasuda Y, Kuroki T, White GS, Patti ME, Weir GC, King GL. Insulin regulates SOCS2 expression and the mitogenic effect of IGF-1 in mesangial cells. Kidney Int. 2008;74:1434-1443. [PubMed] [DOI] |
| 13. | Lee JS, Paek NS, Kwon OS, Hahm KB. Anti-inflammatory actions of probiotics through activating suppressor of cytokine signaling (SOCS) expression and signaling in Helicobacter pylori infection: a novel mechanism. J Gastroenterol Hepatol. 2010;25:194-202. [PubMed] [DOI] |
| 14. | Kim KK, Kim HB. Protein interaction network related to Helicobacter pylori infection response. World J Gastroenterol. 2009;15:4518-4528. [PubMed] [DOI] |
| 15. | Greenhalgh CJ, Metcalf D, Thaus AL, Corbin JE, Uren R, Morgan PO, Fabri LJ, Zhang JG, Martin HM, Willson TA. Biological evidence that SOCS-2 can act either as an enhancer or suppressor of growth hormone signaling. J Biol Chem. 2002;277:40181-40184. [PubMed] [DOI] |
| 16. | Leung KC, Doyle N, Ballesteros M, Sjogren K, Watts CK, Low TH, Leong GM, Ross RJ, Ho KK. Estrogen inhibits GH signaling by suppressing GH-induced JAK2 phosphorylation, an effect mediated by SOCS-2. Proc Natl Acad Sci U S A. 2003;100:1016-1021. [PubMed] [DOI] |
| 17. | Kominea A, Konstantinopoulos PA, Kapranos N, Vandoros G, Gkermpesi M, Andricopoulos P, Artelaris S, Savva S, Varakis I, Sotiropoulou-Bonikou G. Androgen receptor (AR) expression is an independent unfavorable prognostic factor in gastric cancer. J Cancer Res Clin Oncol. 2004;130:253-258. [PubMed] [DOI] |
| 18. | Motohashi M, Wakui S, Muto T, Suzuki Y, Shirai M, Takahashi H, Hano H. Cyclin D1/cdk4, estrogen receptors α and β, in N-methyl-N'-nitro-N-nitrosoguanidine-induced rat gastric carcinogenesis: immunohistochemical study. J Toxicol Sci. 2011;36:373-378. [PubMed] [DOI] |
| 20. | Amegbegnuie Komlan Agbessi, 蔡端, 朱虹光, 张延龄. 胃癌雌激素受体表达及新一代抗受体药物在胃癌治疗中的探讨. 复旦学报(医学版). 2002;29:379-382. |
| 21. | Wu WY, Li J, Wu ZS, Zhang CL, Meng XL. STAT3 activation in monocytes accelerates liver cancer progression. BMC Cancer. 2011;11:506. [PubMed] [DOI] |
| 22. | Mora LB, Buettner R, Seigne J, Diaz J, Ahmad N, Garcia R, Bowman T, Falcone R, Fairclough R, Cantor A. Constitutive activation of Stat3 in human prostate tumors and cell lines: direct inhibition of Stat3 signaling induces apoptosis of prostate cancer cells. Cancer Res. 2002;62:6659-6666. [PubMed] |
| 23. | 童 强, 舒 晓刚, 卢 晓明, 黎 维勇, 陶 凯雄, 陈 道达, 王 国斌. shRNA干扰STAT3基因表达对胃癌细胞MKN-45体内外生物学特性的影响. 世界华人消化杂志. 2008;16:1568-1572. [DOI] |
| 24. | Niu G, Wright KL, Huang M, Song L, Haura E, Turkson J, Zhang S, Wang T, Sinibaldi D, Coppola D. Constitutive Stat3 activity up-regulates VEGF expression and tumor angiogenesis. Oncogene. 2002;21:2000-2008. [PubMed] [DOI] |
| 25. | Gong W, Wang L, Yao JC, Ajani JA, Wei D, Aldape KD, Xie K, Sawaya R, Huang S. Expression of activated signal transducer and activator of transcription 3 predicts expression of vascular endothelial growth factor in and angiogenic phenotype of human gastric cancer. Clin Cancer Res. 2005;11:1386-1393. [PubMed] [DOI] |
| 26. | Jackson CB, Giraud AS. STAT3 as a prognostic marker in human gastric cancer. J Gastroenterol Hepatol. 2009;24:505-507. [PubMed] [DOI] |
| 28. | Lee J, Kang WK, Park JO, Park SH, Park YS, Lim HY, Kim J, Kong J, Choi MG, Sohn TS. Expression of activated signal transducer and activator of transcription 3 predicts poor clinical outcome in gastric adenocarcinoma. APMIS. 2009;117:598-606. [PubMed] [DOI] |
| 30. | Duronio V, Scheid MP, Ettinger S. Downstream signalling events regulated by phosphatidylinositol 3-kinase activity. Cell Signal. 1998;10:233-239. [PubMed] [DOI] |
| 31. | Kim DY, Cha ST, Ahn DH, Kang HY, Kwon CI, Ko KH, Hwang SG, Park PW, Rim KS, Hong SP. STAT3 expression in gastric cancer indicates a poor prognosis. J Gastroenterol Hepatol. 2009;24:646-651. [PubMed] [DOI] |