修回日期: 2012-01-29
接受日期: 2012-02-27
在线出版日期: 2012-02-28
目的: 建探讨外源性一氧化碳(carbonmonoxide, CO)对小肠缺血再灌注(intestinal ischemia-reperfusion, IIR)所致多器官损伤防治作用的机制.
方法: ♂Wistar大鼠64只, 随机分为8组, 给予不同实验方法处理: A组: 假手术对照组, 不阻断肠系膜上动脉(superior mesenteric artery, SMA), 其余手术过程同其他组; B组: 小肠缺血再灌注组, 经T型管吸入空气; C组: 缺血前10 min CO吸入组, 按吸入CO浓度(100 μL/L, 250 μL/L)分为两个亚组(C1组和C2组); D组: 再灌注开始时CO吸入组, 按吸入CO浓度(
100 μL/L, 250 μL/L)分为两个亚组(D1组和D2组); E组: 再灌注后60 min CO吸入组, 按吸入CO浓度(100 μL/L, 250 μL/L)分为两个亚组(E1组和E2组). 实验结束时取不同组织以免疫蛋白印迹杂交法检测p38 MAPKs的密度表达.
结果: 与对照组A组比较, 单纯IIR的B组的小肠、肺、肝组织中p38 MAPKs蛋白表达升高, 但不显著(0.468±0.213 vs 0.474±0.151; 0.439±0.111 vs 0.482±0.103; 0.622±0.112 vs 0.654±0.016, all P>0.05); 与单纯IIR的B组比较, 外源性应用CO的C1、C2、D1、D2、E1、E2组的小肠、肺、肝组织中p38 MAPKs蛋白表达均明显增高(1.540±0.346, 1.626±0.277, 1.365±0.233, 1.483±0.265, 1.353±0.234, 1.372±0.2731 vs 0.474±0.151; 1.654±0.211, 1.701±0.101, 1.398±0.245, 1.444±0.272, 1.288±0.218, 1.366±0.244 vs 0.482±0.103; 1.695±0.234, 1.723±0.213, 1.423±0.221, 1.586±0.254, 1.322±0.261, 1.411±0.296 vs 0.654±0.016, 均P<0.05).
结论: 调节细胞内p38 MAPKs表达是外源性CO防治IIR所致多器官损伤作用的分子生物学基础之一.
引文著录: 韩宁, 金振疆, 祖剑宇. 外源性一氧化碳对小肠缺血再灌注大鼠不同组织p38 MAPKs蛋白表达的影响. 世界华人消化杂志 2012; 20(6): 505-508
Revised: January 29, 2012
Accepted: February 27, 2012
Published online: February 28, 2012
AIM: To investigate the possible mechanism underlying the preventive effect of exogenous carbon monoxide (CO) on multiple organ injury induced by intestinal ischemia-reperfusion (IIR) in rats.
METHODS: Sixty-four male Wistar rats were randomly and equally allocated into eight groups. IIR was induced in rats by clamping the superior mesenteric artery (SMA) for 60 min and reperfusing for 120 min. Group A and sham operation did not undergo SMA clamping. Group B underwent SMA clamping for 60 min and reperfusing for 120 min. Groups C1/C2, D1/D2, and E1/E2 inhaled 100 and 250 µL/L CO 10, 60 min before SMA clamping and 60 min after reperfusion, respectively. The expression of p38 mitogen-activated protein kinases (MAPKs) in different tissues was detected by Western blot.
RESULTS: Compared to Group A, the expression of p38 MAPKs in the intestine, lung and liver increased in Group B, but the differences were not significant (0.468 ± 0.213 vs 0.474 ± 0.151; 0.439 ± 0.111 vs 0.482 ± 0.103; 0.622 ± 0.112 vs 0.654 ± 0.016, all P > 0.05). Compared to Group B, a marked increase in p38 MAPKs expression in the intestine, lung and liver was detected in Groups C1/C2, D1/D2, and E1/E2 (1.540 ± 0.346, 1.626 ± 0.277, 1.36 5± 0.233, 1.483 ± 0.265, 1.353 ± 0.234, 1.372 ± 0.2731 vs 0.474 ± 0.151; 1.654 ± 0.211, 1.701 ± 0.101, 1.398 ± 0.245, 1.444 ± 0.272, 1.288 ± 0.218, 1.366 ± 0.244 vs 0.482 ± 0.103; 1.695 ± 0.234, 1.723 ± 0.213, 1.423 ± 0.221, 1.586 ± 0.254, 1.322 ± 0.261, 1.411 ± 0.296 vs 0.654 ± 0.016, all P < 0.05).
CONCLUSION: Exogenous CO provides protection against IIR-induced multiple organ injury possibly by modulating the expression of p38 MAPKs in rats.
- Citation: Han N, Jin ZJ, Zu JY. Effects of exogenous carbon monoxide on p38 MAPKs expression in rats with intestinal ischemia reperfusion injury. Shijie Huaren Xiaohua Zazhi 2012; 20(6): 505-508
- URL: https://www.wjgnet.com/1009-3079/full/v20/i6/505.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i6.505
小肠缺血再灌注(intestinal ischemia-reperfusion, IIR)过程中, 外界刺激信号经过细胞内各种信号转导通路向细胞核介导可导致多种细胞因子在小肠局部及全身大量释放. 这些细胞因子能互为因果的引起全身炎症反应综合征(systemic inflammation response syndrome, SIRS), 而促炎因子与抑炎因子的严重失衡是最终导致多器官损伤的重要因素之一[1,2]. 丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)现被证明是介导细胞外信号引起核反应的共同通路和汇聚点[3]. 而过去一直被认为是一种毒性气体的CO, 现在经研究被发现其作为一种细胞信使在人体各种生理和病理过程中发挥着重要调节作用[4]. 本研究通过建立大鼠IIR模型, 观察外源性应用CO对大鼠不同组织内p38 MAPKs表达的影响, 进一步探讨外源性CO对 IIR所致多器官损伤防治作用的机制.
64只体质量220-260 g健康的♂Wistar大鼠由中国医科大学实验动物中心提供, 标准CO气体由大连大特气体有限公司提供(压力9.0 MPa, 浓度250×10-6/100×10-6, 空气平衡), UP200H型组织超声匀浆器, BIO-RAD-PAC300型电泳仪, BIO-RAD MiniPROTEANⅡ cell型垂直电泳槽, GIS-2020型凝胶扫描成像分析系统由美国提供, Tanon小型转印电泳槽由上海天能公司提供; B-D微量输液泵、B-D动静脉留置套管针由美国提供.
1.2.1 动物模型制作: 大鼠实验前禁食12 h, 自由饮水. 采用肠系膜上动脉(superior mesenteric artery, SMA)夹闭-开放方式复制IIR模型[5]. 大鼠ip. 乌拉坦(1.0 g/kg)麻醉, 开放股静脉持续微泵输注乳酸钠林格氏液10 mL/(kg•h). 行颈动脉置管(用于测定动脉压及采血), 气管切开插管后接带单向活瓣T型管(活瓣能保证吸入气为所需气体, 呼出气进入大气), 保留自主呼吸. 常规消毒后取腹正中切口3-4 cm, 游离肠系膜上动脉, 血压平稳10 min后行显微手术用无损伤动脉夹关闭SMA起始部, 造成肠缺血; 缝合切口, 60 min后经原切口入腹腔, 去除动脉夹, 恢复小肠血供120 min, 即为IIR模型.
1.2.2 分组: 将大鼠随机分为8组, 每组8只. A组: 假手术对照组, 不阻断SMA, 其余手术过程同其他组; B组: 小肠缺血再灌注组, 经T型管吸入空气; C组: 缺血前10 min CO吸入, 按吸入CO浓度(100 μL/L, 250 μL/L)分为2个亚组(C1组和C2组); D组: 再灌注开始时CO吸入组, 按吸入CO浓度(100 μL/L, 250 μL/L)分为2个亚组(D1组和D2组); E组: 再灌注后60 min CO吸入组, 按吸入CO浓度(100 μL/L, 250 μL/L)分为2个亚组(E1组和E2组).
1.2.3 组织中p38 MAPKs的蛋白表达: 采用免疫蛋白印迹杂交法(Western blot)检测. 样品处理: 肠、肺、肝组织标本用生理盐水冲净后剪碎, 加入6倍体积的细胞裂解液A匀浆, 4 ℃ 17 500 r/min离心2 h, 上清为胞浆蛋白样品. 沉淀(膜的成分)加入1 mL细胞裂解液B在冰水中匀浆, 超声粉碎20 s, 间隔20 s, 2-3次, 静置4 ℃过夜后, 4 ℃ 17 500 r/min离心1.5 h, 取上清为胞膜蛋白样品. Lorry法蛋白定量: 各取样品50 μL蛋白定量, 以浓度最底管为基准, 调节蛋白浓度, 加5×样品缓冲液, 煮沸3-5 min. 转膜与洗膜: 60 V电泳至染料带进入分离胶后100 V电泳2-3 h, 转印(海绵-滤纸-NC膜-凝胶-滤纸-海绵). 100 V 40-50 min. NC膜在1×TBS中浸泡10 min, 封闭1 h, 1×TTBS洗膜2次, 每次5 min. 一抗孵育: NC膜在一抗溶液中浸泡过夜(4 ℃). NC膜从一抗溶液中取出, 用1×TBS快速洗一次, 用1×TTBS洗膜2次, 每次5 min. 二抗孵育: NC膜转到二抗溶液中浸泡2 h(室温), 1×TTBS洗膜2次, 每次5 min, 1×TBS洗膜5 min, 染色至条带呈现, 终止染色. NC膜在滤纸中干燥保存. 蛋白检测: 用GIS-2020凝胶图象分析系统扫描分析结果.
统计学处理 数据以mean±SD表示. 采用SPSS13.0专业统计软件对数据进行单因素方差分析和t检验, P<0.05为差异有统计学意义.
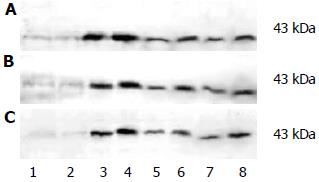
组织中p38 MAPKs蛋白的表达(图1). 与对照组A组比较, 单纯IIR的B组p38 MAPKs蛋白表达升高, 但不显著(P>0.05); 外源性应用CO的C、D、E组p38 MAPKs蛋白表达均明显高于单纯IIR的B组(P<0.05); C、D、E各组内亚组比较, 2组均高于1组(P<0.05, 表1).
| 分组 | A | B | C1 | C2 | D1 | D2 | E1 | E2 |
| 小肠 | 0.468± 0.213 | 0.474± 0.151 | 1.540± 0.346 | 1.626± 0.277 | 1.365± 0.233 | 1.483± 0.265 | 1.353± 0.234 | 1.372± 0.273 |
| 肺 | 0.439± 0.111 | 0.482± 0.103 | 1.654± 0.211 | 1.701± 0.101 | 1.398± 0.245 | 1.444± 0.272 | 1.288± 0.218 | 1.366± 0.244 |
| 肝脏 | 0.622± 0.112 | 0.654± 0.016 | 1.695± 0.234 | 1.723± 0.213 | 1.423± 0.221 | 1.586± 0.254 | 1.322± 0.261 | 1.411± 0.296 |
IIR是临床常见的病理生理现象, 严重IIR可最终导致多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的形成[1,2]. 如何有效地防治MODS的发生和发展一直是临床工作所关注的重要课题. 近年来已经有越来越多的研究发现, 过去一直认为CO是毒性气体分子, 而现在发现他作为一种细胞信使分子在生物体内具有舒张血管和支气管平滑肌、抑制血小板聚集、抑制炎症反应、抗凋亡、抗增殖等多种生理学作用[4,6,7], 在神经、呼吸、循环等生理过程和抑制急性肺损伤、脏器缺血再灌注损伤、器官移植排斥反应等病理过程中发挥重要调节作用[8-12]. 我们以前的研究已经表明, IIR能引起包括肠、肺、肝等在内的多器官损伤; 而在IIR不同阶段外源性应用CO对器官损伤能表现出不同程度的防治作用, 其作用机制可能是通过抑制IIR过程中PMN在组织中的聚集, 抑制TNF-α产生和促进IL-10释放实现的[13-15].
TNF-α、IL-10等细胞因子的产生和释放是外界刺激信号经过细胞内各种信号转导通路向细胞核介导的结果. MAPKs现被证明是介导细胞外信号引起核反应的共同通路和汇聚点, 已经成为现阶段细胞生物学研究的热点之一. MAPKs是细胞内的一类丝氨酸/苏氨酸蛋白激酶. 研究证实, MAPKs信号转导通路存在于大多数细胞内, 在将细胞外刺激信号转导至细胞及其核内、并引起细胞生物学反应(如释放细胞因子, 细胞增殖、分化、转化及凋亡等)过程中具有至关重要的作用[2]. 在哺乳类细胞目前已发现有extracellular signal-regulated kinase(ERK)、JNK/stress-activated protein kinase(SAPK)、p38 MAPKs三条并行的信号通路[3], 促炎因子(如TNF-α、IL-1等)、应激刺激(H2O2、热休克、高渗与蛋白合成抑制剂等)可激活P38 MAPKs及JNK/SAPK通路, 显示这两条通路的激活可能与应激时的多种病理生理过程有关[7]. 目前认为, p38 MAPKs信号通路主要参与应激条件下细胞的免疫调节、炎症反应和细胞凋亡过程, 如IL-10能通过调控巨噬细胞内p38 MAPKs表达来抑制其释放TNF-α、IL-1等致炎因子; CO可通过调控p38 MAPKs的表达实现抑制Fas/FasL、caspases表达, 抑制细胞色素C释放, 增强Bcl-2表达的作用, 最终抑制大鼠肺缺血再灌注时肺动脉上皮细胞的凋亡. 现已发现p38 MAPKs有5个异构体, 分别为p38α、p38β1、p38β2、p38γ、p38δ[5]. 由于p38 MAPKs异构体存在和分布具有组织细胞特异性、其对底物的作用具有选择性、加之不同的异构体与不同的上游激酶偶联, 因此, 不同的p38 MAPKs信号通路在不同细胞中介导不同的生物学效应[6]. 如: 特异性阻断单核巨噬细胞的P38 MAPKs通路, 可抑制脂多糖诱导的TNF及IL-1的产生[7]; 而磷酸化激活P38 MAPKs通路, 可以促进细胞应激时紊乱的肌动蛋白修复[8]; Otterbein等发现CO对高氧诱导急性肺损伤(ALI)的肺上皮细胞的保护作用是通过增强p38β而减弱p38α表达实现的[9,10].
本研究采用的p38抗体只能检测总体p38磷酸化水平, 而不能区分其异构体之间表达的差异. 结果显示, 外源性应用CO组(C、D、E组)与单纯IIR组(B组)相比, 各组织p38 MAPKs蛋白总体表达明显增强, 且C组>D组>E组; 高浓度CO亚组比低浓度亚组表达增强. 这与研究中IL-10变化情况一致, 而与TNF-α变化相反, 各组p38表达的强度比较也进一步证明外源性CO能通过增强p38 MAPKs蛋白总体表达来达到防治IIR所致多器官损伤的作用, 且浓度为250 ppm、缺血前应用作用更明显. 形成这样的结果我们分析认为, CO在小肠缺血前应用可能是通过早期增强组织细胞内p38 MAPKs某个异构体的表达而减弱单核巨噬细胞内p38 MAPKs某个异构体的表达(总体p38表达为增强)起到促进组织细胞修复, 提前抑制TNF-α产生和促进IL-10释放作用, 而且促炎因子产生的减少使其对组织内PMN的激活和聚集作用减弱, 避免了组织器官在结构和功能上进一步的损害, 实现了对器官损伤的防治作用; 而在缺血及再灌注后应用, 虽然CO也能通过这种途径对器官损伤起到治疗作用, 但由于损害已经部分发生, 因此, CO的这种作用减弱.
小肠缺血再灌注是临床常见的病理生理过程, 严重时可导致多器官功能障碍综合征形成. 而过去一直被认为是毒性气体的CO被发现作为一种细胞信使在生物体各种生理和病理过程中发挥着重要调节作用.
门秀丽, 教授, 河北联合大学(原华北煤炭医学院)病理生理学教研室
CO现已被发现在生物体内具有舒张血管和支气管平滑肌、抑制血小板聚集、抑制炎症反应、抗凋亡、抗增殖等多种生理学作用,在神经、呼吸、循环等生理过程和抑制急性肺损伤、脏器缺血再灌注损伤、器官移植排斥反应等病理过程中发挥着重要调节作用.
本研究发现调节细胞内p38 MAPK表达是外源性CO防治小肠缺血再灌注所致多器官损伤作用的分子生物学基础之一.
本研究通过检测小肠缺血再灌注大鼠不同组织内p38 MAPK表达的变化, 探讨外源性CO对小肠缺血再灌注所致多器官损伤防治作用的机制, 为临床治疗MODS提供新的参考.
本研究目的明确, 手段先进, 数据准确, 是外源性一氧化碳对小肠缺血再灌注的深入性研究.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Stallion A, Kou TD, Latifi SQ, Miller KA, Dahms BB, Dudgeon DL, Levine AD. Ischemia/reperfusion: a clinically relevant model of intestinal injury yielding systemic inflammation. J Pediatr Surg. 2005;40:470-477. [PubMed] [DOI] |
| 2. | Cavaillon JM, Adrie C, Fitting C, Adib-Conquy M. Reprogramming of circulatory cells in sepsis and SIRS. J Endotoxin Res. 2005;11:311-320. [PubMed] |
| 3. | Cano E, Mahadevan LC. Parallel signal processing among mammalian MAPKs. Trends Biochem Sci. 1995;20:117-122. [PubMed] [DOI] |
| 4. | Otterbein LE, Mantell LL, Choi AM. Carbon monoxide provides protection against hyperoxic lung injury. Am J Physiol. 1999;276:L688-L694. [PubMed] |
| 5. | Zhu Q, Qian X, Wang S, Yin T, Yang J, Xue Q, Xu B. A comparison of elderly and adult multiple organ dysfunction syndrome in the rat model. Exp Gerontol. 2006;41:771-777. [PubMed] [DOI] |
| 6. | Kohmoto J, Nakao A, Stolz DB, Kaizu T, Tsung A, Ikeda A, Shimizu H, Takahashi T, Tomiyama K, Sugimoto R. Carbon monoxide protects rat lung transplants from ischemia-reperfusion injury via a mechanism involving p38 MAPK pathway. Am J Transplant. 2007;7:2279-2290. [PubMed] [DOI] |
| 7. | Raman KG, Barbato JE, Ifedigbo E, Ozanich BA, Zenati MS, Otterbein LE, Tzeng E. Inhaled carbon monoxide inhibits intimal hyperplasia and provides added benefit with nitric oxide. J Vasc Surg. 2006;44:151-158. [PubMed] [DOI] |
| 8. | Otterbein LE, Otterbein SL, Ifedigbo E, Liu F, Morse DE, Fearns C, Ulevitch RJ, Knickelbein R, Flavell RA, Choi AM. MKK3 mitogen-activated protein kinase pathway mediates carbon monoxide-induced protection against oxidant-induced lung injury. Am J Pathol. 2003;163:2555-2563. [PubMed] [DOI] |
| 9. | Otterbein LE, Bach FH, Alam J, Soares M, Tao Lu H, Wysk M, Davis RJ, Flavell RA, Choi AM. Carbon monoxide has anti-inflammatory effects involving the mitogen-activated protein kinase pathway. Nat Med. 2000;6:422-428. [PubMed] [DOI] |
| 10. | Wen T, Zhao JY, Mei S, Guan L, Zhang YL. [Protective effect of heme oxygenase-1 and its reaction product, carbon monoxide on acute liver injury induced by carbon tetrachloride in rats]. Beijing Da xue Xuebao. 2006;38:618-622. [PubMed] |
| 11. | Lee S, Suk K. Heme oxygenase-1 mediates cytoprotective effects of immunostimulation in microglia. Biochem Pharmacol. 2007;74:723-729. [PubMed] [DOI] |
| 12. | Nijhuis EH, Poot AA, Feijen J, Vermes I. Induction of apoptosis by heat and gamma-radiation in a human lymphoid cell line; role of mitochondrial changes and caspase activation. Int J Hyperthermia. 2006;22:687-698. [PubMed] [DOI] |