修回日期: 2011-12-19
接受日期: 2012-02-17
在线出版日期: 2012-02-18
目的: 研究前列腺干细胞抗原基因(plrostate stem cell antigen gene, PSCA)rs2294008位点多态性与中国藏族胃癌患者遗传易感性的关系.
方法: 收集185例藏族胃癌患者与200例健康人群的外周血样本, 提取基因组DNA, 采用dHPLC方法进行PSCA基因rs2294008位点分型.
结果: PSCA基因rs2294008位点3种基因型CC、CT、TT在胃癌病例组中频率分别为: 40.00%、48.65%和11.35%, 而在对照组中分别为54.00%、39.50%和6.50%. 与CC型比较, 携带CT, TT型基因型者胃癌发生的危险性增加, OR值分别为1.66(95%CI 1.09-2.54)和2.36(95%CI 1.11-5.00).
结论: PSCA基因rs2294008位点CT, TT基因型增加中国藏族人群的胃癌易感性.
引文著录: 赵久达, 耿排力, 赵君慧, 王丽娟, 姬发祥, 李进章, 曹成珠, 贺菊香. 中国藏族PSCA基因rs2294008多态性与胃癌遗传易感性的关系. 世界华人消化杂志 2012; 20(5): 418-421
Revised: December 19, 2011
Accepted: February 17, 2012
Published online: February 18, 2012
AIM: To investigate the relationship between the rs2294008 polymorphism of the PSCA gene and susceptibility to gastric cancer in Tibetans.
METHODS: The rs2294008 genotypes were determined by PCR-based denaturing high-performance liquid chromatography and direct DNA sequencing in 185 sporadic cases of gastric cancer and 200 controls recruited in Tibet.
RESULTS: The frequency of CC genotype was 40.00% in gastric cancer patients and 54.00% in normal controls, and the corresponding percentages for CT and TT genotypes were 48.65% and 39.50%, and 11.35% and 6.50%, respectively. Compared to CC genotype, CT and TT genotypes were associated with an increased risk of gastric cancer (OR = 1.66, 95%CI 1.09-2.54; OR = 2.36, 95%CI 1.11-5.00).
CONCLUSION: The rs2294008 polymorphism of the PSCA gene is associated with increased susceptibility to gastric cancer in Tibetans.
- Citation: Zhao JD, Geng PL, Zhao JH, Wang LJ, Ji FX, Li JZ, Cao CZ, He JX. Relationship between the rs2294008 polymorphism of the PSCA gene and susceptibility to gastric cancer in Tibetans. Shijie Huaren Xiaohua Zazhi 2012; 20(5): 418-421
- URL: https://www.wjgnet.com/1009-3079/full/v20/i5/418.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i5.418
中国为胃癌高发区[1,2], 而青海省男、女胃癌死亡率分别为52.6及27.8(每10万人口标化死亡率), 在全国最高, 其中藏族胃癌发病率较汉族等其他民族高[3]. 单核苷酸多态性(single nucleotide polymorphism, SNP)因具有基因组中的高密度和高保守性, 目前已经成为第3代遗传标记. 近年来有关胃癌相关易感基因SNP的研究取得了许多进展. 2008年千年基因组计划癌症研究组报告PSCA的基因多态性与日本弥漫型胃癌易感性相关[4]. 目前尚未见前列腺干细胞抗原基因(prostate stem cell antigen gene, PSCA)基因rs2294008位点基因多态性与中国藏族胃癌相关性的报道, 因此我们研究了在藏族人群中PSCA基因rs2294008位点基因多态性与胃癌易感性的关系, 现报道如下.
从2008-03/2011-06青海大学附属医院住院的胃癌患者中选择无血缘关系的藏族患者185例, 抽取外周血. 胃癌患者全部以胃镜或手术后病理组织学证实, 且未经放化疗, 其中中低分化腺癌143例、高-中分化腺癌42例, 男138例, 女47例; 平均年龄50.3岁±8.3岁. 另从青海省海南藏族自治州收集正常藏族个体200人外周血作为对照组, 所有对照组人员均为健康人群, 并排除胃部疾病及家族中有肿瘤病史者, 其中男146例, 女53例平均年龄50.8岁±7.8岁. 标本采集获得研究对象的知情同意, 研究方案经青海大学医学伦理委员会批准.
1.2.1 基因组DNA提取: 取EDTA-K2抗凝静脉血5 mL用全血基因组DNA提取试剂盒提取基因组DNA, 紫外分光光度计(A260/A280值为1.6-1.8)测定DNA浓度. 提取DNA置-20 ℃冰箱保存.
1.2.2 PCR反应: 以PSCA基因组序列为依据, 设计PSCA基因rs2294008位点PCR引物. 序列为: F: 5'-AAGTCACCTGAGGCCCTCTC-3', R: 5'-CAAGCCTGCCATCAACAG-3', 产物长度90 bp. PCR反应体系及扩增条件: PCR反应总体系为25 μL, 含100 μg/L DNA模板2 μL, 10×缓冲液215 μL, 25 mmol/L MgCl2 2 μL, 2.5 mmol/L dNTP 2 μL, 10 μmol/L引物上反向各1 μL, 5 U/μL Taq DNA聚合酶0.25 μL. 反应在温度梯度PCR仪(美国Biometra公司)中进行, 条件为: 94 ℃预变性3 min, 95 ℃变性30 s, 72 ℃延伸45 s, 进行35个循环, 72 ℃后延伸10 min. PCR产物2 μL行2%琼脂糖凝胶电泳鉴定扩增产物.
1.2.3 DHPLC分析基因型: 5 μL PCR产物在PCR仪内95 ℃变性3 min, 缓慢退火至45 ℃, 以形成异源和同源双链DNA分子混合物, 样品入进样室. 洗脱液按线性递增方式以0.9 mL/min的流速洗脱, 260 nm波长处读取吸光度(A)值, 形成峰型. PSCA基因rs2294008位点基因型均为CC、CT、TT 3种类型, 可采用部分变性法, 先将纯合型CC、TT与杂合型CT鉴别. 双峰即为CT杂合基因型, 送测序证实, 单峰即可能为CC、TT 2种基因型, 纯合子分型时在2个位点相应的样品上各任选一个测序, 确定基因型后再将其与其余样品混合, 再如前述方法行DHPLC. 若仍为单峰, 说明未知样本基因型与测序样品相同; 若为双峰即为不同.
统计学处理 统计分析使用SPSS (Version13.0)软件. 人群资料先进行Hardy-Weinberg遗传平衡检验, 以χ2检验确定胃癌组与对照组之间3个位点基因型频数分布的差异. 以OR及其95%CI表示相对危险度. 以P<0.05表示差异有统计学意义.
胃癌组与对照组间年龄与性别均衡可比, 吸烟在两组间分布差异无统计学意义, 而Hp感染率两组间分布差异有统计学意义(表1). 对照组PSCA rs2294008基因型分布符合Hardy-Weinberg平衡(P = 0.78), 表明样本具有群体代表性.
| 基本特征 | 胃癌(n = 185) | 对照组(n = 200) | χ2 值 | P值 |
| 年龄 | ||||
| <35岁 | 3(1.62) | 5(2.50) | 0.364 | 0.55 |
| 35-60岁 | 98(52.97) | 105(52.50) | 0.009 | 0.94 |
| ≥60岁 | 84(44.41) | 90(45.00) | 0.006 | 0.94 |
| 性别 | ||||
| 男 | 137(74.05) | 148(74.00) | 0.000 | 0.99 |
| 女 | 48(25.96) | 52(26.00) | ||
| 吸烟史 | ||||
| 无 | 67(36.22) | 71(35.50) | 0.021 | 0.88 |
| 有 | 118(63.78) | 129(64.50) | ||
| 幽门螺杆菌感染 | ||||
| 无 | 66(35.68) | 94(47.00) | 5.074 | 0.02 |
| 有 | 119(64.32) | 106(53.00) |
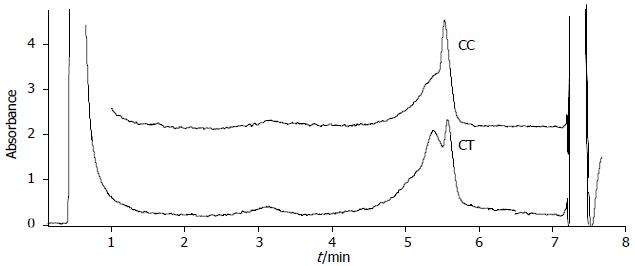
PSCA基因rs2294008位点DHPLC色谱图见图1, CC为单峰, CT为双峰. PSCA基因rs2294008位点CT基因型者患胃癌的危险性增加约1.66倍(95%CI, 1.09-2.54), TT基因型者患胃癌的危险性增加约2.36倍(95%CI, 1.11-5.00), 胃癌组T等位基因频率高于对照组, 患胃癌的危险性增加约1.56倍(95%CI, 1.15-2.12). PSCA基因rs2294008位点CT, TT基因型可能是中国藏族胃癌的遗传易感基因(表2).
| 分组 | 胃癌组(n = 185) | 对照组(n = 200) | OR值 | 95%CI |
| CC | 74(40.00) | 108(54.00) | 1 | |
| CT | 90(48.65) | 79(39.05) | 1.66 | 1.09-2.54 |
| TT | 21(11.35) | 13(6.50) | 2.36 | 1.11-5.00 |
| C | 238(64.32) | 295(73.75) | 1 | |
| T | 132(35.68) | 105(26.25) | 1.56 | 1.15-2.12 |
PSCA为一种细胞表面抗原, 与标记早期造血干细胞的细胞表面蛋白相似. PSCA基因位于染色体8q 24.2, PSCA参与各种细胞功能, 如信号传导、细胞与细胞间黏附等[5]. PSCA cDNA由660 bp组成, 编码含123个氨基酸的蛋白, 与干细胞抗原-2(SCA-2)有30%的同源性. 从其严格表达于基底细胞及与SCA-2同源来看, PSCA在诸如干细胞、祖细胞自我更新(抗凋亡)或增殖等功能方面起重要作用. 研究证实, 多数人类前列腺癌过度表达PSCA, 他是鉴别前列腺切除标本中正常组织与前列腺癌组织重要的标志物[6]. 2008年5月千年基因组计划癌症研究组学者、日本东京国立癌症研究中心Yoshida等[4,7]指出PSCA基因多态性与弥漫型胃癌易感性相关. 研究者首先在日本开展全基因组相关性研究(genome-wide association study), 第一阶段在188例弥漫型胃癌患者和752名对照者中检测了85 576种单核苷酸多态性(SNP). 第二阶段在749例患者和750名对照者中检测了2 753种SNP. 通过二轮筛选后, 研究者将范围缩窄至10种SNP, 位于第8号染色体的PSCA基因在其中脱颖而出. PSCA内含子区的一个SNP(rs2976392)与弥漫型胃癌显著相关, 等位基因特异性比值比(OR)为1.62(P = 1.11×10-9). 另外, PSCA基因第1外显子区一个SNP(rs2294008)的C等位基因若被高危的T等位基因取代, 会降低其上游基因片段的转录活性(r2 = 0.995). 此后, 研究者在韩国对上述结果进行了验证, 研究对象为457例弥漫型胃癌患者、418例场型胃癌患者和390名对照者. 结果显示, 上述2种SNP与弥漫型胃癌显著相关, 与肠型胃癌相关性较弱, rs2294008 T等位基因OR为1.90(P = 8.01×10-8).
我国藏族胃癌高发, 除了与藏族饮食以肉食为主缺乏维生素, 幽门螺杆菌感染和青海地理位居火山岩地带等因素有关外, 遗传因素也可能起着重要作用[3]. 目前国内虽已开展汉族PSCA基因多态性与胃癌易感性相关性的研究, 但藏族PSCA基因多态性与胃癌易感性相关研究的资料尚未见报道. 我们本次的初步研究表明, 藏族人群胃癌与PSCA基因rs2294008位点基因多态性呈相关性, PSCA基因rs2294008位点CT, TT基因型者患胃癌的危险性增加, 与Wu等[8]对中国汉族人群的研究一致, 而与日本Saeki等的研究结果不完全一致, 可能与日本人群中PSCA rs2294008 T等位基因频率较高(61.7%), T等位基因为主要等位基因, 而中国藏族人群中T等位基因频率(26.25%)较低, 为次要等位基因有关. 再次提示提示不同种族的遗传背景差异甚大, 在进行基因多态性与胃癌的遗传易感性研究时, 应充分考虑不同种族、民族或人群的差异.
PSCA基因影响胃癌的发病可能与其参与调节胃上皮细胞增殖有关. 体外研究发现稳定转染PSCA cDNA的胃癌细胞株HSC57的菌落形成明显少于不表达PSCA的细胞株, 正常胃黏膜中PSCA mRNA呈高表达, 其表达主要位于胃腺体峡部, 而胃癌组织中则检测不到PSCA mRNA表达[9,10]. 提示PSCA可能具有抑制胃癌细胞增殖的作用, PSCA rs2294008 T等位基因可能通过下调PSCA表达, 降低其对胃上皮细胞增殖的抑制作用, 从而增加胃癌的发病风险.
今后, 关于PSCA基因与胃癌遗传易感性的关系研究需要进一步扩大其他人群研究及其具体致病机制研究.
中国为胃癌高发区, 而青海省男、女胃癌死亡率分别为52.6及27.8(每10万人口标化死亡率), 在全国最高, 其中藏族胃癌发病率较汉族等其他民族高. 单核苷酸多态性(SNP)因具有基因组中的高密度和高保守性, 目前已经成为第3代遗传标记.
张凤春, 教授, 上海交通大学医学院附属仁济医院
目前国内虽已开展汉族PSCA基因多态性与胃癌易感性相关性的研究, 但藏族PSCA基因多态性与胃癌易感性相关研究的资料尚未见报道.
本文具有一定的科学性, 对临床医生有一定参考价值.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, Lai KC, Hu WH, Yuen ST, Leung SY. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA. 2004;291:187-194. [PubMed] [DOI] |
| 2. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 3. | 赵 久达, 沈 国双, 曹 成珠, 贺 菊香, 马 新福, 王 丽娟, 姬 发祥, 李 进章, 耿 排力. 青海地区藏、回及汉族胃癌发病特征分析. 中华内科杂志. 2009;48:955-956. |
| 4. | Sakamoto H, Yoshimura K, Saeki N, Katai H, Shimoda T, Matsuno Y, Saito D, Sugimura H, Tanioka F, Kato S. Genetic variation in PSCA is associated with susceptibility to diffuse-type gastric cancer. Nat Genet. 2008;40:730-740. [PubMed] [DOI] |
| 5. | Mazzucchelli R, Barbisan F, Santinelli A, Lopez-Beltran A, Cheng L, Scarpelli M, Montironi R. Immunohistochemical expression of prostate stem cell antigen in cystoprostatectomies with incidental prostate cancer. Int J Immunopathol Pharmacol. 2009;22:755-762. [PubMed] |
| 6. | Elsamman E, Fukumori T, Kasai T, Nakatsuji H, Nishitani MA, Toida K, Ali N, Kanayama HO. Prostate stem cell antigen predicts tumour recurrence in superficial transitional cell carcinoma of the urinary bladder. BJU Int. 2006;97:1202-1207. [PubMed] [DOI] |
| 7. | Saeki N, Sakamoto H, Yoshida T. [Genome-wide association study of gastric cancer and GeMDBJ database]. Nihon Rinsho. 2009;67:1227-1232. [PubMed] |
| 8. | Wu C, Wang G, Yang M, Huang L, Yu D, Tan W, Lin D. Two genetic variants in prostate stem cell antigen and gastric cancer susceptibility in a Chinese population. Mol Carcinog. 2009;48:1131-1138. [PubMed] [DOI] |
| 9. | Lochhead P, Frank B, Hold GL, Rabkin CS, Ng MT, Vaughan TL, Risch HA, Gammon MD, Lissowska J, Weck MN. Genetic variation in the prostate stem cell antigen gene and upper gastrointestinal cancer in white individuals. Gastroenterology. 2011;140:435-441. [PubMed] [DOI] |
| 10. | Ou J, Li K, Ren H, Bai H, Zeng D, Zhang C. Association and haplotype analysis of prostate stem cell antigen with gastric cancer in Tibetans. DNA Cell Biol. 2010;29:319-323. [PubMed] [DOI] |