修回日期: 2011-10-18
接受日期: 2011-11-04
在线出版日期: 2012-02-18
目的: 研究非甾体类抗炎药(NSAID)塞来昔布对胃癌细胞MGC-803的抑制作用和对RECK、MMP-2、MMP-9基因表达的影响, 以探讨塞来昔布的抗肿瘤机制.
方法: 培养胃癌MGC-803细胞, 实验用不同浓度的塞来昔布(25、50、100 μg/L)分别处理MGC-803细胞不同时间(12、24 h、48 h), 无血清培养基饥饿24 h达同步化后, MTT(噻唑蓝比色法)观察MGC-803细胞增殖; RT-PCR法检测细胞周期调控因子MMP-9、MMP-2、RECK mRNA的表达; Western blot法检测MMP-9、MMP-2、RECK mRNA蛋白的表达.
结果: MTT法显示塞来昔布能抑制胃癌MGC-803细胞增殖, 作用12 h时, 随着塞来昔布处理浓度的增高, 其抑制作用不明显, 组间比较差异不显著(P>0.05), 在作用24、48 h时呈浓度依赖性(25-100 μg/L), 在25、50、100 μg/L作用浓度呈时间依赖性(24-48 h). 塞来昔布在100 μg/L浓度作用细胞48 h时抑制. RT-PCR法检测结果显示, 在12 h的作用时间点, 随着塞来昔布处理浓度的增高, RECK基因及MMP-2、MMP-9 mRNA变化不是很明显, 组间比较无显著差异(P>0.05), 在12 h后, 塞来昔布能增加胃癌细胞RECK mRNA和蛋白表达, 作用呈浓度(25-100 μg/L)和时间依赖性(24-48 h), MMP-2、MMP-9表达则下降. Western blot法检测结果显示, 作用12 h时, 随着塞来昔布处理浓度的增高, 其RECK蛋白及MMP-2, MMP-9蛋白改变不明显, 组间比较差异不显著(P>0.05), 在12 h以后, 塞来昔布能增加RECK mRNA和蛋白表达并减少MMP-2、MMP-9表达, 且作用呈浓度依赖性和时间依赖.
结论: 塞来昔布可抑制人胃癌MGC-803细胞增殖与转移; 其可能是通过上调RECK基因, 进而下调MMP-2、MMP-9来抑制胃癌细胞MGC-803的增殖与转移.
引文著录: 钟鹰, 李国庆, 黄靓, 毛振江, 王恩湘, 钟茹, 粟滔. 塞来昔布对胃癌MGC-803细胞RECK、MMP-2、MMP-9基因表达的影响. 世界华人消化杂志 2012; 20(5): 368-373
Revised: October 18, 2011
Accepted: November 4, 2011
Published online: February 18, 2012
AIM: To explore the antitumor mechanisms of celecoxib by investigating the impact of non-steroidal anti-inflammatory drug (NSAID) celecoxib on the expression of RECK, MMP-2 and MMP-9 in human gastric cancer cell line MGC-803.
METHODS: MGC-803 cells were starved in serum-free medium for 24 h and treated with different concentrations of celecoxib (25, 50, and 100 μg/L) for different durations (12, 24, and 48 h). Cell proliferation was determined by MTT assay. The expression of MMP-9, MMP-2 and RECK mRNAs and proteins was detected by RT-PCR and Western blot, respectively.
RESULTS: Celecoxib inhibited MGC-803 cell proliferation in a concentration-dependent manner at 24 and 48 h but not at 12 h. The inhibitory effect was also time-dependent. Cell proliferation was mostly inhibited after treatment with celecoxib at a concentration of 100 μg/L for 48 h. The expression of RECK, MMP-2 and MMP-9 mRNAs showed no significant differences (all P > 0.05) among cells treated with different concentrations of celecoxib for 12 h. After 12 h, celecoxib increased RECK mRNA expression in a concentration- and time-dependent manner, but decreased the expression of MMP-2 and MMP-9. Similar results were also obtained for RECK, MMP-2 and MMP-9 protein expression.
CONCLUSION: Celecoxib inhibits the proliferation and metastasis of MGC-803 cells possibly via mechanisms associated with up-regulation of RECK expression and down-regulation of MMP-2 and MMP-9 expression.
- Citation: Zhong Y, Li GQ, Huang L, Mao ZJ, Wang EX, Zhong R, Su T. Celecoxib down-regulates RECK expression and up-regulates MMP-2 and MMP-9 expression in human gastric cancer cell line MGC-803. Shijie Huaren Xiaohua Zazhi 2012; 20(5): 368-373
- URL: https://www.wjgnet.com/1009-3079/full/v20/i5/368.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i5.368
胃癌是最常见的消化系恶性肿瘤, 在中国, 胃癌死亡率已居主要恶性肿瘤(胃癌、肝癌、肺癌、食管癌)死亡的首位[1]. 胃癌的预后不佳, 其5年生存率低于20%. 目前, 胃癌的治疗仍以手术干预、化疗以及放化疗联合的综合治疗为主, 虽然近年的治疗技术有明显提高, 但其治疗效果仍欠佳[2]. 非类甾体类抗炎药(nonsteroidal anti-inflammatory drugs, NSAID)对直结肠癌[3,4]、食管癌[5,6]、头颈癌[7]、胃癌[8-10]、胰腺癌[11-13]、肺癌[14]等多种肿瘤均有抑制作用. 众多体内及体外实验均表明NSAID具有抗血管及抗转移活性, 其阻断血管形成及抗转移的机制与MMP活性有关[15,16].
RECK(reversion-inducing-cysteine-rich protein with kazal motifs)基因是1998年Takahashi等[17]在v-Ki-ras转染的NIH3T3细胞中发现的一种新基因. RECK基因是新发现的一种MMP抑制剂, 其能在转录后水平抑制至少3种MMP(MMP-2, MMP-9及MT1-MMP)表达进而抑制肿瘤的血管形成及转移. RECK基因在大部分正常细胞株及正常组织中均表达, 但在多种肿瘤组织及细胞株中不表达. 在正常人纤维细胞系MRC-5中, RECK基因高表达, 而在纤维肉瘤转化的细胞系HT-1080中, RECK基因表达量很低[17]. 实验表明, 在结肠癌[18]、乳腺癌[19-21]、胰腺癌[22,23]等组织中其RECK基因表达量较相应的癌旁组织明显下降. 研究表明, 将RECK基因转移到肿瘤细胞中去(如HT1080纤维肉瘤细胞株[24,25]或B16黑色素瘤细胞株[26]), 其侵袭及转移能力明显受到抑制[27]. 因此NSAID是否通过诱导RECK基因的表达, 抑制MMP的活性, 从而起到抗肿瘤活性成为研究的热点.
1640细胞培养基购自美国Gibco公司; 胎牛、小牛血清购自杭州四季青生物有限公司; 质粒提取试剂盒购自天根生化科技(北京)有限公司; 总RNA提取试剂盒(TRIzol法)购自北京百泰克生物技术有限公司; RT试剂盒购自美国MBI公司; PCR试剂盒购自天根生化科技有限公司; MMP-9、MMP-2、RECK基因引物购自上海生工生物技术公司合成; 兔抗MMP-2, MMP-9, RECK单克隆抗体购自美国Santa Cruz公司等.
1.2.1 MGC-803的细胞培养: MGC-803细胞在含有100 mL/L胎牛血清(FBS)的RPMI-1640培养基中贴壁生长, 置于37 ℃、含50 mL/L CO2的孵箱中培养.
1.2.2 分组: 每次实验均在呈指数生长的细胞中进行. 接种2×105-3×105个细胞于25 cm2玻璃培养瓶, 培养箱中孵育至细胞接近70%融合时, 弃培养液, 换含0.1%FBS的RPMI-1640培养液, 继续培养24 h, 使细胞基本同步化于G0期后再进行分组.
1.2.3 MTT法检测细胞增殖: 取对数生长期MGC-803细胞, 以1.0×104个/mL接种于96孔板(每孔200 μL), 细胞长至70%-80%融合后, 换无血清的RPMI 1640培养液饥饿24 h, 按分组加入不同的处理因素继续培养, 倒置显微镜下动态观察细胞生长情况. 在孵育结束前4 h每孔加入5 g/L的MTT 20 μL, 培养4 h后吸弃孔内培养液, 每孔各加入DMSO 150 μL, 37 ℃孵育15 min后振荡混匀, 用酶联免疫检测仪测定吸光度(A, 检测波长570 nm), 绘制细胞生长曲线. 实验重复3次, 每组设6个复孔, 统计数据取A值均值.
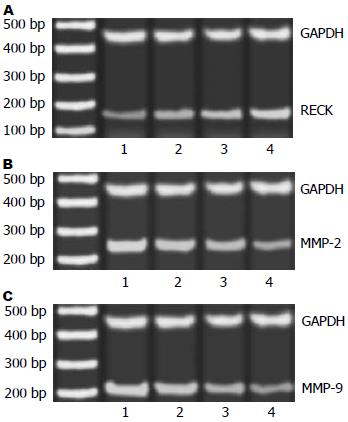
1.2.4 RT-PCR检测mRNA表达: 待细胞长至70%-80%融合状态时, 无血清的RPMI-1640培养基同步化饥饿细胞24 h, 按分组加入不同的处理因素继续培养至一定时间后收集细胞, 提取总RNA, 进行RT-PCR反应. 每组实验重复3次. 人RECK基因和MMP-2、MMP-9、GAPDH(内参)的引物由上海生工合成, 序列分别如下: RECK: 上游: 5'-CCTCAGTGAGCACAGTTCAGA-3', 下游5'-GCAGCACACACACTGCTGTA-3'; MMP-2: 上游5'-AGATCTTCTTCTTCAAGGACCGGT-3', 下游5'-GGCTGGTCAGTGGCTTGGGGTA-3', MMP-9: 上游5'-GCGGAGATTGGGAACCAGCTGT-3', 下游GACGCGCCTGTGTACACCCACA-3'; GAPDH: 上游5'-GGACCTGACAGACTACCTC-3', 下游5'-CGTACTCCTGCTTGCTGAT-3'. PCR产物长度分别为150 bp、225 bp、208 bp和486 bp. 具体反应条件如下: 94 ℃ 30 min, 随后95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s. 共30循环, 最后72 ℃延伸7 min.
1.2.5 Western blot检测蛋白定量表达: 待细胞长至70%-80%融合状态时, 无血清的RPMI-1640培养基同步化饥饿细胞24 h, 按分组加入不同的处理因素继续培养至实验所需时间后收集细胞, 提取总蛋白进行实验. 每组实验重复3次.
统计学处理 各组实验数据以mean±SD表示, 采用SPSS16.0统计软件进行单因素方差分析, 组间均数比较采用LSD或者Dunnett'υμ s T3检验, 用P<0.05判断统计差异有无显著性.
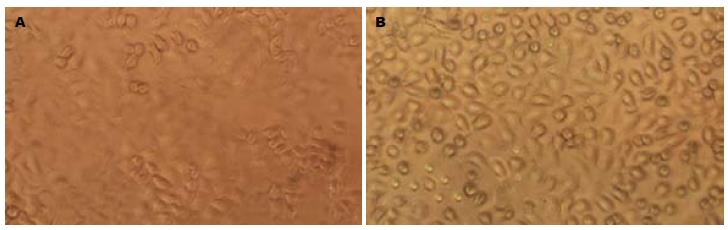
MGC-803细胞在培养瓶中呈单层贴壁生长, 多呈梭形或多角形, 少数呈类圆形, 核大, 核分裂象多见, 胞体小, 突起少而短. 培养基中加入100 μg/L塞来昔布处理细胞 24 h后, 与对照组比较, 细胞增殖不明显, 小圆形细胞增多, 常成对、成团出现, 为分裂期或刚完成分裂的细胞(图1).
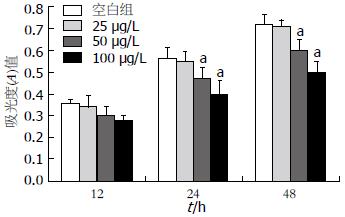
MTT法测定结果显示, 用不同浓度的塞来昔布(终末浓度为25、50、100 μg/L)处理人胃癌MGC-803细胞不同时间(12、24、48 h), 与对照组(0.1%FBS)相比, 其增殖活性在12 h的作用时间点, 随着塞来昔布处理浓度的增高, 其抑制作用不明显, 组间比较差异不显著(P>0.05); 在24 h和48 h 2个时间点, 随着塞来昔布浓度的逐渐增加, 其抑制作用逐渐增强, 组间比较差异显著(P<0.05). 当塞来昔布作用浓度为100 μg/L, 时间为48 h时, MGC-803细胞抑制作用最明显(48 h, 增殖抑制率47.22%, P<0.01, 图2). IC50为(50.35±4.28) μg/L.
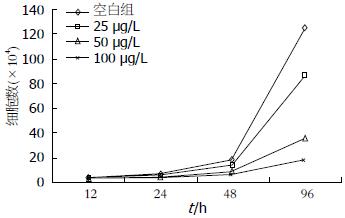
选取处于对数生长期的细胞, 用无血清的1640培养基同步化24 h. 0.25%胰蛋白酶消化细胞制成细胞悬液, 以每孔3×104个细胞接种于24孔培养板中, 每孔加500 μL培养基. 将细胞放入37 ℃、50 mL/L CO2培养箱中培养. 在12、24、48、96 h 4个时间用血球计数板计数并记录, 绘制细胞生长曲线. 由结果可以得出, 随着塞来昔布药物浓度的增加, 其对胃癌MGC-803细胞的抑制作用逐渐增强, 并具有时间依赖性(图3).
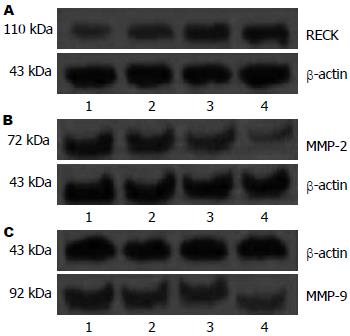
Western blot法检测分析不同浓度塞来昔布处理胃癌MGC-803细胞不同时间后, MMP-2、MMP-9和RECK蛋白的表达情况. 灰度扫描定量分析显示, 与对照组比较, 在12 h的作用时间点, 随着塞来昔布处理浓度的增高RECK蛋白、MMP-2、MMP-9没有显著性差异, 但在处理24 h后, RECK蛋白表达呈浓度依赖性增加, 与对照组比较差异显著(P<0.05). MMP-2和MMP-9呈浓度依赖性递减, 采用50 μg/L塞来昔布分别处理细胞12、24和48 h后, RECK蛋白表达呈时间依赖性增加, 与对照组比较差异显著(P<0.05), MMP-2和MMP-9的表达呈时间依赖性减少, 与对照组比较差异显著(P<0.05, 图4).
RT-PCR检测不同浓度塞来昔布处理胃癌MGC-803细胞不同时间后, MMP-2、MMP-9和RECK mRNA表达水平的变化情况. 灰度扫描定量分析显示, 25、50、100 μg/L塞来昔布处理细胞24 h后, RECK基因mRNA表达呈浓度依赖性增加, MMP-2、MMP-9 mRNA表达呈浓度依赖性下降, 与对照组比较差异显著(P<0.05). 采用50 μg/L塞来昔布分别处理细胞12 h、24 h和48 h后, RECK mRNA呈时间依赖性增加, MMP-2、MMP-9 mRNA表达呈时间依赖性下降, 与对照组比较差异显著(P<0.05, 图5).
胃癌是我国高发的恶性肿瘤之一, 但目前我们对胃癌的发病机制尚缺乏全面和深入的了解. 现有研究证明, NSAID通过对RECK基因的调节, 抑制肿瘤的发生与转移. 本文通过实验证实塞来昔布使得MGC-803细胞的增殖速率受到了抑制; 在人胃癌细胞MGC-803中, 通过对RECK、MMP-2、MMP-9蛋白测定, 进一步发现, NSAID对MGC-803细胞增殖的抑制作用至少部分是通过调节RECK基因实现的.
最近一项研究表明, 有规律的服用阿司匹林或NSAID, 可使结肠癌的发生率降低40%-50%[28]. 有研究表明, 每月有规律地服用阿斯匹林或其他NSAID 16次以上, 可使结肠癌的患病相对危险度减少40%-50%; 舒林酸似乎可减少家族性息肉病腺瘤息肉的数量和体积[29]. Harris与Nelson[30]调查了NSAID与前列腺癌的关系, 通过对417例前列腺癌患者及控制组的调查发现, 每天有规律地使用阿斯匹林或布洛芬可以降低危险性66%(相对危险度为0.34), 曾经用过NSAID的男性前列腺癌发病可能性也显著降低. 塞来昔布属于NSAID, 是特异性COX-2抑制剂, 目前发现其对消化系恶性肿瘤、乳腺癌、卵巢癌及前列腺癌等有明显的防治作用. NSAID通过激活RECK基因高表达, 其转录产物抑制至少3种基质金属蛋白酶(MMP-2, MMP-9及MT1-MMP), 进而抑制肿瘤的血管形成及转移.
实验中, 我们选取RECK、MMP-2、MMP-9为研究对象, 观察塞来昔布对RECK、MMP-2、MMP-9的调节作用. 通过MTT法、RT-PCR、Western blot法结果表明: 塞来昔布对MGC-803细胞增殖的抑制作用呈剂量和时间依赖性. 随着塞来昔布浓度增加, 可明显增加RECK基因的表达, 降低MMP-2和MMP-9的表达, 进而MMP-2和MMP-9的mRNA和蛋白表达均降低.
本实验进一步证实提示, 塞来昔布能够抑制MMP-2、MMP-9的转录和翻译水平, 是一种有用的降低肿瘤侵袭转移力的药物. 有研究表明, 将CL-1肺癌细胞株在有或无NSAID的条件下分别培养48 h后, RT-PCR检测其基因表达水平. 结果表明, NSAID可以明显提高细胞中RECK的表达水平, 且MMP-2活性成分明显减少, 而MMP-2的前体成分却明显增加. 先前的研究表明, NSAID可以直接抑制MMP-2的表达, 因此, NSAID抑制MMP-2的表达可能通过以下途径: (1)通过干扰ERK/Sp1信号途径直接抑制MMP-2的表达; (2)通过诱导RECK的表达, 从而阻碍前体MMP-2向活性MMP-2的转换. 此外, 有研究表明NSAID明显降低RECK基因的甲基化, 并能通过抑制NF-κB的活性从而间接提高RECK基因的表达水平.
RECK基因是新发现的抑癌基因, 其在多种肿瘤组织中表达下降, 如何提高其表达水平是抑制肿瘤侵袭转移的重点之一. 已有的研究表明多种NSAID可诱导RECK基因表达, 从而抑制肿瘤的侵袭和转移, 本研究在细胞层面表明对于胃癌细胞株MGC803, 塞来昔布有明显的诱导RECK基因表达的作用, 且明显抑制MMP-2和MMP-9的表达. 关于其机制的研究有待于进一步阐明.
近年胃癌的治疗技术虽有明显提高, 但其愈合仍然欠佳, 癌细胞侵袭及转移是制约临床治疗效果的常见因素, 是涉及众多基因变化的一系列复杂过程.
傅春彬, 主任医师, 吉化集团公司总医院一院消化内科
目前对于胃癌确切的病因学、发病机制仍未完全明了. 非甾体类抗炎与RECK、MMP-9、MMP-2,以及RECK与MMP-9、MMP-2之间相互作用有待进一步的研究.
RECK这种新型的膜表面锚定的MMP抑制基因, 是影响肿瘤转移及侵袭能力的主要因素, 且其下降的幅度与肿瘤侵袭转移能力成明显正相关.
本文阐述了塞来昔布对RECK、MMP-2、MMP-9的调节作用, 对临床指导胃癌或有胃癌癌前病变患者的药物治疗或预防具有一定意义.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Mitchell RA. Mechanisms and effectors of MIF-dependent promotion of tumourigenesis. Cell Signal. 2004;16:13-19. [PubMed] [DOI] |
| 2. | Petrenko O, Moll UM. Macrophage migration inhibitory factor MIF interferes with the Rb-E2F pathway. Mol Cell. 2005;17:225-236. [PubMed] [DOI] |
| 3. | Hopkins MH, Owen J, Ahearn T, Fedirko V, Flanders WD, Jones DP, Bostick RM. Effects of supplemental vitamin D and calcium on biomarkers of inflammation in colorectal adenoma patients: a randomized, controlled clinical trial. Cancer Prev Res (Phila). 2011;4:1645-1654. [PubMed] [DOI] |
| 4. | Passarelli MN, Coghill AE, Hutter CM, Zheng Y, Makar KW, Potter JD, Newcomb PA. Common colorectal cancer risk variants in SMAD7 are associated with survival among prediagnostic nonsteroidal anti-inflammatory drug users: a population-based study of postmenopausal women. Genes Chromosomes Cancer. 2011;50:875-886. [PubMed] [DOI] |
| 5. | Pandeya N, Webb PM, Sadeghi S, Green AC, Whiteman DC. Gastro-oesophageal reflux symptoms and the risks of oesophageal cancer: are the effects modified by smoking, NSAIDs or acid suppressants? Gut. 2010;59:31-38. [PubMed] [DOI] |
| 6. | Abnet CC, Freedman ND, Kamangar F, Leitzmann MF, Hollenbeck AR, Schatzkin A. Non-steroidal anti-inflammatory drugs and risk of gastric and oesophageal adenocarcinomas: results from a cohort study and a meta-analysis. Br J Cancer. 2009;100:551-557. [PubMed] [DOI] |
| 7. | Wilson JC, Anderson LA, Murray LJ, Hughes CM. Non-steroidal anti-inflammatory drug and aspirin use and the risk of head and neck cancer: a systematic review. Cancer Causes Control. 2011;22:803-810. [PubMed] [DOI] |
| 8. | Wu CY, Wu MS, Kuo KN, Wang CB, Chen YJ, Lin JT. Effective reduction of gastric cancer risk with regular use of nonsteroidal anti-inflammatory drugs in Helicobacter pylori-infected patients. J Clin Oncol. 2010;28:2952-2957. [PubMed] [DOI] |
| 9. | Tian W, Zhao Y, Liu S, Li X. Meta-analysis on the relationship between nonsteroidal anti-inflammatory drug use and gastric cancer. Eur J Cancer Prev. 2010;19:288-298. [PubMed] [DOI] |
| 10. | Epplein M, Nomura AM, Wilkens LR, Henderson BE, Kolonel LN. Nonsteroidal antiinflammatory drugs and risk of gastric adenocarcinoma: the multiethnic cohort study. Am J Epidemiol. 2009;170:507-514. [PubMed] [DOI] |
| 11. | Bradley MC, Hughes CM, Cantwell MM, Napolitano G, Murray LJ. Non-steroidal anti-inflammatory drugs and pancreatic cancer risk: a nested case-control study. Br J Cancer. 2010;102:1415-1421. [PubMed] [DOI] |
| 12. | Zhang Z, Huang L, Zhao W, Rigas B. Annexin 1 induced by anti-inflammatory drugs binds to NF-kappaB and inhibits its activation: anticancer effects in vitro and in vivo. Cancer Res. 2010;70:2379-2388. [PubMed] [DOI] |
| 13. | Capurso G, Schünemann HJ, Terrenato I, Moretti A, Koch M, Muti P, Capurso L, Delle Fave G. Meta-analysis: the use of non-steroidal anti-inflammatory drugs and pancreatic cancer risk for different exposure categories. Aliment Pharmacol Ther. 2007;26:1089-1099. [PubMed] [DOI] |
| 14. | Johnson CC, Hayes RB, Schoen RE, Gunter MJ, Huang WY. Non-steroidal anti-inflammatory drug use and colorectal polyps in the Prostate, Lung, Colorectal, And Ovarian Cancer Screening Trial. Am J Gastroenterol. 2010;105:2646-2655. [PubMed] [DOI] |
| 15. | Sternlicht MD, Werb Z. How matrix metalloproteinases regulate cell behavior. Annu Rev Cell Dev Biol. 2001;17:463-516. [PubMed] [DOI] |
| 16. | Leeman MF, Curran S, Murray GI. New insights into the roles of matrix metalloproteinases in colorectal cancer development and progression. J Pathol. 2003;201:528-534. [PubMed] [DOI] |
| 17. | Takahashi C, Sheng Z, Horan TP, Kitayama H, Maki M, Hitomi K, Kitaura Y, Takai S, Sasahara RM, Horimoto A. Regulation of matrix metalloproteinase-9 and inhibition of tumor invasion by the membrane-anchored glycoprotein RECK. Proc Natl Acad Sci U S A. 1998;95:13221-13226. [PubMed] [DOI] |
| 18. | Cho CY, Wang JH, Chang HC, Chang CK, Hung WC. Epigenetic inactivation of the metastasis suppressor RECK enhances invasion of human colon cancer cells. J Cell Physiol. 2007;213:65-69. [PubMed] [DOI] |
| 19. | Liu BB, Wei J, Fu L. [Updates on genes related to breast cancer metastasis]. Zhonghua Binglixue Zazhi. 2008;37:266-269. [PubMed] |
| 20. | Span PN, Sweep CG, Manders P, Beex LV, Leppert D, Lindberg RL. Matrix metalloproteinase inhibitor reversion-inducing cysteine-rich protein with Kazal motifs: a prognostic marker for good clinical outcome in human breast carcinoma. Cancer. 2003;97:2710-2715. [PubMed] [DOI] |
| 21. | Lei H, Hemminki K, Altieri A, Johansson R, Enquist K, Hallmans G, Lenner P, Försti A. Promoter polymorphisms in matrix metalloproteinases and their inhibitors: few associations with breast cancer susceptibility and progression. Breast Cancer Res Treat. 2007;103:61-69. [PubMed] [DOI] |
| 22. | Masui T, Doi R, Koshiba T, Fujimoto K, Tsuji S, Nakajima S, Koizumi M, Toyoda E, Tulachan S, Ito D. RECK expression in pancreatic cancer: its correlation with lower invasiveness and better prognosis. Clin Cancer Res. 2003;9:1779-1784. [PubMed] |
| 23. | Kim NY, Lee JE, Chang HJ, Lim CS, Nam DH, Min BH, Park GH, Oh JS. Gamma-irradiation enhances RECK protein levels in Panc-1 pancreatic cancer cells. Mol Cells. 2008;25:105-111. [PubMed] |
| 24. | Tian QS, Li DC. Lentivirus-mediated reversion-inducing cysteine-rich protein with Kazal motifs gene transfer suppresses pancreatic cancer invasion in vitro. Saudi Med J. 2010;31:752-758. [PubMed] |
| 25. | Takagi S, Simizu S, Osada H. RECK negatively regulates matrix metalloproteinase-9 transcription. Cancer Res. 2009;69:1502-1508. [PubMed] [DOI] |
| 26. | Hurley LH, Reck T, Thurston DE, Langley DR, Holden KG, Hertzberg RP, Hoover JR, Gallagher G, Faucette LF, Mong SM. Pyrrolo[1,4]benzodiazepine antitumor antibiotics: relationship of DNA alkylation and sequence specificity to the biological activity of natural and synthetic compounds. Chem Res Toxicol. 1988;1:258-268. [PubMed] [DOI] |
| 27. | Furumoto K, Arii S, Mori A, Furuyama H, Gorrin Rivas MJ, Nakao T, Isobe N, Murata T, Takahashi C, Noda M. RECK gene expression in hepatocellular carcinoma: correlation with invasion-related clinicopathological factors and its clinical significance. Reverse-inducing--cysteine-rich protein with Kazal motifs. Hepatology. 2001;33:189-195. [PubMed] [DOI] |
| 28. | Smalley W, Ray WA, Daugherty J, Griffin MR. Use of nonsteroidal anti-inflammatory drugs and incidence of colorectal cancer: a population-based study. Arch Intern Med. 1999;159:161-166. [PubMed] [DOI] |
| 29. | Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM, Edwards DA, Flickinger AG, Moore RJ, Seibert K. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors. Cancer Res. 2000;60:1306-1311. [PubMed] |