修回日期: 2012-01-09
接受日期: 2012-02-06
在线出版日期: 2012-02-08
目的: 探讨胃肠道间质瘤(gastrointestinal stromal tumors, GIST)的临床、病理和免疫组织化学特征.
方法: 收集澳门仁伯爵医院及北京医院2002-01/2008-07资料完整GIST患者138例的临床、手术及病理资料、免疫组织化学测得的CD117、CD34、SMA、Desmin、S100蛋白表达结果, 回顾性分析GIST临床与病理的特点及关系.
结果: 138例间质瘤位于胃90例(65.22%), 小肠36例(26.09%), 结直肠9例(6.52%), 腹膜后3例(2.17%); 最大直径1-14 cm. 瘤组织由梭形细胞和/或上皮样细胞构成. 梭形细胞: 形态较一致, 呈长梭形, 胞质丰富, 嗜酸性, 胞核呈杆状或腊肠样或长梭形, 大多数似平滑肌细胞, 少许似神经鞘或神经纤维细胞; 上皮样细胞: 体积较大, 形态不一, 呈多角形或卵圆形, 胞质空亮或微嗜酸性, 核周出现亮区, 核形多样与核分裂数成正比. 梭形细胞型114例(82.61%), 上皮样细胞型6例(4.35%), 混合型18例(13.04%); 核分裂小于或等于5个/50 HPF 99例, 5-10个/50 HPF 24例, 大于10个/50 HPF 15例. 免疫组织化学阳性表达率为CD117 97.38%, CD34 73.91%, SMA 6.52%, Desmin2.17%, S100 2.17%; 良性肿瘤24例(17.39%), 低度恶性潜力39例(28.26%), 中度恶性潜力33例(23.91%), 高度恶性潜力21例(15.22%), 恶性21例(15.22%).
结论: GIST具有独特的临床特征; CD117对GIST的诊断具有较高的特异性和敏感性, 但与CD34、SMA、Desmin、S100等同时检测有助于GIST的诊断; GIST良恶性的评估取决于肿瘤的部位、大小和核分裂数的多少.
引文著录: 罗庆锋, 刘继喜, 刘晓, 许乐. 胃肠间质瘤的临床及病理特征分析138例. 世界华人消化杂志 2012; 20(4): 332-335
Revised: January 9, 2012
Accepted: February 6, 2012
Published online: February 8, 2012
AIM: To explore the clinical, pathologic and immunohistochemical characteristics of gastrointestinal stromal tumors (GISTs).
METHODS: The clinical, surgical, immunohistochemical and pathologic data for 138 patients with GISTs were retrospectively analyzed. The expression of CD117, CD34, SMA, Desmin and S-100 was detected using the Envision immunohistochemical method.
RESULTS: The lesion was located in the stomach in 90 cases (65.22%), in the small intestine in 36 cases (26.09%), in the colorectum in 9 cases (6.52%), and in the retroperitoneum in 3 cases (2.17%). Of 138 cases, 114 were detected as spindle type, 6 as epithelioid type, 18 as mixture type; 99 had mitotic figures ≤5/50 HPF, 24 had mitotic figures 5-10/50 HPF, 15 had mitotic figures >10/50 HPF; 97.38% were positive for CD117, 73.91% for CD34, 6.52% for SMA, 2.17% for Desmin, 2.17% for S100 (2.17%); 24 (17.39%) were benign, 39 (28.26%) had low tendency of malignancy, 33 (23.91%) had moderate tendency of malignancy, 21 (15.225%) had high tendency of malignancy, 21 (15.22%) were malignant.
CONCLUSION: GISTs have unique clinical and pathologic characteristics. CD117 detection has high specificity and sensitivity in diagnosing GISTs. Detecting CD34, SMA, Desmin, and S100 together can help diagnose GISTs. The malignancy of GISTs depends on the size, location and mitotic count of the lesion.
- Citation: Luo QF, Liu JX, Liu X, Xu L. Clinical and pathological features of gastrointestinal stromal tumors: an analysis of 138 cases. Shijie Huaren Xiaohua Zazhi 2012; 20(4): 332-335
- URL: https://www.wjgnet.com/1009-3079/full/v20/i4/332.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i4.332
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是发生于胃肠道的非上皮性肿瘤, 有其独特的临床及病理特征. 过去由于认识及诊断方法的不足, 很多被误诊为平滑肌瘤或神经源性肿瘤, 但是GIST与平滑肌瘤或神经源性肿瘤在发病机制、生物学行为、病理特征及治疗和预后上均有很大不同, 研究GIST的临床病理特征对临床正确的诊断和治疗是非常重要的. 因此, 我们对GIST患者138例的临床及病理资料进行了综合分析, 以提高对GIST的认识.
收集澳门仁伯爵医院及北京医院2002-01/2008-07资料完整的诊断为GIST的患者共138例. 其中男78例、女60例. 年龄42-85岁, 平均年龄(62.9±17.7)岁.
1.2.1 病理方法: 所有组织均为手术切除后标本, 经10%甲醛固定, 常规石蜡包埋, 切片, HE染色, 光镜观察; 免疫组织化学用Enision两步法, 染色步骤和抗体稀释度均按产品说明书进行, 对照用试剂盒所带切片, C-KIT(CD117)、CD34、SMA、S-100、Desmin抗体均购自丹麦Dako公司. 结果判定: 按照试剂盒要求, 阳性细胞为棕黄色着色颗粒, 阳性颗粒定位于细胞质或细胞膜, 不着色或着色强度与背景无差异为阴性.
1.2.2 良恶性的判断: 参照2002年Fletcher等提出的GIST恶性危险度分级标准[1].
统计学处理 采用χ2检验并分析良恶性与肿瘤大小及核分裂数的关系.
138例间质瘤位于胃90例(65.22%), 小肠36例(26.09%, 其中十二指肠6例), 结直肠9例(6.52%), 腹膜后3例(2.17%); 最大直径1-14 cm.
严重症状是消化系出血, 许多患者以非特异性腹部症状或其他原因就诊检查时发现. 消化系出血51例(41.30%), 腹部包块 (或伴肠梗阻)24例(17.39%)腹部不适、腹胀、腹痛、纳差36例(26.09%), 无症状或其他原因就诊、检查时偶然发现21例(15.22%).
肿块呈圆形、椭圆形、分叶状或结节状. 良性者呈膨胀性生长, 周界清楚, 切面灰白色、编织状、质韧, 中等硬度, 一般无出血坏死. 恶性者肿瘤可浸润黏膜、肌层或周围组织, 周界欠清, 切面质细, 似鱼肉状, 常见坏死、出血、囊性变. 交界性的肉眼多同良性, 但切面可有出血、坏死、囊性变.
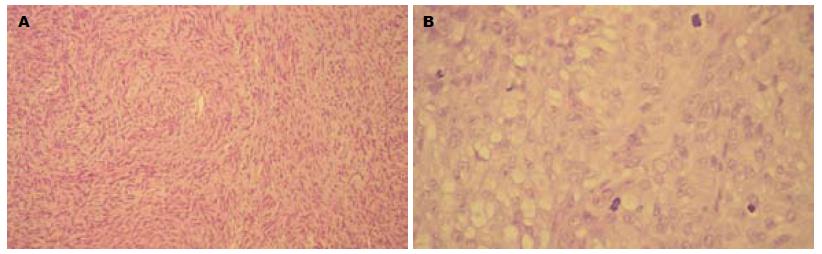
瘤组织由梭形细胞和/或上皮样细胞构成. 梭形细胞: 形态较一致, 呈长梭形, 胞质丰富, 嗜酸性, 胞核呈杆状或腊肠样或长梭形, 大多数似平滑肌细胞, 少许似神经鞘或神经纤维细胞; 上皮样细胞: 体积较大, 形态不一, 呈多角形或卵圆形, 胞质空亮或微嗜酸性, 核周出现亮区, 核形多样性程度与核分裂数成正比. 梭形细胞型114例(82.61%), 上皮样细胞型6例(4.35%), 混合型18例(13.04%); 核分裂计数小于或等于5个/50 HPF 99例, 6-10个/50 HPF 24例, 大于10个/50 HPF 15例(图1).
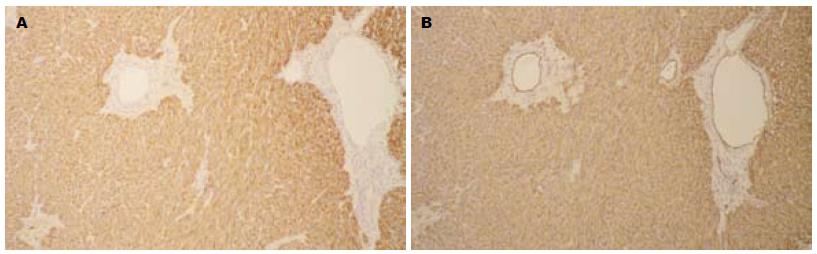
阳性表达率为CD117 97.38%, CD34 73.91%, SMA 6.52%, Desmin 2.17%, S100 2.17%, 1例CD117阴性者来自腹膜后腔, 不除外为成肌纤维瘤(图2).
良性24例(17.39%), 低度恶性潜力39例(28.26%), 中度恶性潜力33例(23.91%), 高度恶性潜力21例 (15.225%), 恶性21例(15.22%). 其中良性与恶性及高度恶性潜力与肿瘤大小(χ2 = 9.41, P<0.0 5 )、核分裂计数相关(χ2 = 8.76, P<0.05, 表1).
| 有丝分裂相计数 | 肿瘤大小 | 良性 | 低度恶性潜力 | 中度恶性潜力 | 高度恶性潜力 | 恶性 |
| ≤5/50HPF | ≤2 cm | 21 | 0 | 0 | 0 | 0 |
| >2 ≤5 cm | 3 | 21 | 9 | 0 | 0 | |
| >5 ≤10 cm | 0 | 18 | 21 | 0 | 0 | |
| >10 cm | 0 | 0 | 0 | 6 | 0 | |
| >5/50HPF | ≤2 cm | 0 | 0 | 0 | 0 | 0 |
| >2 ≤ 5 cm | 0 | 0 | 3 | 0 | 0 | |
| >5 ≤10 cm | 0 | 0 | 0 | 12 | 15 | |
| >10 cm | 0 | 0 | 0 | 3 | 6 |
GIST是最常见的消化系间质肿瘤, 主要发病于中老年人, 中位发病年龄为50岁, 男性与女性所占比例无显著差异. 大多数发生于胃, 约占50%-70%; 其次为小肠, 约占20%-30%; 结肠和直肠小于10%; 食管较少见, 约占0%-6%. 本组研究与此分布大致相同. 这种位置分布特点与消化系平滑肌瘤不同, 后者多发生于食道及胃, 而小肠很少见. GIST还可发生于消化系以外的腹膜腔如肠系膜、网膜、腹膜后等. GIST发生位置与恶性程度有一定相关性, 如小肠及消化系以外的腹膜腔发生的GIST较胃恶性度高.
GIST的症状无特异性, 其表现与肿瘤的部位、大小和生长方式有关. GIST以向壁内或壁外生长为主, 也可呈纺锤形同时向壁内外生长. 患者多表现为腹痛、腹胀、腹部不适、纳差等非特异症状或其他原因就诊进一步检查时发现GIST病灶. 最常见的症状是消化系出血, GIST组织富血管化明显, 当肿瘤表面溃疡形成时容易导致消化系出血. 可触及的腹部肿块也是较常见的症状, 此时多为恶性或高度恶性风险. 部分可出现肠梗阻而急症就诊. 约20%的患者首诊时已发生转移, 最常转移至肝脏和腹膜, 较少累及淋巴结, 腹部以外的转移少见.
GIST主要有3种细胞类型, 一型为梭形细胞型, 约占GIST病例的70%-80%, 另一型为上皮样型, 约占GIST 病例的20%-30%, 部分病例为两型细胞均有的混合型. 肿瘤内可有不同程度的炎症细胞浸润以及出血与坏死灶.
GIST普遍表达CD117抗原, 免疫组化表现为弥漫强阳性表现. CD117 抗原是表面酪氨酸激酶受体(c-Kit)细胞外功能区的一个抗原决定簇, 其配体是干细胞因子(SCF). 大约5%的GIST Kit 染色弱或呈阴性, Medeiros等[2-5]提出与KIT阳性者相比, KIT阴性者GIST在形态学上多倾向于上皮细胞型, 包括PDGFRA突变型, 多起源于网膜/腹膜表面. CD34敏感性不高, CD34在GIST阳性率报道约为56%-83%, 由于许多其他梭形细胞肿瘤也表现为CD34阳性, 因此CD34的特异性差. 各种肌源性(如SMA, Desmin)或神经源性免疫标记(如S-100)GIST表达均很低, c-KIT和CD34在典型的平滑肌瘤和神经鞘瘤均为阴性.
肿瘤大小和有丝分裂数仍是判断GIST恶性程度的最公认的指标[6,7]. 随后的研究发现不同部位的GIST在相同的肿瘤大小和核分裂数下, 恶性程度并不完全一致, 因此, GIST的恶性程度与部位相关, 肿瘤部位也是预测原发GIST切除术后复发的独立因素(小肠GIST术后复发率最高)[8-10]. 明确浸润性生长和发生复发转移的GIST 是完全恶性的, 无需作危险度分级. 基因突变位点的不同与肿瘤的恶性程度也相关, 虽然不是独立的预后因素, 但是kit外显子9和11突变的GIST术后复发率较高, 而野生型的患者复发率居中[9]. 另外, 部分研究认为肿瘤细胞多形性的程度、细胞形态(如上皮样型较梭形细胞型恶性度高)、年龄与恶性度有一定相关性.
由于GIST对放疗、化疗均不敏感, 临床上GIST的主要治疗手段是手术治疗. 完整切除肿瘤, 保证切缘阴性是关键[9,11,12]. 术中避免肿瘤破溃与播散, 这是影响GIST预后的重要因素. 只有发现淋巴结有转移的证据时, 才行淋巴结切除术. 若有区域淋巴结转移但没有远处转移, 行区域淋巴结清扫能降低局部复发率和提高生存率. 因为GIST没有跳跃式的淋巴结转移, 所以对GIST并不主张常规行周围淋巴结清扫[9,11,13]. 分子靶向治疗药物甲磺酸伊马替尼(Imatinib Mesylate)是一种选择性的小分子酪氨酸激抑制剂(tyrosine kinase inhibitor, TKI), 能阻断KIT的ATP结合位点, 干扰其信号转导过程, 从而抑制GIST细胞增殖, 促进凋亡, 用于治疗恶性转移性及手术无法切除的GIST[11,14,15].
总之, GIST作为一种概念上较新的肿瘤类型, 许多问题仍有待研究. 随着对GIST认识的进一步加深, 治疗规范的逐渐形成, GIST的治疗效果也将进一步提高.
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是发生于胃肠道的非上皮性肿瘤, 有其独特的临床及病理特征. 过去由于认识及诊断方法的不足, 很多被误诊为平滑肌瘤或神经源性肿瘤, 研究GIST的临床病理特征对临床正确的诊断和治疗是非常重要的.
张小晋, 主任医师, 北京积水潭医院消化内科
GIST作为一种概念上较新的肿瘤类型, 许多问题仍有待研究. 随着对GIST认识的进一步加深, 治疗规范的逐渐形成, GIST的治疗效果也将进一步提高.
Medeiros等提出与KIT阳性者相比, KIT阴性者GIST在形态学上多倾向于上皮细胞型, 包括PDGFRA突变型, 多起源于网膜/腹膜表面.
本文总结内容较全面, 138例患者都有病理诊断和免疫组织化学的分析, 是一篇对临床消化科医生有帮助和参考的病例总结.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, Miettinen M, O'Leary TJ, Remotti H, Rubin BP. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol. 2002;33:459-465. [PubMed] [DOI] |
| 2. | Medeiros F, Corless CL, Duensing A, Hornick JL, Oliveira AM, Heinrich MC, Fletcher JA, Fletcher CD. KIT-negative gastrointestinal stromal tumors: proof of concept and therapeutic implications. Am J Surg Pathol. 2004;28:889-894. [PubMed] [DOI] |
| 3. | González-Cámpora R, Delgado MD, Amate AH, Gallardo SP, León MS, Beltrán AL. Old and new immunohistochemical markers for the diagnosis of gastrointestinal stromal tumors. Anal Quant Cytol Histol. 2011;33:1-11. [PubMed] |
| 4. | Lucas DR. Clinicopathology and molecular diagnostics of gastrointestinal stromal tumors. Curr Probl Cancer. 2011;35:233-244. [PubMed] [DOI] |
| 5. | Miettinen M, Lasota J. Histopathology of gastrointestinal stromal tumor. J Surg Oncol. 2011;104:865-873. [PubMed] [DOI] |
| 6. | Raut CP, DeMatteo RP. Prognostic factors for primary GIST: prime time for personalized therapy? Ann Surg Oncol. 2008;15:4-6. [PubMed] [DOI] |
| 7. | DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg. 2000;231:51-58. [PubMed] [DOI] |
| 8. | Dematteo RP, Gold JS, Saran L, Gönen M, Liau KH, Maki RG, Singer S, Besmer P, Brennan MF, Antonescu CR. Tumor mitotic rate, size, and location independently predict recurrence after resection of primary gastrointestinal stromal tumor (GIST). Cancer. 2008;112:608-615. [PubMed] [DOI] |
| 9. | 何 裕隆. 提高胃肠间质瘤的诊治水平. 中华普通外科学文献(电子版). 2008;2:258-261. |
| 12. | Caram MV, Schuetze SM. Advanced or metastatic gastrointestinal stromal tumors: systemic treatment options. J Surg Oncol. 2011;104:888-895. [PubMed] [DOI] |
| 13. | Rossi CR, Mocellin S, Mencarelli R, Foletto M, Pilati P, Nitti D, Lise M. Gastrointestinal stromal tumors: from a surgical to a molecular approach. Int J Cancer. 2003;107:171-176. [PubMed] |
| 14. | Gastrointestinal stromal tumors. Int J Colorectal Dis. 2011; Nov 29. [Epub ahead of print]. [PubMed] |