修回日期: 2011-12-31
接受日期: 2012-02-06
在线出版日期: 2012-02-08
目的: 研究食管癌发病过程中染色质解旋酶DNA结合蛋白5(Chromodomain helicase DNA-binding protein 5, CHD5)基因表观遗传学改变, 探讨CHD5基因甲基化作为食管癌诊断标志物的可行性.
方法: 用甲基化特异性聚合酶链反应(methylation specific PCR, MSP)检测72例食管癌组织及成对癌旁组织, 9例正常食管黏膜组织及4株食管癌细胞系中CHD5基因的甲基化状态, 并用逆转录聚合酶链式反应(RT-PCR)检测CHD5基因在上述食管癌细胞系的表达.
结果: 69%(50/72)食管癌组织发生CHD5基因启动子区甲基化, 32%(23/72)癌旁组织发生甲基化, 差异具有统计学意义(χ2 = 20.254, P<0.05). 9例食管正常组织未发生甲基化, 2株食管癌细胞系中由于基因启动子区甲基化导致CHD5基因表达缺失, 经5-aza-deoxycytidine处理96 h后CHD5重新表达.
结论: 食管癌中CHD5基因频繁发生甲基化, 表观遗传学改变是其基因表达的重要调节机制, CHD5基因甲基化有可能作为食管癌诊断的标志物.
引文著录: 陈香宇, 何巧玉. CHD5基因在食管癌中的表观遗传学改变. 世界华人消化杂志 2012; 20(4): 323-326
Revised: December 31, 2011
Accepted: February 6, 2012
Published online: February 8, 2012
AIM: To investigate epigenetic changes of the chromodomain helicase DNA-binding protein 5 (CHD5) gene during esophageal carcinogenesis, and to explore the possibility of using CHD5 promoter methylation as a marker for human esophageal cancer.
METHODS: Methylation-specific polymerase chain reaction (MSP) was used to detect the methylation status of CHD5 in 72 cases of esophageal cancer and matched tumor-adjacent tissue, 9 cases of normal esophageal mucosa, and 4 esophageal cancer cell lines. Reverse transcription-polymerase chain reaction (RT-PCR) was performed to detect the expression of CHD5 in esophageal cancer cell lines mentioned above.
RESULTS: CHD5 methylation was detected in 69% (50∕72) of cases of esophageal cancer and 32% (23∕72) of cases of matched tumor-adjacent tissue (χ2 = 20.254, P < 0.05), but not detected in 9 cases of normal esophageal mucosa. Loss of CHD5 expression was found in 2 esophageal cancer cell lines which showed CHD5 promoter methylation, and after treatment with 5-aza-deoxycytidine for 96 h, CHD5 was re-expressed.
CONCLUSION: CHD5 is frequently methylated in esophageal cancer. Epigenetic change may be an important mechanism for regulation of CHD5 expression, and CHD5 promoter methylation may be used as a marker for human esophageal cancer.
- Citation: Chen XY, He QY. Methylation of CHD5 in human esophageal cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(4): 323-326
- URL: https://www.wjgnet.com/1009-3079/full/v20/i4/323.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i4.323
食管癌是人类常见的消化系恶性肿瘤之一, 以鳞状上皮癌多见, 近20年发病率在全球范围呈上升趋势, 每年约380 000患者死于该病[1,2]. 我国是世界上食管癌的高发国家, 也是世界上食管癌高死亡率的国家之一. 目前对于食管癌的治疗包括手术、放疗、化疗、内镜下治疗和综合治疗. 但食管癌的早期诊断是本病根治的关键, 目前食管癌的确切发病机制尚不清楚, 近年, 表观遗传学在肿瘤的发病机制研究中越来越受到重视. 认为肿瘤表观遗传学标志物可以用于疾病的早期诊断、转移、复发、生存期、耐药、化疗敏感性等的判断指标[3,4]. 染色质解旋酶DNA结合蛋白5(CHD5)基因是chromodomain超家族的一员, 定位于人染色体1p36上, 是2003年新发现的抑癌基因. 研究发现CHD5基因表达的缺失与人类多种肿瘤相关, 如神经母细胞瘤、黑色素瘤、血液系统的恶性肿瘤和上皮源性的恶性肿瘤[5]. CHD5基因启动子区异常甲基化导致该基因沉默在不同的人类肿瘤中已有报道[6], 但食管癌中该基因的甲基化状态及表达在国内外尚缺乏研究. 本研究拟对CHD5基因在食管癌发病过程中的表观遗传学改变进行研究, 探讨CHD5基因启动子区异常甲基化与该基因表达的关系, 寻找食管癌潜在的早期诊断标志物.
1.1 食管癌组织收集及DNA提取 72例食管癌组织及成对癌旁组织均来自安阳市肿瘤医院, 所有患者均经病理诊断为食管癌. 9例食管正常黏膜组织由内镜下取自非肿瘤患者食管上皮组织. 所有病例均经该院伦理委员会审核同意. DNA提取采用酚、氯仿抽提, 乙醇沉淀法, 溶于TE缓冲液, 紫外分光光度仪(A260/280)检测其含量和浓度, 并于-20 ℃保存备用.
1.2.1 食管癌细胞系DNA及总RNA制备: 食管癌细胞系KYSE70、KYSE140、SKGT4及YES2由本实验室保存. 培养基为RPMI1640(北京钮因华信科技发展有限公司), GIBCO胎牛血清(invitrogen)及青、链霉素. 待细胞70%融合时, 分别提取总RNA及DNA. DNA提取方法与组织相同. 总RNA提取采用Trizol试剂(Life Technologies), 紫外分光光度仪检测含量和纯度.
1.2.2 5-aza-dc(Sigma)体外诱导食管癌细胞系去甲基化: 将KYSE70、KYSE140、SKGT4及YES2接种于75 mL培养瓶中过夜, 据生长速度决定接种时密度. 向培养基中加入5-aza-dc至终浓度2 µmol/L, 每24 h更换1次培养基后用Trizol提取总RNA, 连续处理96 h.
1.2.3 甲基化特异PCR(MSP)检测食管癌CHD5启动子甲基化: 取2 µg DNA用于亚硫酸氢钠修饰, 详见文献[7]. 取修饰后DNA用于PCR扩增, 每个PCR反应体系为: 2 µL修饰后DNA, 2.5 µL的10×PCR buffer, dNTP 2 µL, Taq酶0.2 µL, 上下引物各0.5 µL, 双蒸水定容至25 µL. CHD5启动子甲基化引物为: CHD5-ML: 5'-TTAAGGTAGTTTTAAGATTTGTCGTC-3', CHD5-MR: 5'-TACGAATCTACGATATCTATACCCA-3'. CHD5基因启动子区非甲基化引物为: CHD5-UL: 5'-TTTTTAAGGTAGTTTTAAGATTTGTTGTT-3', CHD5-UR: 5'-TACAAATCTACAATATCTATACCCAAAA-3'. 两对引物加入同一反应体系中[8]. PCR反应条件如下: 95 ℃×10 min; 95 ℃×30 s, 53 ℃×30 s, 72 ℃×30 s, 35 circles; 72 ℃×10 min结束反应. 扩增产物各取10 µL, 2%琼脂糖凝胶电泳进行检测.
1.2.4 RT-PCR检测食管癌细胞系CHD5基因表达: 根据逆转录操作试剂盒(invitrogen)说明将RNA逆转录为cDNA. 取2.5 µL稀释后(稀释倍数为5倍)逆转录产物用于PCR扩增. GAPDH作为内参对照. GAPDH引物序列: GAPDH-F: 5'-GACCACAGTCCATGCCATCAC-3', GAPDH-R: 5'-GTCCACCACCCTGTTGCTGTA-3'(扩增产物为454 bp). CHD5引物序列: CHD5F: 5'-TGGAGGAGGTGGAGCGGGAAAT-3', CHD5R: 5'-CCTTCCGCTGTCGGGCATTG-3'. 两对引物加入同一反应体系中. PCR扩增条件: 95 ℃×5 min; 94 ℃×30 s, 64 ℃×30 s, 72 ℃×40 s, 3个循环; 94 ℃×30 s, 61 ℃×30 s, 72 ℃×40 s, 3个循环; 94 ℃×30 s, 58 ℃×30 s, 72 ℃×40 s, 3个循环; 94 ℃×30 s, 55 ℃×30 s, 72 ℃×40 s, 28个循环; 72 ℃×5 min结束. 扩增产物为390 bp. 各取10 µL PCR产物上样, 2%琼脂糖凝胶电泳检测.
统计学处理 采用χ2检验分析在食管癌组织及成对癌旁组织中CHD5基因甲基化水平的差异. 数据采用SPSS17.0统计软件包进行统计分析.
72例食管癌组织中有50例CHD基因发生甲基化, 甲基化率为69%, 72例成对癌旁组织中有23例发生甲基化, 甲基化率为32%, 差异有统计学意义(χ2 = 20.254, P<0.05). 9例正常食管黏膜组织CHD5基因均未发生甲基化(图1).
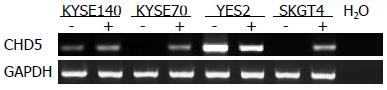
4株食管癌细胞系中, SKGT4和KYSE70两株细胞系CHD5基因启动子区发生甲基化, 通过RT-PCR进一步检测4株食管癌细胞系中CHD5基因的表达情况. 结果显示: CHD5基因在YES2、KYSE140中有表达, 而KSKGT4和KYSE70 2株细胞系中CHD5表达缺失, 于SKGT4、KYSE702细胞系培养基中加入5-aza-dc干预96 h后, RT-PCR结果发现CHD5基因重新表达(图2).
表观遗传学是研究基因组DNA序列未发生变化、而基因表达及基因功能的诱导和维持却发生可遗传变化的科学. 表观遗传是指在没有DNA序列变化的基础上, 基因表达状态的可遗传性的改变. 目前的研究情况表明, 表观遗传学变化主要集中在3大方面: DNA甲基化修饰、组蛋白修饰、非编码RNA的调控作用. 3者相互作用, 共同决定复杂的生物学过程. 任何一种修饰的异常都可诱导基因表达异常从而导致肿瘤或其他疾病的发生, 并且肿瘤表观遗传学标志物可以应用于早期诊断及转移、复发、生存期、耐药、化疗敏感性等判断指标[3,4].
DNA甲基化是目前研究最多的表观遗传学修饰方式, DNA甲基化是指生物体在DNA甲基转移酶(DNA methyltransferase, DNMT)的催化下, 以S-腺苷甲硫氨酸(SAM)为甲基供体, 将甲基转移到特定的碱基上的过程[9]. 多数研究表明基因启动子区异常甲基化是导致许多抑癌基因转录缺失的常见机制, 包括在食管癌中, 已报道的频繁发生甲基化的基因有: GATA4、GATA5、hMLH1等[10,11].
CHD5是2003年新发现的1个基因, 定位于1号染色体短臂3区6带(1p36), 该区域在很多人类肿瘤中发生缺失, 提示该区域可能存在1个抑癌基因[12,13]. 有研究报道, 在多项人类肿瘤中发现该区域CHD5基因表达缺失, 如Brodeur研究小组[14]在神经母细胞瘤中发现该区域几乎检测不到CHD5基因表达, 而Maser等[15]在染色体不稳定性淋巴瘤小鼠模型中同样检测出该区域CHD5基因表达的缺失. 上述研究表明, CHD5基因可能是该区域最重要的潜在抑癌基因.
本研究发现CHD5在食管癌中频繁发生甲基化, 明显高于成对癌旁组织, 表明CHD5基因启动子区的甲基化可能与食管癌的发病相关, 参与了食管癌的发病机制, CHD5基因启动子区甲基化可能成为食管癌的肿瘤标志物. 而正常食管黏膜无甲基化, 提示CHD5基因甲基化具有肿瘤相关性, 而非组织特异性.
对食管癌细胞系的研究发现, CHD5在食管癌细胞系SKGT4及KYSE70中表达缺失, 通过5-aza-dc干预96 h后, CHD5基因重新表达. 进一步通过甲基化特异PCR检测发现, CHD5基因在上述2个细胞系中存在基因启动子区的甲基化, 与RT-PCR结果相符. 表明启动子区异常甲基化影响CHD5基因的转录, 导致该基因表达的沉默. 另外, Bagchi等[14,16]通过RNA干扰技术, 在小鼠模型中发现CHD5基因是4.3 Mb染色体区段内通过p19Arf/p53信号通路调控细胞增殖、衰老、及凋亡的基因. 然而, 其在食管癌中是否具有调控细胞增殖及凋亡的作用, 还需进一步研究.
总之, 我们证明了CHD5基因在食管癌中频繁发生甲基化, 启动子区甲基化所致CHD5基因表达沉默是食管癌发生的重要机制之一.
目前食管癌的确切发病机制尚不清楚. 近年, 表观遗传学在肿瘤的发病机制研究中越来越受到重视, DNA甲基化是目前研究最多的表观遗传学修饰方式, 多数研究表明基因启动子区异常甲基化是导致许多抑癌基因转录缺失的常见机制.
代智, 副研究员, 复旦大学附属中山医院肝癌研究所
Brodeur研究小组在神经母细胞瘤中发现该区域几乎检测不到CHD5基因表达, 而Maser等在染色体不稳定性淋巴瘤小鼠模型中同样检测出该区域CHD5基因表达的缺失.
本研究对CHD5基因在食管癌发病过程中的表观遗传学改变进行研究, 探讨CHD5基因启动子区异常甲基化与该基因表达的关系, 寻找食管癌潜在的早期诊断标志物.
在食管癌中CHD5基因的甲基化状态及表达在国内外尚缺乏研究, 因此该研究有很强的创新性, 研究结果也具有很好的临床价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Pohl H, Welch HG. The role of overdiagnosis and reclassification in the marked increase of esophageal adenocarcinoma incidence. J Natl Cancer Inst. 2005;97:142-146. [PubMed] [DOI] |
| 3. | Smits KM, Cleven AH, Weijenberg MP, Hughes LA, Herman JG, de Bruïne AP, van Engeland M. Pharmacoepigenomics in colorectal cancer: a step forward in predicting prognosis and treatment response. Pharmacogenomics. 2008;9:1903-1916. [PubMed] [DOI] |
| 4. | Garber K. Momentum building for human epigenome project. J Natl Cancer Inst. 2006;98:84-86. [PubMed] [DOI] |
| 5. | White PS, Thompson PM, Gotoh T, Okawa ER, Igarashi J, Kok M, Winter C, Gregory SG, Hogarty MD, Maris JM. Definition and characterization of a region of 1p36.3 consistently deleted in neuroblastoma. Oncogene. 2005;24:2684-2694. [PubMed] [DOI] |
| 6. | Mulero-Navarro S, Esteller M. Chromatin remodeling factor CHD5 is silenced by promoter CpG island hypermethylation in human cancer. Epigenetics. 2008;3:210-215. [PubMed] [DOI] |
| 7. | Zerilli F, Bonanno C, Shehi E, Amicarelli G, Adlerstein D, Makrigiorgos GM. Methylation-specific loop-mediated isothermal amplification for detecting hypermethylated DNA in simplex and multiplex formats. Clin Chem. 2010;56:1287-1296. [PubMed] [DOI] |
| 10. | Guo M, House MG, Akiyama Y, Qi Y, Capagna D, Harmon J, Baylin SB, Brock MV, Herman JG. Hypermethylation of the GATA gene family in esophageal cancer. Int J Cancer. 2006;119:2078-2083. [PubMed] [DOI] |
| 11. | Tzao C, Hsu HS, Sun GH, Lai HL, Wang YC, Tung HJ, Yu CP, Cheng YL, Lee SC. Promoter methylation of the hMLH1 gene and protein expression of human mutL homolog 1 and human mutS homolog 2 in resected esophageal squamous cell carcinoma. J Thorac Cardiovasc Surg. 2005;130:1371. [PubMed] [DOI] |
| 12. | Bagchi A, Mills AA. The quest for the 1p36 tumor suppressor. Cancer Res. 2008;68:2551-2556. [PubMed] [DOI] |
| 13. | Isidor B, Le Cunff M, Boceno M, Boisseau P, Thomas C, Rival JM, David A, Le Caignec C. Complex constitutional subtelomeric 1p36.3 deletion/duplication in a mentally retarded child with neonatal neuroblastoma. Eur J Med Genet. 2008;51:679-684. [PubMed] [DOI] |
| 14. | Okawa ER, Gotoh T, Manne J, Igarashi J, Fujita T, Silverman KA, Xhao H, Mosse YP, White PS, Brodeur GM. Expression and sequence analysis of candidates for the 1p36.31 tumor suppressor gene deleted in neuroblastomas. Oncogene. 2008;27:803-810. [PubMed] [DOI] |