修回日期: 2012-01-10
接受日期: 2012-02-06
在线出版日期: 2012-02-08
目的: 探讨鞘胺醇激酶1(SphK1)对结肠癌lovo细胞增殖、迁移和凋亡的影响及其作用机制.
方法: 培养人结肠癌lovo细胞株, 实验分3组: 对照组、PMA组和DMS组. PMA组加入佛波醇-12-豆蔻酸酯-13-乙酸酯(PMA, 100 nmol/L), DMS组加入N, N-二甲基鞘胺醇(DMS, 50 µmol/L), 对照组加入等量的培养基. 采用MTT法和克隆形成实验检测细胞生长增殖的变化, 流式细胞术检测细胞凋亡, Tranwell小室模型观察细胞迁移能力的变化, RT-PCR检测mRNA的表达, Western blot检测蛋白的表达.
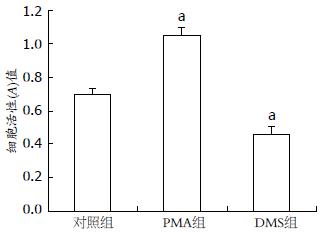
结果: PMA显著促进细胞的增殖、迁移并抑制细胞的凋亡, DMS则显著抑制细胞的增殖、迁移并促进细胞的凋亡(对照组、PMA组和DMS组的细胞增殖活力: 0.71±0.03 vs 1.05±0.05 vs 0.46±0.04; 克隆形成率: 1.32%±0.26% vs 2.17%±0.17% vs 0.73%±0.13%; 凋亡率: 16.25% vs 9.15% vs 32.58%; 迁移细胞数: 72.19±3.36 vs 98.46±6.25 vs 40.48±4.27; 均P<0.05). PMA显著促进黏着斑激酶(FAK)的活性和表达, 相反DMS则抑制FAK的活性和表达[对照组、PMA组和DMS组FAK mRNA的表达强度: 0.151±0.008 vs 0.212±0.014 vs 0.114±0.021; 蛋白: 0.332±0.022 vs 0.374±0.029 vs 0.296±0.018; 磷酸化FAK(p-FAK Tyr 397)蛋白: 0.186±0.032 vs 0.234±0.017 vs 0.112±0.023; 均P<0.05].
结论: SphK1可促进lovo细胞的增殖和迁移能力并抑制细胞的凋亡, 其机制可能是通过激活FAK通路而发挥作用.
引文著录: 苏颖洁, 黄杰安, 刘诗权, 钟月圆, 覃蒙斌. SphK1对结肠癌lovo细胞的增殖、迁移和凋亡的影响. 世界华人消化杂志 2012; 20(4): 276-281
Revised: January 10, 2012
Accepted: February 6, 2012
Published online: February 8, 2012
AIM: To investigate the effect of sphingosine kinase 1 (SphK1) on the proliferation, apoptosis and migration of colon cancer cells and to explore the molecular mechanisms involved.
METHODS: Cultured lovo cells were divided into three groups: PMA group, DMS group and control group. Cells of the PMA group were treated with 100 nmol/L of phorbol 12-myristate 13-acetate (PMA). The DMS group was treated with 50 µmol/L N, N-dimethylsphingosine (DMS), while the control group was treated with equal volume of culture medium. After treatment, cell proliferation was determined by MTT assay and colony formation assay, and cell apoptosis was detected by flow cytometry. Cell migration was assessed using Transwell chamber assays. RT-PCR and Western blot were used to evaluate the mRNA and protein expression of Sphk1 and FAK, respectively.
RESULTS: PMA significantly enhanced cell proliferation and migration but suppressed cell apoptosis, whereas DMS suppressed cell proliferation and migration but enhanced cell apoptosis. Cell viability, colony formation rate, apoptosis rate and number of migrated cells for the control group, PMA group and DMS group were as follows: cell viability: 0.71 ± 0.03, 1.05 ± 0.05 and 0.46 ± 0.04; colony formation rate: 1.32% ± 0.26%, 2.17% ± 0.17% and 0.73% ± 0.13%; apoptosis rate: 16.25%, 9.15% and 32.58%; number of migrated cells: 72.19 ± 3.36 vs 98.46 ± 6.25 vs 40.48 ± 4.27 (all P < 0.05 vs the control group). PMA significantly up-regulated the expression and activity of focal adhesion kinase (FAK), while DMS down-regulated the expression and activity of FAK (FAK mRNA: 0.151 ± 0.008 vs 0.212 ± 0.014 vs 0.114 ± 0.021; FAK protein: 0.332 ± 0.022 vs 0.374 ± 0.029 vs 0.296 ± 0.018; phosphor-FAK protein: 0.186 ± 0.032 vs 0.234 ± 0.017 vs 0.112 ± 0.023; all P < 0.05 vs the control group).
CONCLUSION: SphK1 enhances cell proliferation and migration and suppresses cell apoptosis in human colon cancer cell line lovo possibly by activating FAK.
- Citation: Su YJ, Huang JA, Liu SQ, Zhong YY, Qin MB. Sphingosine kinase 1 enhances cell proliferation and migration and suppresses apoptosis in human colon cancer cell line lovo. Shijie Huaren Xiaohua Zazhi 2012; 20(4): 276-281
- URL: https://www.wjgnet.com/1009-3079/full/v20/i4/276.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i4.276
鞘氨醇激酶1(sphingosine kinase 1, SphK1)不仅是维持细胞内鞘脂平衡的重要限速酶, 而且是调控细胞生命活动的重要代谢酶, 其主要生化功能是磷酸化鞘氨醇生成1-磷酸鞘氨醇(sphingosine 1-phosphate, S1P). 研究表明SphK1/S1P信号通路是调节细胞增殖、迁移和趋化、细胞间的接触和黏附以及肿瘤生长、转移的重要途径之一[1-3], 但其作用机制尚未完全明了. 黏着斑激酶(focal adhesion kinase, FAK)是一种关键的信号转导分子, 是调节与细胞运动相关信号传导通路的"枢纽点"[4-6]. 本研究试图通过调控SphK1的活性, 观察SphK1对结肠癌lovo细胞株的增殖、凋亡及迁移等生物学行为的影响及其对FAK表达的影响, 以期了解SphK1的作用及其分子机制.
人结肠癌lovo细胞株购自南京凯基生物科技发展有限公司; 佛波醇-12-豆蔻酸酯-13-乙酸酯和鼠抗人SphK1单克隆抗体购自美国Sigma-Aldrich公司; 兔抗人FAK单克隆抗体购自美国Cell Signaling Technology公司; 兔抗人p-FAK(Tyr 397)单克隆抗体购自英国Abcam公司; β-actin和二抗购自美国Santa Cruz公司; N, N-二甲基鞘氨醇(DMS)购自德国Merck-Calbiochem公司; 四氮唑蓝(MTT)购自北京索莱宝科技有限公司; 逆转录聚合酶链反应(RT-PCR)试剂购自美国Promega公司; DMEM(高糖型)培养基、胰蛋白酶购自美国Gibco公司; 人工基质Matrigel购自美国BD Biosciences公司.
1.2.1 细胞培养: 人结肠癌lovo细胞采用含100 mL/L胎牛血清的DMEM培养基, 在50 mL/L CO2、37 ℃的培养箱中培养. 取对数生长期细胞重悬, 以5×105/孔接种在6孔板中.
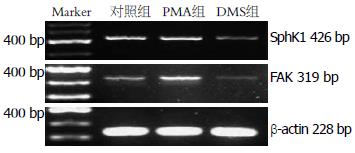
1.2.2 PMA和DMS对FAK和SphK1mRNA表达的影响: 细胞分别加入100 nmol/L的PMA(PMA组)和50 μmol/L的DMS(DMS组), 以生理盐水代药物为对照组, 继续培养24 h, 提取细胞总RNA, 用MMLV逆转录酶合成cDNA. 应用Primer5.0软件设计PCR扩增引物, SphK1: 上游引物5'-ATGCACGAGGTGGTGAACG-3', 下游引物5'-GGAGGCAGGTGTCTTGGAAC-3', 扩增片段长度为426 bp; FAK: 上游引物5'-ACCTCAGCTAGTGACGTATGG-3', 下游引物5'-CGGAGTCCCAGGACACTGTG-3', 扩增片段长度为319 bp; β-actin上游引物为5'-AGCCATGTACGTAGCCATCC-3', 下游引物为5'-CTCTCAGCTGTGGTGGTGAA-3', 扩增片段为228 bp. 取PCR产物电泳, 凝胶电泳成像系统拍照, 图像分析软件测量吸光度(A)值, 以目的条带A值/β-actin条带A值表示细胞各因子mRNA的相对表达水平.
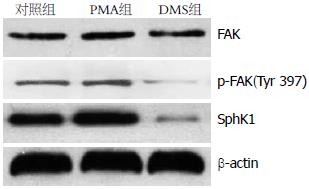
1.2.3 PMA和DMS对FAK蛋白表达的影响: 各组细胞培养24 h后提取总蛋白, 行聚丙烯酰胺凝胶电泳并转膜, 脱脂奶粉进行封闭, 加一抗4 ℃振荡孵育过夜, 再用辣根过氧化物酶标记的二抗37 ℃孵育1 h, 采用增强化学发光盒检测杂交信号, χ线医学胶片上曝光显影, 成像系统拍照, 图像分析软件测量A值, 蛋白相对表达强度 = 目的蛋白A值/β-actin A值.
1.2.4 MTT法检测细胞增殖活力: 常规培养lovo细胞, 取对数生长期细胞, 接种于96孔板, 12 h后细胞贴壁, 分别加入100 nmol/L PMA及50 μmol/L DMS, 空白对照组的细胞用含100 mL/L胎牛血清的培养基培养, 空白调零孔为无细胞等体积的培养基, 每组设3个复孔, 培养24 h后, 每孔加入20 μL(5 g/L)的MTT溶液, 继续培养4 h, 弃上清, 加入DMSO 150 μL避光反应15 min后, 用酶联免疫检测仪在490 nm波长下测定各孔A值, 反映细胞活力.
1.2.5 克隆形成实验检测细胞增殖活性: 将各组细胞分别培养, 取各组细胞, 按1×103个细胞/孔接种于6孔板, 每组接种3孔. 以十字方向轻轻晃动6孔板, 使细胞分散均匀, 置37 ℃、50 mL/L CO2的培养箱中, 静止培养7 d至六孔板出现肉眼可见的克隆, PBS液小心洗涤细胞2次, 甲醇固定5 min, 结晶紫染色15 min, 流水缓慢洗去染色液, 空气干燥, 倒置显微镜下观察其克隆数, 大于或等于50个细胞计为一个克隆, 并计算克隆形成率, 克隆形成率 = (克隆数/接种细胞数)×100%.
1.2.6 流式细胞术检测细胞凋亡率: 取对数生长期细胞, 按1×105个细胞/孔接种于6孔板, 每组接种3孔, 待细胞贴壁后按实验分组干预细胞: 以生理盐水代药物为对照组, PMA组加入终浓度为100 nmol/L PMA, DMS组加入终浓度为50 μmol/L DMS, 干预24 h后用不含EDTA的胰酶消化收集细胞, 然后用PBS洗涤细胞2次(2 000 r/min离心5 min), 收集5×105细胞, 加入500 μL Binding Buffer悬浮细胞, 加入5 μL Annexin V-FITC混匀后, 加入5 μL Propidium Iodide, 混匀, 室温避光反应10 min, 1 h内进行流式细胞仪的观察和检测. 使用未经凋亡诱导处理的空白对照组的细胞进行荧光补偿调节去除光谱重叠和设定十字门的位置.
1.2.7 细胞迁移实验: 细胞干预同上, 胰酶消化细胞, 并用1%的含血清培养基洗涤细胞2次, 制备细胞悬液, 调整细胞密度为5×105/mL. Transwell上室加200 μL细胞悬液, Transwell下室加入600 μL细胞培养基, 37 ℃孵育24 h, 棉签擦去Transwell上室的非迁移细胞, 移去Transwell, 倒置风干, 37 ℃下0.1%结晶紫染色30 min后取出, PBS清洗, 相差显微镜观察并拍照, 每个样片随机取4个视野拍照并计数迁移细胞, 计算平均值, 以空白试剂为对照, 分析数据.
统计学处理 采用SPSS13.0和Image Lab统计软件进行统计分析. 以上实验均独立重复3次, 各实验结果以mean±SD表示, 采用t检验和单因素方差分析, P<0.05为差异有统计学意义.
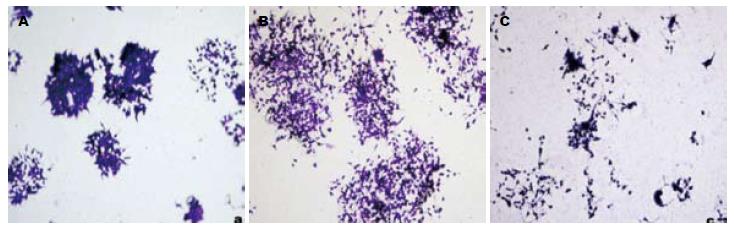
作用24 h, PMA明显促进结肠癌细胞的增殖, DMS则抑制细胞的增殖(图1). 对照组、PMA组和DMS组形成克隆率分别为(1.32%±0.26%、2.17%±0.17%、0.73%±0.13%), PMA组的克隆形成数目明显高于对照组(P<0.05), 且克隆体积较大, 细胞亦有往外迁移的趋势, 而DMS组的克隆形成数目明显低于对照组(P<0.05), 且克隆体积亦较小(图2).
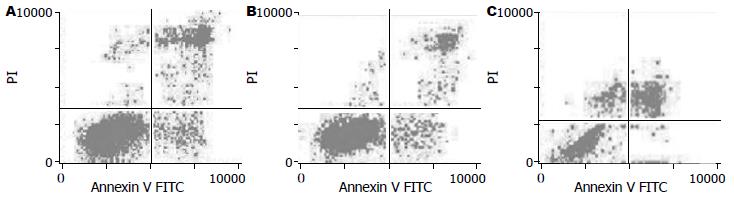
PMA显著抑制结肠癌细胞的凋亡(P<0.01), 而DMS明显促进结肠癌细胞的凋亡(P<0.01). 对照组、PMA组、DMS组细胞凋亡率分别是16.25%, 9.15%和32.58%(图3).
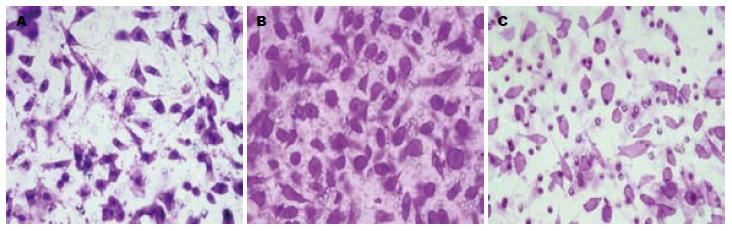
对照组、PMA组和DMS组的迁移细胞数分别为72.19±3.36、98.46±6.25和40.48±4.27. 与对照组比较, PMA组迁移细胞数量明显增多(P<0.01), DMS组迁移细胞数量明显减少(P<0.01, 图4).
PMA可以明显诱导SphK1 mRNA的表达并增强FAK mRNA的表达; 相反, DMS则抑制SphK1 mRNA的表达并下调FAK mRNA的表达(图5). 对照组、PMA组和DMS组的FAK mRNA表达强度分别为0.151±0.008、0.212±0.014、0.114±0.021(P<0.05).
对照组、PMA组和DMS组FAK总蛋白的表达强度分别为0.332±0.022、0.374±0.029和0.296±0.018, p-FAK(Tyr 397)蛋白的表达强度则分别为0.186±0.032、0.234±0.017、0.112±0.023, PMA显著促进FAK和p-FAK蛋白的表达, 而DMS则明显抑制FAK和p-FAK的表达(均P<0.05, 图6).
SphK1及其催化产物S1P被认为在细胞调节过程中起着重要的作用[7,8], SphK1活化后生成S1P增多, 可促进食道肿瘤的侵袭与转移[9], 而SphK1抑制剂能抑制胶质母细胞瘤细胞生长[10], 并促进前列腺细胞的凋亡[11]. 有研究提示SphK1可能是作为与肿瘤细胞运动和侵袭有关的细胞表面受体的辐合点而发挥作用[12]. S1P与受体结合后, 可以激活MAPK、PI-3K、Akt等信号途径, 从而调节体内多种细胞的生理应答, 包括细胞扩增、血小板聚集、肿瘤迁移等, 特别是在促内皮细胞的扩增、迁移及管腔化形成作用方面甚至强于VEGF[13-15]. 本研究采用PMA和DMS来调节SphK1的活性和表达, 发现细胞的增殖活力、克隆形成率以及细胞迁移能力随SphK1的激活而增高, 随SphK1的抑制而降低; 相反, 细胞凋亡率随SphK1的激活而下降, 随SphK1的抑制而升高, 说明SphK1可调控结肠癌lovo细胞的增殖、凋亡和迁移.
FAK是一种非受体型酪氨酸激酶, 是胞内多条信号通路的交汇点, 通过激活一系列信号通路发挥调节细胞生长、迁移和生存的作用[16,17]. FAK是一种潜在癌基因, 在肝癌、胃癌、食管癌等多种消化系恶性肿瘤组织中高表达[18-20], 有研究[21,22]发现结肠癌中FAK高表达, 并促进肿瘤细胞的侵袭转移. 细胞实验中增加FAK的磷酸化可促进细胞运动、增加细胞侵袭力等细胞生物学改变[23]. 通过FRNK(一种内源性的FAK可变剪切转录产物、能够竞争并抑制FAK的活性)过量表达方法抑制FAK功能后, 可以导致细胞增殖、迁移和侵袭的抑制[24]. Tyr 397是FAK最主要的自主磷酸化位点, 其磷酸化后可催化FAK的其他酪氨酸磷酸化位点使其发生磷酸化, 使FAK完全激活[25], 亦使FAK信号转导通路活化, 启动下游相应的事件发生. 作为整个事件的启动点, Tyr 397的磷酸化水平可反映细胞内FAK的活化状况[26]. 本研究发现SphK1的活性不但与FAK mRNA的表达而且与FAK总蛋白及p-FAK的表达正相关. 因此在lovo细胞中, SphK1的激活不但与FAK的表达而且与FAK的活性有关.
有研究表明, 活化的FAK-RAS-MAPK是促进细胞迁移和增殖的重要信号通路[27]. FAK活化PI3K/AKT及MAPK/ERK1/2存活信号通路能激活NF-κB, 最终阻断caspase-3级联反应, 从而抑制细胞凋亡[28]. 增加SphK1的表达可激活COX-2/PGE2和ERK/P38 MARK信号通路, 从而增强转录因子CREB及NF-κB活性[29]. SphK1自分泌S1P可通过上调ERK1/2和PKC来促进甲状腺癌ML-1细胞的迁移[30]. 我们之前的研究发现[31], SphK1可通过激活ERK1/2和NF-κB从而促进lovo细胞的生长增殖与侵袭并抑制细胞的凋亡. 因此, SphK1活化FAK信号通路进而激活ERK1/2和NF-κB信号通路, 可能是SphK1促进结肠癌lovo细胞增殖、迁移, 抑制细胞凋亡的机制之一.
SphK1/S1P信号通路是调节细胞增殖、迁移和趋化以及肿瘤生长、转移的重要途径之一; 黏着斑激酶是调节与细胞运动相关信号传导通路的"枢纽点", SphK1调节细胞生存、运动的机制是否与FAK的激活有关, 目前仍不明确.
陈其奎, 教授, 中山大学附属第二医院消化内科
现有资料表明, SphK1和FAK均可通过MAPK及NF-κB信号通路影响肿瘤细胞的生存, 促进肿瘤细胞的迁移, 但二者有无联系及相关作用机制尚不清楚.
Huang等报道FAK活化MAPK/ERK1/2存活信号通路能激活NF-κB, 从而抑制细胞凋亡. 余红梅等发现增加SphK1的表达可激活COX-2/PGE2和ERK/P38 MARK信号通路, 从而增强转录因子CREB及NF-κB活性.
通过调控SphK1的活性, 观察其对结肠癌lovo细胞生物学行为的影响, 及其对FAK表达和活性的影响, 探讨SphK1促进结肠癌肿瘤进展的相关机制.
SphK1活化FAK信号通路可能是SphK1促进结肠癌lovo细胞增殖、迁移并抑制细胞凋亡的机制之一. 抑制SphK1的活性或许可以阻止结肠癌的发生、发展.
本研究有较好的理论价值, 提供了一些有价值的信息.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Taha TA, Hannun YA, Obeid LM. Sphingosine kinase: biochemical and cellular regulation and role in disease. J Biochem Mol Biol. 2006;39:113-131. [PubMed] [DOI] |
| 2. | Bao M, Chen Z, Xu Y, Zhao Y, Zha R, Huang S, Liu L, Chen T, Li J, Tu H. Sphingosine kinase 1 promotes tumour cell migration and invasion via the S1P/EDG1 axis in hepatocellular carcinoma. Liver Int. 2012;32:331-338. [PubMed] [DOI] |
| 3. | Meng H, Yuan Y, Lee VM. Loss of Sphingosine kinase 1/S1P signaling impairs cell growth and survival of neurons and progenitor cells in the developing sensory ganglia. PLoS One. 2011;6:e27150. [PubMed] [DOI] |
| 4. | Gerthoffer WT. Mechanisms of vascular smooth muscle cell migration. Circ Res. 2007;100:607-621. [PubMed] [DOI] |
| 5. | Dasari VR, Kaur K, Velpula KK, Dinh DH, Tsung AJ, Mohanam S, Rao JS. Downregulation of Focal Adhesion Kinase (FAK) by cord blood stem cells inhibits angiogenesis in glioblastoma. Aging (Albany NY). 2010;2:791-803. [PubMed] |
| 6. | An JY, Zhang XL, Yao DM, Dun ZN, Xie SR, Hao LS. [The influence of down-regulation of focal adhesion kinase by RNA interference on the adhesion and migration of rat hepatic stellate cells in vitro]. Zhonghua Ganzangbing Zazhi. 2009;17:509-514. [PubMed] |
| 7. | Lebman DA, Spiegel S. Cross-talk at the crossroads of sphingosine-1-phosphate, growth factors, and cytokine signaling. J Lipid Res. 2008;49:1388-1394. [PubMed] [DOI] |
| 8. | Maceyka M, Alvarez SE, Milstien S, Spiegel S. Filamin A links sphingosine kinase 1 and sphingosine-1-phosphate receptor 1 at lamellipodia to orchestrate cell migration. Mol Cell Biol. 2008;28:5687-5697. [PubMed] [DOI] |
| 9. | Miller AV, Alvarez SE, Spiegel S, Lebman DA. Sphingosine kinases and sphingosine-1-phosphate are critical for transforming growth factor beta-induced extracellular signal-regulated kinase 1 and 2 activation and promotion of migration and invasion of esophageal cancer cells. Mol Cell Biol. 2008;28:4142-4151. [PubMed] [DOI] |
| 10. | Kapitonov D, Allegood JC, Mitchell C, Hait NC, Almenara JA, Adams JK, Zipkin RE, Dent P, Kordula T, Milstien S. Targeting sphingosine kinase 1 inhibits Akt signaling, induces apoptosis, and suppresses growth of human glioblastoma cells and xenografts. Cancer Res. 2009;69:6915-6923. [PubMed] [DOI] |
| 11. | Sauer L, Nunes J, Salunkhe V, Skalska L, Kohama T, Cuvillier O, Waxman J, Pchejetski D. Sphingosine kinase 1 inhibition sensitizes hormone-resistant prostate cancer to docetaxel. Int J Cancer. 2009;125:2728-2736. [PubMed] [DOI] |
| 12. | Shida D, Fang X, Kordula T, Takabe K, Lépine S, Alvarez SE, Milstien S, Spiegel S. Cross-talk between LPA1 and epidermal growth factor receptors mediates up-regulation of sphingosine kinase 1 to promote gastric cancer cell motility and invasion. Cancer Res. 2008;68:6569-6577. [PubMed] [DOI] |
| 13. | Novgorodov AS, El-Alwani M, Bielawski J, Obeid LM, Gudz TI. Activation of sphingosine-1-phosphate receptor S1P5 inhibits oligodendrocyte progenitor migration. FASEB J. 2007;21:1503-1514. [PubMed] [DOI] |
| 14. | Rosen H, Gonzalez-Cabrera PJ, Sanna MG, Brown S. Sphingosine 1-phosphate receptor signaling. Annu Rev Biochem. 2009;78:743-768. [PubMed] [DOI] |
| 15. | Maeda Y, Seki N, Sato N, Sugahara K, Chiba K. Sphingosine 1-phosphate receptor type 1 regulates egress of mature T cells from mouse bone marrow. Int Immunol. 2010;22:515-525. [PubMed] [DOI] |
| 16. | Saleem S, Li J, Yee SP, Fellows GF, Goodyer CG, Wang R. beta1 integrin/FAK/ERK signalling pathway is essential for human fetal islet cell differentiation and survival. J Pathol. 2009;219:182-192. [PubMed] [DOI] |
| 17. | Li Y, Wang JP, Santen RJ, Kim TH, Park H, Fan P, Yue W. Estrogen stimulation of cell migration involves multiple signaling pathway interactions. Endocrinology. 2010;151:5146-5156. [PubMed] [DOI] |
| 18. | Zhao J, Guan JL. Signal transduction by focal adhesion kinase in cancer. Cancer Metastasis Rev. 2009;28:35-49. [PubMed] [DOI] |
| 19. | Yuan Z, Zheng Q, Fan J, Ai KX, Chen J, Huang XY. Expression and prognostic significance of focal adhesion kinase in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2010;136:1489-1496. [PubMed] [DOI] |
| 20. | Su JM, Gui L, Zhou YP, Zha XL. Expression of focal adhesion kinase and alpha5 and beta1 integrins in carcinomas and its clinical significance. World J Gastroenterol. 2002;8:613-618. [PubMed] |
| 21. | de Heer P, Koudijs MM, van de Velde CJ, Aalbers RI, Tollenaar RA, Putter H, Morreau J, van de Water B, Kuppen PJ. Combined expression of the non-receptor protein tyrosine kinases FAK and Src in primary colorectal cancer is associated with tumor recurrence and metastasis formation. Eur J Surg Oncol. 2008;34:1253-1261. [PubMed] [DOI] |
| 23. | Mukai M, Iwasaki T, Tatsuta M, Togawa A, Nakamura H, Murakami-Murofushi K, Kobayashi S, Imamura F, Inoue M. Cyclic phosphatidic acid inhibits RhoA-mediated autophosphorylation of FAK at Tyr-397 and subsequent tumor-cell invasion. Int J Oncol. 2003;22:1247-1256. [PubMed] |
| 24. | Hauck CR, Hsia DA, Puente XS, Cheresh DA, Schlaepfer DD. FRNK blocks v-Src-stimulated invasion and experimental metastases without effects on cell motility or growth. EMBO J. 2002;21:6289-6302. [PubMed] [DOI] |
| 25. | Cai X, Lietha D, Ceccarelli DF, Karginov AV, Rajfur Z, Jacobson K, Hahn KM, Eck MJ, Schaller MD. Spatial and temporal regulation of focal adhesion kinase activity in living cells. Mol Cell Biol. 2008;28:201-214. [PubMed] [DOI] |
| 26. | Fu YM, Zhang H, Ding M, Li YQ, Fu X, Yu ZX, Meadows GG. Specific amino acid restriction inhibits attachment and spreading of human melanoma via modulation of the integrin/focal adhesion kinase pathway and actin cytoskeleton remodeling. Clin Exp Metastasis. 2004;21:587-598. [PubMed] [DOI] |
| 27. | Margadant C, van Opstal A, Boonstra J. Focal adhesion signaling and actin stress fibers are dispensable for progression through the ongoing cell cycle. J Cell Sci. 2007;120:66-76. [PubMed] [DOI] |
| 28. | Huang D, Khoe M, Befekadu M, Chung S, Takata Y, Ilic D, Bryer-Ash M. Focal adhesion kinase mediates cell survival via NF-kappaB and ERK signaling pathways. Am J Physiol Cell Physiol. 2007;292:C1339-C1352. [PubMed] [DOI] |
| 30. | Bergelin N, Blom T, Heikkilä J, Löf C, Alam C, Balthasar S, Slotte JP, Hinkkanen A, Törnquist K. Sphingosine kinase as an oncogene: autocrine sphingosine 1-phosphate modulates ML-1 thyroid carcinoma cell migration by a mechanism dependent on protein kinase C-alpha and ERK1/2. Endocrinology. 2009;150:2055-2063. [PubMed] [DOI] |