修回日期: 2012-12-08
接受日期: 2012-12-20
在线出版日期: 2012-12-28
目的: 探讨KLF6(krüppel-like factor 6)在胃癌和癌前病变中的表达及其意义.
方法: 收集郑州大学第二附属医院手术切除32例胃癌组织及其配对的正常胃黏膜组织新鲜标本, 采用RT-PCR检测组织中KLF6 mRNA的表达. 同期收集20例正常胃黏膜、45例肠上皮化生、16例异型增生及30例胃癌组织存档蜡块, 采用免疫组织化学SP法检测组织中KLF6蛋白的表达, 并结合临床资料进行分析.
结果: 正常胃黏膜与Ⅲ型肠上皮化生、异型增生及胃癌组间KLF6蛋白的表达差异有统计学意义(均P<0.05); KLF6蛋白的表达与肿瘤分化程度、肿瘤大小相关, 差异有统计学意义(均P<0.05). 正常胃黏膜与胃癌组织KLF6 mRNA表达差异无统计学意义(P = 0.357).
结论: KLF6蛋白的表达异常与Ⅲ型肠化、异型增生、胃癌的发生发展密切相关, 其在监测癌前病变的进展及早期胃癌的发现中有一定价值.
引文著录: 马歆花, 周英发, 郑鹏远, 于洋, 张庆, 张令巧. KLF6在胃癌和癌前病变中的表达及其意义. 世界华人消化杂志 2012; 20(36): 3683-3688
Revised: December 8, 2012
Accepted: December 20, 2012
Published online: December 28, 2012
AIM: To detect the expression of the krüppel-like factor 6 (KLF6) in human gastric carcinoma and premalignant gastric lesions to investigate its role in the occurrence and development of gastric cancer.
METHODS: Fresh frozen gastric carcinoma tissues and matched tumor-adjacent normal gastric mucosa tissues were collected from 32 patients with gastric carcinoma. RT-PCR was used to analyze the expression level of KLF6 mRNA in these tissue samples. Meanwhile, the expression of KLF6 protein was detected by immunohistochemistry in 111 formalin-fixed paraffin-embedded samples, including 20 cases of normal gastric mucosa, 45 cases of intestinal metaplasia, 16 cases of dysplasia, and 30 cases of gastric carcinoma. The association of KLF6 expression with clinicopathological characteristics was analyzed.
RESULTS: The positive rate of KLF6 protein expression in normal gastric mucosa was significantly different from those in type Ⅲ intestinal metaplasia, dysplasia and gastric carcinoma (χ2 = 6.033, 3.889, 11.092, P = 0.014, 0.049, 0.001). The positive rate of KLF6 expression in gastric carcinoma was associated with tumor differentiation and size (P = 0.009, 0.010). There was no significant difference in the expression of KLF6 mRNA between normal gastric mucosa and gastric carcinoma (P = 0.357).
CONCLUSION: Abnormal expression of KLF6 is closely related to type Ⅲ intestinal metaplasia, dysplasia, and gastric carcinoma. Detection of KLF6 expression may have certain value in the surveillance of premalignant lesions and the discovery of early gastric carcinoma.
- Citation: Ma XH, Zhou YF, Zheng PY, Yu Y, Zhang Q, Zhang LQ. Expression of KLF6 in gastric carcinoma and premalignant gastric lesions. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3683-3688
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3683.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3683
胃癌是消化系常见的恶性肿瘤, 死亡率居第2位[1], 中晚期胃癌预后极差, 5年生存率仅10%-20%[2], 而早期胃癌5年生存率可达90%以上[3]. 但是目前临床上首次就诊的胃癌患者中, 80%左右为中晚期[4]. 造成这种状况的原因很多, 其中缺乏特异、敏感的高危人群预警和早期诊断的生物学指标和方法是导致早期发现困难的关键所在. 因此, 研究胃癌的变异特征, 阐明胃癌多阶段演进的分子基础, 为胃癌癌前高危人群预警、早期癌的诊断等提供重要分子标志有重要的意义[5,6]. KLF(krüppel-like factor)基因家族为哺乳类动物的转录调节因子, 其正常表达与人类及动物细胞的正常分化、增殖及血管形成有着密切关系[7]. 新近研究发现, KLF6基因变异与人体多种肿瘤包括前列腺癌、乳腺癌、非小细胞肺癌、肝癌和结直肠癌的发生、发展有密切关系, 在肿瘤的发生过程中, 常常出现KLF6基因的丢失、点突变、启动子甲基化等遗传学变异[8-10]. 但KLF6基因与人胃癌癌前病变的发生、发展的关系不明确. 本课题以临床胃癌以及癌前病变患者作为研究对象, 采用免疫组织化学SP法和RT-PCR检测KLF6在组织中的表达, 以期分析其在肿瘤发生、发展中的作用及与肿瘤临床病理特征的相关性.
收集2011-10/2012-05郑州大学第二附属医院普外科和胸外科切除的胃癌手术标本64例, 其中胃癌组织32例, 与其对应的正常胃黏膜组织32例, 取新鲜标本置于装有RNA保护液的EP管中, 4 ℃过夜, 而后冻存于-80 ℃超低温冰箱备用. 另同期收集郑州大学第二附属医院病理科存档蜡块111例, 肠上皮化生45例, 异型增生16例, 胃癌30例, 对照组选取正常胃黏膜组织20例, 年龄在21-75岁之间, 平均年龄58岁, 所有标本均经病理学证实. 分期参照美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)第7版胃癌TNM分期[11].
1.2.1 黏液组织化学: 蜡块4 μm切片, 60 ℃烤箱烤片30 min, 常规二甲苯脱蜡, 梯度乙醇脱水; 蒸馏水洗片刻; 按说明书经HID-AB-PAS染色后[12], 常规梯度乙醇脱水, 中性树胶封片.
1.2.2 免疫组织化学染色: 蜡块4 μm切片, 60 ℃烤箱烤片30 min, 常规二甲苯脱蜡, 梯度乙醇脱水; 按说明书操作; 其中一抗为兔抗人KLF6多克隆抗体(美国Santa Cruz, 稀释度1:200); DAB (DAKO)显色剂显色后, 镜下观察, 当细胞内出现棕黄色颗粒后用蒸馏水冲洗中止反应; 自来水充分冲洗; 苏木素复染, 1%盐酸乙醇分化, 水洗, 氨水返蓝, 梯度乙醇脱水、透明、封片. 利用结肠阳性对照片作为阳性对照, 以PBS代替一抗作阴性对照.
1.2.3 RT-PCR: 按照TRIzol(Invitrogen)说明书提取新鲜组织总mRNA, 测定总mRNA的纯度, 浓度及完整性, 取2 μL总mRNA反转录为cDNA, 并用于PCR(内参为β-actin), KLF6正向引物: 5'-CGGACGCACACAGGAGAAAA-3', 反向引物: 5'-CGGTGTGCTTTCGGAAGTG-3'; β-actin正向引物: 5'-TGGCACCCAGCACAATGAA-3', 反向引物: 5'-CTAAGTCATAGTCCGCCTAGAAGCA-3'. PCR反应体系为50 μL, 反应条件: 95 ℃预变性5 min、95 ℃变性30 s, 60 ℃退火45 s, 72 ℃延伸1 min, 共32个循环, 最终72 ℃延伸10 min. 用2%琼脂糖凝胶进行电泳, 电泳条件为120 mV, 25 min, 用目的基因条带和内参β-actin条带积分A的比值作为相对值进行统计学分析.
统计学处理 用SPSS17.0软件进行统计学分析. 免疫组织化学评分参考IRS评分法[13]. 统计KLF6在不同病变胃黏膜中的表达差异用四格表χ2检验, 胃癌组织阳性表达与临床参数间的差异用Fisher精确概率法, RT-PCR结果采用定量资料t检验, 结果采用mean±SD表示. 当P<0.05时认为差异有统计学意义.
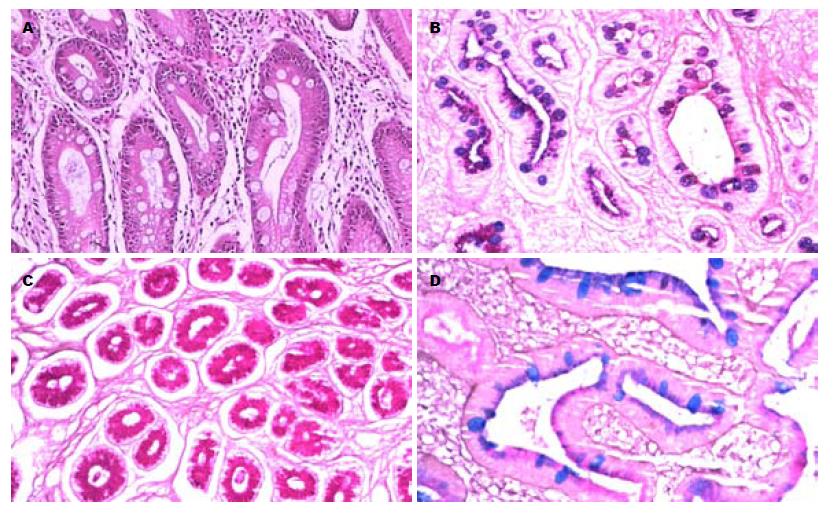
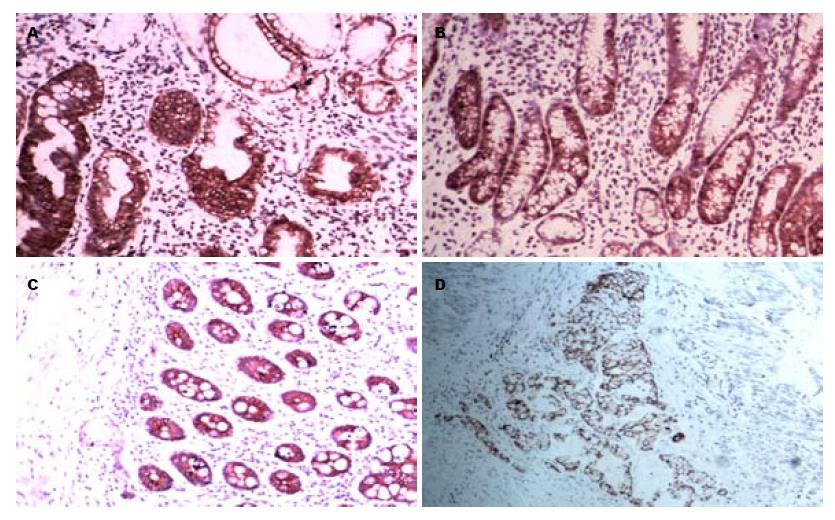
肠上皮化生组织经HID-AB-PAS染色, 分为Ⅰ、Ⅱ、Ⅲ型(图1). 其中Ⅲ型肠上皮化生柱状细胞分泌硫酸黏液(棕黑色); Ⅱ型肠上皮化生柱状细胞分泌中性黏液(红色);Ⅰ型肠上皮化生杯状细胞分泌唾液酸黏液(蓝色)[14]. KLF6蛋白阳性表达为细胞质和细胞膜着深棕色或棕色(图2), 其在正常胃黏膜与Ⅲ型肠上皮化生, 异型增生, 胃癌组织间表达差异有统计学意义(表1: χ2 = 6.033, 3.889, 11.092, P = 0.014, 0.049, 0.001), 其中KLF6蛋白阳性表达与肿瘤分化程度、肿瘤大小相关, 差异有统计学意义(P = 0.009, 0.010), 而与性别、年龄、部位、浸润程度、组织类型(胃癌组织学分型参照Lauren分型[15])、区域淋巴结转移无关(表2). 其幽门螺杆菌(Helicobacter pylori, H. pylori)感染率因原始资料不全未行统计.
| 组织类型 | n | 阳性数 | 阴性数 | χ2 | P值 |
| 正常胃黏膜 | 20 | 18 | 2 | ||
| 肠上皮化生 | |||||
| I、II型肠化 | 30 | 22 | 8 | 2.803 | 0.149 |
| III型肠化 | 15 | 8 | 7 | 6.033 | 0.014 |
| 异型增生 | 16 | 10 | 6 | 3.889 | 0.049 |
| 胃癌 | 30 | 13 | 17 | 11.092 | 0.001 |
| 临床参数 | n | KLF6 | P值 | |
| 阳性 | 阴性 | |||
| 性别 | ||||
| 男 | 21 | 10 | 11 | 0.691 |
| 女 | 9 | 3 | 6 | |
| 年龄(岁) | ||||
| ≥45 | 11 | 6 | 5 | 0.454 |
| <45 | 19 | 7 | 12 | |
| 部位 | ||||
| 胃窦 | 15 | 6 | 9 | 1.000 |
| 胃底体 | 15 | 7 | 8 | |
| 浸润程度 | ||||
| TI,T2 | 19 | 9 | 10 | 0.708 |
| T3,T4 | 11 | 4 | 7 | |
| 分化程度 | ||||
| 高, 中 | 14 | 10 | 4 | 0.009 |
| 低 | 16 | 3 | 13 | |
| 组织学分型 | ||||
| 肠型 | 15 | 8 | 7 | 0.462 |
| 弥漫型 | 15 | 5 | 10 | |
| 区域淋巴结转移 | ||||
| 有 | 17 | 7 | 10 | 1.000 |
| 无 | 13 | 6 | 7 | |
| 肿瘤大小(cm) | ||||
| ≥5 | 23 | 7 | 16 | 0.010 |
| <5 | 7 | 6 | 1 | |
RT-PCR检测结果显示(图3), 在正常胃黏膜组织和胃癌中KLF6 mRNA表达水平分别为0.64±0.44和0.58±0.21, 其表达差异无统计学意义(P = 0.357).
胃癌的发病有明显的地区差异和家族聚居现象, 提示遗传和环境致癌因素在胃癌的发病中皆起着重要作用[16]. 胃癌的发生、发展是多因素、多阶段的综合发展过程[17,18]. 对于分化型胃癌, 其病理发生过程, 即萎缩性胃炎-肠化-异型增生-胃
癌[19], 已为人们所公认, 但其详细病理过程及其分子机制仍不明确[20]. 例如对于肠化生, 究竟何种类型的肠化生更具癌变倾向, 目前仍存在争议. 以往研究提示不同类型肠化生与胃癌的关系不同, 发现柱状细胞分泌大量硫酸黏液的不完全型肠化生(Ⅲ型肠上皮化生)与胃癌关系更密切[21]. 对于胃黏膜肠上皮化生、不典型增生与癌的关系, 长期胃镜活检及临床随访发现具有相同病理特点的癌前病变, 部分可持续加重至恶变, 部分却减轻或逆转为正常黏膜上皮. 很显然, 单纯从形态学上很难区别具有持续癌变倾向的高危人群. 然而, 这些形态学相似的癌前病变具有不同的分子变化, 这种分子差异是导致其不同临床转归的关键[22]. 因此, 阐明胃癌及癌前病变的分子特征, 尤其是甄别导致肠化和异型增生持续向癌方向发生、发展的关键基因和蛋白, 不仅有助于揭示胃癌多阶段演进的分子机制, 更在确定胃癌癌变高危人群、早期癌的诊断和疾病进展监测时具有重要临床应用价值.
KLF基因家族为哺乳类动物的锌指转录调节因子, 已发现人类的KLF基因至少有16个亚型[23]. KLF基因家族的正常表达与人类及动物细胞的分化、增殖及血管形成有着密切关系. KLF6, 又称锌指转录因子9 (zine finger factor 9, ZF9)或核心转录元件结合蛋白(core promoter-element binding protein, CPBP), 定位于人类染色体10p15, 全长约7 kb, 最初是从胎盘基因表达库中筛选出来的, 被认为是一种重要的核转录调控因子, 作用于缺乏TATA盒的核心启动元件, 通过参与细胞分化、发育、生长信号的转导、细胞增殖、凋亡和血管形成等过程参与正常组织的生长发育或肿瘤的发生发展[24]. 新近研究发现, KLF6在肝癌[25]、前列腺癌[26]和结肠癌[27,28]中均起着抑癌作用. 其中, KLF6基因位点的杂合性丢失(LOH)促进了结肠癌由黏膜内癌快速进展为浸润性癌[29].
本研究首次发现, 胃癌及癌前病变(肠上皮化生及异型增生)组织中存在KLF6表达的异常, 与正常胃黏膜组织相比, KLF6在Ⅲ型肠上皮化生, 异型增生及胃癌组织呈低表达, 提示其异常表达与胃癌发生密切相关, 在低分化组织以及>5 cm的癌组织中表达差异显著, 提示其异常表达可能与肿瘤进展相关, 这一发现提示KLF6的监测可能在胃癌的早发现、早诊断以及癌前病变的随访中, 特别是Ⅲ型肠上皮化生以及异型增生的随访中, 有重要临床应用价值.
近期的功能性研究发现KLF6主要通过非P53依赖途径上调P21WAF1/CIP1从而抑制细胞增殖, 以及抑制细胞周期素D1/细胞周期蛋白依赖性激酶复合物活性进而阻止细胞周期进程[30]. KLF6在癌组织中存在多种表达丢失机制, 如在前列腺癌、结直肠癌、神经胶质瘤、鼻咽癌以及肝癌中的LOH和体细胞突变机制, 在食管癌细胞系中的启动子甲基化, 在前列腺癌和卵巢癌中的选择性剪接[31,32]. 而其在胃癌发生、发展中的变异特征, 如KLF基因出现丢失的频率有多高、是否出现点突变和基因启动子的甲基化等, KLF基因在胃癌癌前病变(肠上皮化生和异型增生)、早期胃癌、进展期胃癌以及癌转移等不同疾病阶段的变异及表达规律如何, 是否可作为胃癌转移和复发的检测指标以及是否可作为化疗疗效判断的有效检测指标等, 都有待进行深入研究.
胃癌是消化系常见的恶性肿瘤之一. 近年来, 随着胃癌的发病率及死亡率呈上升趋势, 筛查具有持续癌变倾向的高危人群显得尤为重要. 因此探讨胃癌的发病机制, 寻找可以早期诊断的生物学指标, 是目前迫切需要解决的问题.
陈光, 教授, 吉林大学第一医院消化器官外科
胃癌的发生、发展受多个基因的调控, 抑癌基因KLF6变异与人体多种肿瘤包括前列腺癌、肝癌的发生、发展有密切关系, 在其发生过程中, 常有KLF6基因的丢失、点突变、启动子甲基化等遗传学变异.
Reeves等研究发现KLF6基因位点的杂合性丢失(LOH)促进了结肠癌由黏膜内癌快速进展为浸润性癌.
本文应用免疫组织化学法与RT-PCR联合检测KLF6在胃癌及癌旁正常黏膜组织中的表达情况, 从而在蛋白水平及RNA水平上探讨其与胃癌各项临床病理参数之间的关系, 为KLF6成为预测胃癌生物学行为的重要参考指标提供理论依据.
本文证实了KLF6在胃癌及癌前病变的表达变化可以为胃癌的早期诊断提供重要参考, 为胃癌早期发现、早期诊断提供重要依据.
癌前病变: 某些具有潜在癌变可能性的良性病变.HID-AB-PAS染色法: 可区分羟基化酸性黏液、硫酸化黏液和中性黏液物质, 分别染成蓝色、棕黑色和红色, 可以将肠上皮化生分为Ⅰ型、Ⅱ型和Ⅲ型.
文章的科学性、创新性和可读性能较好地反映我国和国际胃肠病学临床和基础研究的先进水平.
编辑: 田滢 电编:鲁亚静
| 1. | Zhang J, Guo SB, Duan ZJ. Application of magnifying narrow-band imaging endoscopy for diagnosis of early gastric cancer and precancerous lesion. BMC Gastroenterol. 2011;11:135. [PubMed] [DOI] |
| 2. | Paoletti X, Oba K, Burzykowski T, Michiels S, Ohashi Y, Pignon JP, Rougier P, Sakamoto J, Sargent D, Sasako M. Benefit of adjuvant chemotherapy for resectable gastric cancer: a meta-analysis. JAMA. 2010;303:1729-1737. [PubMed] [DOI] |
| 3. | Peddanna N, Holt S, Verma RS. Genetics of gastric cancer. Anticancer Res. 1995;15:2055-2064. [PubMed] |
| 4. | Layke JC, Lopez PP. Gastric cancer: diagnosis and treatment options. Am Fam Physician. 2004;69:1133-1140. [PubMed] |
| 5. | Roder DM. The epidemiology of gastric cancer. Gastric Cancer. 2002;5 Suppl 1:5-11. [PubMed] [DOI] |
| 6. | Abbaszadegan MR, Moaven O, Sima HR, Ghafarzadegan K, A'rabi A, Forghani MN, Raziee HR, Mashhadinejad A, Jafarzadeh M, Esmaili-Shandiz E. p16 promoter hypermethylation: a useful serum marker for early detection of gastric cancer. World J Gastroenterol. 2008;14:2055-2060. [PubMed] [DOI] |
| 7. | Schuh R, Aicher W, Gaul U, Côté S, Preiss A, Maier D, Seifert E, Nauber U, Schröder C, Kemler R. A conserved family of nuclear proteins containing structural elements of the finger protein encoded by Krüppel, a Drosophila segmentation gene. Cell. 1986;47:1025-1032. [PubMed] [DOI] |
| 8. | Ghaleb AM, Yang VW. The Pathobiology of Krüppel-like Factors in Colorectal Cancer. Curr Colorectal Cancer Rep. 2008;4:59-64. [PubMed] [DOI] |
| 9. | Chen C, Hyytinen ER, Sun X, Helin HJ, Koivisto PA, Frierson HF, Vessella RL, Dong JT. Deletion, mutation, and loss of expression of KLF6 in human prostate cancer. Am J Pathol. 2003;162:1349-1354. [PubMed] [DOI] |
| 10. | Ito G, Uchiyama M, Kondo M, Mori S, Usami N, Maeda O, Kawabe T, Hasegawa Y, Shimokata K, Sekido Y. Krüppel-like factor 6 is frequently down-regulated and induces apoptosis in non-small cell lung cancer cells. Cancer Res. 2004;64:3838-3843. [PubMed] [DOI] |
| 11. | Washington K. 7th edition of the AJCC cancer staging manual: stomach. Ann Surg Oncol. 2010;17:3077-3079. [PubMed] |
| 12. | Shah M, Shrikhande SS. Mucin histochemistry of the upper gastrointestinal tract. Indian J Gastroenterol. 1989;8:83-84. [PubMed] |
| 13. | Kaemmerer D, Peter L, Lupp A, Schulz S, Sänger J, Baum RP, Prasad V, Hommann M. Comparing of IRS and Her2 as immunohistochemical scoring schemes in gastroenteropancreatic neuroendocrine tumors. Int J Clin Exp Pathol. 2012;5:187-194. [PubMed] |
| 14. | Jass JR, Filipe MI. The mucin profiles of normal gastric mucosa, intestinal metaplasia and its variants and gastric carcinoma. Histochem J. 1981;13:931-939. [PubMed] [DOI] |
| 15. | Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol Microbiol Scand. 1965;64:31-49. [PubMed] |
| 16. | Lin Y, Wolk A, Hakansson N, Lagergren J, Lu Y. Dietary intake of lignans and risk of esophageal and gastric adenocarcinoma: a cohort study in Sweden. Cancer Epidemiol Biomarkers Prev. 2012; Nov 28. [Epub ahead of print]. [PubMed] [DOI] |
| 17. | Xia HH, Wong BC, Lam SK. Chemoprevention of gastric cancer: current status. Chin Med J (Engl). 2003;116:5-10. [PubMed] |
| 18. | Chiba T, Marusawa H, Matsumoto Y, Takai A. [Chronic inflammation and gastric cancer development]. Nihon Rinsho. 2012;70:1694-1698. [PubMed] |
| 19. | Rokkas T, Filipe MI, Sladen GE. Detection of an increased incidence of early gastric cancer in patients with intestinal metaplasia type III who are closely followed up. Gut. 1991;32:1110-1113. [PubMed] [DOI] |
| 20. | Correa P. A human model of gastric carcinogenesis. Cancer Res. 1988;48:3554-3560. [PubMed] |
| 21. | Li ML, Zhang JC, Li SG, Wu WG, Rao LH, Dong P, Gu J, Lu JH, Zhang L, Ding QC. Characteristic gene expression profiles in the progression from normal gastric epithelial cells to moderate gastric epithelial dysplasia and to gastric cancer. Chin Med J (Engl). 2012;125:1777-1783. [PubMed] |
| 22. | Black AR, Black JD, Azizkhan-Clifford J. Sp1 and krüppel-like factor family of transcription factors in cell growth regulation and cancer. J Cell Physiol. 2001;188:143-160. [PubMed] [DOI] |
| 23. | Dang DT, Pevsner J, Yang VW. The biology of the mammalian Krüppel-like family of transcription factors. Int J Biochem Cell Biol. 2000;32:1103-1121. [PubMed] [DOI] |
| 24. | Kremer-Tal S, Reeves HL, Narla G, Thung SN, Schwartz M, Difeo A, Katz A, Bruix J, Bioulac-Sage P, Martignetti JA. Frequent inactivation of the tumor suppressor Kruppel-like factor 6 (KLF6) in hepatocellular carcinoma. Hepatology. 2004;40:1047-1052. [PubMed] [DOI] |
| 25. | Narla G, Heath KE, Reeves HL, Li D, Giono LE, Kimmelman AC, Glucksman MJ, Narla J, Eng FJ, Chan AM. KLF6, a candidate tumor suppressor gene mutated in prostate cancer. Science. 2001;294:2563-2566. [PubMed] [DOI] |
| 26. | Reeves HL, Narla G, Ogunbiyi O, Haq AI, Katz A, Benzeno S, Hod E, Harpaz N, Goldberg S, Tal-Kremer S. Kruppel-like factor 6 (KLF6) is a tumor-suppressor gene frequently inactivated in colorectal cancer. Gastroenterology. 2004;126:1090-1103. [PubMed] [DOI] |
| 28. | Wahab AH, Kassem AM, Matter S, El Deen AF, Helmy AS, Ismaeil MM, Zakaria MS. Role of KLF6 tumor suppressor gene mutations in the development of colorectal carcinoma in an Egyptian population. Hepatogastroenterology. 2010;57:1405-1410. [PubMed] |
| 29. | Benzeno S, Narla G, Allina J, Cheng GZ, Reeves HL, Banck MS, Odin JA, Diehl JA, Germain D, Friedman SL. Cyclin-dependent kinase inhibition by the KLF6 tumor suppressor protein through interaction with cyclin D1. Cancer Res. 2004;64:3885-3891. [PubMed] [DOI] |
| 30. | Sangodkar J, Shi J, DiFeo A, Schwartz R, Bromberg R, Choudhri A, McClinch K, Hatami R, Scheer E, Kremer-Tal S. Functional role of the KLF6 tumour suppressor gene in gastric cancer. Eur J Cancer. 2009;45:666-676. [PubMed] [DOI] |