修回日期: 2012-11-16
接受日期: 2012-12-17
在线出版日期: 2012-12-28
目的: 观察红花注射液(injection of carthamus tinctorius, ICT)对2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)所致大鼠溃疡性结肠炎(ulcerative colitis, UC)的治疗作用, 并通过观察ICT对大鼠结肠黏膜白细胞介素-4(interleukin-4, IL-4)和白细胞介素-1β(interleukin-1β, IL-1β)蛋白及mRNA表达的影响, 初步探讨其治疗UC的作用机制.
方法: 30只Wistar大鼠随机分为实验组、模型组和对照组3组, 每组各10只, 其中实验组和模型组大鼠分别用TNBS灌肠, 以复制UC模型, 同时实验组给予ICT干预治疗. 疗程结束后, 观察疾病活动指数(disease activity index, DAI), 剖取大鼠8 cm结肠, 进行结肠大体形态评分, 将标本进行HE染色, 并进行组织学损伤评分; 采用免疫组织化学染色及RT-PCR检测结肠IL-4和IL-1β蛋白及mRNA的表达.
结果: 实验组与模型组相比, UC大鼠的DAI、结肠黏膜的大体形态及组织学损伤明显改善(均P<0.05), 实验组IL-4蛋白及mRNA的表达与正常对照组相比无显著性差异(P>0.05), 与模型组相比显著升高(P<0.05); 模型组及实验组IL-1β蛋白及mRNA的表达较正常对照组显著升高(P<0.05), 而实验组较模型组显著降低(P<0.05).
结论: ICT对TNBS法诱导的大鼠UC有治疗作用, 其机制可能是通过上调抗炎因子IL-4的释放和抑制促炎细胞因子IL-1β的表达而起作用.
引文著录: 原皓, 赵雪曼, 原子英, 王鹤鸣, 赵文花. 红花注射液对溃疡性结肠炎大鼠IL-4和IL-1β表达的影响. 世界华人消化杂志 2012; 20(36): 3678-3682
Revised: November 16, 2012
Accepted: December 17, 2012
Published online: December 28, 2012
AIM: To investigate the therapeutic effects of Carthamus Tinctorius Injection (CTI) against ulcerative colitis (UC) induced with 2,4,6-trinitrobenzene sulfonic acid (TNBS) in rats and to explore the possible mechanisms involved.
METHODS: Thirty male Wistar rats were randomly divided into a treatment group, a model group, and a normal control group (n = 10 for each group). UC was induced with TNBS in rats in both the treatment group and model group. The treatment group was additionally treated with CTI. At the end of the treatment, colonic mucosal samples were taken to calculate disease activity index (DAI) and observe gross morphology of the colon and tissue injury. Colonic mucosal pathological changes were observed by HE staining. The expression of interleukin-4 (IL-4) and IL-1β mRNAs and proteins in colon tissue was detected by reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry (IHC).
RESULTS: Compared to the model group, the DAI and gross morphology and pathological changes in colon tissue were significantly improved in the treatment group (all P < 0.05). The level of IL-4 in the treatment group was significantly higher than that in the model group (P < 0.05), but no differences was detected between the treatment group and control group. The level of IL-1β in treatment group and model group was significantly higher than that in control group (P < 0.05), but the level in treatment group was significantly lower than that in model group (P < 0.05).
CONCLUSION: CTI treatment relieved TNBS-induced colitis in rats possibly via mechanism associated with increasing IL-4 expression and decreasing IL-1β expression.
- Citation: Yuan H, Zhao XM, Yuan ZY, Wang HM, Zhao WH. Treatment with Carthamus Tinctorius Injection up-regulates IL-4 expression and down-regulates IL-1β expression in ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3678-3682
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3678.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3678
溃疡性结肠炎(ulcerative colitis, UC)是一种结肠慢性非特异性炎症性疾病, 病程长, 常反复发作, 病变多局限于黏膜及黏膜下层, 目前其确切发病机制尚不清楚, 可能与免疫异常, 感染及遗传等因素有关[1], 而免疫异常导致的促炎因子与抗炎因子表达失衡在其发病机制中处于重要地位[2,3]. 除此之外, 微血栓形成也是其重要的病理机制之一[4,5]. 治疗UC的传统药物虽能在一定时间内改善大多数患者的症状, 但长期使用的不良反应较大[6,7]. 因此寻找不良反应小的药物意义重大. 红花注射液(injection of carthamus tinctorius, ICT)为红花有效成分提取物, 研究表明ICT不仅具有活血化瘀的作用, 多种成分还具有抗炎作用[8], 因此推测ICT理应对UC有一定的治疗作用. 本实验旨在观察ICT对大鼠UC的疗效, 并初步探讨其作用机制.
健康Wistar大鼠, 体质量200 g±10 g(山东中医药大学动物中心). 主要试剂: 2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)(美国Sigma公司); ICT(亚宝药业, 批号: Z14020783); RT-PCR检测试剂盒(大连宝生物工程有限公司); 兔抗大鼠IL-1β和IL-4多克隆抗体、PV-6001超敏性免疫试剂盒、浓缩型DAB试剂盒(ZLI-9032, 北京中杉金桥生物技术公司).
1.2.1 分组与造模: 将30只健康Wistar大鼠适应性饲养1 wk, 体质量达到200 g左右后随即分为3组, 每组10只. 按照文献所述[9,10], 禁食不禁水24 h后, 根据大鼠的体质量, 以50 mg/kg为标准, 计算出治疗组和模型组大鼠灌肠所需混合药液的用量, TNBS与无水乙醇以1:1比例混匀, 将导管经肛门缓慢插入约8 cm后, 将药液注入, 并倒提大鼠30 min, 对照组大鼠则灌注等量生理盐水, 常规饲养. 造模第1-10 d, 治疗组给予ICT, 以400 mg/(kg·d)为标准, 计算UC大鼠所需药量, 将其稀释至2 mL, 注入腹膜腔, 同时对照组和模型组给予生理盐水2 mL腹腔注射.
1.2.2 标本的制备: 造模第10天, 观察各组大鼠的一般情况后, 用10%水合氯醛处死动物, 剖取距肛门7-8 cm处结肠, 剪去一部分置冷生理盐水中冲洗干净, 先放入液氮罐中, 再转移至-80 ℃冰箱备用, 剩余部分沿纵轴剖开, 用冷生理盐水洗净后置于滤纸上吸干, 放入4%多聚甲醛中固定.
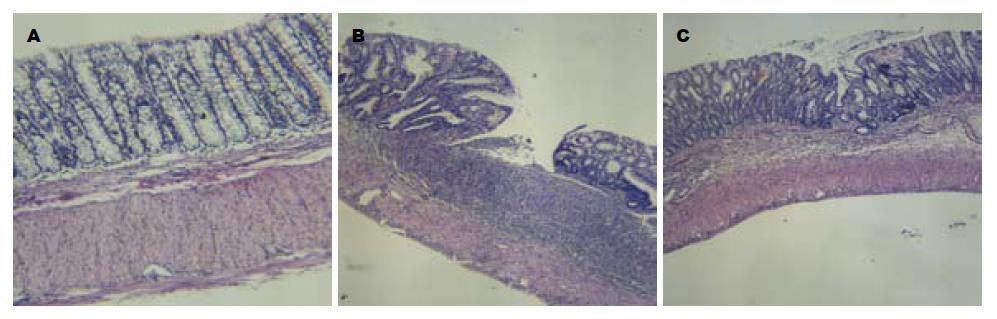
1.2.3 结肠炎症的评价标准: 采用疾病活动指数(disease activity index, DAI)、结肠大体形态及组织学损伤评分来评价结肠炎症. (1)DAI评分[11,12]: 造模10 d后, 综合大鼠体质量下降百分率 (体质量不变为0分, 1-5为1分, 6-10为2分, 11-15为3分, >15为4分)、大便黏稠度(正常为0, 松散大便为2分, 腹泻为4分)和大便带血情况(正常0分, 隐血阳性为2分, 显性出血为4分)来进行积分; (2)大体形态评分[13,14], 0分: 无损伤; 1分: 局部充血、水肿, 但未出现溃疡; 2分: 有溃疡, 但没有明显炎症; 3分: 有溃疡, 仅有一处出现炎症; 4分: 可见多处溃疡及炎症, 但溃疡均<1 cm; 5分: 可见多处溃疡及炎症, 且至少有一处溃疡>1 cm; (3)组织学损伤评分[15,16], 将甲醛固定的组织用石蜡包埋、切片(厚5 μm), 行HE染色, 镜下观察, 取10个视野(×100)的平均评分: 黏膜糜烂、溃疡伴显著炎性细胞浸润计4分, 固有层覆盖单层上皮伴轻度炎性细胞浸润计3分, 隐窝缺损2/3计2分, 隐窝缺损1/3计1分, 正常结肠黏膜组织计0分.
1.2.4 免疫组织化学法检测IL-4和IL-1β蛋白的表达: 按试剂盒说明书所述进行染色, 光镜下可见阳性细胞的胞质和/或胞膜呈棕黄色. 染色完成后, 每张切片随机选取5个高倍镜视野, 每个视野分别计数200个细胞, 共1 000个, 之后计算阳性细胞所占比率.
1.2.5 RT-PCR检测IL-4 mRNA、IL-1β mRNA的相对表达: 从-80 ℃冰箱中取出备用组织, 提取总RNA并检测其纯度和含量, 然后用其合成cDNA, 并检测RT-PCR产物. IL-1β基因的上游引物: 5'-GCCAACAAGTGGTATTCTCCAT-3', 下游引物: 5'-TCTTTCATCACACAGGACAGGT-3', 产物115 bp. IL-4基因上游引物: 5'-TCACCCTGTTCTGCTTTCTCAT-3', 下游引物: 5'-GAGTCCTTTTTCTGTGACCTG-3', 产物111 bp. 扩增反应条件为: 95 ℃预变性30 s, 95 ℃ 5 s, 60 ℃ 30 s, 共40个循环, 对扩增过程进行连续荧光检测并计算Ct值. Ct值可反映DNA的拷贝数, DNA拷贝数越高, 可检测到的荧光信号循环数就越少, 所得Ct值就越小. 本实验用2-△△Ct表示样品中目的基因mRNA的相对表达量, 以比较各组大鼠结肠组织中IL-4 mRNA、IL-1β mRNA的表达情况.
统计学处理 实验数据用mean±SD表示, 采用SPSS16.0软件进行统计学分析, 并对数据进行单因素方差分析(one-way ANOVA)分析. 以P<0.05为差异有统计学意义.
造模后的大鼠于1-2 d出现大便变稀的情况, 严重者便中可见脓血, 肛周污秽, 与正常组比较, 进食明显减少, 体质量减轻, 毛干涩, 喜卧扎堆. 红花组上述症状较模型组轻.
肉眼见治疗组和模型组UC大鼠严重者肠腔内出现血性分泌物, 轻者见肠壁明显增厚、黏膜充血水肿、糜烂及溃疡形成, 镜下见结肠黏膜出现明显的炎症细胞浸润, 两者与正常组相比, 大体形态、DAI及组织学损伤评分均明显增高(P<0.05),而治疗组与模型组相比, 其大体形态、DAI及组织损伤评分均明显降低(P<0.05, 表1, 图1).
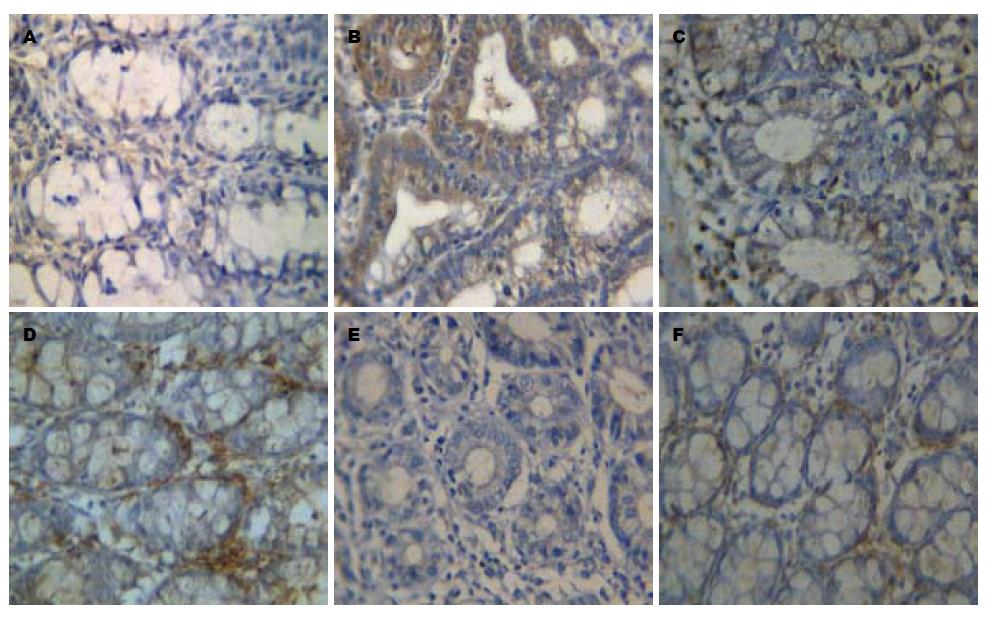
IL-1β和IL-4均以胞质和/或胞膜呈棕黄色为阳性, 实验中可见, 模型组IL-1β蛋白的表达较高, 而对照组IL-1β蛋白的表达较弱, 治疗组IL-1β蛋白的表达仍高于对照组, 但较模型组显著降低(P<0.05, 图2A-C), 说明ICT能抑制IL-1β的表达. 正常对照组和治疗组的IL-4蛋白的表达差异不显著, 而模型组IL-4蛋白的表达较对照组显著减低(P<0.05, 表2, 图2D-F), 提示ICT能促进IL-4的表达.
模型组及治疗组中IL-1β mRNA的相对表达较对照组显著升高(P<0.05), 而治疗组IL-1β mRNA的相对表达较模型组显著降低(P<0.05), 提示ICT能抑制IL-1β mRNA的表达. 模型组IL-4 mRNA的表达较对照组及治疗组显著减低(P<0.05, 表3), 而治疗组与正常对照组IL-4 mRNA的表达较差异无显著性, 说明ICT促进了IL-4 mRNA的表达.
UC是一种局限于黏膜及黏膜下层的慢性炎症性疾病, 腹痛、腹泻、黏液脓血便是其最常见的症状, 其病因及发病机制尚不完全明确. 近几年, 促炎细胞因子与抗炎细胞因子之间的平衡失调可导致肠黏膜炎症反应这一观点已得到人们的广泛认可[17-19], 而IL-1β作为促炎细胞因子IL-1的主要活性形式备受关注. IL-1β主要由单核巨噬细胞, 中性粒细胞和内皮细胞分泌, 研究表明, IL-1β可以促进炎症细胞的活化与聚集[20,21], 并且可以通过刺激其他细胞因子、炎症介质产物的自分泌和旁分泌以上调炎症反应, 在UC黏膜炎症反应中具有极其重要的作用, 其在UC急性活动期表达明显增加[22-25], 而IL-4主要由活化的T淋巴细胞产生, 是一种重要的抑炎因子, 其在炎症性肠病患者体内分泌减少, 提示其与炎症性肠病的发生有密切关系[26], 他可以抑制单核巨噬细胞产生IL-1β和TNF-α等炎症因子[27-31], 还能下调单核巨噬细胞分泌氧自由基的能力. 炎症因子和抗炎因子的表达处于动态平衡的状态, 而这种平衡一旦被打破, 炎症反应便会随之发生.
ICT是中药红花有效成分的提取物, 因其具有活血化瘀, 消肿止痛, 改善循环的作用, 临床上广泛用于治疗心脑血管及血栓栓塞性疾病, 近些年的研究表明, 红花除具有以上作用外, 还能抑制炎症反应. 本实验中, 造模后的大鼠结肠黏膜的大体形态、DAI及组织学损伤在经ICT治疗后明显得到改善, 这表明ICT对UC确有治疗作用. 通过免疫组织化学和PCR技术发现, 模型组受累结肠组织IL-1β的表达显著升高, 而IL-4的表达较正常组显著降低, 说明病变局部促炎因子和抑炎因子失去了平衡, 这可能是结肠炎症发生的原因之一, 而经过ICT治疗后, IL-4的表达明显升高, 而IL-1β的表达降低, 说明ICT能够调节炎症细胞因子与抗炎细胞因子之间的平衡从而控制炎症反应的发生, 促进炎症愈合, 这可能是ICT治疗UC的机制之一.
总之, ICT对UC有良好的治疗作用, 能够调节促炎因子IL-1β和抑炎因子IL-4的表达, 其对人类UC的疗效有待进一步研究.
溃疡性结肠炎(UC)是一种慢性炎症性肠病, 往往需终生服药治疗, 传统治疗药物疗效好但不良反应大, 因此寻找不良反应小的治疗药物是研究的热点之一. UC病变处除炎症外, 还存在淤血, 微循环破坏、障碍, 红花注射液能改善微循环并有抗炎作用, 推测对UC应有治疗作用.
张志坚, 教授, 福州总医院消化内科
UC的发生主要与遗传、免疫、环境、精神等因素有关, 其中免疫因素可导致UC发病这一观点已经得到人们广泛认可, 而促炎细胞因子与抗炎细胞因子作为免疫功能的重要组成部分, 逐渐成为人们研究的热点, 研究表明, 在正常组织中, 两者长期保持动态平衡, 而这种平衡一旦被打破, 即可导致肠黏膜免疫功能紊乱, 进而引发肠道炎症.
研究表明, UC患者多存在微循环障碍及免疫功能紊乱, 红花注射液(ICT)作为中药红花有效成分的提取物, 在临床上广泛应用于血栓栓塞性疾病, 近几年研究表明, 其不但具有活血化瘀、消肿止痛的作用, 其多种成分还具有抗炎作用, 且不良反应较小.
ICT在临床上广泛应用于治疗心血管及血栓栓塞性疾病, UC除炎症外还存在病变处微循环破坏、障碍, 将活血化瘀的ICT用于UC的治疗并观察其对促炎因子IL-1β及抑炎因子IL- 4表达的影响从而初步探讨其治疗机制.
经现代科学研究证实, ICT除具有抑制血小板聚集、改善脑血管及冠状血管供血、增加实验动物对缺氧耐受性等作用外, 其多种成分还具有抗炎作用, 本实验说明ICT可调节抗炎因子及抑炎因子之间的平衡, 抑制炎症反应, 且其不良反应小, 将其用于治疗UC值得进一步研究.
白介素-1(IL-1): 包括IL-1α和IL-1β, 二者与相同的受体结合, 主要由单核细胞产生, 能促进免疫应答, 参与炎症反应, 促进伤口愈合, 刺激造血功能, 引起发热等.白介素-4(IL-4): Ⅱ型辅助T细胞细胞分泌的细胞因子. IL-4的生物作用, 包括刺激活化B细胞和T细胞增殖、 CD4+T细胞分化成Ⅱ型辅助T细胞, 他也在调节体液免疫和适应性免疫中起关键作用, 还是一种重要的抑炎因子.
本文设计基本合理, 采取的技术路线较为成熟, 研究结果可信, 结论基本客观, 能够为未来临床应用提供一定的理论依据.
编辑: 翟欢欢 电编:鲁亚静
| 1. | Hisamatsu T, Kanai T, Mikami Y, Yoneno K, Matsuoka K, Hibi T. Immune aspects of the pathogenesis of inflammatory bowel disease. Pharmacol Ther. 2012; Oct 26. [Epub ahead of print]. |
| 2. | Ogata H, Hibi T. Cytokine and anti-cytokine therapies for inflammatory bowel disease. Curr Pharm Des. 2003;9:1107-1113. [PubMed] [DOI] |
| 3. | Kirsner JB. Historical origins of current IBD concepts. World J Gastroenterol. 2001;7:175-184. [PubMed] [DOI] |
| 5. | Canero A, Parmeggiani D, Avenia N, Atelli PF, Goffredi L, Peltrini R, Madonna I, Ambrosino P, Apperti S, Apperti M. Thromboembolic tendency (TE) in IBD (Inflammatory bowel disease) patients. Ann Ital Chir. 2012;83:313-317. [PubMed] |
| 7. | Martínez-Montiel MP, Muñoz-Yagüe MT. Biologic therapies for chronic inflammatory bowel disease. Rev Esp Enferm Dig. 2006;98:265-291. [PubMed] [DOI] |
| 9. | Ha X, Yin Q, Hui L, Jia Q, Wang M, Zhang J, Xu Y, Chang Y, Yang X. Effect of oral hepatocyte growth factor gene mediated by attenuated salmonella on 2-, 4-, 6-trinitro-benzene-sulfonic-acid-induced ulcerative colitis in rat. J Gastroenterol Hepatol. 2012;27:609-615. [PubMed] [DOI] |
| 10. | Dai SX, Zou Y, Feng YL, Liu HB, Zheng XB. Baicalin down-regulates the expression of macrophage migration inhibitory factor (MIF) effectively for rats with ulcerative colitis. Phytother Res. 2012;26:498-504. [PubMed] [DOI] |
| 11. | Mao JW, Tang HY, Tan XY, Wang YD. Effect of Etiasa on the expression of matrix metalloproteinase-2 and tumor necrosis factor-α in a rat model of ulcerative colitis. Mol Med Rep. 2012;6:996-1000. [PubMed] |
| 12. | Porter SN, Howarth GS, Butler RN. An orally administered growth factor extract derived from bovine whey suppresses breath ethane in colitic rats. Scand J Gastroenterol. 1998;33:967-974. [PubMed] [DOI] |
| 15. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] [DOI] |
| 16. | Tjandra K, Le T, Swain MG. Experimental colitis attenuates development of toxin-induced cholangitis in rats. Dig Dis Sci. 2002;47:1216-1223. [PubMed] [DOI] |
| 17. | Matricon J. [Immunopathogenesis of inflammatory bowel disease]. Med Sci (Paris). 2010;26:405-410. [PubMed] [DOI] |
| 18. | Lacruz-Guzmán D, Torres-Moreno D, Pedrero F, Romero-Cara P, García-Tercero I, Trujillo-Santos J, Conesa-Zamora P. Influence of polymorphisms and TNF and IL1β serum concentration on the infliximab response in Crohn's disease and ulcerative colitis. Eur J Clin Pharmacol. 2013;69:431-438. [PubMed] |
| 19. | Gologan S, Iacob R, Iancu D, Iacob S, Cotruta B, Vadan R, Catuneanu AM, Constantinescu I, Barbarii L, Gheorghe C. Inflammatory gene expression profiles in Crohn's disease and ulcerative colitis: A comparative analysis using a reverse transcriptase multiplex ligation-dependent probe amplification protocol. J Crohns Colitis. 2012; Sep 24. [Epub ahead of print]. |
| 21. | Pope RM, Tschopp J. The role of interleukin-1 and the inflammasome in gout: implications for therapy. Arthritis Rheum. 2007;56:3183-3188. [PubMed] [DOI] |
| 22. | 万 德惠, 徐 萍. 溃疡性结肠炎患者血浆IL-1β、TGF-β1的检测及临床意义. 中国临床医药研究杂志. 2005;142:15400-15401. |
| 23. | Gotteland M, Lopez M, Muñoz C, Saez R, Altshiller H, Llorens P, Brunser O. Local and systemic liberation of proinflammatory cytokines in ulcerative colitis. Dig Dis Sci. 1999;44:830-835. [PubMed] [DOI] |
| 24. | Ashwood P, Harvey R, Verjee T, Wolstencroft R, Thompson RP, Powell JJ. Functional interactions between mucosal IL-1, IL-ra and TGF-beta 1 in ulcerative colitis. Inflamm Res. 2004;53:53-59. [PubMed] [DOI] |
| 26. | Nielsen OH, Køppen T, Rüdiger N, Horn T, Eriksen J, Kirman I. Involvement of interleukin-4 and -10 in inflammatory bowel disease. Dig Dis Sci. 1996;41:1786-1793. [PubMed] [DOI] |
| 27. | Wang X, Jiang B, Li L, Yao H, Deng H. [Effects of total alkaloid of Sophora alopecuroides on serum IL-1beta and IL-4 expression in mice with acute ulcerative colitis]. Zhongguo Zhong Yao Za Zhi. 2010;35:1177-1180. [PubMed] |
| 28. | Linehan JD, Kolios G, Valatas V, Robertson DA, Westwick J. Immunomodulatory cytokines suppress epithelial nitric oxide production in inflammatory bowel disease by acting on mononuclear cells. Free Radic Biol Med. 2005;39:1560-1569. [PubMed] [DOI] |
| 29. | Mora AL, Stephenson LM, Enerson B, Youn J, Keegan AD, Boothby M. New programming of IL-4 receptor signal transduction in activated T cells: Stat6 induction and Th2 differentiation mediated by IL-4Ralpha lacking cytoplasmic tyrosines. J Immunol. 2003;171:1891-1900. [PubMed] [DOI] |
| 30. | Schreiber S, Heinig T, Panzer U, Reinking R, Bouchard A, Stahl PD, Raedler A. Impaired response of activated mononuclear phagocytes to interleukin 4 in inflammatory bowel disease. Gastroenterology. 1995;108:21-33. [PubMed] [DOI] |