修回日期: 2012-11-15
接受日期: 2012-12-17
在线出版日期: 2012-12-28
目的: 研究细胞信号分子糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)在D-氨基半乳糖/脂多糖联合注射诱导小鼠重型肝炎肝衰竭中的作用.
方法: 以C57BL/6小鼠为研究对象, 腹腔注射D-氨基半乳糖/脂多糖建立小鼠重型肝炎肝衰竭模型. 动物实验分组: 对照组, 重型肝炎肝衰竭模型组, SB216763干预组(建模前2 h腹腔注射), SB216763治疗组(建模后2 h腹腔注射). Western blot检测肝脏组织GSK-3β磷酸化水平, 检测血清转氨酶(alanine aminotransferase, ALT)、天门冬酸氨基转移酶(aspartate aminotransferase, AST)评价肝脏功能, 观察肝脏组织病理变化评价肝脏损伤情况, 实时荧光定量PCR法检测肝脏细胞炎症因子基因表达, 并检测凋亡相关蛋白Caspase 3的活性表达. 多组样本均数的两两比较采用One-way ANOVA分析(方差齐者用LSD-t检验, 方差不齐者用Games-Howell法), P<0.05有统计学意义.
结果: Western blot结果显示, GSK-3β在急性肝衰竭过程中磷酸化水平先降低(活性升高)后再次升高; 抑制GSK-3β活性, 无论是干预还是治疗都改善肝脏功能(血清ALT、AST水平明显下降, 肝组织病理损伤明显改善), 并且抑制炎症反应[抑制促炎因子肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白介素6(Interleukin-6, IL-6)、IL-1β表达, 促进抗炎因子IL-10高表达], 并可降低凋亡相关蛋白Caspase 3表达.
结论: 在D-氨基半乳糖/脂多糖诱导小鼠急性肝衰竭过程中GSK-3β被激活, 抑制GSK-3β活性通过降低炎症反应和肝细胞凋亡从而改善肝损伤. 因此, 对信号分子GSK-3β活性进行干预有可能为重型肝炎肝衰竭的治疗提供一个新的靶点.
引文著录: 杨丙章, 任锋, 温韬, 殷继明, 王欣欣, 朴正福, 陈德喜, 郑素军, 张晶, 陈煜, 段钟平, 师水生. 糖原合成酶激酶-3β在D-GalN/LPS诱导的小鼠急性肝衰竭中的作用. 世界华人消化杂志 2012; 20(36): 3656-3662
Revised: November 15, 2012
Accepted: December 17, 2012
Published online: December 28, 2012
AIM: To study the role of glycogen synthase kinase-3β (GSK-3β) in the pathogenesis of acute liver failure (ALF) induced by injection of D-galactosamine/lipopolysaccharide (D-GalN/LPS) in mice.
METHODS: ALF was induced in C57BL/6 mice by intraperitoneal injection of D-GalN/LPS. Animal experimental groups included control group, ALF model group, SB216763 pretreatment group (SB216763 in DMSO, i.p, two hours before the induction of ALF) and SB216763 treatment group (SB216763 in DMSO, i.p, two hours after the induction of ALF). Phosphorylation level of GSK-3β was analyzed by Western blot. Serum levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were measured to assess the liver function. HE staining was conducted to analyze histological injury. Inflammatory gene expression was detected by quantitative real-time PCR. The expression of apoptosis-related protein Caspase 3 was detected by Western blot. One-way ANOVA was used for pair-wise comparison of means of multiple samples (homogeneity of variance with LSD-t test, unequal variances with Games-Howell method).
RESULTS: The phosphorylation level of GSK-3β decreased initially and then increased in the progression of ALF. Inhibition of GSK-3β, either by pretreatment or treatment with SB216763, could improve liver function (serum ALT and AST levels decreased significantly, and there was obvious improvement in liver tissue injury), suppress inflammatory responses (inhibition of expression of pro-inflammatory cytokines, such as TNF-α, IL-6 and IL-1β, and promotion of expression of anti-inflammatory cytokine IL-10), and reduced the expression of apoptosis-related protein Caspase 3.
CONCLUSION: GSK-3β is activated in D-GalN/LPS-induced ALF in mice, and inhibition of GSK-3β activity can improve liver injury by reducing inflammation and hepatocyte apoptosis, GSK-3β may be a new target for the treatment of ALF.
- Citation: Yang BZ, Ren F, Wen T, Yin JM, Wang XX, Piao ZF, Chen DX, Zheng SJ, Zhang J, Chen Y, Duan ZP, Shi SS. Role of glycogen synthase kinase 3β in the pathogenesis of D-GalN/LPS-induced acute liver injury in mice. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3656-3662
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3656.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3656
重型肝炎肝衰竭在临床上病情危重、发展迅速、病死率很高, 迄今在临床上还缺少特异有效的治疗药物和方法, 这主要是因为其确切发病机制并不清楚. 目前认为主要是免疫损伤、缺血缺氧性损伤和内毒素血症损伤等促进炎症反应及细胞凋亡, 最终导致肝衰竭[1-4]. 细胞内信号分子糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)在炎症反应以及细胞凋亡调节方面均发挥着重要作用[5-17]. 那么, GSK-3β在重型肝炎肝衰竭发病机制中作用如何?最新的实验表明, 在D-氨基半乳糖/脂多糖联合注射诱导小鼠重型肝炎肝衰竭模型中, GSK-3β活性升高, 说明GSK-3β在重型肝炎肝衰竭致病机制中发挥一定调节作用, 因此我们分别利用GSK-3β特异性抑制剂SB216763, 分别探讨GSK-3β活性抑制对重型肝炎肝衰竭的干预和治疗作用.
健康♂C57BL/6小鼠, 8-12周龄, 体质量18-25 g, 购自军事医学科学院, 在北京市肝病研究所饲养, 实验前12 h和实验期间禁食, 自由饮水; GSK-3β特异性抑制剂SB216763购自美国Sigma公司; p-GSK-3β、GSK-3β、Caspase 3、Cleaved caspase 3兔抗鼠单克隆抗体以及辣根过氧化酶(HPR)偶联的羊抗兔多克隆抗体均购自美国Cell Signaling公司; β-Actin抗体购自美国Santa Cruz公司; 增强化学发光试剂盒购自美国Thermo公司; 蛋白定量试剂盒购自美国Bio-Rad公司, SuperScript Ⅲ Platinum Two-step qRT-PCR试剂盒和TRIzol试剂均购自美国Invitrogen公司.
1.2.1 模型的建立: C57BL/6小鼠腹腔注射D-氨基半乳糖(700 mg/kg)/脂多糖(10 μg/kg), SB216763在注射D-GalN/LPS之前或之后2 h注射, 浓度为50 mg/kg. 随后在不同的时间点处死小鼠收集肝脏组织及外周血.
1.2.2 实验分组: 为研究GSK-3β在重型肝炎肝衰竭过程中的表达, 将模型组分为0、1、3、6 h 4个亚组, 干预实验分建模前2 h和建模后2 h 2个亚组, 于建模后6 h处死小鼠.
1.2.3 肝组织蛋白提取、浓度测定及Western blot检测: 取小鼠肝组织约100 mg, 立即置于l mL预冷的组织裂解液, 冰浴下充分匀浆, 然后于冰上静置30 min, 4 ℃下12 000 g离心5 min, 用Bio-Rad Dc蛋白分析微孔板法测定上清液中蛋白浓度, 具体操作按说明书进行; Western blotting操作如下: 取60 μg肝脏组织蛋白上样、蛋白样品的电泳(开始80 V, 当蛋白Marker电泳至分离胶后调为120 V至蛋白充分分离)、蛋白转膜(聚偏氟乙烯膜, 30 V、4 ℃过夜转膜)、一抗(1:1 000稀释)4 ℃孵育过夜、二抗(1:2 000稀释)室温孵育1 h、TBST漂洗3次, 取等量的增强化学发光试剂A液和B液混匀后孵育聚偏氟乙烯膜, 压片曝光.
1.2.4 生物化学分析仪检测 采用全自动生物化学分析仪测定血清转氨酶(alanine aminotransferase, ALT)、天门冬酸氨基转移酶(aspartate aminotransferase, AST)水平.
1.2.5 病理学检测: 常规石蜡包埋, 切片HE染色, 光学显微镜观察肝组织损伤情况.
1.2.6 炎症因子实时荧光定量PCR检测: 使用TRIzol试剂提取肝脏组织总RNA, 具体操作按照说明书进行; 测定总RNA浓度并配制等量总RNA的溶液; 使用SuperScript Ⅲ Platinum Two-step qRT-P CR试剂盒合成cDNA第一链, 随后进行实时荧光定量PCR检测, 具体操作按试剂盒说明书进行; 所测定细胞炎症因子及其引物见表1.
| 靶基因 | 正向引物 | 反向引物 |
| HPRT | 5-TCAACGGGGGACATAAAAGT-3 | 5-TGCATTGTTTTACCAGTGTCAA-3 |
| IL-10 | 5-ACTGCACCCACTTCCCAGT-3 | 5-TGTCCAGCTGGTCCTTTGTT-3 |
| IL-12p40 | 5-CAGCTTCTTCATCAGGGACAT-3 | 5-CTTGAGGGAGAAGTAGGAATGG-3 |
| TNF-α | 5-GCCTCTTCTCATTCCTGCTTGT-3 | 5-TTGAGATCCATGCCGTTG-3 |
| IL-1b | 5-TTGACGGACCCCAAAAGAT-3 | 5-GATGATCTGAGTGTGAGGGTCTG-3 |
| IL-6 | 5-GCTACCAAACTGGATATAATCAGGA-3 | 5- CCAGGTAGCTATGGTACTCCAGAA -3 |
统计学处理 所有数据采用均数±标准差(mean±SD)表示, 用SPSS13.0进行数据处理, 多组样本均数的两两比较采用One-way ANOVA分析(方差齐者用LSD-t检验, 方差不齐者用Games-Howell法), P<0.05有统计学意义.
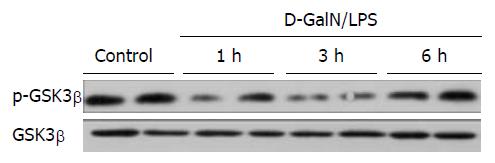
Western blot结果显示(图1), 总GSK-3β水平在重型肝炎肝衰竭期间虽无明显变化, 但GSK-3β第9位丝氨酸位点磷酸化水平在建模后1、3 h降低(活性升高), 建模后6 h磷酸化水平又重新升高(活性降低), 结果说明GSK-3β活性在重型肝炎肝衰竭中的活性增高是暂时的, 随疾病的进展其活性再次降低.
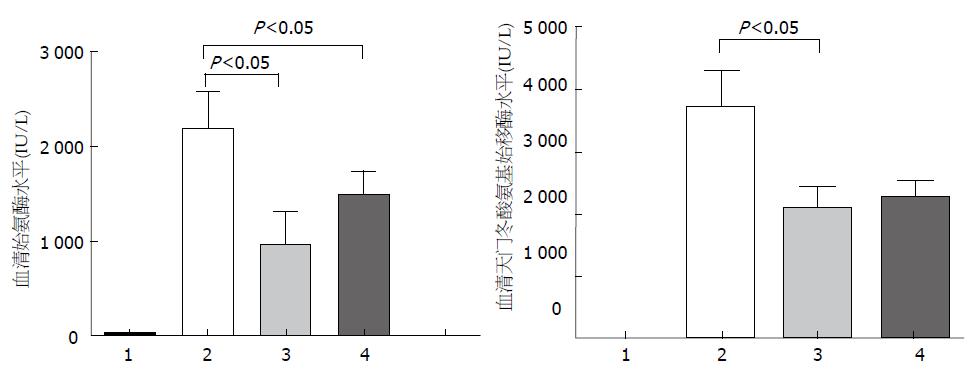
对于模型组, 在建模6 h后, 小鼠血清ALT、AST水平分别为2 195.3 IU/L±450.5 IU/L和3 705.3 IU/L±632.8 IU/L; 对于SB216763干预组, 血清ALT、AST水平分别为961.1 IU/L±356.0 IU/L和2 709.9 IU/L±423.9 IU/L, 与模型组相比, 差异具有显著的统计学意义. 对于SB216763治疗组, 血清ALT、AST水平分别为1 491.2 IU/L±622.9 IU/L和2 274.5 IU/L±651.0 IU/L, 与模型组相比, 差异也具有显著的统计学意义(图2). 因此, 无论是干预和治疗, 抑制GSK-3β活性都显著改善重型肝炎肝衰竭小鼠的肝脏功能.
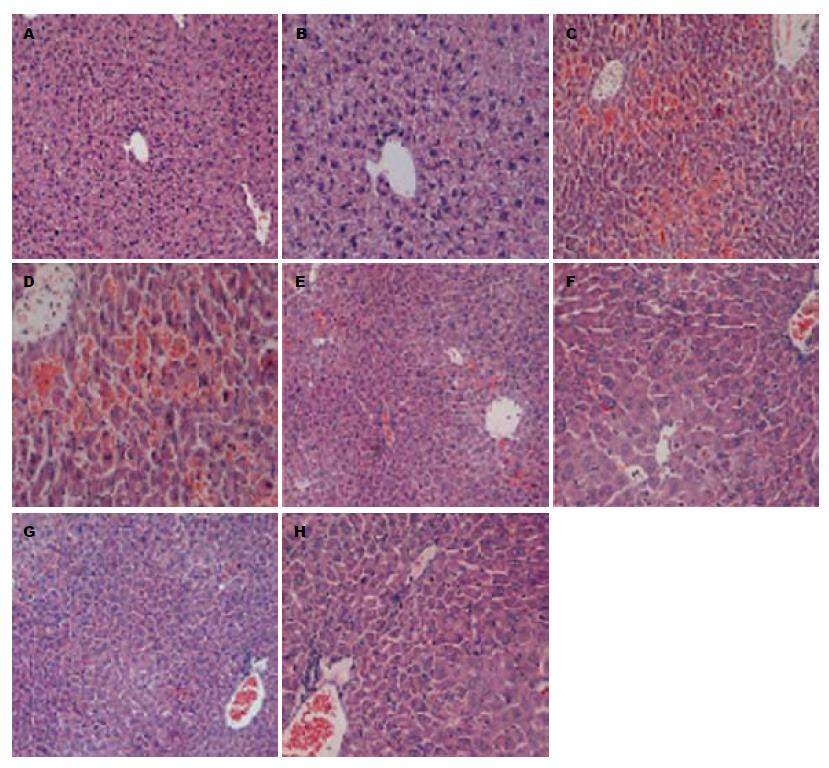
正带小鼠肝脏体积正常, 呈鲜红色, 表面光滑, 边缘整齐, HE染色显示肝小叶形态结构完整, 未见变性、坏死及炎症细胞浸润等. D-GalN/LPS诱导重型肝炎肝衰竭6 h, 部分肝小叶出现结构紊乱、细胞肿胀变性、细胞凋亡及炎症细胞浸润, 可见大块坏死区. 给予SB216763干预或者治疗, 肝细胞变性、坏死明显减轻, 炎细胞浸润减少, 坏死区明显减少(图3). 结果提示GSK-3β抑制剂改善D-GalN/LPS所致小鼠重型肝炎肝衰竭的病理损伤.
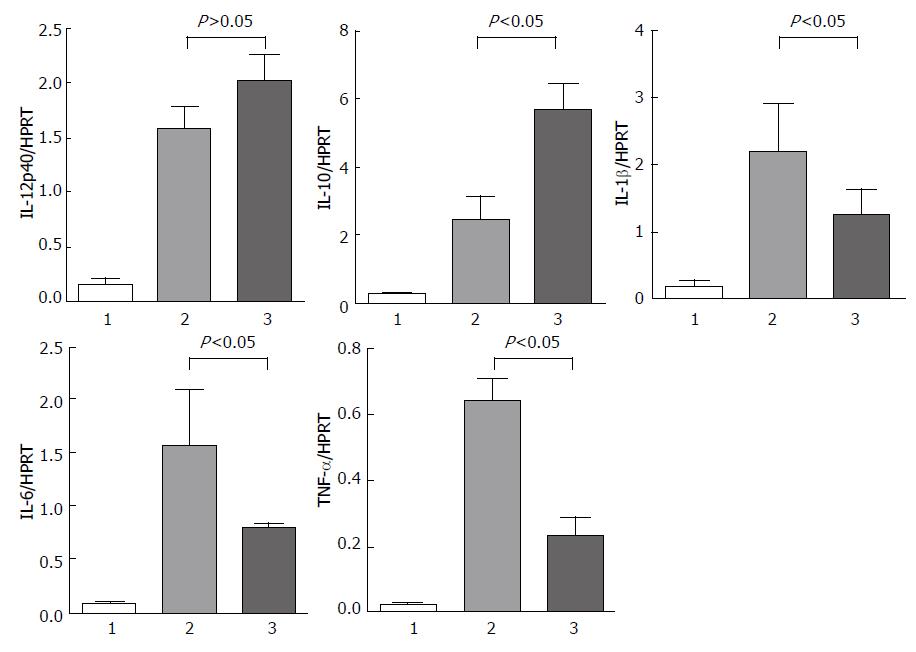
RT-PCR结果表明, D-GalN/LPS诱导的急性肝衰竭模型组肝脏组织中促炎因子肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白介素6(interleukin-6, IL-6)、IL-1β基因表达升高, IL-10表达也升高; 而GSK-3β活性干预组肝脏组织中TNF-α、IL-6、IL-1b的表达明显降低, 同时促进抗炎因子IL-10的基因高表达, 并且差异均具有统计学意义(图4). 该研究表明抑制GSK-3β活性显著减轻D-GalN/LPS所致小鼠肝脏炎症反应.
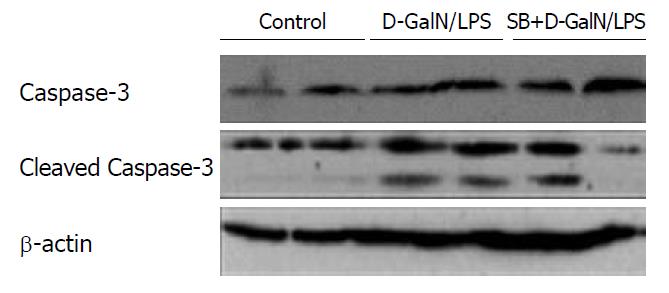
为了探明抑制GSK-3β活性对小鼠肝脏中肝细胞凋亡的影响, 我们分别检测了肝脏中Caspase-3及其活性片断的蛋白表达情况. 结果表明, D-GalN/LPS诱导的急性肝衰竭模型组6 h时间点的Caspase-3活性片断Cleaved Caspase-3的表达升高, 说明肝脏中肝细胞的大量凋亡存在; 而SB216763干预组较模型组相比, Cleaved Caspase 3表达降低, 说明干预组中肝脏组织肝细胞凋亡减少(图5). 因此研究结果提示GSK-3β活性抑制可抑制D-GalN/LPS诱导的肝细胞凋亡.
糖原合成酶激酶-3是一个丝氨酸/苏氨酸类激酶, 广泛存在于真核生物中, 哺乳动物体内发现有2种亚型: GSK-3α和GSK-3β, 在不同的组织中有不同的分布. 早期研究认为GSK-3β主要功能是磷酸化肝糖原合成酶(glycogen synthase, GS)并使之失活, 后来研究表明, GSK-3β在调节细胞活性、分化和生存方面具有广泛的生物学活性, 并且在静止细胞中持续表达. 后来研究表明, 该酶可磷酸化众多底物而发挥调节细胞增殖、凋亡, 调节炎症反应等重要功能[18,19], 在蛋白质合成、细胞增殖、细胞分化和炎症反应[2-5]等诸多方面扮演着相当重要的角色. 我们过去的实验已经证明GSK-3β活性调节在小鼠肝脏热缺血再灌注损伤中发挥重要作用[20,21]. 我们最新研究结果显示, GSK-3β在D-GalN/LPS诱导小鼠重型肝炎肝衰竭中也发挥重要的作用.
本研究的结果显示, 在D-GalN/LPS诱导小鼠重型肝炎肝衰竭过程中, GSK-3β磷酸化水平在建模后1、3 h明显降低而活性升高, 建模后6 h磷酸化水平又明显升高而活性降低, 这提示GSK-3β活性调节比较精细, 可能在重型肝炎肝衰竭中发挥着重要作用.
GSK-3β在细胞凋亡和炎症反应发挥着调节作用[5,22-29]. GSK-3β活性增强可通过调节外源性凋亡信号途径和内源性凋亡信号途径调节细胞凋亡. GSK-3β活性增强, 促进了一些促炎细胞因子的产生, 例如: IL-6、IL-1β和TNF-α; 另一方面, GSK-3β活性增强却减少了抗炎因子IL-10的产生; 而抑制GSK-3β的活性却大大减少了促炎因子IL-6、IL-1β和TNF-α的产生并且增加了抗炎因子IL-10的产生[5]. 由此可以推断, 抑制GSK-3β活性可能通过抑制炎症反应和细胞凋亡, 对D-GalN/LPS诱导小鼠重型肝炎肝衰竭起到一定的治疗作用.
我们的研究结果也表明, 抑制GSK-3β活性可以显著改善小鼠肝脏功能; 可以改善小鼠肝脏病理损伤; 可以抑制促炎因子TNF-α、IL-6、IL-1b的表达, 相反促进抗炎因子IL-10的表达, 而改善肝脏的炎症反应; 同时可以降低凋亡效应蛋白Cleaved Caspase 3表达. 我们可以做出推断, 抑制GSK-3β活性可以通过抑制炎症反应和细胞凋亡, 来改善肝脏功能、减轻肝脏损伤[30-32].
总之, GSK-3β活性在D-GalN/LPS诱导小鼠重型肝炎肝衰竭中发挥重要作用. 抑制GSK-3β活性对D-GalN/LPS诱导小鼠重型肝炎肝衰竭进行干预, 可减轻肝脏炎症反应和病理损伤, 抑制细胞凋亡, 改善肝脏功能. 因此, 干预GSK-3β活性可能为重型肝炎肝衰竭治疗提供新的靶点.
在我国, 肝衰竭的发病原因主要是肝炎病毒, 其发病机制一是由病毒直接或间接所致原发性损伤(炎症反应), 二是以内毒素-细胞因子轴-肝细胞凋亡学说为核心的继发性损伤. 国内外研究相继发现糖原合成酶激酶(GSK-3β)在炎症反应和细胞凋亡中发挥着重要作用, 但GSK-3β在肝衰竭中的作用机制尚不清楚.
唐世刚, 教授, 湖南省人民医院
任锋等报道, 缺血提高了GSK-3β的活性, 促进炎症反应的发生并导致肝脏组织的损伤. 特异性抑制GSK-3β后, 可通过降低炎症反应水平来减轻小鼠肝脏的缺血再灌注损伤.
本文首次试图以GSK-3β, 从炎症反应和细胞凋亡两方面入手, 研究重型肝炎肝衰竭可能的发病机制.
目前国内外对重型肝炎肝衰竭的治疗主要包括药物治疗、人工肝治疗及肝移植. 这些治疗虽然对减轻肝脏损伤, 挽救患者生命起一定的作用, 但尚缺乏特异、有效的干预手段, 整体疗效较差, 病死率居高不下. 而GSK-3β有可能为重型肝炎肝衰竭的治疗提供新的靶点.
本文以不同的实验方法验证同一问题, 方法可靠, 数据可信. 有较好的临床应用价值.
编辑: 田滢 电编:鲁亚静
| 1. | Matsuda T, Yamaguchi Y, Matsumura F, Akizuki E, Okabe K, Liang J, Ohshiro H, Ichiguchi O, Yamada S, Mori K. Immunosuppressants decrease neutrophil chemoattractant and attenuate ischemia/reperfusion injury of the liver in rats. J Trauma. 1998;44:475-484. [PubMed] [DOI] |
| 2. | Zwacka RM, Zhang Y, Halldorson J, Schlossberg H, Dudus L, Engelhardt JF. CD4(+) T-lymphocytes mediate ischemia/reperfusion-induced inflammatory responses in mouse liver. J Clin Invest. 1997;100:279-289. [PubMed] [DOI] |
| 3. | Clavien PA, Rüdiger HA, Selzner M. Mechanism of hepatocyte death after ischemia: apoptosis versus necrosis. Hepatology. 2001;33:1555-1557. [PubMed] [DOI] |
| 5. | Martin M, Rehani K, Jope RS, Michalek SM. Toll-like receptor-mediated cytokine production is differentially regulated by glycogen synthase kinase 3. Nat Immunol. 2005;6:777-784. [PubMed] [DOI] |
| 6. | Whittle BJ, Varga C, Pósa A, Molnár A, Collin M, Thiemermann C. Reduction of experimental colitis in the rat by inhibitors of glycogen synthase kinase-3beta. Br J Pharmacol. 2006;147:575-582. [PubMed] [DOI] |
| 7. | Hoeflich KP, Luo J, Rubie EA, Tsao MS, Jin O, Woodgett JR. Requirement for glycogen synthase kinase-3beta in cell survival and NF-kappaB activation. Nature. 2000;406:86-90. [PubMed] [DOI] |
| 8. | Schwabe RF, Brenner DA. Role of glycogen synthase kinase-3 in TNF-alpha-induced NF-kappaB activation and apoptosis in hepatocytes. Am J Physiol Gastrointest Liver Physiol. 2002;283:G204-G211. [PubMed] |
| 9. | Racanelli V, Rehermann B. The liver as an immunological organ. Hepatology. 2006;43:S54-S62. [PubMed] [DOI] |
| 10. | Gao B, Jeong WI, Tian Z. Liver: An organ with predominant innate immunity. Hepatology. 2008;47:729-736. [PubMed] [DOI] |
| 11. | Steinhorn DM, Cerra FB. Comparative effects of lipopolysaccharide on newborn versus adult rat hepatocyte and nonparenchymal cell cocultures. Crit Care Med. 1997;25:121-127. [PubMed] [DOI] |
| 12. | Wanner GA, Müller PE, Ertel W, Bauer M, Menger MD, Messmer K. Differential effect of anti-TNF-alpha antibody on proinflammatory cytokine release by Kupffer cells following liver ischemia and reperfusion. Shock. 1999;11:391-395. [PubMed] |
| 13. | Colletti LM, Kunkel SL, Walz A, Burdick MD, Kunkel RG, Wilke CA, Strieter RM. The role of cytokine networks in the local liver injury following hepatic ischemia/reperfusion in the rat. Hepatology. 1996;23:506-514. [PubMed] [DOI] |
| 14. | Suzuki S, Toledo-Pereyra LH, Rodriguez FJ, Cejalvo D. Neutrophil infiltration as an important factor in liver ischemia and reperfusion injury. Modulating effects of FK506 and cyclosporine. Transplantation. 1993;55:1265-1272. [PubMed] [DOI] |
| 15. | Jaeschke H, Farhood A. Neutrophil and Kupffer cell-induced oxidant stress and ischemia-reperfusion injury in rat liver. Am J Physiol. 1991;260:G355-G362. [PubMed] |
| 16. | Methe H, Zimmer E, Grimm C, Nabauer M, Koglin J. Evidence for a role of toll-like receptor 4 in development of chronic allograft rejection after cardiac transplantation. Transplantation. 2004;78:1324-1331. [PubMed] [DOI] |
| 17. | Tailleux L, Schwartz O, Herrmann JL, Pivert E, Jackson M, Amara A, Legres L, Dreher D, Nicod LP, Gluckman JC. DC-SIGN is the major Mycobacterium tuberculosis receptor on human dendritic cells. J Exp Med. 2003;197:121-127. [PubMed] [DOI] |
| 18. | Jope RS, Johnson GV. The glamour and gloom of glycogen synthase kinase-3. Trends Biochem Sci. 2004;29:95-102. [PubMed] [DOI] |
| 19. | Woodgett JR. Molecular cloning and expression of glycogen synthase kinase-3/factor A. EMBO J. 1990;9:2431-2438. [PubMed] |
| 20. | Ren F, Duan Z, Cheng Q, Shen X, Gao F, Bai L, Liu J, Busuttil RW, Kupiec-Weglinski JW, Zhai Y. Inhibition of glycogen synthase kinase 3 beta ameliorates liver ischemia reperfusion injury by way of an interleukin-10-mediated immune regulatory mechanism. Hepatology. 2011;54:687-696. [PubMed] [DOI] |
| 21. | 任 锋, 张 海燕, 朴 正福, 郑 素军, 陈 煜, 武 志明, 段 钟平. 糖原合成酶激酶-3β在肝脏热缺血再灌注损伤中的作用及其干预. 中华肝脏病杂志. 2011;19:547-551. |
| 25. | Hancock WW, Gao W, Csizmadia V, Faia KL, Shemmeri N, Luster AD. Donor-derived IP-10 initiates development of acute allograft rejection. J Exp Med. 2001;193:975-980. [PubMed] [DOI] |
| 26. | Hu X, Paik PK, Chen J, Yarilina A, Kockeritz L, Lu TT, Woodgett JR, Ivashkiv LB. IFN-gamma suppresses IL-10 production and synergizes with TLR2 by regulating GSK3 and CREB/AP-1 proteins. Immunity. 2006;24:563-574. [PubMed] [DOI] |
| 27. | Wajant H, Pfizenmaier K, Scheurich P. Tumor necrosis factor signaling. Cell Death Differ. 2003;10:45-65. [PubMed] [DOI] |
| 28. | Ashkenazi A, Dixit VM. Death receptors: signaling and modulation. Science. 1998;281:1305-1308. [PubMed] [DOI] |
| 29. | Geisler F, Algül H, Paxian S, Schmid RM. Genetic inactivation of RelA/p65 sensitizes adult mouse hepatocytes to TNF-induced apoptosis in vivo and in vitro. Gastroenterology. 2007;132:2489-2503. [PubMed] [DOI] |
| 30. | Kim AJ, Shi Y, Austin RC, Werstuck GH. Valproate protects cells from ER stress-induced lipid accumulation and apoptosis by inhibiting glycogen synthase kinase-3. J Cell Sci. 2005;118:89-99. [PubMed] [DOI] |
| 31. | Srinivasan S, Ohsugi M, Liu Z, Fatrai S, Bernal-Mizrachi E, Permutt MA. Endoplasmic reticulum stress-induced apoptosis is partly mediated by reduced insulin signaling through phosphatidylinositol 3-kinase/Akt and increased glycogen synthase kinase-3beta in mouse insulinoma cells. Diabetes. 2005;54:968-975. [PubMed] [DOI] |