修回日期: 2012-12-21
接受日期: 2012-12-22
在线出版日期: 2012-12-28
目的: 探讨莫沙比利对氯吡格雷所致人胃黏膜上皮细胞(gastric mucosal epithelium cells, GES-1)损伤的保护作用及其机制.
方法: 建立GES-1单层细胞模型, 将细胞分为阴性对照组、氯吡格雷IC50浓度(0.36 mmol/L)损伤组及不同浓度莫沙比利(0.4、0.5、0.6 µmol/L)联合氯吡格雷IC50浓度组, 噻唑蓝比色法(MTT)和流式细胞仪检测各组细胞增殖、凋亡情况; 采用Western blot检测各细胞组p-P38以及紧密连接蛋白Occludin、ZO-1的表达量.
结果: 莫沙比利对氯吡格雷致GES-1细胞损伤有抑制作用(P<0.05); 与阴性对照组相比, 氯吡格雷损伤组p-P38表达显著增加, 而莫沙比利组p-P38表达量较氯吡格雷损伤组减少(P<0.05); 同时随着p-P38表达量的减少, Occludin、ZO-1表达量逐渐增加.
结论: 莫沙比利能够抑制氯吡格雷所致GES-1细胞损伤, 可能是通过抑制p38MAPK的磷酸化、上调紧密连接蛋白Occludin、ZO-1的表达, 从而达到保护胃黏膜的作用.
引文著录: 吴海露, 张振玉, 段兆涛, 袁芳岑, 高欣, 王劲松, 黄文斌. 莫沙比利通过p38/MAPK通路保护氯吡格雷所致胃黏膜上皮细胞损伤. 世界华人消化杂志 2012; 20(36): 3632-3637
Revised: December 21, 2012
Accepted: December 22, 2012
Published online: December 28, 2012
AIM: To investigate whether mosapride has a protective effect against clopidogrel-induced gastric mucosal epithelium cells (GES-1) damage and to explore the underlying mechanisms.
METHODS: GES-1 cells were cultured in vitro and divided into control group, clopidogrel group (treated with clopidogrel at a concentration of IC50, 0.36 mmol/L) and clopidogrel plus mosapride groups (treated with clopidogrel and 0.4, 0.5, or 0.6 µmol/L of mosapride). MTT assay and flow cytometry were used to detect the proliferation and apoptosis of cells of each group. The expression of phosphorylated P38 (p-P38), occludin and ZO-1 proteins in GES-1 cells was detected by Western blot.
RESULTS: Compared to the control group, p-P38 expression was significantly up-regulated in the clopidogrel group (P < 0.05). The expression of p-P38 in the clopidogrel plus mosapride groups was significantly lower than that in the clopidogrel group (all P < 0.05). With the decrease in p-P38 expression, the expression of occludin and ZO-1 were gradually increased.
CONCLUSION: Mosapride exerts a protective effect against clopidogrel-induced GES-1 cell damage probably by inhibiting p38/MAPK phosphorylation and up-regulating the expression of tight junction proteins occludin and ZO-1.
- Citation: Wu HL, Zhang ZY, Duan ZT, Yuan FC, Gao X, Wang JS, Huang WB. Mosapride protects against clopidogrel-induced gastric mucosal epithelium cell damage via the p38 MAPK signaling pathway. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3632-3637
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3632.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3632
氯吡格雷作为新型噻吩吡啶类药物已广泛用于缺血性心脑血管疾病, 但随之而来的胃肠道损伤亦引起临床医师的广泛关注[1-3], 目前临床通常联合使用质子泵抑制剂(proton pump inhibitor, PPI)预防氯吡格雷引起的消化道损伤[4,5], 但有研究显示联合使用质子泵抑制剂会增加急性冠脉综合征患者死亡和再住院的风险[6-10], 因此有必要寻找其他能减轻氯吡格雷引起的消化道损伤的药物. 近年来有文献报道5-HT4受体激动剂有胃黏膜保护作用[11,12], 但具体机制尚不明确. 其中莫沙比利是目前最常用的5-HT4受体激动剂之一. 因此本研究在细胞水平上初步探讨莫沙比利对人胃黏膜保护作用及可能的机制.
硫酸氯吡格雷购自北京诺德恒信化工技术有限公司(批号: NDS0060513); 枸橼酸莫沙比利由成都康弘药业有限公司馈赠(批号: 100901); 噻唑蓝(MTT)购自美国Sigma公司; Annexin V FITC/PI凋亡检测试剂盒购自美国BD公司; β-actin、ZO-1抗体购自Santa Cruz; p-P38、Occludin抗体购自cell signal公司.
1.2.1 细胞培养: 将人胃黏膜上皮细胞(gastric mucosal epithelium cells, GES-1)细胞置于含DMEM培养液(含10%小牛血清, pH 7.4)的细胞培养瓶内, 于37 ℃、50 mL/L CO2温箱中培养, 隔天更换培养液, 每3天按1:3比例传代, 实验时取对数生长期细胞.
1.2.2 细胞生长抑制试验: 应用MTT比色法, 将处于对数生长期的GES-1细胞用胰蛋白酶消化后, 以每孔2×105个细胞接种于96孔培养板中, 每孔体积200 μL, 培养24 h, 吸净培养液. 分别换上含氯吡格雷IC50[13](0.36 mmol/L)浓度的培养液200 μL, 为氯吡格雷损伤组; 含不同浓度莫沙比利(0.4、0.5、0.6 μmol/L)联合氯吡格雷IC50(0.36 mmol/L)浓度的培养液200 μL, 为莫沙比利联合氯吡格雷组. 每组设4个复孔, 同时设只加DMEM培养液的空白对照组、不加药物的阴性对照组. 继续培养24 h后, 加入50 μL MTT. 继续培养4 h, 吸净培养液, 每孔加入150 μL DMSO, 室温平板摇床摇匀10 min后以490 nm为测定波长, 用酶标仪检测吸光度(A)值, 计算抑制率. 抑制率 = (阴性对照孔A值-加药孔A值)/(阴性对照组A值)×100%. 每次实验重复3次.
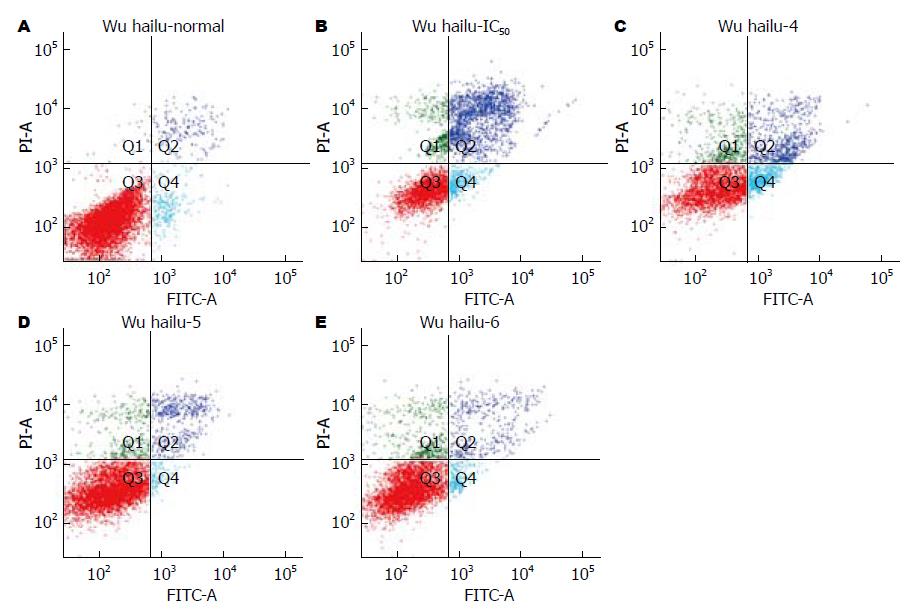
1.2.3 流式细胞仪检测: 取对数生长期的细胞,将细胞浓度调至3×105/mL、每孔3 mL体积接种于6孔板, 细胞贴壁后, 设1组为阴性对照组, 1组为氯吡格雷(0.36 mmol/L)损伤组, 另外3组分别为莫沙比利(0.4、0.5、0.6 µmol/L)联合氯吡格雷(0.36 mmol/L)组. 培养24 h, 用不含EDTA的胰酶消化后离心收集细胞, PBS液洗涤两遍, 加入500 µL Binding buffer及Annexin V-FITC和PI各5 µL, 混匀后室温避光反应15 min, 流式细胞仪检测细胞凋亡情况. 实验重复3次取均值. 正常活细胞Annexin Ⅴ及PI均低染(Annexin Ⅴ-PI-), 分布在流式细胞分析图的左下区; 凋亡早期细胞Annexin Ⅴ高染而PI低染(Annexin Ⅴ+PI-), 分布在图的右下区; 凋亡晚期细胞或死亡细胞Annexin Ⅴ及PI均高染(Annexin Ⅴ+PI+), 分布在图的右上区.
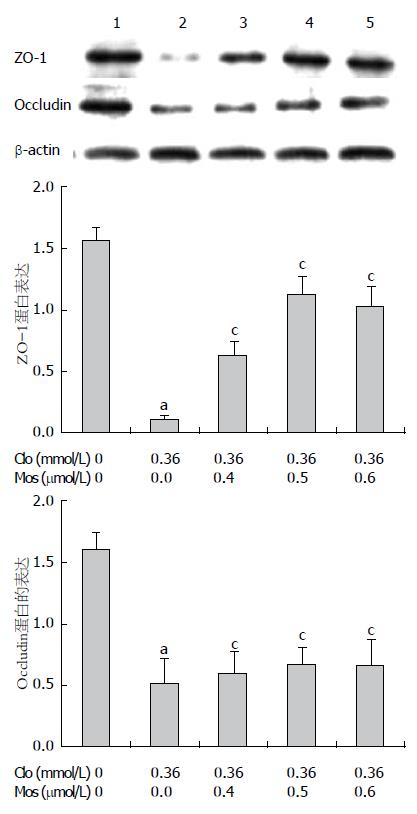
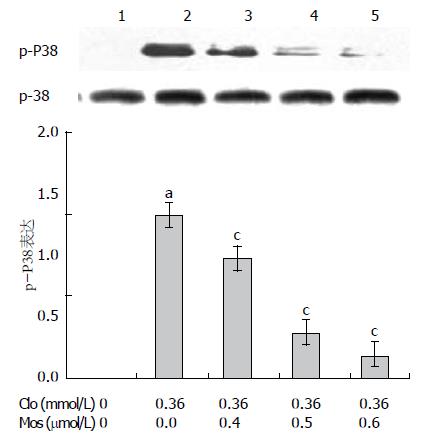
1.2.4 Western blot 检测: 取对数生长期的细胞, 以每孔5×106个细胞接种于6孔板, 各组分别加药后培养24 h, 加入蛋白裂解液, 4 ℃裂解, 14 000 r/min离心15 min, 取上清为全蛋白提取物, BCA法进行蛋白浓度测定, 每孔蛋白浓度在10-20 μg/μL. 将蛋白提取物与蛋白上样缓冲液混合, 煮沸 5 min, 分装保存于-80 ℃冰箱. 进行SDS-PAGE凝胶电泳, 转膜, 封闭后加入一抗4 ℃过夜. 再加入辣根过氧化物酶标记的二抗, 孵育后ECL法显色于X光片后照相, 以β-actin作为内参照, 使用ImageJ 1.38x软件分析处理. 各组蛋白表达水平均以实际灰度值/β-actin灰度值的比值来表示.
统计学处理 实验数据用mean±SD表示, 多组间比较采用One-way ANOVA分析, SPSS11.5软件进行数据处理及分析, 以P<0.05为差异有统计学意义.
氯吡格雷IC50(0.36 mmol/L)损伤组、莫沙比利(0.4、0.5、0.6 µmol/L)联合氯吡格雷IC50(0.36 mmol/L)组对细胞的增殖抑制率分别是49.13%±0.27%, 38.08%±2.00%, 33.51%±2.78%, 34.71%±3.87%. 3种不同浓度莫沙比利联合氯吡格雷IC50组对细胞的抑制率均低于氯吡格雷IC50损伤组(P<0.05).
流式细胞仪显示(图1): 阴性对照组凋亡率为2.9%(早期凋亡率为2.6%, 晚期凋亡率为0.3%); 氯吡格雷损伤组凋亡率为39.9%(早期凋亡率为26.1%, 晚期凋亡率为13.8%); 莫沙比利0.4 µmol/L联合氯吡格雷IC50组凋亡率为13.5%(早期凋亡率为6.2%, 晚期凋亡率为7.3%); 莫沙比利0.5 µmol/L联合氯吡格雷IC50组凋亡率为5.9%(早期凋亡率为4.5%, 晚期凋亡率为1.4%); 莫沙比利0.6 µmol/L联合氯吡格雷IC50组组凋亡率为6.3%(早期凋亡率为3.9%, 晚期凋亡率为2.4%).
Western blot结果显示(图2, 3), 氯吡格雷IC50损伤组与阴性对照组相比, Occludin与ZO-1蛋白表达减少、p-P38表达显著增加; 而氯吡格雷IC50联合莫沙比利0.4、0.5、0.6 µmol/L各组与氯吡格雷IC50损伤组相比, Occludin与ZO-1蛋白表达均增加, 而p-P38表达显著降低, 呈递减趋势.
氯吡格雷作为一种新型抗血小板药物, 已成为心脑血管疾病抗血小板治疗的基石, 但临床应用氯吡格雷常引起胃肠道不适或消化道出血风险升高, 我们在前期的研究中已证实氯吡格雷对人胃黏膜上皮细胞株GES-1具有直接损伤作用, 诱导细胞发生凋亡, 并且呈现剂量依赖性[13]. 为了预防氯吡格雷引起的胃肠道损伤事件, 临床广泛合用质子泵抑制剂, 但近来许多研究发现, PPIs合用氯吡格雷会增加患者心血管不良事件的风险, 这引起了临床医师的普遍关注.
最近有研究显示5-HT4受体激动剂具有胃黏膜保护作用: Akimoto等[14]的研究表明大剂量促胃肠动力药西沙比利可增加胃黏膜NO含量, NO可扩张胃黏膜血管, 加速损伤物质的清除, 抑制血小板聚集, 促进HCO3-分泌, 从而起到胃黏膜保护作用; Fujisawa等[15]的研究显示莫沙比利可通过5-HT4受体激活减轻NSAID的促溃疡作用, 此效应可能是通过促进副交感神经释放ACh而激活免疫细胞, 特别是ED1-阳性巨噬细胞实现的. 本实验中MTT结果示莫沙比利对氯吡格雷损伤GES-1细胞具有明显抑制作用, 流式细胞术检测结果的趋势与MTT相似.
胃肠黏膜的损伤常由胃肠黏膜屏障受损所致[16,17]. 研究表明胃肠黏膜上皮屏障功能主要由细胞内紧密连接复合体维持, 紧密连接复合体包括紧密连接蛋白、黏附因子和桥粒[18,19]. 紧密连接蛋白主要包括跨膜蛋白Occludin、Claudins、JAMs, 胞质附着蛋白ZO家族(zonulaoccludensprotein)及与其相连的细胞骨架蛋白[20]. 其中以Occludin与ZO-1尤为重要. 跨膜蛋白Occludin直接参与TJs的构成, 是目前研究较多的紧密连接蛋白. ZO-1, 位于多种上皮细胞和内皮细胞间的闭锁小带中, 他的氨基端与Occludin的羧基端的coiled-coil结构域结合. Occludin与ZO-1结合后, 将跨膜蛋白和细胞骨架连接在一起, 并调节细胞内外信号转导途径, 改变肌动蛋白收缩性, 影响细胞间紧密连接功能, 调节其通透性. 因此我们在本课题的研究中, 选择以Occludin、ZO-1作为研究对象. 而丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号传导通路能够通过调节多种紧密连接蛋白的表达并因此改变紧密连接复合体的分子组成[21-23]. 在人类MAPK信号传导通路主要由p38/MAPK、ERK/MAPK、JNK/MAPK这3个家族组成. 其中p38/MAPK是目前最主要、研究最深入的MAPK家族成员之一, 被认为是多条信号途径的交汇点和共同通道, 生理条件下p38/MAPK表达活性很低, 可被应激和各种刺激因素磷酸化激活, 在应激和炎症反应调控中具有极其重要的作用[24]. 在对增殖、凋亡的调节中p38/MAPK也发挥了重要作用[25,26], p38/MAPK既可被生长因子类刺激激活来参与细胞分化与增殖的调控, 也可被应激刺激和病理性损伤信号所激活来介导细胞凋亡反应. 故目前已有较多研究报道p38/MAPK在调节胃上皮增生、分化、凋亡中发挥重要作用[27,28], 且与溃疡的发生密切相关[29]. 国外已有研究报道阿司匹林可通过磷酸化激活p38/MAPK信号通路导致紧密连接蛋白Claudin-7的表达量下降从而引起胃黏膜上皮损伤[30].
通过Western blot结果我们发现: 氯吡格雷损伤组与阴性组相比p-P38表达量明显增高,莫沙比利预处理组与氯吡格雷损伤组相比, 随着莫沙比利浓度的增高p-P38的表达量逐渐下降; 同时Occludin、ZO-1亦随着p-P38表达量的下降逐渐上升. 因此本实验认为莫沙比利可能是通过抑制了p38的活化, 使紧密连接蛋白Occludin、ZO-1破坏减少, 维持了胃黏膜细胞的紧密连接结构, 从而保证了胃黏膜上皮的屏障功能、减轻了胃黏膜的损伤. 但细胞因子激活的信号转导过程是极其复杂的, 通路之间互相存在着交联, 信号转导过程中又受到体内较多因素的调控, 形成一个复杂的信号传导网络. 因此, 莫沙比利对胃黏膜保护作用的机制还有待进一步研究.
随着氯吡格雷的广泛使用, 其胃肠道并发症发生率正逐年上升. 目前临床通常联合质子泵抑制剂以预防其相关的胃肠道损伤, 但研究显示联合质子泵抑制剂可增加心脑血管事件的发生率和死亡率. 有关氯吡格雷引起的胃肠道损伤的防治引起了国内外临床医生的共同关注.
袁建业, 副研究员, 上海中医药大学附属龙华医院/脾胃病研究所
研究显示5-HT4受体激动剂有胃黏膜保护作用, 但具体机制尚不明确, 其中莫沙比利是目前最常用的5-HT4受体激动剂之一.
Masahiko等多位研究者已通过动物实验证实莫沙比利可减轻非甾体类抗炎药引起的胃黏膜损伤.
目前有关莫沙比利对氯吡格雷相关的胃肠道损伤是否具有保护作用的研究甚少, 该文通过体外实验进行初步证实, 并对其可能的机制进行了探讨.
本文为莫沙比利新的临床领域的开拓提供了一定的理论依据, 为临床更好的应用氯吡格雷, 减少其胃肠道不良反应提供了新思路.
丝裂原活化蛋白激酶(MAKP): 细胞内的一类丝氨酸/苏氨酸蛋白激酶. 研究证实, MAPK信号转导通路存在于大多数细胞内, 将细胞外刺激信号转导至细胞及其核内, 并引起生物学反应(如细胞增殖、分化、转化及凋亡等)的过程中具有至关重要的作用.
该文设计合理, 实验方法较为经典, 数据可靠, 为莫沙比利对氯吡格雷相关的胃肠道损伤的防治提供了客观的理论依据.
编辑: 翟欢欢 电编:鲁亚静
| 1. | Chan FK, Ching JY, Hung LC, Wong VW, Leung VK, Kung NN, Hui AJ, Wu JC, Leung WK, Lee VW. Clopidogrel versus aspirin and esomeprazole to prevent recurrent ulcer bleeding. N Engl J Med. 2005;352:238-244. [PubMed] [DOI] |
| 2. | Shin JS, Abah U. Is routine stress ulcer prophylaxis of benefit for patients undergoing cardiac surgery? Interact Cardiovasc Thorac Surg. 2012;14:622-628. [PubMed] [DOI] |
| 3. | Uotani T, Sugimoto M, Nishino M, Kodaira C, Yamade M, Sahara S, Yamada T, Osawa S, Sugimoto K, Tanaka T. Ability of rabeprazole to prevent gastric mucosal damage from clopidogrel and low doses of aspirin depends on CYP2C19 genotype. Clin Gastroenterol Hepatol. 2012;10:879-885. e2. |
| 4. | Bhatt DL, Scheiman J, Abraham NS, Antman EM, Chan FK, Furberg CD, Johnson DA, Mahaffey KW, Quigley EM. ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. Circulation. 2008;118:1894-1909. [PubMed] [DOI] |
| 5. | Fontes-Carvalho R, Albuquerque A, Araújo C, Pimentel-Nunes P, Ribeiro VG. Omeprazole, but not pantoprazole, reduces the antiplatelet effect of clopidogrel: a randomized clinical crossover trial in patients after myocardial infarction evaluating the clopidogrel-PPIs drug interaction. Eur J Gastroenterol Hepatol. 2011;23:396-404. [PubMed] [DOI] |
| 6. | Juurlink DN, Gomes T, Ko DT, Szmitko PE, Austin PC, Tu JV, Henry DA, Kopp A, Mamdani MM. A population-based study of the drug interaction between proton pump inhibitors and clopidogrel. CMAJ. 2009;180:713-718. [PubMed] [DOI] |
| 7. | Ho PM, Maddox TM, Wang L, Fihn SD, Jesse RL, Peterson ED, Rumsfeld JS. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome. JAMA. 2009;301:937-944. [PubMed] [DOI] |
| 8. | Gilard M, Arnaud B, Le Gal G, Abgrall JF, Boschat J. Influence of omeprazol on the antiplatelet action of clopidogrel associated to aspirin. J Thromb Haemost. 2006;4:2508-2509. [PubMed] [DOI] |
| 9. | Small DS, Farid NA, Payne CD, Weerakkody GJ, Li YG, Brandt JT, Salazar DE, Winters KJ. Effects of the proton pump inhibitor lansoprazole on the pharmacokinetics and pharmacodynamics of prasugrel and clopidogrel. J Clin Pharmacol. 2008;48:475-484. [PubMed] [DOI] |
| 10. | Fontana P, Senouf D, Mach F. Biological effect of increased maintenance dose of clopidogrel in cardiovascular outpatients and influence of the cytochrome P450 2C19*2 allele on clopidogrel responsiveness. Thromb Res. 2008;121:463-468. [PubMed] [DOI] |
| 11. | Bockaert J, Fozard JR, Dumuis A, Clarke DE. The 5-HT4 receptor: a place in the sun. Trends Pharmacol Sci. 1992;13:141-145. [DOI] |
| 14. | Akimoto M, Hashimoto H, Shigemoto M, Yamashita K, Yokoyama I. Changes of nitric oxide and growth factors during gastric ulcer healing. J Cardiovasc Pharmacol. 2000;36:S282-S285. [PubMed] |
| 15. | Fujisawa M, Murata T, Hori M, Ozaki H. The 5-HT4 receptor agonist mosapride attenuates NSAID-induced gastric mucosal damage. J Gastroenterol. 2010;45:179-186. [PubMed] [DOI] |
| 16. | Agarwal R, Mori Y, Cheng Y, Jin Z, Olaru AV, Hamilton JP, David S, Selaru FM, Yang J, Abraham JM. Silencing of claudin-11 is associated with increased invasiveness of gastric cancer cells. PLoS One. 2009;4:e8002. [PubMed] [DOI] |
| 17. | Hayashi D, Tamura A, Tanaka H, Yamazaki Y, Watanabe S, Suzuki K, Suzuki K, Sentani K, Yasui W, Rakugi H. Deficiency of claudin-18 causes paracellular H+ leakage, up-regulation of interleukin-1β, and atrophic gastritis in mice. Gastroenterology. 2012;142:292-304. [PubMed] [DOI] |
| 18. | Kinugasa T, Sakaguchi T, Gu X, Reinecker HC. Claudins regulate the intestinal barrier in response to immune mediators. Gastroenterology. 2000;118:1001-1011. [PubMed] [DOI] |
| 19. | Oshima T, Koseki J, Chen X, Matsumoto T, Miwa H. Acid modulates the squamous epithelial barrier function by modulating the localization of claudins in the superficial layers. Lab Invest. 2012;92:22-31. [PubMed] [DOI] |
| 20. | Tsukita S, Furuse M, Itoh M. Multifunctional strands in tight junctions. Nat Rev Mol Cell Biol. 2001;2:285-293. [PubMed] [DOI] |
| 21. | Matter K, Balda MS. Signalling to and from tight junctions. Nat Rev Mol Cell Biol. 2003;4:225-236. [PubMed] [DOI] |
| 22. | Carrozzino F, Pugnale P, Féraille E, Montesano R. Inhibition of basal p38 or JNK activity enhances epithelial barrier function through differential modulation of claudin expression. Am J Physiol Cell Physiol. 2009;297:C775-C787. [PubMed] [DOI] |
| 23. | Oshima T, Sasaki M, Kataoka H, Miwa H, Takeuchi T, Joh T. Wip1 protects hydrogen peroxide-induced colonic epithelial barrier dysfunction. Cell Mol Life Sci. 2007;64:3139-3147. [PubMed] [DOI] |
| 24. | Morazzani M, de Carvalho DD, Kovacic H, Smida-Rezgui S, Briand C, Penel C. Monolayer versus aggregate balance in survival process for EGF-induced apoptosis in A431 carcinoma cells: Implication of ROS-P38 MAPK-integrin alpha2beta1 pathway. Int J Cancer. 2004;110:788-799. [PubMed] [DOI] |
| 25. | Chen L, Zhang SS, Barnstable CJ, Tombran-Tink J. PEDF induces apoptosis in human endothelial cells by activating p38 MAP kinase dependent cleavage of multiple caspases. Biochem Biophys Res Commun. 2006;348:1288-1295. [PubMed] [DOI] |
| 26. | Porras A, Zuluaga S, Black E, Valladares A, Alvarez AM, Ambrosino C, Benito M, Nebreda AR. P38 alpha mitogen-activated protein kinase sensitizes cells to apoptosis induced by different stimuli. Mol Biol Cell. 2004;15:922-933. [PubMed] [DOI] |
| 27. | Ding SZ, Smith MF, Goldberg JB. Helicobacter pylori and mitogen-activated protein kinases regulate the cell cycle, proliferation and apoptosis in gastric epithelial cells. J Gastroenterol Hepatol. 2008;23:e67-e78. [PubMed] [DOI] |
| 28. | Wang H, Sun Y, Liu S, Yu H, Li W, Zeng J, Chen C, Jia J. Upregulation of progranulin by Helicobacter pylori in human gastric epithelial cells via p38MAPK and MEK1/2 signaling pathway: role in epithelial cell proliferation and migration. FEMS Immunol Med Microbiol. 2011;63:82-92. [PubMed] [DOI] |
| 29. | Kobayashi N, Kataoka T, Ono A, Tsukimi Y, Okabe S. Role of p38 mitogen-activated protein kinase in the healing of gastric ulcers in rats. J Physiol Pharmacol. 2001;52:195-210. [PubMed] |
| 30. | Oshima T, Miwa H, Joh T. Aspirin induces gastric epithelial barrier dysfunction by activating p38 MAPK via claudin-7. Am J Physiol Cell Physiol. 2008;295:C800-C806. [PubMed] [DOI] |