修回日期: 2012-12-05
接受日期: 2012-12-20
在线出版日期: 2012-12-28
目的: 在体外幽门螺杆菌感染(Helicobacter pylori, H. pylori)模型中, 研究H. pylori感染对食管上皮细胞的影响.
方法: 体外培养人食管腺癌细胞OE33, 经酸化脱氧胆酸[(deoxycholic acid, DCA), 200 µmol/L, pH 6.0)]、H. pylori 26695及阴性对照处理. CCK-8检测细胞增殖活性, AnnexinV-FITC/7-AAD双染流式细胞术检测细胞凋亡, 实时定量PCR检测尾型同源框转录因子2(caudal-related homeobox transcription factor 2, CDX2)和黏蛋白-2(mucin-2, MUC2)mRNA表达, 电泳凝胶迁移实验和Western blot检测核因子κB(nuclear factor kappa, NF-κB)的DNA结合活性及蛋白表达.
结果: 与对照组相比, 酸化DCA和H. pylori处理后OE33细胞增殖活性均明显下降(46.504%, 56.147% vs 100%, DCA组, H. pylori组 vs 对照组), 凋亡增加明显(15.68%, 76.41% vs 4.25%, DCA组, H. pylori组 vs 对照组, P<0.01); 酸化DCA和H. pylori均可增加CDX2和MUC2 mRNA表达. 并且, 二者均增加磷酸化IκBα及磷酸化P65表达, 增加NF-κB的DNA结合活性.
结论: 体外H. pylori感染抑制食管上皮细胞的增殖活性并诱导其凋亡, 增加食管上皮细胞CDX2和MUC2表达及NF-κB的活性.
引文著录: 王淑君, 王蔚虹, 滕贵根, 戴芸, 褚云香, 李江. 幽门螺杆菌感染对食管上皮细胞的影响. 世界华人消化杂志 2012; 20(36): 3625-3631
Revised: December 5, 2012
Accepted: December 20, 2012
Published online: December 28, 2012
AIM: To investigate the effect of Helicobacter pylori (H. pylori) exposure on esophageal cell line OE33 in vitro.
METHODS: Human esophageal adenocarcinoma cell line OE33 was cultured and treated with 200 mmol/L acidified deoxycholic acid (pH 6.0) or infected with H. pylori 26695. After treatment or infection, cell viability was tested by CCK-8 assay; cell apoptosis was determined by flow cytometric analysis with Annexin V-FITC/7-AAD; the mRNA expression of CDX2 and MUC2 was assessed by real time-PCR; nuclear factor-kB (NF-kB)-associated proteins were examined by Western blot; and the DNA binding activity of NF-kB was evaluated by electrophoretic mobility shift assay (EMSA).
RESULTS: The viability of OE33 cells was reduced significantly after treatment with acidified deoxycholic acid or infection with H. pylori compared with negative controls (both P < 0.01). Treatment with acidified deoxycholic acid or infection with H. pylori induced apoptosis and increased the mRNA expression of CDX2 and MUC2 (all P < 0.01). Both H. pylori infection and treatment with acidified deoxycholic acid enhanced the DNA binding activity of NF-kB and the protein expression of phosphorylated IkBa and P65 in esophageal epithelial cells.
CONCLUSION: H. pylori infection reduces cell viability, induces apoptosis, and increases the expression of CDX2 and MUC2 and the activation of NF-kB in esophageal epithelial cells.
- Citation: Wang SJ, Wang WH, Teng GG, Dai Y, Chu YX, Li J. Effect of Helicobacter pylori infection on esophageal epithelial cells in vitro. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3625-3631
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3625.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3625
食管腺癌是一种恶性度高、病死率高的肿瘤, 其发生与食管下端慢性炎症及肠上皮化生相关[1]. 研究表明, Barrett化生与胃内容物及胆酸的慢性反流有关[2]. 作为胃食管反流物的主要组分, 酸和胆盐在诱导食管黏膜损伤中起着协同作用[3,4]. 胆酸, 尤其是脱氧胆酸(deoxycholic acid, DCA)具有基因毒性, 可以诱导活性氧自由基产生, 激活核转录因子κB进而诱导多种与炎症及肠化有关的基因表达, 参与Barrett食管以及食管腺癌的发生[5-7].
幽门螺杆菌感染(Helicobacter pylori, H. pylori)在胃内定植可以激活胃上皮细胞核因子κB(nuclear factor kappa, NF-κB), 释放炎性细胞因子, 诱发炎症及肿瘤的生成[8]. 尾型同源盒转录因子2(caudal-related homeobox transcription factor 2, CDX2)是维持肠型上皮细胞早期分化特性的关键转录因子, 也是标志肠化发生的最重要的转录因子[9]. CDX2异常表达参与上皮的肠化及腺癌的发生, NF-κB可调节CDX2表达[10]. 杯状细胞是肠化生的组织学标志, CDX2可上调杯状细胞特异分子黏蛋白-2(mucin-2, MUC2)[11]. 早期的研究显示, H. pylori可定植于发生胃上皮化生的食管下段黏膜[12]. 然而, H. pylori在食管下段定植对食管疾病发生的影响尚不清楚. 我们既往的动物实验发现, 食管H. pylori的定植与食管黏膜的炎症损伤程度、Barrett食管以及食管腺癌的发生相关[9], 提示食管H. pylori定植可能与胃内H. pylori定植的致病作用相似. 本研究旨在体外H. pylori感染的食管上皮细胞模型中, 探讨H. pylori感染对食管上皮细胞炎症及肠化相关分子表达的影响.
标准菌株H. pylori 26695购自ATCC(American type culture collection), 由中国疾病预防控制中心流行病研究所张建中教授惠赠; 食管腺癌细胞OE33购自ECACC(European collection of cell cultures); DCA购自美国Sigma公司, 溶于酸化的1640培养基中(pH 6.0), 浓度为200 µmol/L; CCK-8试剂盒(Cell Counting Kit-8)购自日本同仁化学研究所; AnnexinV-FITC/7-AAD检测试剂盒购自美国BD公司; SYBR Green Real-time PCR Master Mix购自美国Applied Biosystems公司; 兔抗p-IκBα mAb、兔抗p-P65、P65 mAb、HRP标记的山羊抗兔IgG和HRP标记的山羊抗小鼠IgG购自cell signaling technology; 小鼠抗β-actin单克隆抗体购自北京中杉金桥生物技术有限公司; 细胞核蛋白提取试剂盒NE-PER购自Thermo; EMSA检测试剂盒DIG Gel Shift Kit购自Roche.
1.2.1 H. pylori培养:H. pylori 26695接种于含8%羊血的哥伦比亚琼脂培养基中, 37 ℃, 微需氧条件生长48 h, 收集至PBS中(pH 7.4), 调整细菌浓度至108 CFU/mL, 按细菌和细胞比例200:1加入细胞培养皿中.
1.2.2 细胞培养及处理: 人食管腺癌细胞株OE33种植于含100 mL/L胎牛血清的1640培养基中, 37 ℃, 50 mL/L CO2的条件下培养至70%融合度, 分别加入DCA(200 µmol/L, pH 6.0)、H. pylori 26695及PBS阴性对照.
1.2.3 细胞增殖活性检测: 经上述处理12 h的细胞, 用酶标仪检测450 nm吸光度(A)值.
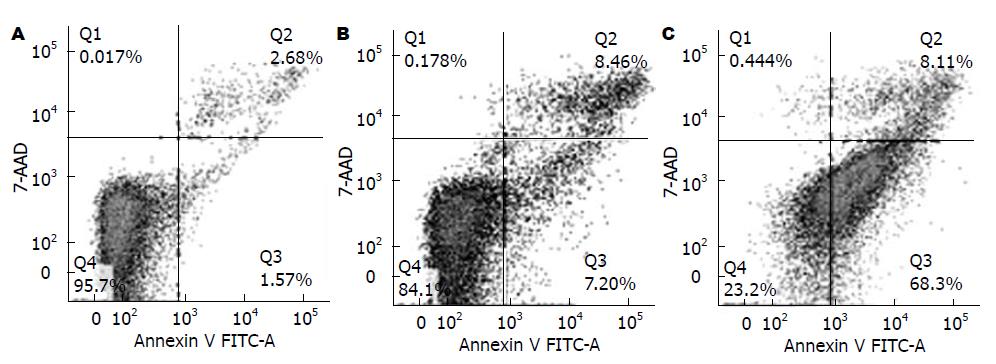
1.2.4 流式细胞仪分析细胞凋亡情况: 收集经上述处理6 h的细胞, 加入Annexin-V 5 µL、7-AAD 5 µL混匀, 室温避光放置15 min, 加入1×binding buffer 400 µL, 过滤到流式管中, 流式细胞术检测细胞凋亡率. 实验设4组: 未标记细胞组、单标记Annexin-V FITC组、单标记7-AAD组、Annexin-V FITC和7-AAD双标记组.
1.2.5 总RNA提取与逆转录: 经上述处理12 h的OE33细胞, TRIzol一步法提取总RNA, 紫外分光光度仪检测RNA浓度. 按照ABI公司高通量反转录试剂盒说明书反转录: 1 µg RNA溶于10 µL DEPC水中, 加无RNase水4.2 µL, 10×RT Buffer 2.0 µL, 10×Random Primers 2.0 µL, Multi Scribe Reverse Transcriptase 1.0 µL, 25×dNTP Mix 0.8 µL, 25 ℃ 10 min, 37 ℃ 2 h, 85 ℃ 5 min. cDNA 放-20 ℃保存.
1.2.6 实时定量PCR: 内参为GAPDH, 引物设计采用Primer Express 3.0软件, CDX2: Sense 5'-CAGTCGCTACATCACCATCC-3', Antisense 5'-CTCCTTTGCTCTGCGGTTCT-3'; MUC2: Sense 5'-TGCTCCTACGTGGCTGTTCA-3', Antisense 5'-GACGTTCTCGGTGATGATGCT-3'; GAPDH: Sense 5'-GCCTGGTCACCAGGGCT-3', Antisense 5'-AATTTGCCATGGGTGGAATC-3', 由北京天一辉远生物科技公司合成. Real-time PCR反应在ABI PRISM 7300 Detector System进行, 25 µL反应体系包括: SYBR Green Real-time PCR Master Mix (ABI)12.5 µL, 上下游引物各1 µL(5 pmol/L), cDNA 2.5 µL, DEPC水补至25 µL. 反应循环参数95 ℃ 10 min, 预变性, 95 ℃ 15 s, 60 ℃ 1 min, 40个循环; 熔解曲线95 ℃ 15 s, 60 ℃ 30 s, 96 ℃ 15 s. 经定量PCR得到相应Ct值, 运用2-△△Ct法计算实验组目的基因的表达相对于对照组的变化倍数, △△Ct = (Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组.
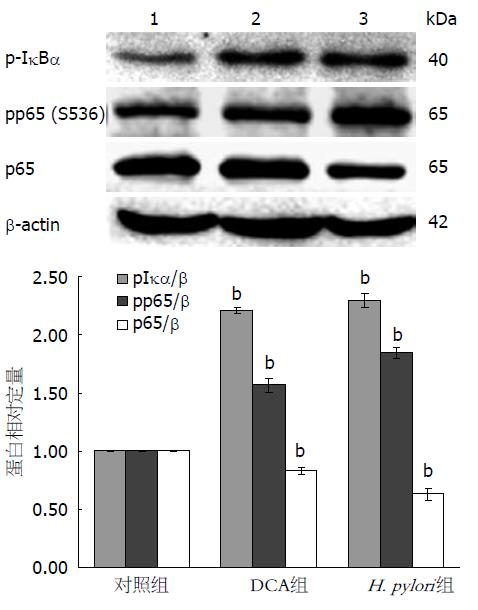
1.2.7 Western印迹法: OE33处理1 h后, 提取细胞总蛋白, 裂解缓冲液为RIPA和磷酸化酶抑制剂. BCA定量试剂盒测定蛋白浓度. 取等量蛋白10%聚丙烯酰胺凝胶电泳分离, 4 ℃电转至PVDF膜上. 5%脱脂牛奶封闭后, 分别加1:1 000的抗β-actin、兔抗p-IκBα mAb、兔抗p-P65和P65 mAb, 4 ℃过夜. PBST洗膜后, 再加1:3 000 HRP标记的IgG, 室温孵育1 h. 曝光, 显影.
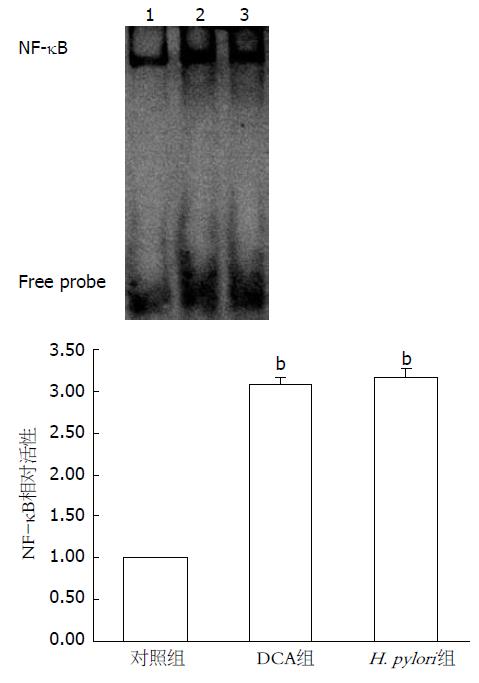
1.2.8 凝胶电泳迁移率实验: OE33细胞经上述处理1 h, 提取细胞核蛋白, BCA法测定蛋白浓度. 含有NF-κB结合位点的引物核苷酸序列: 5'-AGTTGAGGGGACTTTCCCAGGC-3'; 5'-GCCTGGGAAAGTCCCCTCAACT-3', 由上海生工生物工程技术服务有限公司合成. DIG末端标记探针. 8%聚丙烯酰胺胶预电泳15 min, 取核蛋白12 µg与探针结合反应15 min后, 加入上样孔, 电泳50 V, 2 h. 以Bio-Rad电转仪200 mA, 30 min转至Hybond+尼龙膜, 紫外1 200×100 µJ/cm2交联. 抗DIG抗体反应, 曝光.
统计学处理 SPSS16.0医学统计软件统计分析. 每组实验重复3次. 实验结果采用mean±SD, 两组间比较采用独立样本t检验, 3组间比较采用单一因素方差分析(LSD法). 以P<0.05为差异有统计学意义.
酸化DCA和H. pylori处理12 h后, OE33细胞增殖活性分别为43.504%和56.147%, 与阴性对照组相比, 增殖活性明显下降(P<0.01). 提示酸化DCA及H. pylori对OE33细胞生长均有抑制作用(表1).
流式细胞术检测OE33经酸化DCA和H. pylori处理6 h细胞凋亡情况. 结果显示, H. pylori增加OE33细胞凋亡比例(76.41%), 以早期凋亡(LR)为主(68.3%±0.02%), 与对照组相比, 差异具有统计学意义(P<0.01, 表2, 图1).
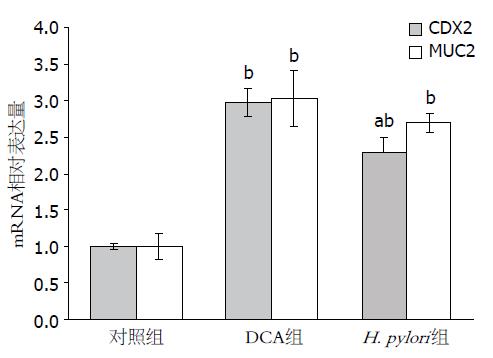
RT-PCR结果显示(图2), 酸化DCA和H. pylori处理后CDX2 mRNA的相对表达量明显高于对照组(P<0.01), 提示酸化DCA和H. pylori均上调CDX2 mRNA表达, 且酸化DCA对CDX2表达的诱导作用高于H. pylori(P<0.05). 酸化DCA和H. pylori处理后MUC2 mRNA的相对表达量明显高于对照组(P<0.01), 提示酸化DCA和H. pylori均上调MUC2 mRNA表达.
OE33细胞处理1 h后, Western blot方法检测NF-κB相关蛋白的表达(图3A), 与对照组相比, 酸化DCA和H. pylori均分别增加磷酸化IκBα、磷酸化P65表达(P<0.01), 降低P65表达(P<0.01, 图3B). EMSA方法对核蛋白的检测发现, 酸化DCA和H. pylori处理后, 与对照组相比, NF-κB的DNA结合活性均明显增加(图4).
H. pylori是胃癌Ⅰ型致癌因子, 他可以通过促进肠化相关基因CDX2等的表达促进胃上皮肠化, 参与胃癌发生的进程[13]. H. pylori感染对食管Barrett化生以及食管腺癌的发生存在争议. 然而, 反流性食管炎患者H. pylori感染率并不低, 大约为5%-51%[14,15], H. pylori可能作为反流物的一部分进入食管, 对食管疾病的发生产生一定影响. 既往研究显示, H. pylori确实可定植于发生胃上皮化生的食管下段黏膜, 其在食管下段的感染率为15.09%-50.00%[12,16]. 既往的动物实验也发现, H. pylori可定植于食管下段黏膜, 且H. pylori的定植可上调食管黏膜环氧化酶2(cyclooxygenase-2, COX-2)以及前列腺素E2(prostaglandin E2, PGE2)的表达, 食管H. pylori定植与食管黏膜的炎症损伤程度、Barrett食管以及食管腺癌的发生相关. 本研究在体外H. pylori感染的细胞模型上, 进一步发现H. pylori可降低食管上皮细胞增值活性, 诱导食管上皮细胞凋亡, 并诱导食管上皮细胞表达肠化相关分子CDX2、MUC2表达, 提示H. pylori在食管下段黏膜定植可能导致与其在胃黏膜定植相似的致病过程.
NF-κB是一种多效应的转录调节因子, 可以激活多种细胞进程的基因转录, 包括炎症、 细胞增殖、分化以及凋亡等[17]. NF-κB在很多炎症相关肿瘤的进程中被激活. 典型的NF-κB复合体是由P50-P65异源二聚体组成, 在大多数细胞的静息状态下, P50和P65(RelA)与其抑制分子IκBα结合存在于胞浆, 各种刺激因素例如脂多糖(lipopolysaccharide, LPS)、特异的细胞因子等可激活细胞内特异信号通路, 随后激活IκB激酶复合物, 促使IκBα磷酸化进而被蛋白酶体降解[18], 使P50-P65磷酸化并转移至细胞核与DNA上的κB位点结合, 激活并启动下游基因的表达, 从而导致广泛的生物学效应. 磷酸化的P65亚单位决定NF-κB介导的转录反应强度以及持续时间[19,20]. 本研究检测到食管上皮细胞与H. pylori共培养后, NF-κB DNA结合活性增强伴随磷酸化的IκBα、磷酸化的P65表达增加. 既往研究显示, 从正常食管到食管炎, 以及从Barrett食管到食管腺癌, NF-κB表达活性是增加的[21]. cagA阳性H. pylori可激活胃上皮细胞NF-κB活性, 参与胃腺癌的发生进程[22]. Abdel-Latif等[23]的研究显示, cagA阳性H. pylori及其提取物可增强食管腺癌细胞NF-κB的DNA结合活性, 降低IκBα的表达, 并诱导炎症相关分子COX-2, 转录因子AP-1(activator protein-1, AP-1)和白介素-8(interleukin 8, IL-8)的表达. 抗氧化剂维生素C则抑制H. pylori诱导的NF-κB, 表明H. pylori可能参与GERD和食管炎的发生. H. pylori诱导NF-κB的活性在1 h最强, 而酸化DCA则在2 h的活性最强[1]. 本研究显示H. pylori不仅诱导食管腺癌细胞NF-κB的激活, 伴随磷酸化IκBα和磷酸化P65增加, 还可诱导食管肠化相关分子CDX2及下游MUC2的表达, 提示H. pylori可能参与食管肠化以及腺癌的发生.
NF-κB与CDX基因关系密切, CDX2启动子上有2个NF-κB的结合位点, 突变后的CDX2启动子失活[24,25]. NF-κB在调节CDX2表达中起核心作用, 提示炎症可以诱导肠化的发生[26,27]. 脱氧胆酸可以激活NF-κB并诱导炎症和肠化相关基因如COX-2[28]、CDX2[29]、MUC2[11]等表达, 促进Barrett食管以及食管腺癌的发生[30]. 脱氧胆酸的pKa为6.2, 其在pH 6.0时可以产生最大的生物活性[31]. 本研究以脱氧胆酸处理为阳性对照, 观察H. pylori感染对食管上皮细胞的影响, 与酸化的脱氧胆酸相似, H. pylori可降低细胞增殖活性, 诱导食管上皮细胞凋亡. Jones等[32]采用Hoechst染色研究H. pylori对正常食管上皮细胞和OE33细胞的凋亡作用发现: 与正常食管上皮细胞相比, 完整的cagA阳性H. pylori以剂量依赖的方式增加OE33细胞凋亡, 而H. pylori提取物则产生较低的凋亡率. 此外, H. pylori还可增加OE33细胞Fas蛋白的表达, 提示H. pylori通过Fas级联反应诱导OE33细胞发生凋亡, 而NF-κB激活则可以调节Fas级联反应进而促进肿瘤细胞产生凋亡[33].
食管腺癌在我国发病率日益增高[34], 其5年生存率仅有5%-13%[35], 明确病因并阻断其发展至关重要. 胃食管反流物中的酸和胆盐被认为是导致食管腺癌的致病因子, 本研究结果表明, DCA和H. pylori均可抑制食管上皮细胞OE33的增殖, 诱导凋亡, 并增加CDX2和MUC2的表达. DCA对细胞增殖的抑制作用较H. pylori显著; H. pylori对凋亡的诱导较DCA显著; DCA对CDX2表达的诱导作用较H. pylori明显. 体外实验的结果可能与DCA及H. pylori的浓度、处理时间有关. 体内DCA及H. pylori可能同时作用于食管上皮细胞, 推测二者同时存在时对食管上皮细胞动力及肠化相关基因表达的诱导作用会更加明显, 这有待后续的研究进一步证实. 本研究提示, H. pylori与酸化胆盐均可能参与Barrett食管及食管腺癌的发生. 因此, 临床上应重视对合并食管H. pylori感染的胃食管反流病或Barrett患者的治疗及随访, 以防食管下段疾病的恶性转化.
AGE和RAGE与多种糖尿病合并症密切相关, 如: 糖尿病心脏病、糖尿病视网膜病、糖尿病肾病和糖尿病动脉粥样硬化等. 虽然有少量有关AGE和RAGE与糖尿病胃肠合并症的报道, 但是尚缺乏广泛和深入的研究.
魏继福, 研究员, 江苏省人民医院; 洪天配, 教授, 北京大学第三医院内分泌科
糖尿病胃肠合并症是目前国内外的研究热点之一, 而AGE和RAGE可能与其有密切关系. 为了探讨AGE和RAGE在糖尿病胃肠道合并症中的作用, 了解AGE和RAGE在正常胃肠道中的系统分布是亟待研究和解决的问题, 这正是本研究的重点所在.
本文首次系统性地探讨了AGE及其受体在整个胃肠道的分布.
本研究为进一步探讨AGE及RAGE在糖尿病胃肠道合并症中的作用奠定了基础.
糖基化终末产物: 一类多分子蛋白的总称, 通过一系列复杂的非酶催化反应诱导糖基连接到不同蛋白质的氨基酸上. 糖基化终末产物受体: 免疫球蛋白超家族的一种跨膜受体, 其能与AGE结合从而引发一系列反应. AGE和RAGE与糖尿病合并症密切相关.
本文系统的研究了AGE及其受体(RAGE)在成年Wistar大鼠胃肠道各段组织中的分布. 研究创新性强, 研究结果可靠, 具有一定的科学价值.
编辑: 田滢 电编:鲁亚静
| 1. | Abdel-Latif MM, O'Riordan J, Windle HJ, Carton E, Ravi N, Kelleher D, Reynolds JV. NF-kappaB activation in esophageal adenocarcinoma: relationship to Barrett's metaplasia, survival, and response to neoadjuvant chemoradiotherapy. Ann Surg. 2004;239:491-500. [PubMed] [DOI] |
| 2. | Appelman HD, Umar A, Orlando RC, Sontag SJ, Nandurkar S, El-Zimaity H, Lanas A, Parise P, Lambert R, Shields HM. Barrett's esophagus: natural history. Ann N Y Acad Sci. 2011;1232:292-308. [PubMed] [DOI] |
| 3. | Nehra D, Howell P, Williams CP, Pye JK, Beynon J. Toxic bile acids in gastro-oesophageal reflux disease: influence of gastric acidity. Gut. 1999;44:598-602. [PubMed] [DOI] |
| 4. | Bajpai M, Liu J, Geng X, Souza RF, Amenta PS, Das KM. Repeated exposure to acid and bile selectively induces colonic phenotype expression in a heterogeneous Barrett's epithelial cell line. Lab Invest. 2008;88:643-651. [PubMed] [DOI] |
| 5. | Jenkins GJ, D'Souza FR, Suzen SH, Eltahir ZS, James SA, Parry JM, Griffiths PA, Baxter JN. Deoxycholic acid at neutral and acid pH, is genotoxic to oesophageal cells through the induction of ROS: The potential role of anti-oxidants in Barrett's oesophagus. Carcinogenesis. 2007;28:136-142. [PubMed] [DOI] |
| 6. | Jenkins GJ, Cronin J, Alhamdani A, Rawat N, D'Souza F, Thomas T, Eltahir Z, Griffiths AP, Baxter JN. The bile acid deoxycholic acid has a non-linear dose response for DNA damage and possibly NF-kappaB activation in oesophageal cells, with a mechanism of action involving ROS. Mutagenesis. 2008;23:399-405. [PubMed] [DOI] |
| 7. | Wu J, Gong J, Geng J, Song Y. Deoxycholic acid induces the overexpression of intestinal mucin, MUC2, via NF-kB signaling pathway in human esophageal adenocarcinoma cells. BMC Cancer. 2008;8:333. [PubMed] [DOI] |
| 8. | Ng MT, Van't Hof R, Crockett JC, Hope ME, Berry S, Thomson J, McLean MH, McColl KE, El-Omar EM, Hold GL. Increase in NF-kappaB binding affinity of the variant C allele of the toll-like receptor 9 -1237T/C polymorphism is associated with Helicobacter pylori-induced gastric disease. Infect Immun. 2010;78:1345-1352. [PubMed] [DOI] |
| 9. | Liu FX, Wang WH, Wang J, Li J, Gao PP. Effect of Helicobacter pylori infection on Barrett's esophagus and esophageal adenocarcinoma formation in a rat model of chronic gastroesophageal reflux. Helicobacter. 2011;16:66-77. [PubMed] [DOI] |
| 10. | Takeshima E, Tomimori K, Kawakami H, Ishikawa C, Sawada S, Tomita M, Senba M, Kinjo F, Mimuro H, Sasakawa C. NF-kappaB activation by Helicobacter pylori requires Akt-mediated phosphorylation of p65. BMC Microbiol. 2009;9:36. [PubMed] [DOI] |
| 11. | Hu Y, Jones C, Gellersen O, Williams VA, Watson TJ, Peters JH. Pathogenesis of Barrett esophagus: deoxycholic acid up-regulates goblet-specific gene MUC2 in concert with CDX2 in human esophageal cells. Arch Surg. 2007;142:540-544; discussion 540-544. [PubMed] [DOI] |
| 13. | Jang BG, Kim WH. Molecular pathology of gastric carcinoma. Pathobiology. 2011;78:302-310. [PubMed] [DOI] |
| 14. | Henihan RD, Stuart RC, Nolan N, Gorey TF, Hennessy TP, O'Morain CA. Barrett's esophagus and the presence of Helicobacter pylori. Am J Gastroenterol. 1998;93:542-546. [PubMed] [DOI] |
| 15. | Newton M, Bryan R, Burnham WR, Kamm MA. Evaluation of Helicobacter pylori in reflux oesophagitis and Barrett's oesophagus. Gut. 1997;40:9-13. [PubMed] |
| 16. | Peitz U, Hackelsberger A, Günther T, Clara L, Malfertheiner P. The prevalence of Helicobacter pylori infection and the pattern of gastritis in Barrett's esophagus. Dig Dis. 2001;19:164-169. [PubMed] [DOI] |
| 18. | Chen LF, Greene WC. Shaping the nuclear action of NF-kappaB. Nat Rev Mol Cell Biol. 2004;5:392-401. [PubMed] [DOI] |
| 19. | Viatour P, Merville MP, Bours V, Chariot A. Phosphorylation of NF-kappaB and IkappaB proteins: implications in cancer and inflammation. Trends Biochem Sci. 2005;30:43-52. [PubMed] [DOI] |
| 20. | Bohuslav J, Chen LF, Kwon H, Mu Y, Greene WC. p53 induces NF-kappaB activation by an IkappaB kinase-independent mechanism involving phosphorylation of p65 by ribosomal S6 kinase 1. J Biol Chem. 2004;279:26115-26125. [PubMed] [DOI] |
| 21. | Colleypriest BJ, Palmer RM, Ward SG, Tosh D. Cdx genes, inflammation and the pathogenesis of Barrett's metaplasia. Trends Mol Med. 2009;15:313-322. [PubMed] [DOI] |
| 22. | Yang GF, Deng CS, Xiong YY, Gong LL, Wang BC, Luo J. Expression of nuclear factor-kappa B and target genes in gastric precancerous lesions and adenocarcinoma: association with Helicobactor pylori cagA (+) infection. World J Gastroenterol. 2004;10:491-496. [PubMed] |
| 23. | Abdel-Latif MM, Windle H, Terres A, Eidhin DN, Kelleher D, Reynolds JV. Helicobacter pylori extract induces nuclear factor-kappa B, activator protein-1, and cyclooxygenase-2 in esophageal epithelial cells. J Gastrointest Surg. 2006;10:551-562. [PubMed] [DOI] |
| 24. | Kim S, Domon-Dell C, Wang Q, Chung DH, Di Cristofano A, Pandolfi PP, Freund JN, Evers BM. PTEN and TNF-alpha regulation of the intestinal-specific Cdx-2 homeobox gene through a PI3K, PKB/Akt, and NF-kappaB-dependent pathway. Gastroenterology. 2002;123:1163-1178. [PubMed] [DOI] |
| 25. | Kazumori H, Ishihara S, Rumi MA, Kadowaki Y, Kinoshita Y. Bile acids directly augment caudal related homeobox gene Cdx2 expression in oesophageal keratinocytes in Barrett's epithelium. Gut. 2006;55:16-25. [PubMed] [DOI] |
| 26. | Baeuerle PA, Henkel T. Function and activation of NF-kappa B in the immune system. Annu Rev Immunol. 1994;12:141-179. [PubMed] [DOI] |
| 27. | Barnes PJ, Karin M. Nuclear factor-kappaB: a pivotal transcription factor in chronic inflammatory diseases. N Engl J Med. 1997;336:1066-1071. [PubMed] [DOI] |
| 28. | Shirvani VN, Ouatu-Lascar R, Kaur BS, Omary MB, Triadafilopoulos G. Cyclooxygenase 2 expression in Barrett's esophagus and adenocarcinoma: Ex vivo induction by bile salts and acid exposure. Gastroenterology. 2000;118:487-496. [DOI] |
| 29. | Hu Y, Williams VA, Gellersen O, Jones C, Watson TJ, Peters JH. The pathogenesis of Barrett's esophagus: secondary bile acids upregulate intestinal differentiation factor CDX2 expression in esophageal cells. J Gastrointest Surg. 2007;11:827-834. [PubMed] [DOI] |
| 30. | Morita S, Matsumoto Y, Okuyama S, Ono K, Kitamura Y, Tomori A, Oyama T, Amano Y, Kinoshita Y, Chiba T. Bile acid-induced expression of activation-induced cytidine deaminase during the development of Barrett's oesophageal adenocarcinoma. Carcinogenesis. 2011;32:1706-1712. [PubMed] [DOI] |
| 31. | McQuaid KR, Laine L, Fennerty MB, Souza R, Spechler SJ. Systematic review: the role of bile acids in the pathogenesis of gastro-oesophageal reflux disease and related neoplasia. Aliment Pharmacol Ther. 2011;34:146-165. [PubMed] [DOI] |
| 32. | Jones AD, Bacon KD, Jobe BA, Sheppard BC, Deveney CW, Rutten MJ. Helicobacter pylori induces apoptosis in Barrett's-derived esophageal adenocarcinoma cells. J Gastrointest Surg. 2003;7:68-76. [DOI] |
| 33. | Liu F, Bardhan K, Yang D, Thangaraju M, Ganapathy V, Waller JL, Liles GB, Lee JR, Liu K. NF-κB directly regulates Fas transcription to modulate Fas-mediated apoptosis and tumor suppression. J Biol Chem. 2012;287:25530-25540. [PubMed] [DOI] |
| 35. | Eloubeidi MA, Mason AC, Desmond RA, El-Serag HB. Temporal trends (1973-1997) in survival of patients with esophageal adenocarcinoma in the United States: a glimmer of hope? Am J Gastroenterol. 2003;98:1627-1633. [PubMed] |