修回日期: 2012-12-04
接受日期: 2012-12-13
在线出版日期: 2012-12-18
目的: 探讨C-Jun蛋白在食管鳞癌(esophageal squamous cell carcinoma, ESCC)患者组织中的表达及其与临床生物行为之间的关系.
方法: 运用免疫组织化学及RT-PCR方法检测96例ESCC患者癌组织及相应癌旁织中C-Jun蛋白的表达情况, 分析C-Jun蛋白表达于ESCC临床生物学行为的关系.
结果: C-Jun在ESCC患者癌组织中的表达(0.7703±0.3330)高于癌旁组织(0.2546±0.1328), 差异有统计学意义(t = -11.23, P<0.05), 并且C-Jun蛋白在ESCC组织中的表达与肿瘤淋巴转移及TNM分期相关(P<0.05).
结论: C-Jun蛋白在ESCC组织中高表达, 与肿瘤淋巴转移及TNM分期相关, 可能与ESCC的发生发展相关.
引文著录: 赵俊刚, 任开明, 汤隽, 张磊. C-Jun蛋白在食管鳞癌组织中的表达及临床意义. 世界华人消化杂志 2012; 20(35): 3580-3583
Revised: December 4, 2012
Accepted: December 13, 2012
Published online: December 18, 2012
AIM: To investigate the relationship between C-Jun protein expression and clinical biological behavior of esophageal squamous cell carcinoma (ESCC).
METHODS: Immunohistochemistry and RT-PCR were used to detect the expression of C-Jun protein and mRNA in 96 cases of ESCC tissue and matched tumor-adjacent esophageal tissue. The correlation between C-Jun protein expression and clinical biological behavior of ESCC was analyzed.
RESULTS: C-Jun expression in ESCC was significantly higher in ESCC tissue than in matched tumor-adjacent esophageal tissue (0.7703 ± 0.3330 vs 0.2546 ± 0.1328, t = -11.23, P < 0.05). C-Jun protein expression was correlated with lymph node metastasis and TNM stage in ESCC (both P < 0.05).
CONCLUSION: C-Jun protein is highly expressed in ESCC, which correlates with lymph node metastasis and TNM stage. This finding suggests that high expression C-Jun protein may be related to the occurrence and development of ESCC.
- Citation: Zhao JG, Ren KM, Tang J, Zhang L. Significance of C-Jun expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3580-3583
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3580.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3580
食管鳞癌(esophageal squamous cell carcinoma, ESCC)是世界第6大肿瘤死亡原因, 在我国排名位于肿瘤死因的第4位, 而目前在我国的食管癌的病理类型80%以上为鳞癌. C-Jun原癌基因属于核内转录因子, 其编码的C-Jun蛋白是早期转录活化因子(activator protein 1, AP-1)家族的成员之一[1], 他可以结合在许多基因的启动子上参与基因转录的调控[2], 在许多肿瘤中都存在C-Jun蛋白的异常变化, 其异常表达是肿瘤形成的重要因素之一[3], 但在食管鳞癌中的报道较少. 为了探讨其在食管鳞癌患者组织中的表达及其与临床生物行为之间的关系, 本实验应用免疫组织化学法和RT-PCR法检测ESCC患者肿瘤组织及其对应癌旁组织中C-Jun蛋白及mRNA的表达, 并探讨与ESCC发生及转移的可能关系及临床意义.
收集2006-09/2011-09中国医科大学附属盛京医院手术获得的食管鳞癌标本96例. 患者术前均未接受放、化疗治疗. 其中男60例, 女36例, 年龄42-77岁(平均62.3岁), 其中Ⅰ期20例, Ⅱ期24例, Ⅲ期32例, Ⅳ期20例, 区域淋巴结转移66例, 肿瘤≥3 cm 50例. 全部肿瘤组织经病理诊断证实为鳞状细胞癌, 癌旁组织标本来源于距肿瘤5 cm以上的食管黏膜组织. 术中取得的新鲜标本一式三份, 一份送病理检查, 一份迅速切成0.5 cm×0.5 cm×0.8 cm大小组织块, 放入灭酶、灭菌的冻存管中, -80 ℃保存备用, 一份40 g/L甲醛固定后石蜡包埋. RT-PCR试剂盒为TakaRa公司产品, 应用Premien 5.0软件设计引物, 引物由上海生物工程公司提供. 鼠抗人C-Jun多克隆抗体购自Santacruz公司, 抗体工作浓度为1:150, SP-9001免疫组织化学试剂盒, PAB显色系统购自北京中杉金桥生物技术有限公司.
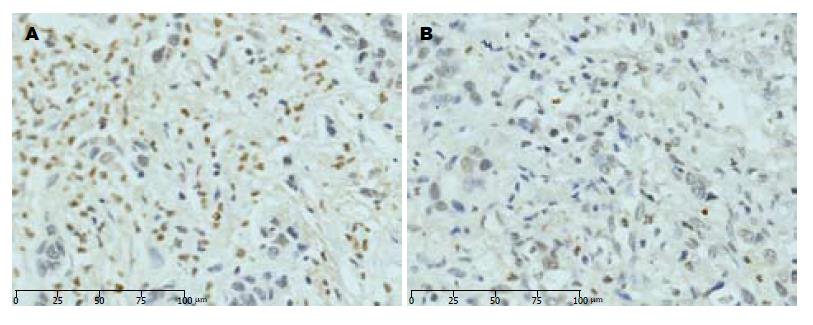
1.2.1 免疫组织化染色试剂、方法及结果判定: 免疫组织化学检查此采用SP三步法, 具体步骤参考说明书进行, 以PBS缓冲液替代抗体作为空白对照, 用已知阳性照片作阳性对照. 所有的切片处理方式一致, 同时所有步骤处理时间均相同. 结果判定: 由两位病理医师采用双盲法观察每张切片, C-Jun在ESCC组织中表达主要定位于细胞核, 在癌旁组织中表达主要定位于细胞浆. 阳性判定如下: 首先按切片中瘤细胞染色强度计分: 0分: 细胞无显色; 1分: 呈淡黄色; 2分: 呈棕黄色; 3分, 呈棕褐色. 再按切片中阳性癌细胞数所占的百分比计分: 0分为阴性; 1分为癌细胞≤10%; 2分为11%-50%; 3分为51%-74%; 4分为75%以上. 染色强度与阳性细胞百分比的乘积>3为免疫组织化学反应阳性.
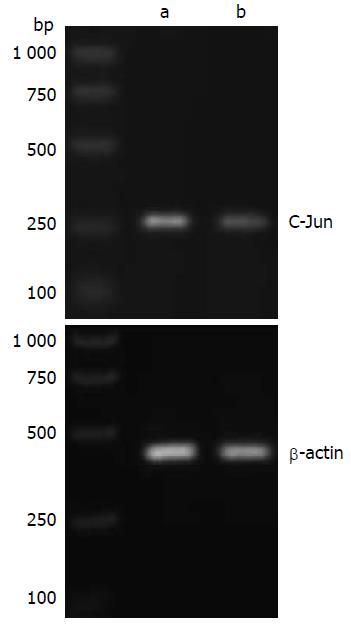
1.2.2 RT-PCR试剂、方法及结果判定: C-Jun上游引物: 5'-ATGACTGCAAAGATGGAAACGACC-3', 下游引物: 5'-GATGTGCCCGTTGCTGGACTGGAT-3', 扩增片段长度为264 bp; 内参β-actin上游引物: 5'-CGAGCGGGAAATCGTGCGTGACATTAAGGAGA-3', 下游引物: 5'-CGTCATACTCCTGCTTGCTGATCCACATCTGC-3', 扩增片段长度为479 bp. 组织RNA提取: 组织标本放入研钵中并倒入液氮研磨, 组织磨碎后加入1 mL TRIzol研磨成粉状, 移至1.5 mL的经DEPC水处理过的无菌离心管中, 其余步骤严格按TRIzol RNA提取试剂说明书进行, 所得RNA经紫外分光光度仪测定A260和A280, 检测总RNA的纯度和含量. RT-PCR扩增: 逆转录总体系为20 μL严格按照试剂盒说明书步骤合成cDNA. 以cDNA为模板进行PCR扩增. 扩增条件为94 ℃预变性3 min; 94 ℃变性40 s, 退火温度53.5 ℃, 40 s, 72 ℃延伸40 s, 35个循环; 72 ℃, 7 min. PCR产物于15 g/L的琼脂糖凝胶做电泳, 采用凝胶成像系统对电泳条带进行扫描和半定量分析, 检测图像灰度值进行图像分析. 用C-Jun目的基因与β-actin光密度的比值来代表目的基因的相对表达含量.
统计学处理 应用SPSS11.0软件统计学软件, 率的比较用χ2检测, 均数比较用t检验, 以P<0.05为差异有统计学意义.
ESCC及对应癌旁组织中C-Jun蛋白呈阳性表达的患者分别为84例(87.50%), 14例(14.58%). ESCC及癌旁组织中C-Jun蛋白阳性表达率的差异有统计学意义(P<0.05, 图1).
C-Jun蛋白表达与肿瘤淋巴转移及TNM分期及淋巴结转移相关(P<0.05), 与肿瘤大小无关(P>0.05, 表1).
| 临床病理指标 | 阳性数(n) | 阳性率n(%) | P值 |
| TNM分期 | |||
| 早期Ⅰ+Ⅲ | 44 | 13(29.55) | |
| 中晚期Ⅱ+Ⅳ | 52 | 3(5.77) | <0.05 |
| 淋巴结转移 | |||
| 阳性 | 66 | 2(3.03) | |
| 阴性 | 30 | 15(50.00) | <0.05 |
| 肿瘤大小(cm) | |||
| <3 | 46 | 9(19.57) | |
| ≥3 | 50 | 8(16.60) | >0.05 |
C-Jun mRNA在癌组织和癌旁组织中平均灰度值分别是0.7703±0.3330和0.2546±0.1328, 两者平均灰度值比较有统计学意义(t = -11.23, P<0.05)(图2). 表明C-Jun mRNA在ESCC组织中表达上调.
肿瘤的发生发展是一个多阶段、多因素的过程, 其中一条重要途径就是各种刺激和因素作用于转录因子, 继而转录因子控制其靶基因的表达[4]. C-Jun基因是1987年Bohmann发现的转录因子, 是从RNA肿瘤病毒中分离的癌基因. C-Jun基因编码的蛋白分子量大均为39 kDa, C-Jun蛋白由C端的基本亮氨酸拉链(B-21P)DNA结合区和N端的转录激活区组成[5]. C-Jun通过亮氨酸拉链与FOS形成异源二聚体或与其他C-Jun相关蛋白形成同源/异源二聚体来发挥其功能[6]. C-Jun主要通过使许多靶基因转录失调而发挥细胞转录的作用, 因刺激和诱导因素的不同, 组织和细胞的不同会对不同的靶基因进行调节, 所以产生的调节作用也不同[7]. 侯巧燕等[8]发现在舌鳞癌组织的C-Jun蛋白表达显著高于正常舌组织和舌良性肿瘤组织(P<0.05), C-Jun在淋巴结未转移组和临床Ⅰ、Ⅱ期组舌癌组织的表达(8/10)明显低于淋巴结转移组和临床Ⅲ、Ⅳ组(10/10).
为了解C-Jun基因及蛋白表达与ESCC的关系, 我们采用免疫组织化学方法和RT-PCR法检测C-Jun在ESCC中的表达. 表明两种方法检测结果一致, 即C-Jun蛋白在ESCC组织中的表达明显高于癌旁组织中的表达(P<0.05), 提示了C-Jun可能参与了ESCC的发生发展机制, 其异常表达增加了细胞的恶性转化程度和肿瘤的形成. C-Jun的主要作用就是编码癌基因的核蛋白, 其表达的产物主要定位细胞核中, 在遇到刺激后可以产生Ap-1, 后者可以和DNA结合, 然后通过转录水平来调节其下游相对应的靶基因表达, 使其发生改变, 进而参与细胞的增殖及转化[9,10], 这种情况在癌变的早期出现, 促进细胞发生癌变[11], 这与我们的研究结果相吻合. 同时在C-Jun蛋白表达与ESCC组织临床生物学行为的关系中的结果显示C-Jun表达与淋巴结转移及TNM分期相关(P<0.05), 这说明C-Jun在ESCC发生发展中有至关重要的作用, 表明早期细胞增殖活跃, 在ESCC中表达上调可能与C-Jun的泛素化有关[12], 其具体作用机制有待进一步研究. 有淋巴结转移组的阳性率要低于无淋巴结转移组, 说明在ESCC的生物学特性中转移肿瘤和原发肿瘤是不同的. C-Jun的表达与ESCC的肿瘤大小无关.
C-Jun对细胞恶性转变的决定主要取决于刺激的性质, 细胞类型和微环境[13], C-Jun作为AP-1转录因子的主要成分和细胞信号网络的枢纽, 与其他核因子共同调控细胞增殖、分化、凋亡和侵袭[14,15], 因此C-Jun在ESCC中扮演何种角色主要与其调控的下游靶基因有关, 还有待于进一步研究, 但已证实其与食管鳞癌的发生关系密切. 如能阻断其表达或破坏其活性, 或许可以收到良好的治疗效果, 为抗肿瘤药物的研发提供一定的思路.
在许多肿瘤中都存在C-Jun蛋白的异常表达. 本文探讨其在食管鳞癌患者组织中的表达及其与临床生物行为之间的关系.
邓昊, 副教授, 江汉大学医学院病理学与病理生理学教研室
本实验应用免疫组织化学法和RT-PCR法检测ESCC患者肿瘤组织及其对应癌旁组织中C-Jun蛋白和mRNA的表达, 并探讨其与ESCC发生及转移的可能关系及临床意义.
侯巧燕等发现在舌鳞癌组织中的C-Jun蛋白表达显著高于正常舌组织和舌良性肿瘤组织(P<0.05), C-Jun在淋巴结未转移组和临床Ⅰ、Ⅱ期组舌癌组织的表达(8/10)明显低于淋巴结转移组和临床Ⅲ、Ⅳ组(10/10).
检测ESCC患者肿瘤组织及其对应癌旁组织中C-Jun蛋白及mRNA的表达, 并探讨与ESCC发生及转移可能的关系及临床意义.
本文具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 2. | Guma M, Firestein GS. c-Jun N-Terminal Kinase in Inflammation and Rheumatic Diseases. Open Rheumatol J. 2012;6:220-231. [PubMed] [DOI] |
| 3. | Sundaresan NR, Vasudevan P, Zhong L, Kim G, Samant S, Parekh V, Pillai VB, Ravindra PV, Gupta M, Jeevanandam V. The sirtuin SIRT6 blocks IGF-Akt signaling and development of cardiac hypertrophy by targeting c-Jun. Nat Med. 2012;18:1643-1650. [PubMed] [DOI] |
| 4. | Herrmann JL, Byekova Y, Elmets CA, Athar M. Liver kinase B1 (LKB1) in the pathogenesis of epithelial cancers. Cancer Lett. 2011;306:1-9. [PubMed] [DOI] |
| 5. | Nagahara Y, Suzuki E, Sekine Y, Uchiro H, Yoshimi Y, Shinomiya T, Ikekita M. SUTAF, a novel β-methoxyacrylate derivative, promotes neurite outgrowth with extracellular signal-regulated kinase and c-jun N-terminal kinase activation. Eur J Pharmacol. 2012;694:53-59. [PubMed] [DOI] |
| 6. | Wang S, Li KJ, Lin XW, Jiang CZ, Chen DH, Wu Q, Hua ZC. Using c-Fos/c-Jun as hetero-dimer interaction model to optimize donor to acceptor concentration ratio range for three-filter fluorescence resonance energy transfer (FRET) measurement. J Microsc. 2012;248:58-65. [PubMed] [DOI] |
| 7. | Yang QH, Hu SP, Zhang YP, Ping HH, Yang HW, Chen TY, Liu HT. Effects of different therapeutic methods and typical recipes of Chinese medicine on activation of c-Jun N-terminal Kinase in Kupffer cells of rats with fatty liver disease. Chin J Integr Med. 2012;18:769-774. [PubMed] [DOI] |
| 9. | Zhou X, Meng Q, Xu X, Zhi T, Shi Q, Wang Y, Yu R. Bex2 regulates cell proliferation and apoptosis in malignant glioma cells via the c-Jun NH2-terminal kinase pathway. Biochem Biophys Res Commun. 2012;427:574-580. [PubMed] [DOI] |
| 10. | Schonthaler HB, Guinea-Viniegra J, Wagner EF. Targeting inflammation by modulating the Jun/AP-1 pathway. Ann Rheum Dis. 2011;70 Suppl 1:i109-i112. [PubMed] [DOI] |
| 11. | Shaulian E. AP-1--The Jun proteins: Oncogenes or tumor suppressors in disguise? Cell Signal. 2010;22:894-899. [PubMed] [DOI] |
| 12. | Takabe W, Li R, Ai L, Yu F, Berliner JA, Hsiai TK. Oxidized low-density lipoprotein-activated c-Jun NH2-terminal kinase regulates manganese superoxide dismutase ubiquitination: implication for mitochondrial redox status and apoptosis. Arterioscler Thromb Vasc Biol. 2010;30:436-441. [PubMed] [DOI] |
| 13. | Han CY, Hien TT, Lim SC, Kang KW. Role of Pin1 in UVA-induced cell proliferation and malignant transformation in epidermal cells. Biochem Biophys Res Commun. 2011;410:68-74. [PubMed] [DOI] |