修回日期: 2012-11-17
接受日期: 2012-12-03
在线出版日期: 2012-12-18
目的: 探讨人类相关转录因子3(human runt-related transcription factor 3, Runx3)、Ras相关区域家族1A(ras-association domain family 1a, Rassf1a)基因启动子区的甲基化和甲基转移酶1(DNA methyltransferase 1, Dnmt1)基因的表达与胃癌发生的关系及临床意义.
方法: 采用甲基化特异性聚合酶链反应(methylation specific PCR, MSP)检测68例胃癌组织及其相应癌旁正常组织中Runx3、Rassf1a基因启动子区甲基化状态; 同时应用实时荧光定量逆转录-多聚合酶链反应(real-time RT-PCR)和免疫组织化学SP法分别检测基因的Runx3、Rassf1a、Dnmt1 3个基因mRNA和蛋白的表达情况.
结果: 胃癌组织中Runx3、Rassf1a基因的甲基化阳性率较正常组织明显升高(45.59% vs 10.29%; 64.70% vs 7.35%). 胃癌组织中Runx3和Rassf1a mRNA阳性表达率明显低于正常组织(36.76% vs 100%; 27.94% vs 97.06%), 而胃癌组织中Dnmt1 mRNA阳性表达率则明显高于正常组织(80.88% vs 17.65%), 差异均有统计学意义差异. 胃癌组织与正常组织RUNX3、RASSF1a、DNMT1蛋白与mRNA表达基本相一致. Runx3 mRNA、Rassf1a mRNA阴性表达的胃癌组织中其基因启动子的甲基化率较阳性表达者明显升高(72.09% vs 0; 85.71% vs 2.94%), 差异具有统计学意义. 胃癌组织中RUNX3、RASSF1a与DNMT1蛋白的表达均呈负相关(r = -0.627, P<0.0001; r = -0.477, P<0.0001).
结论: Runx3、Rassf1a基因启动子区的高甲基化及Dnmt1基因高表达可能与胃癌发生有关.
引文著录: 姜相君, 初蕾蕾, 崔艳欣, 宋明全, 解祥军, 田字彬. Runx3、Rassf1a基因启动子在胃癌组织中的高甲基化及Dnmt1的表达. 世界华人消化杂志 2012; 20(35): 3457-3463
Revised: November 17, 2012
Accepted: December 3, 2012
Published online: December 18, 2012
AIM: To analyze the promoter methylation of the human runt-related transcription factor 3 (Runx3) and ras-association domain family 1a (Rassf1a) genes and Dnmt1 protein expression in gastric cancer and to analyze their relationship with gastric carcinogenesis.
METHODS: Methylation status of the Runx3 and Rassf1a genes in 68 gastric carcinoma tissues and 68 paired surgical marginal normal gastric tissues was detected using methylation-specific PCR. Real-time RT-PCR was used to detect the expression of Runx3, Rassf1a, and Dnmt1 mRNAs, and immunohistochemistry was used to detect the expression of RUNX3, RASSF1a, and DNMT1 proteins in the above samples.
RESULTS: The positive rates of promoter methylation of the Runx3 and Rassf1a genes were significantly higher in gastric cancer than in normal tissue (45.59% vs 10.29%; 64.70% vs 7.35%; both P < 0.0001). The positive rates of Runx3 and Rassf1a mRNA expression in gastric cancer were significantly lower than those in normal tissue (36.76% vs 100%; 27.94% vs 97.06%; both P < 0.0001), while that of Dnmt1 mRNA expression was higher compared to normal tissue (80.88% vs 17.65%, P < 0.0001). The expression patterns of RUNX3, RASSF1a, and DNMT1 proteins were consistent with those of Runx3, Rassf1a, and Dnmt1 mRNAs. The negative rates of Runx3 and Rassf1a mRNA expression in gastric cancer were significantly higher in the methylation group than in the non-methylation group (72.09% vs 0%; 85.71% vs 2.94%; both P < 0.0001). There was a negative correlation between the expression of RUNX3 and RASSF1a proteins and that of DNMT1 protein in gastric cancer tissue (r = -0.627, P < 0.0001; r = - 0.477, P < 0.0001).
CONCLUSION: The promoter methylation of the Runx3 and Rassf1a genes and high expression of Dnmt1 may be associated with the occurrence of gastric cancer.
- Citation: Jiang XJ, Chu LL, Cui YX, Song MQ, Xie XJ, Tian ZB. Relationship between promoter methylation of the Runx3 and Rassf1a genes and Dnmt1 expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3457-3463
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3457.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3457
胃癌的发生是一个多基因、多阶段变异累积的过程[1], 其中涉及基因机制和表观遗传学机制, 而表观遗传机制中最常见的是DNA甲基化[2]. DNA甲基化是在甲基转移酶(DNA methyltransferase, Dnmt)催化作用下, 将甲基基团转移至某些基因的碱基上并进行转录水平调控, 其中Dnmtl是维持机体现有DNA甲基化模式的关键因素. 大量证据表明, 肿瘤的发生与抑癌基因启动子区异常高甲基化有关[3]. 我们之前的研究结果表明: 人类相关转录因子3(human runt-related transcription factor 3, Runx3)、Ras相关区域家族1A(ras-association domain family 1a, Rassf1a)基因在胃癌组织中表达低下甚至缺失[4,5], 而胃癌组织中Runx3、Rassf1a基因的低表达与Dnmt1的关系如何, 则未见相关文献报道. 本实验通过采用甲基化特异性PCR检测68例胃癌组织及其相应癌旁正常组织中Runx3、Rassf1a基因启动子区甲基化状态; 同时应用实时荧光定量逆转录-多聚合酶链反应(real-time RT-PCR)和免疫组织化学SP法分别检测Runx3、Rassf1a、Dnmt1 3个基因mRNA和蛋白的表达情况, 探讨Runx3、Rassf1a基因启动子区的甲基化与Dnmt1基因的表达在胃癌发生发展中的作用及可能的机制, 进一步完善胃癌发生中甲基化修饰理论, 也为胃癌的靶向治疗提供新的思路.
收集青岛大学医学院附属青岛市市立医院普外科(2011-04/2012-05)手术切除的肿瘤标本68例, 标本均经深资病理科医师复核并确诊为原发性胃癌, 其中男40例, 女28例, 年龄37-87岁, 平均年龄63.76岁±11.89岁, 中位年龄62岁. 胃癌组织取自癌灶中央非坏死区域, 正常组织取自与之配对的距离癌组织5 cm以上区域, 所有标本均取双份, 一份立即置RNA保存液中, -80 ℃冰箱保存, 用于提取DNA和RNA; 另一份置于40 g/L中性甲醛溶液, 固定24 h, 用于免疫组织化学检测. 入选患者术中均行淋巴结清扫, 术前未行放化疗, 拥有完整的临床资料.
1.2.1 组织DNA提取: 组织DNA提取严格按照离心柱试剂盒(北京天根)操作说明书进行. 核酸蛋白分析仪测其A值, A260/280在1.8-2.0之间, 符合纯度要求, 表明提取的DNA无蛋白质及RNA污染. 凝胶电泳检测提取DNA的质量, 剩余DNA置于-20 ℃冻存.
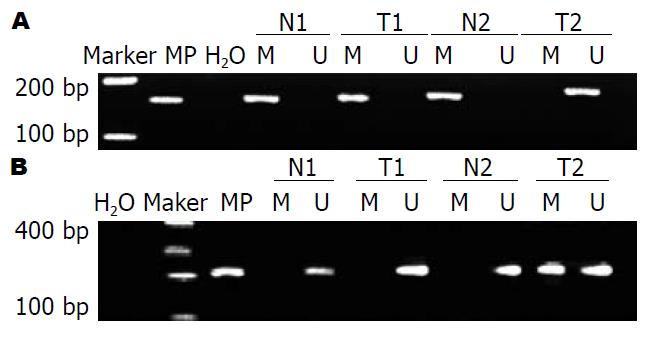
1.2.2 组织DNA修饰及甲基化特异性PCR(methylation specific PCR): 取组织DNA 500 ng, 采用EZ DNA Methylation-GOLD Kit(D5005)试剂盒(美国Zymo Research)进行DNA亚硫酸氢盐修饰与纯化, 经此步后, DNA序列中未甲基化的胞嘧啶(C)转变为尿嘧啶(U). 取修饰后DNA, 根据试剂盒(北京天根)的说明书进行PCR反应. Runx3、Rassf1a引物设计参照文献[6,7], 由上海生工合成. PCR反应体系包括: 2×Master Mix 12.5 μL, 上下游引物(10 μmol/L)各1 μL, DNA模板1 μg, 加ddH2O补足至25 μL. PCR反应条件设定为94 ℃预变性5 min, 94 ℃变性30 s, 甲基化64 ℃/非甲基化59 ℃退火, 72℃延伸45 s, 共35个循环, 72 ℃延伸10 min. 取PCR产物5 μL, 1.5%琼脂糖凝胶电泳, 紫外线下观察拍照分析.
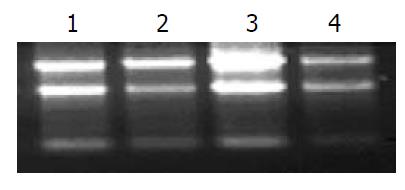
1.2.3 组织RNA提取: 取组织100 mg研磨棒充分研磨, 加入RNA提取试剂(日本TakaRa公司)1 mL, 并严格按照试剂说明书进行操作. 提取的RNA经l.0%琼脂糖凝胶电泳检测完整性, 核酸蛋白分析仪测其浓度及A值, 测得1.80<A260/280<2.00, 符合纯度要求, -80 ℃冻存备用.
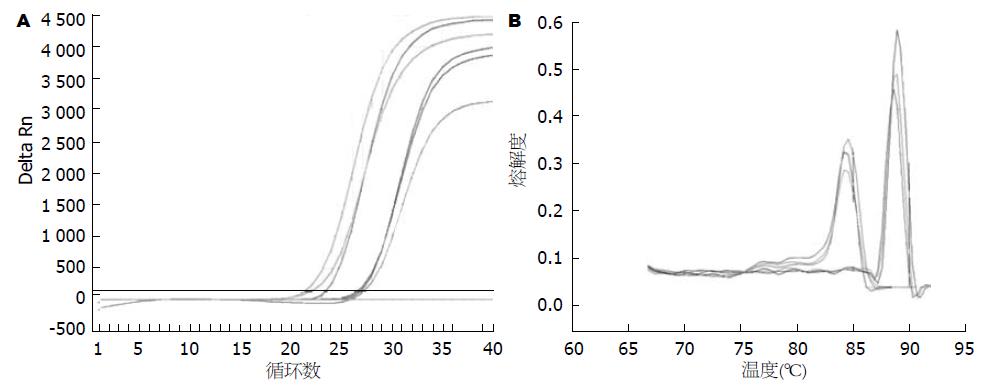
1.2.4 逆转录-多聚合酶链反应: 取1 μg RNA严格按照逆转录试剂盒(日本TaKaRa公司) 说明书合成cDNA, -20 ℃保存备用. 以β-actin作为内参进行PCR扩增, 其上游引物5'-AAA TCG TGC GTG ACA TTA A-3', 下游引物5'-CTC GTC ATA CTC CTG CTT G-3', Runx3上游引物5'-TCT GTA AGG CCC AAA GTG GGT A-3', 下游引物5'-ACC TCA GCA TGA CAA TAT GTC ACA A-3'; Rassf1a上游引物5'-ACT TGC GGA AGC TGT TGG A-3', 下游引物5'-CGC TGC AGG ATA CGT AGG AA-3'; Dnmt1上游引物5'-CGG TTC TTC CTC CTG GAG AAT GTC A-3'下游引物5'-CAC TGA TAG CCC ATG CGG ACC A-3', 引物均由上海生工生物工程技术有限公司设计并合成. PCR反应体系为25 μL, 体系中含SYBR® Premix Ex TaqTMⅡ(×2)12.5 μL(日本TaKaRa公司), 上下游引物各1.0 μL, cDNA模板2 μL, ROX Reference Dye(×50) 0.5 μL, dH2O 8.0 μL; 反应参数: 94 ℃ 30 s预变性; 94 ℃ 5 s、55 ℃ 30 s、72 ℃ 45 s共40个循环. ABI 7300 Real-time PCR仪实时检测扩增过程中产生的荧光信号, 扩增结束后自动分析溶解曲线. 采用2-∆∆Ct法分析数据结果, 样品中Ct值>30视为阴性表达.
1.2.5 免疫组织化学SP法: 常规石蜡包埋, 组织蜡块4 µm厚连续切片, 常规脱蜡水化, 3%H2O2 37 ℃孵育15 min, 消除内源性过氧化物酶活性, 95 ℃微波15 min修复抗原后, 按照SP试剂盒说明书进行操作. SP试剂盒购自北京博奥森生物技术有限公司, 一抗工作液浓度为1:100. 采用PBS代替一抗作阴性对照, 已知的RUNX3、RASSF1a和DNMT1阳性的正常标本作阳性对照.
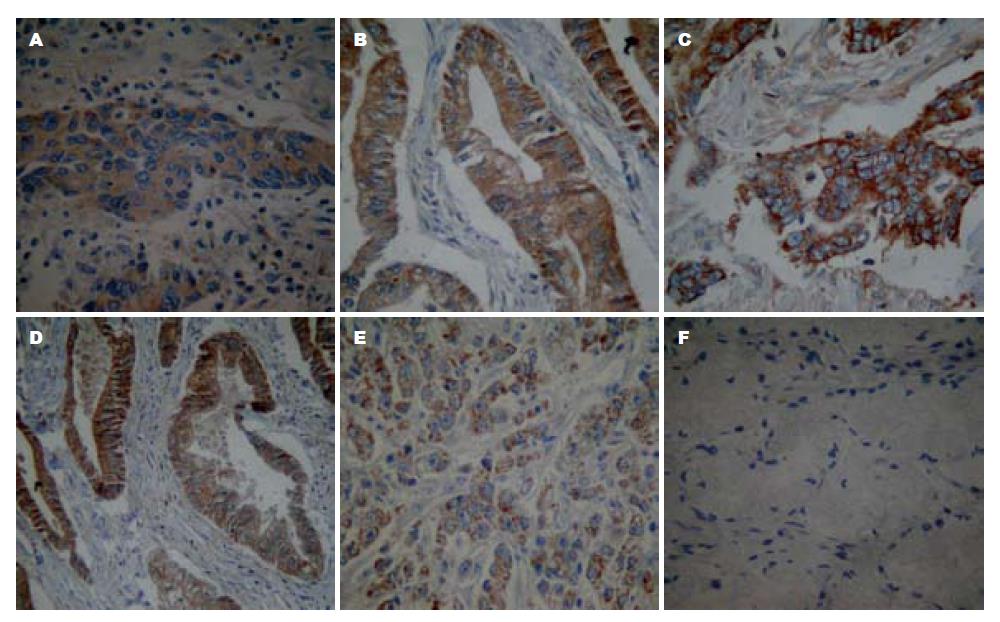
1.2.6 免疫组织化学结果判定: 每张切片随机选取5个视野, 每个视野计数200个细胞, RUNX3、RASSF1a、DNMT1阳性表达部位主要在腺体细胞的胞浆中, 部分细胞核中也有表达. 采用半定量积分法判断结果, 阳性细胞密度<5%为0分, 6%-25%为1分, 26%-50%为2分, 5l%-75%为3分, >75%为4分; 免疫组织化学显色强度以多数细胞呈色反应为准, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分两积分相乘, 0分为阴性(-), l-4分为弱阳性(+), 5-8分为阳性(++), 9-12分为强阳性(+++), 将阴性与弱阳性视为阴性表达, 阳性与强阳行视为阳性表达.
统计学处理 应用SPSS17.0软件包进行统计学处理, 计量资料数据组间比较采用t检验, 计数资料比较采用χ2检验, P为双侧性检验, P<0.05认为差异有统计学意义.
胃癌组织中Runx3启动子区甲基化率为45.59%(31/68), 明显高于正常组织10.29%(7/68), 差异有统计学意义(χ2 = 21.035, P<0.0001). 胃癌组织中Rassf1a启动子区甲基化率为64.70%(44/68), 明显高于正常组织7.35%(5/68), 差异有统计学意义(χ2 = 48.524, P<0.0001, 图1).
RNA的完整性检测见图2, 可见5S、18S和28S rRNA 3条清晰的条带. 荧光定量PCR的扩增曲线均呈典型的S型, 融解曲线呈单峰(图3), 可以排除引物二聚体及非特异性扩增, 得到的Ct值可信. 癌组织中Runx3和Rassf1a mRNA阳性表达率分别为36.76%(25/68)、27.94%(19/68), 明显低于正常组织100%(68/68)、97.06%(66/68), 差异有统计学意义(χ2 = 30.63, P<0.0001; χ2 = 69.30, P<0.0001). 而胃癌组织中Dnmt1 mRNA阳性表达率为80.88%(55/68), 明显高于正常组织17.65%(12/68), 差异有统计学意义(χ2 = 57.80, P<0.0001).
胃癌组织与正常组织RUNX3、RASSF1a、DNMT1蛋白的阳性表达率与mRNA基本相一致. RUNX3在正常组织中的表达阳性率为91.18%(62/68), 明显高于胃癌组织29.76%(20/68), 差异有统计学意义(χ2 = 54.18, P<0.001). RASSF1a在正常组织中的表达阳性率为86.76%(66/68), 明显高于胃癌组织25.00%(17/68), 差异有统计学意义(χ2 = 74.23, P<0.001). DNMT1在胃癌组织的表达阳性率82.35%(56/68), 明显高于正常组织14.71%(10/68), 差异具有统计学意义(χ2 = 62.29, P<0.001, 图4).
在43例Runx3 mRNA阴性表达的胃癌组织中, 检测出31例该基因启动子甲基化, 甲基化率为72.09%; 而在25例Runx3 mRNA阳性表达的胃癌组织中, 则未检测出该基因启动子存在甲基化, 差异有统计学意义(χ2 = 33.124, P<0.0001). 在49例Rassf1a mRNA表达阴性的胃癌组织中, 检测出42例该基因启动子甲基化, 甲基化率为85.71%; 而在19例Rassf1a mRNA阳性表达的胃癌组织中, 只检测出2例存在该基因启动子区甲基化, 差异具有统计学意义(χ2 = 33.892, P<0.0001).
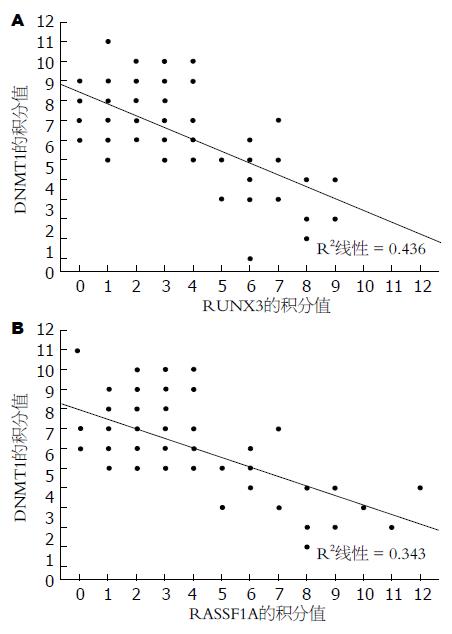
Spearman相关性分析相关提示: 胃癌组织中RUNX3与DNMT1蛋白的表达呈负相关(r = -0.627, P<0.0001), RASSF1a与DNMT1蛋白的表达呈负相关(r = -0.477, P<0.0001, 图5) .
Runx3基因定位于人染色体1号短臂1p36.1, 是转录生长因子β(transforming growth factor, TGF-β)信号通路下游的一个转录因子[8,9]. 在TGF-β介导的凋亡信号转导通路中, 激活的Smad复合物必须在RUNX蛋白的指导下才能从细胞质转入细胞核, 并准确结合和激活特定靶位点, 其表达失活, 可以使细胞凋亡受抑制而无限增殖, 从而形成肿瘤[10,11]. Rassf1a是新近发现的候选肿瘤抑癌基因, 是一种Ras的效应分子, 既可以促进细胞生长和分化, 又可以抑制细胞生长、促进凋亡和衰老[12-15]. 研究发现: Runx3、Rassf1a几乎在全身所有组织中都有表达, 而在绝大多数恶性肿瘤中(如结直肠癌、食管癌、鼻咽癌及乳腺癌等)则表达沉默[16-18]. 本研究发现: RUNX3、RASSF1a蛋白的表达与mRNA的表达基本一致, 即: 胃癌组织中的RUNX3、RASSF1a蛋白的阳性表达率较正常组织明显减少, 差异具有统计学意义. 因此推测: Runx3、Rassf1a基因沉默可能参与胃癌的发生发展.
本研究发现: 胃癌组织中Runx3和Rassf1a启动子区的甲基化率较正常组织明显升高, 差异具有统计学意义. 这一研究结果与国内外学者的研究结果一致[19-24], 也支持我们之前的实验结果. 为了更好地阐明Runx3、Rassf1a基因甲基化与表达之间的关系, 我们将Runx3 mRNA、Rassf1a mRNA阴性表达和阳性表达的分开统计甲基化率, 结果显示: Runx3 mRNA、Rassf1a mRNA阴性表达的胃癌组织中其基因启动子的甲基化率较阳性表达者明显升高, 差异具有统计学意义. 推测Runx3、Rassf1a表达缺失与该因子基因启动子的甲基化有关[25-29], 抑癌基因高甲基化可能是降低的原因. 对于胃癌中个别不存在Runx3和Rassf1a启动子甲基化而基因表达阴性, 考虑可能解释的原因是有点突变、杂合性缺失等机制共同调节作用.
在研究Runx3及Rassf1a甲基化状况的同时, 我们还对其可能的机制进行了初步的探索. Dnmt1是人类DNMTs家族中的成员之一, 目前的研究结果表明Dnmt1与基因的甲基化关系密切, 具有维持甲基化的作用. 丁雯瑾等[30]研究发现DNMT1蛋白在胃癌组织中的表达阳性率为81.6%, 显著高于正常组织10.5%, 差异具有统计学意义. 而我们的研究结果显示: DNMT1蛋白在胃癌组织中的表达率较正常组织明显升高, 其mRNA的表达同蛋白表达基本一致, 差异具有统计学意义. 与他们的研究结果基本一致. 本实验还发现: 胃癌组织中DNMT1与RUNX3、RASSFLA蛋白的表达均呈负相关, 差异具有统计学意义. 综合以上研究结果, 我们初步推测: 胃癌组织中DNMT1的mRNA及蛋白表达显著增高, 导致抑癌基因Runx3及Rassf1a基因启动子区发生异常甲基化, 使抑癌基因mRNA及蛋白表达减少, 失去对肿瘤发生的抑制作用. 这仅是本实验的一些初步推测, 具体的发生机制, 还有待于大样本实验的进一步证实.
目前胃癌是仍是亚洲地区第二大致死性疾病, 虽然外科治疗是胃癌目前的主要治疗手段, 但早期诊断及早期手术是降低胃癌病死率的关键[31]. 由于DNA甲基化贯穿于肿瘤发生发展的全过程, 并具有一定组织特异性, 所以今后在本实验的基础上, 深入研究甲基化与胃癌的关系, 建立起胃癌相关基因的甲基化谱, 并研究DNMTs家族的作用及具体机制, 为胃癌的预防、早期诊断和抗甲基化治疗提供实验和理论依据. 另外, 胃癌的发生不但与抑癌基因启动子甲基化有关, 还与幽门螺杆菌(Helicobacter pylori, H. pylori)感染有一定关系, 那么抑癌基因启动子甲基化H. pylori与之间是否有关, 为我们今后的胃癌研究提供了新的思路.
胃癌是多种基因(包括原癌基因、抑癌基因)参与的多阶段多途径的基因调节异常疾病. 表观遗传学异常是胃癌发生发展过程中较普遍的现象, 即不改变基因序列的情况下通过调控DNA-组蛋白之间的相互作用来改变基因的活性, 从而调控基因的表达.
黄缘, 教授, 南昌大学第二附属医院消化内科, 江西省分子医学重点实验室
目前国内外关于胃癌的甲基化研究多集中在单个基因, 随着胃癌相关基因的异常甲基化被不断报道, 提示胃癌可能同时存在多个基因的异常甲基化, 多个肿瘤相关基因CpG位点甲基化的联合检测更有利于揭示肿瘤分子病理机制, 进而为临床胃癌的早期诊断提供方法和依据.
林海等研究发现胃癌组织中Runx3、Rassf1a启动子区甲基化率分别为69.4%和66.1%, 较正常组织26.8%和23.1%明显升高, Runx3和Rassf1a高甲基化可能是导致其表达降低的原因.
本研究发现胃癌组织中Runx3和Rassf1a表达降低与其基因启动子区发生甲基化有关, 且Runx3和Rassf1a基因启动子区甲基化的发生与Dnmt1的表达增加有关, 在此基础上深入研究甲基化与胃癌的关系, 建立胃癌相关基因甲基化谱.
本研究通过对Runx3、Rassf1a基因启动子区的甲基化与Dnmt1基因的表达在胃癌发生发展中的作用及可能机制的探讨, 进一步完善胃癌发生中甲基化修饰理论, 为胃癌的靶向治疗提供了新的思路; 某些CpG岛的异常甲基化特异地出现在癌或癌前病变中, 对其进行检测有助于肿瘤的早期诊断.
DNA甲基化: 指由DNA甲基化转移酶家族Dnmts介导、以S-腺苷甲硫氨酸作为甲基化供体, 将胞嘧啶转变为5-甲基胞嘧啶的一种反应, 其中Dnmtl是维持机体现有DNA甲基化模式的关键因素.
本文选题很好, 课题设计合理, 实验过程缜密, 结果详实可信, 有一定的临床指导价值.
编辑: 翟欢欢 电编:闫晋利
| 1. | Jang BG, Kim WH. Molecular pathology of gastric carcinoma. Athobiology. 2011;78:302-310. [PubMed] [DOI] |
| 2. | Goswami UC, Sharma N. Efficiency of a few retinoids and carotenoids in vivo in controlling benzo[a]pyrene-induced forestomach tumour in female Swiss mice. Br J Nutr. 2005;94:540-543. [PubMed] [DOI] |
| 3. | Kurkjian C, Kummar S, Murgo AJ. DNA methylation: its role in cancer development and therapy. Curr Probl Cancer. 2008;32:187-235. [PubMed] [DOI] |
| 6. | Li WQ, Pan KF, Zhang Y, Dong CX, Zhang L, Ma JL, Zhou T, Li JY, You WC. RUNX3 methylation and expression associated with advanced precancerous gastric lesions in a Chinese population. Carcinogenesis. 2011;32:406-410. [PubMed] [DOI] |
| 8. | Ito Y. RUNX genes in development and cancer: regulation of viral gene expression and the discovery of RUNX family genes. Adv Cancer Res. 2008;99:33-76. [PubMed] [DOI] |
| 9. | Zhao C, Bu X. Promoter methylation of tumor-related genes in gastric carcinogenesis. Histol Histopathol. 2012;27:1271-1282. [PubMed] |
| 10. | Subramaniam MM, Chan JY, Yeoh KG, Quek T, Ito K, Salto-Tellez M. Molecular pathology of RUNX3 in human carcinogenesis. Biochim Biophys Acta. 2009;1796:315-331. [PubMed] |
| 11. | Ito K. RUNX3 in oncogenic and anti-oncogenic signaling in gastrointestinal cancers. J Cell Biochem. 2011;112:1243-1249. [PubMed] [DOI] |
| 13. | Pijnenborg JM, Dam-de Veen GC, Kisters N, Delvoux B, van Engeland M, Herman JG, Groothuis PG. RASSF1A methylation and K-ras and B-raf mutations and recurrent endometrial cancer. Ann Oncol. 2007;18:491-497. [PubMed] [DOI] |
| 14. | Song MS, Chang JS, Song SJ, Yang TH, Lee H, Lim DS. The centrosomal protein RAS association domain family protein 1A (RASSF1A)-binding protein 1 regulates mitotic progression by recruiting RASSF1A to spindle poles. J Biol Chem. 2005;280:3920-3927. [PubMed] [DOI] |
| 15. | Dammann R, Schagdarsurengin U, Liu L, Otto N, Gimm O, Dralle H, Boehm BO, Pfeifer GP, Hoang-Vu C. Frequent RASSF1A promoter hypermethylation and K-ras mutations in pancreatic carcinoma. Oncogene. 2003;22:3806-3812. [PubMed] [DOI] |
| 16. | Soong R, Shah N, Peh BK, Chong PY, Ng SS, Zeps N, Joseph D, Salto-Tellez M, Iacopetta B, Ito Y. The expression of RUNX3 in colorectal cancer is associated with disease stage and patient outcome. Br J Cancer. 2009;100:676-679. [PubMed] [DOI] |
| 17. | Lo PH, Xie D, Chan KC, Xu FP, Kuzmin I, Lerman MI, Law S, Chua D, Sham J, Lung ML. Reduced expression of RASSF1A in esophageal and nasopharyngeal carcinomas significantly correlates with tumor stage. Cancer Lett. 2007;257:199-205. [PubMed] [DOI] |
| 18. | Li Y, Wei Q, Cao F, Cao X. Expression and promoter methylation of the RASSF1A gene in sporadic breast cancers in Chinese women. Oncol Rep. 2008;19:1149-1153. [PubMed] |
| 19. | Fan XY, Hu XL, Han TM, Wang NN, Zhu YM, Hu W, Ma ZH, Zhang CJ, Xu X, Ye ZY. Association between RUNX3 promoter methylation and gastric cancer: a meta-analysis. BMC Gastroenterol. 2011;11:92. [PubMed] [DOI] |
| 20. | Homma N, Tamura G, Honda T, Matsumoto Y, Nishizuka S, Kawata S, Motoyama T. Spreading of methylation within RUNX3 CpG island in gastric cancer. Cancer Sci. 2006;97:51-56. [PubMed] [DOI] |
| 21. | Dammann R, Schagdarsurengin U, Seidel C, Strunnikova M, Rastetter M, Baier K, Pfeifer GP. The tumor suppressor RASSF1A in human carcinogenesis: an update. Histol Histopathol. 2005;20:645-663. [PubMed] |
| 22. | Ben Ayed-Guerfali D, Benhaj K, Khabir A, Abid M, Bayrouti MI, Sellami-Boudawara T, Gargouri A, Mokdad-Gargouri R. Hypermethylation of tumor-related genes in Tunisian patients with gastric carcinoma: clinical and biological significance. J Surg Oncol. 2011;103:687-694. [PubMed] [DOI] |
| 23. | Guo W, Dong Z, Chen Z, Yang Z, Wen D, Kuang G, Guo Y, Shan B. Aberrant CpG island hypermethylation of RASSF1A in gastric cardia adenocarcinoma. Cancer Invest. 2009;27:459-465. [PubMed] [DOI] |
| 24. | Hu SL, Huang DB, Sun YB, Wu L, Xu WP, Yin S, Chen J, Jiang XD, Shen G. Pathobiologic implications of methylation and expression status of Runx3 and CHFR genes in gastric cancer. Med Oncol. 2011;28:447-454. [PubMed] [DOI] |
| 25. | Chen W, Gao N, Shen Y, Cen JN. Hypermethylation downregulates Runx3 gene expression and its restoration suppresses gastric epithelial cell growth by inducing p27 and caspase3 in human gastric cancer. J Gastroenterol Hepatol. 2010;25:823-831. [PubMed] [DOI] |
| 26. | Tang GH, Sun SW, He XS. [Correlation of CpG methylation status of Runx3 with pathogenesis of gastric carcinoma]. Zhonghua Binglixue Zazhi. 2012;41:314-319. [PubMed] |
| 27. | Lu XX, Yu JL, Ying LS, Han J, Wang S, Yu QM, Wang XB, Fang XH, Ling ZQ. Stepwise cumulation of RUNX3 methylation mediated by Helicobacter pylori infection contributes to gastric carcinoma progression. Cancer. 2012;118:5507-5517. [PubMed] [DOI] |
| 29. | Yao D, Shi J, Shi B, Wang N, Liu W, Zhang G, Ji M, Xu L, He N, Hou P. Quantitative assessment of gene methylation and their impact on clinical outcome in gastric cancer. Clin Chim Acta. 2012;413:787-794. [PubMed] [DOI] |
| 31. | Leung WK, Wu MS, Kakugawa Y, Kim JJ, Yeoh KG, Goh KL, Wu KC, Wu DC, Sollano J, Kachintorn U. Screening for gastric cancer in Asia: current evidence and practice. Lancet Oncol. 2008;9:279-287. [PubMed] [DOI] |