修回日期: 2012-08-30
接受日期: 2012-12-16
在线出版日期: 2012-12-18
目的: 采用多聚酶链反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis, PCR-DGGE)技术研究葡聚糖硫酸钠(dextran sulfate sodium, DSS)所致溃疡性结肠炎(ulcerative colitis, UC)模型大鼠肠道菌群的多样性和丰度, 从"肠道微生态"这一全新角度为该模型提供更丰富的数据, 也为深入探讨UC的发生发展提供新的实验依据.
方法: 26只健康♂SD大鼠随机分为空白组和UC模型组, 模型组饮用4%的DSS溶液7 d复制UC模型. 收集两组大鼠粪便排泄物, 采用PCR-DGGE法研究肠道菌群的多样性、相似性及丰度; 对优势条带进行回收测序, 鉴定菌种. 所得结果及数据采用Quantity one、Chromas、MGAE5、SIMCA-P+及SPSS18.0等软件进行分析.
结果: DSS诱导UC后7 d, 模型大鼠出现便血、病理形态学改变等典型的UC炎性病变特征. 样本优势条带菌种鉴定显示大鼠的肠道细菌主要归属于拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)及变形菌门(Proteobacteria)3大类, 但与空白组相比, 模型组肠道菌群的丰度及多样性指数明显降低(P<0.05). 菌种鉴定表明UC组乳酸杆菌(Lactobacillus sp)和毛螺科菌(Lachnospiraceae bacterium)菌种显著较少, 而双酶梭菌(Clostridium bifermentans)等菌种含量明显增多(均P<0.05).
结论: 饮用4%DSS溶液7 d造成的UC大鼠模型的肠道微生态存在显著失衡, 多样性和丰度均下降, 含量变化较为显著的是乳酸杆菌、毛螺科菌和双酶梭菌.
引文著录: 韩晓霞, 侯天舒, 杨阳, 赵纪岚, 吴巧凤, 余曙光. 葡聚糖硫酸钠致溃疡性结肠炎大鼠模型的肠道微生态. 世界华人消化杂志 2012; 20(35): 3445-3451
Revised: August 30, 2012
Accepted: December 16, 2012
Published online: December 18, 2012
AIM: To study the abundance and diversity of the gut flora in rats with dextran sulfate sodium (DSS)-induced ulcerative colitis (UC) to provide new knowledge about the pathogenesis of this disease.
METHODS: Twenty-six healthy male SD rats were randomly divided into a control group and a model group. UC was induced by giving 40g/L of DSS for 7 days. Fecal samples were collected from the rats and polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE) was employed to analyze the composition and diversity of gut flora. The specific bands were recovered and sequenced, and data were analyzed using Quantity-one, Chromas, SIMCA-P+, MGAE5 and SPSS18.0.
RESULTS: After 7 days of treatment with DSS, rats showed typical symptoms and characteristics of UC. DGGE results showed that gut floras in both group mainly belonged to Bacteroidetes, Firmicutes and Proteobacteria. Compared to the control group, the numbers of Lactobacillus sp. and Lachnospiraceae bacterium significantly decreased and the number of Clostridium bifermentans increased significantly in the model group (all P < 0.05).
CONCLUSION: The abundance and diversity of the intestinal floras obviously decrease in rats with UC. The numbers of Lactobacillus sp., Lachnospiraceae bacterium and Clostridium bifermentans change significantly in the intestinal tract of rats with UC.
- Citation: Han XX, Hou TS, Yang Y, Zhao JL, Wu QF, Yu SG. Intestinal microecology in rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3445-3451
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3445.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3445
肠道是微生物的王国, 不同种类和数量的肠道细菌相互协调、相互制约, 共同构成庞大的微生态系统, 参与宿主营养物质的消化吸收、能量代谢、免疫调节等诸多过程[1-4]. 肠道菌群紊乱会造成肠道防御、免疫调节功能降低, 引发各种肠道疾病[3,5,6]. 近来研究表明, 溃疡性结肠炎(ulcerative colitis, UC)、克罗恩氏病(crohn disease, CD)、肠易激综合征(irritable bowel syndrome, IBS)等肠道疾病的发生与肠道菌群失调、肠黏膜屏障功能缺陷、肠道通透性增高以及肠道内成分诱发的异常免疫反应等因素有关[7-9]. 其中UC的发病率无论在国外还是国内均有逐年增高的趋势[10,11]. 最近研究认为, 肠道菌群改变可能是UC发生和发展的关键因素[12-15]. 因此, 通过了解肠道菌群与UC的关系有助于认识肠道微生态在疾病发生发展中的重要作用. 葡聚糖硫酸钠(dextran sulfate sodium, DSS)所致的UC模型是科研工作中使用较多的一种UC模型, 但相关的微生态数据还比较缺乏[16-18], 本实验运用多聚酶链反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis, PCR-DGGE)技术, 从"肠道微生态"的角度研究了DSS所致UC模型大鼠肠道微生态的改变, 以期为深入认识该模型与人类UC的相似性提供证据, 也为揭示UC的发病机制提供更为丰富的实验数据.
DSS(分子量36 000-50 000, MP Biomedicals公司); DNA提纯试剂盒(北京赛百盛); pEASY-T3 Cloning Kit试剂盒(北京全式金生物技术有限公司); PCR引物(北京基诺来普生物科技有限公司). 光学显微镜(莱卡DM600M); 凝胶成像系统(Bio-rad公司Gel-Doc2000); 变性梯度凝胶电泳仪(Bio-Rad公司PowerPac); 测序仪(Hitachi公司3730xlDNA Analyzer). 清洁级健康♂SD大鼠26只, 体质量200 g±20 g(由简阳市动物中心提供, 合格证号: SCXK(川)2008-24).
1.2.1 动物分组与造模: 动物在实验前进行适应性驯养, 自由进食和饮水. 室温控制在20 ℃左右, 相对湿度70%, 驯养期模拟捕捉所有大鼠, 1次/d, 大鼠驯养2 wk后采用随机数字表法按体质量随机分为空白组和UC模型组, UC组大鼠自由饮用浓度为4%的DSS溶液, 7 d诱发急性UC模型, 之后改为正常饮水.
1.2.2 一般指标检测方法: 实验过程中观察并记录各组大鼠的体质量变化、大便性状及出血情况, 比较各组大鼠的一般活动状况; 采用联苯胺法评价各组大鼠的粪便隐血情况; 造模后7 d取大鼠盲部和远端结肠组织观察病理形态学改变.
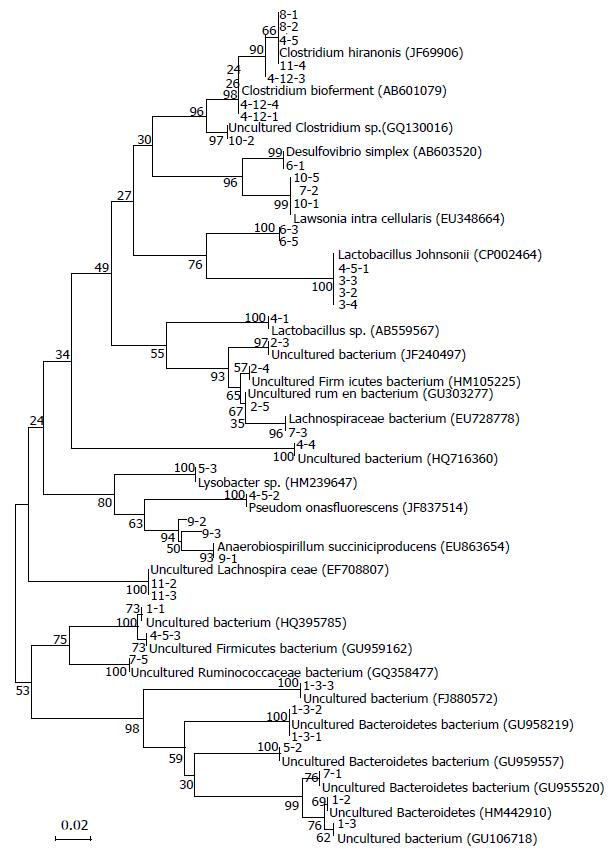
1.2.3 肠道微生态研究: 造模7 d收集大鼠粪便排泄物, 提取粪便DNA, 采用PCR-DGGE方法进行研究. (1)PCR引物: PCR通用引物, GC338F&518R(GC-338F: 5'-CGCCCGCC GCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG-3', 518R: 5'-ATTACCGCGGCTGCTGG-3'); 测序通用引物: M13F&M13R(M13F: 5'-CGCCAGGGTTTTCCCAGTCAGG AC-3' M13R: 5'-CAG GAA ACAGCT ATGACC-3'); (2)总DNA的提取: 参照说明书和文献报道[10]提取粪便总DNA, 具体过程为: 取冻存的200-220 mg粪便至2 mL离心管, 加800 mL 1×TE缓冲液并捣碎涡旋, 使之充分溶解, 9 000 r/min离心1-3 min后去上清留沉淀, 加800 μL裂解液使沉淀充分混匀, 室温放置5 min, 13 000 r/min离心1 min, 上清液倒入吸附柱, 13 000 r/min再离心1 min, 吸附柱下的液体倒回吸附柱内, 再次离心, 上述步骤重复2-3次, 用0.5 mL漂洗液清洗吸附柱2-3次, 13 000 r/min离心30 s, 将漂洗完的离心纯化柱再离心1-2 min, 彻底除去漂洗液, 将离心纯化柱套入干净、空的1.5 mL离心管中, 加入50 μL TE缓冲液到硅胶模上, 静置10 min后13 000 r/min离心1 min, 离心管中的洗脱液再次洗脱后收集、保存, 测定DNA浓度, 并用1%的琼脂糖凝胶电泳检测其质量, 所有DNA样本保存于-20 ℃以用于后续的PCR分析; (3)细菌16S rDNA片段的扩增: PCR扩增体系为: 5 μL 10×PCR缓冲液; 3.2 μL dNTP(2.5 mmol/L); 0.4 μL Taq酶(5 U/μL); 1 μL GC-338F(20 mmol/L); 1 μL 518R(20 mmol/L); 50 ng模板DNA; 补ddH2O至50 μL, 扩增程序: 94 ℃预变性5 min; 94 ℃变性1 min; 55 ℃复性45 s; 72 ℃延伸1 min, 30个循环; 最终72 ℃延伸10 min; 4 ℃保存, PCR产物用2%的琼脂糖凝胶进行电泳, 以检测是否出现条带; (4)变性梯度凝胶电泳(DGGE)用抽滤法纯化PCR产物, 取10 μL纯化后的PCR产物上样于8%的(变性梯度40%-60%)聚丙烯酰胺凝胶上, 60 ℃ 200 V预电泳10 min, 然后加入PCR样品15 μL, 200 V电泳4 h, 电泳结束后用银染法对DGGE胶进行染色, 显影, 用灭菌手术刀切下待回收的DGGE条带, 放于纯水中, 4 ℃备用; (5)基因克隆与测序: 将重新扩增的DNA片段切胶回收、纯化后, 连接到pEASY-T3载体上, 并转化至Trans-T1感受态细胞中, 菌液铺板, 培养过夜, 挑选阳性克隆, 用M13F、M13R、T7promoter引物测序, 进行序列分析; (6)构建系统进化树及优势菌种鉴定: 利用"载体序列去除软件"去除拼接好的阳性克隆序列中载体序列, 获得阳性克隆中完整的细菌16S rDNA序列, 并与NCBI数据库(http://www.ncbi.nlm.nih.gov/blast)中已知细菌比较, 利用ClustalX-MEGA 4软件对序列进行同源性分析后, 构建系统发育进化树(采用NJ算法, Bootstrap为1 000次), 进一步对各优势菌群在各组中含量进行分析, 筛选得到含量发生明显变化的细菌.
1.2.4 图像分析与数据处理: 用Quantity One(Bio-Rad Laboratories, USA)数字化DGGE指纹图谱上的条带, 采用非加权配对算数聚类法(UPGAMA)对细菌群落进行聚类分析, 不同组间微生物群落结构的相似性通过Dice相似系数比较. Dice相似系数S = 2NAB/(NA+NB), NAB表示两站点的共有谱带数, NA和NB分别代表样品A和B的特有谱带数. 采用Shannon-Weaver指数H对细菌群落的多样性进行分析. Shannon-Weaver指数H = -∑Pi lnPi式中Pi = ni/N, Pi代表某一泳道的第i个条带的光密度的百分含量.
统计学处理 所有数据以mean±SD表示, 采用SPSS18.0软件进行统计学分析, 组间样本数据比较采用独立样本t检验, P<0.05表示差异有统计学意义.
2.1.1一般状况: 空白组大鼠在整个实验过程中毛发有光泽, 精神状态良好, 较活跃, 大便正常. 模型组大鼠逐渐出现拱背、厌食、大便性状改变以及体质量明显减轻等现象; 造模3 d后模型组大鼠大便隐血实验阳性, 造模7 d后模型大鼠出现黏液血便或脓血便, 有典型的UC症状. 造模7 d后, 剖腹观察可见模型组结肠缩短, 充血水肿明显, 肠壁明显增厚, 肠黏膜广泛充血、水肿, 局部有糜烂出血, 并以回盲部及远端结肠为重, 空白组结肠长度正常, 各部位肠壁光滑, 无水肿、充血及溃疡面.
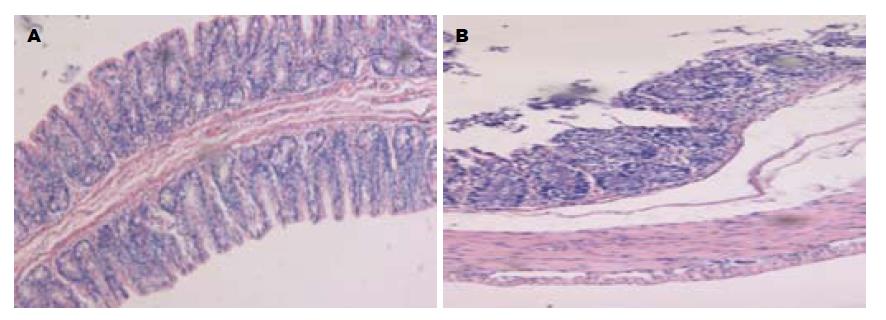
2.1.2 肠道病理形态学改变: 光学显微镜下观察可见空白组肠黏膜组织完整, 腺体排列整齐, 柱状上皮细胞、固有层和黏膜肌层的腺体排列整齐; 模型组黏膜层结构破坏, 并可见溃疡面, 黏膜下层充血水肿, 大量炎细胞浸润, 可见游离的坏死组织(图1), 表明UC模型复制成功.
2.2.1 总DNA的抽提: 琼脂糖凝胶电泳结果显示样本总DNA片段大小在20 kb以上, 条带清晰可见, 说明提取的总DNA质量好, 无拖尾, 降解, 符合继续进行实验的要求.
2.2.2 16S rDNA片段的扩增: 16S rDNA序列扩增后获得唯一目的条带, 条带清晰, 片段大小约为230 bp, 说明扩增产物纯度高, 符合DGGE电泳实验要求.
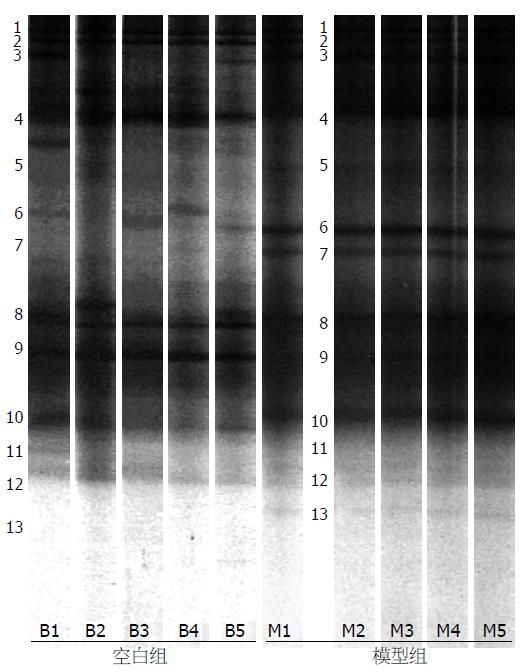
2.2.3 DGGE电泳结果: 空白组与模型组的样品DGGE带谱在条带的数量、位置及条带的亮度上均存在着较大的差异(图2), 一定程度上反应了各组样本中细菌种类的复杂多样性, 丰度及多样性指数统计结果显示, 两组样品的丰度在11-15之间, 多样性指数(H值)在2.28-2.72之间, 模型组的丰度值及多样性指数明显低于空白组(P<0.05, 表1), 说明DSS诱导的UC模型对肠道菌群的丰度及多样性有显著影响. DGGE电泳图谱优势条带回收测序后与NCBI数据库进行序列比对, 并根据最相似的菌株名称、相似度及分类类群构建系统发育树, 结果显示回收的条带所代表的细菌与数据库中的细菌大部分有97%同源性, 有的同源性甚至达到了100%(表2), 鉴定按细菌分类主要属于3大优势类群: 厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes), 及变形菌门(Proteobacteria)(图3), 与空白组相比, 模型组Bacteroidetes和Proteobacteria细菌含量降低(均P<0.05); 模型组Firmicutes总含量增加, 差异有统计学意义(P<0.05).
| 条带编号 | 最相似细菌名称 | 登录号 | 相似度 | 分类类群 |
| 1 | Uncultured bacterium | HQ395785 | 100% | Bacteroidetes |
| 2 | Uncultured Firmicutes bacterium | HM105225 | 100% | Bacteroidetes |
| 3 | Lactobacillus johnsonii | CP002464 | 100% | Firmicutes |
| 4 | Uncultured bacterium | HQ716360 | 100% | Firmicutes |
| 5 | Uncultured Bacteroidetes bacterium | GU959557 | 100% | Bacteroidetes |
| 6 | Lactobacillus sp. | AB559567 | 100% | Bacteroidetes |
| 7 | Lachnospiraceae bacterium | EU728778 | 99% | Firmicutes |
| 8 | Clostridium hiranonis | JF693906 | 100% | Firmicutes |
| 9 | Anaerobiospirillum succiniciproducens | EU863654 | 98% | Gammaproteobacteria |
| 10 | Lawsonia intracellularis | EU348664 | 100% | Deltaproteobacteria |
| 11 | Uncultured Lachnospiraceae | EF708807 | 100% | Firmicutes |
| 12 | Uncultured bacterium | HM124330 | 100% | Firmicutes |
| 13 | Clostridium bifermentans | AB601079 | 100% | Firmicutes |
进一步对各优势菌群在各组中含量进行分析, 结果发现: Lactobacillus sp.与Lachnospiraceae bacterium含量在模型组中显著降低, 与空白组比较, 差异有统计学意义(P<0.05). Clostridium bifermentans的含量在模型组则显著升高, 高于空白组, 差异有统计学意义(P<0.05, 表3).
越来越多的证据表明, 栖息于宿主体内的肠道菌群与肠道疾病的发生发展密切相关, 菌群与人共同形成了"超生物体", 共同发挥稳定肠道免疫、炎症水平和局部微环境的作用. 因此, 深入认识肠道菌群在肠道疾病中的作用及变化规律将为治疗肠道疾病带来新的机遇. UC是一种慢性非特异性炎症性肠病, 其发病机制与遗传、免疫、环境等多个因素有关. 流行病学调查显示, 肠道菌群改变与UC的发生存在相关性[19,20]. UC患者肠道内正常细菌数量减少, 活动性UC较非活动性UC的菌群总数也明显减少, 并且有意义的厌氧菌(包括双歧杆菌、真菌和梭菌)、兼性厌氧菌和微需氧菌(肠杆菌、乳酸杆菌)均减少[11], 表明肠道微生态是UC发生发展中不可忽视的重要因素. DSS所致的UC模型不仅具有典型的UC临床症状的特点, 并且人为反复运用DSS刺激, 可诱导大鼠出现类似人类急性期和缓解期交替出现的变化, 与人类UC的反复发作, 迁延难愈的疾病特点极为相似[21]. 因此, 很有必要从肠道微生态的角度进一步认识该模型的病变特点, 以期为今后采用DSS诱导的UC模型的应用提供更为丰富的证据.
本研究首先从一般情况、组织形态学等方面观察了DSS诱导的UC模型, 结果与文献报道一致[17,21], 说明该模型符合研究目的, 然后重点对UC模型大鼠肠道菌群的多样性和丰度进行了研究, 模型组的丰度值及多样性指数明显低于空白组, 与空白组比较P<0.05, 差异有统计学意义, 说明DSS诱导UC模型对肠道菌群的丰富度及多样性有一定的影响; 菌群的多样性是反应物种丰富度的重要指标, 菌群多样性越高, 不同细菌的关联度也越高, 说明菌群具有较强的自身稳定性和较强的抗定植能力, 从而很好地维持机体的健康; 而当病变发生时, 多样性指数往往会下降, 稳定性会降低, 抗定植能力减弱, 从而造成肠道微生态失调[22,23]. 本研究进一步培养和鉴定了主要的菌种. 结果表明, UC模型大鼠肠道优势菌群主要为Bacteroidetes、Firmicutes及Proteobacteria大类, 其中对Lachnospiraceae bacterium、L.sp、C. bifermentans在两组中含量进行统计学分析, 结果发现:Lachnospiraceae bacterium与L.sp含量在模型组中显著降低,与空白组比较,差异有统计学意义(P<0.05). 对优势菌种的培养和鉴定表明UC组乳酸杆菌(Lactobacillus sp.)和L. johnsonii菌种显著较少, 而双酶梭菌(Clostridium bifermentans)等菌种含量明显增多. 乳酸杆菌属于Firmicutes, 可作为益生菌在体内通过发酵碳水化合物产生乳酸, 从而促进消化和吸收, 还可以对肠内环境的酸化起到良性调节作用, 抑制有害细菌黏附于肠上皮. 此外, 乳酸杆菌还可以刺激肠道产生免疫球蛋白增强宿主的免疫能力[24-28], 加强肠道屏障功能、降低通透性等, 是目前应用最为广泛的益生素菌种之一, 临床研究表明对UC具有保护作用. 毛螺科菌也属于Firmicutes. Frank等[27]对190名CD、UC和非IBD受试者肠道组织样本的研究发现, 属于梭菌目毛螺菌科的一些产酪酸菌在IBD患者的样本中减少了24%-34%. Amit-Romach等[28]也发现毛螺旋菌在IBD患者肠道中的相对数量少于正常人群. 由此可见, 毛螺科菌与乳酸杆菌同样属于益生菌, 对治疗UC具有积极作用[29], 但其机制仍有待于进一步研究. 双酶梭菌是一种消化系常见的梭状菌, 本研究中其含量增高, 这与Hans等[30]采用腹腔注射抗生素的方法观察到DSS小鼠肠道菌群中拟杆菌和梭状芽胞杆菌增多的结果基本一致, 但目前有关双酶梭菌的具体作用研究尚少, 其意义还不甚清楚.
综上所述, 本研究应用PCR-DGGE技术分析DSS所致的UC大鼠肠道微生态的变化, 了解DSS对肠道菌群多样性和丰度的影响, 并进一步分析鉴定了对UC有影响的相关菌种, 这为将来采用DSS诱导的UC模型在相关研究中的应用提供了可靠的数据. 本研究结果只提示肠道菌群变化可能是继发性改变, 对肠道菌群变化与UC之间关系还需要进一步研究.
溃疡性结肠炎(UC)是一种慢性非特异性炎症性肠病, 其发病机制与遗传、免疫、环境等多个因素有关. 流行病学调查显示, 肠道菌群改变与UC的发生存在相关性. 通过了解肠道菌群与UC的关系有助于认识肠道微生态在疾病发生发展中的重要作用. 葡聚糖硫酸钠(DSS)所致的UC模型是科研工作中使用较多的一种UC模型, 但相关的微生态数据还比较缺乏.
江学良, 教授, 主任医师, 中国人民解放军济南军区总医院消化科
有研究发现: 人为给无菌小鼠移植螺杆菌将引发严重的肠炎, 而同时移植脆弱拟杆菌则保护宿主免受侵害.
本实验运用多聚酶链反应-变性梯度凝胶电泳(PCR-DGGE)技术, 从"肠道微生态"的角度研究了DSS所致UC模型大鼠肠道微生态的改变.
本研究为深入认识该模型与人类UC的相似性提供证据, 也为揭示UC的发病机制提供更为丰富的实验数据.
本研究应用PCR-DGGE技术分析DSS所致的UC大鼠肠道微生态的变化, 了解DSS对肠道菌群多样性和丰度的影响, 并进一步分析鉴定了对UC有影响的相关菌种, 这为将来采用DSS诱导的UC模型在相关研究中的应用提供了可靠的数据.
编辑: 田滢 电编:闫晋利
| 1. | Campieri M, Gionchetti P. Bacteria as the cause of ulcerative colitis. Gut. 2001;48:132-135. [PubMed] [DOI] |
| 2. | Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci U S A. 2004;101:15718-15723. [PubMed] [DOI] |
| 3. | Kelly D, Conway S, Aminov R. Commensal gut bacteria: mechanisms of immune modulation. Trends Immunol. 2005;26:326-333. [PubMed] [DOI] |
| 4. | Hooper LV, Gordon JI. Commensal host-bacterial relationships in the gut. Science. 2001;292:1115-1118. [PubMed] [DOI] |
| 6. | Dignass A, Preiss JC, Aust DE, Autschbach F, Ballauff A, Barretton G, Bokemeyer B, Fichtner-Feigl S, Hagel S, Herrlinger KR. [Updated German guideline on diagnosis and treatment of ulcerative colitis, 2011]. Z Gastroenterol. 2011;49:1276-1341. [PubMed] [DOI] |
| 7. | Sasaki M, Klapproth JM. The role of bacteria in the pathogenesis of ulcerative colitis. J Signal Transduct. 2012;2012:704953. [PubMed] |
| 8. | Kim IW, Myung SJ, Do MY, Ryu YM, Kim MJ, Do EJ, Park S, Yoon SM, Ye BD, Byeon JS. Western-style diets induce macrophage infiltration and contribute to colitis-associated carcinogenesis. J Gastroenterol Hepatol. 2010;25:1785-1794. [PubMed] [DOI] |
| 11. | Karlinger K, Györke T, Makö E, Mester A, Tarján Z. The epidemiology and the pathogenesis of inflammatory bowel disease. Eur J Radiol. 2000;35:154-167. [PubMed] [DOI] |
| 12. | Guarner F. Microecology as a target for therapeutic intervention in inflammatory bowel disease. IDrugs. 2003;6:868-873. [PubMed] |
| 13. | Kinross JM, von Roon AC, Holmes E, Darzi A, Nicholson JK. The human gut microbiome: implications for future health care. Curr Gastroenterol Rep. 2008;10:396-403. [PubMed] [DOI] |
| 14. | Saric J, Wang Y, Li J, Coen M, Utzinger J, Marchesi JR, Keiser J, Veselkov K, Lindon JC, Nicholson JK. Species variation in the fecal metabolome gives insight into differential gastrointestinal function. J Proteome Res. 2008;7:352-360. [PubMed] [DOI] |
| 15. | Mazmanian SK, Round JL, Kasper DL. A microbial symbiosis factor prevents intestinal inflammatory disease. Nature. 2008;453:620-625. [PubMed] [DOI] |
| 16. | Perše M, Cerar A. Dextran sodium sulphate colitis mouse model: traps and tricks. J Biomed Biotechnol. 2012;2012:718617. [PubMed] |
| 17. | Yan Y, Kolachala V, Dalmasso G, Nguyen H, Laroui H, Sitaraman SV, Merlin D. Temporal and spatial analysis of clinical and molecular parameters in dextran sodium sulfate induced colitis. PLoS One. 2009;4:e6073. [PubMed] [DOI] |
| 18. | Macfarlane S, Steed H, Macfarlane GT. Intestinal bacteria and inflammatory bowel disease. Crit Rev Clin Lab Sci. 2009;46:25-54. [PubMed] [DOI] |
| 19. | Lepage P, Häsler R, Spehlmann ME, Rehman A, Zvirbliene A, Begun A, Ott S, Kupcinskas L, Doré J, Raedler A. Twin study indicates loss of interaction between microbiota and mucosa of patients with ulcerative colitis. Gastroenterology. 2011;141:227-236. [PubMed] [DOI] |
| 20. | Ohkusa T, Yoshida T, Sato N, Watanabe S, Tajiri H, Okayasu I. Commensal bacteria can enter colonic epithelial cells and induce proinflammatory cytokine secretion: a possible pathogenic mechanism of ulcerative colitis. J Med Microbiol. 2009;58:535-545. [PubMed] [DOI] |
| 21. | Trivedi PP, Jena GB. Dextran sulfate sodium-induced ulcerative colitis leads to increased hematopoiesis and induces both local as well as systemic genotoxicity in mice. Mutat Res. 2012;744:172-183. [PubMed] [DOI] |
| 23. | 魏 华. 不同外源扰动因素对肠道菌群组成结构影响的研究. 上海交通大学生命科学技术学院. 2008;. |
| 24. | Robosky LC, Wells DF, Egnash LA, Manning ML, Reily MD, Robertson DG. Communication regarding metabonomic identification of two distinct phenotypes in Sprague-Dawley (Crl: CD(SD)) rats. Toxicol Sci. 2006;91:309. [PubMed] [DOI] |
| 25. | Zocco MA, dal Verme LZ, Cremonini F, Piscaglia AC, Nista EC, Candelli M, Novi M, Rigante D, Cazzato IA, Ojetti V. Efficacy of Lactobacillus GG in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther. 2006;23:1567-1574. [PubMed] [DOI] |
| 26. | 张 美玲. 两种肠道疾病中肠道菌群结构变化的分子生态学研究. 上海交通大学生命科学技术学院. 2007;. |
| 27. | Frank DN, St Amand AL, Feldman RA, Boedeker EC, Harpaz N, Pace NR. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases. Proc Natl Acad Sci U S A. 2007;104:13780-13785. [PubMed] [DOI] |
| 28. | Amit-Romach E, Sklan D, Uni Z. Microflora ecology of the chicken intestine using 16S ribosomal DNA primers. Poult Sci. 2004;83:1093-1098. [PubMed] |
| 29. | Ye J, Lee JW, Presley LL, Bent E, Wei B, Braun J, Schiller NL, Straus DS, Borneman J. Bacteria and bacterial rRNA genes associated with the development of colitis in IL-10(-/-) mice. Inflamm Bowel Dis. 2008;14:1041-1050. [PubMed] [DOI] |
| 30. | Hans W, Schölmerich J, Gross V, Falk W. The role of the resident intestinal flora in acute and chronic dextran sulfate sodium-induced colitis in mice. Eur J Gastroenterol Hepatol. 2000;12:267-273. [PubMed] [DOI] |