修回日期: 2012-11-15
接受日期: 2012-12-03
在线出版日期: 2012-12-18
目的: 应用大鼠肝大部切除肝再生模型, 将前期构建好的靶向SMAD3基因的shRNA重组慢病毒注射入大鼠体内, 观察SMAD3 shRNA对大鼠肝再生的影响.
方法: 将60只♂Wistar大鼠随机分为3组: SMAD3 shRNA组(20只)、shRNA对照组(20只)、生理盐水对照组(20只), 通过脾脏注射方法给药, 慢病毒给药剂量为1.0×108 TU/只, 生理盐水对照组给予等体积500 μL生理盐水. 给药96 h后行2/3肝大部切除, 构建大鼠肝再生模型; 肝大部切除术后96 h各组分别除死大鼠7只, 剩余大鼠于144 h处死, 收集肝脏标本, Real-Time PCR、免疫组织化学检测肝组织SMAD3表达, 免疫组织化学检测肝组织Ki67表达, 测定大鼠肝质量/体质量, 观察SMAD3 shRNA对肝再生的影响.
结果: Real-Time PCR检测显示, 通过脾脏注射慢病毒, 在96、144 h处死时间点, SMAD3 shRNA组SMAD3 mRNA分别较shRNA对照组平均下降73%、63%. 免疫组织化学检测显示SMAD3蛋白表达明显下降. Ki67免疫组织化学结果显示, 肝大部切除术后96、144 h, SMAD3 shRNA组Ki67表达阳性细胞数均明显多于生理盐水对照组及shRNA对照组, 表明抑制SMAD3表达后肝细胞增殖活跃. 大鼠肝质量与体质量比值显示, SMAD3 shRNA组分别较生理盐水对照组及shRNA对照组有增加趋势(96 h: 4.50±0.43 vs 3.97±0.55 vs 3.98±0.40, 144 h: 4.66±0.54 vs 4.15±0.51 vs 4.20±0.34), 但没有统计学意义(P>0.05).
结论: SMAD3 shRNA在大鼠体内可一定程度上促进肝细胞增殖, 但对肝再生的促进作用尚弱.
引文著录: 张莹, 孔贺利, 郑素军, 刘梅, 陈煜, 刘霜, 段钟平. 靶向SMAD3基因的shRNA重组慢病毒对大鼠肝再生的作用. 世界华人消化杂志 2012; 20(35): 3431-3438
Revised: November 15, 2012
Accepted: December 3, 2012
Published online: December 18, 2012
AIM: To investigate the effect of lentiviral-mediated delivery of shRNA targeting the SMAD3 gene on liver regeneration in rats.
METHODS: Sixty male rats were randomly divided into three groups: SMAD3 shRNA group (n = 20), shRNA control group (n = 20), and normal saline group (n = 20). Intrasplenic injection of lentivirus carrying the SMAD3 shRNA or control shRNA at a dose of 1.0 × 108 TU per rat was performed in rats of the SMAD3 shRNA group and shRNA control group, respectively, while the normal saline group was given equal volume of normal saline. After 96 h, 2/3 partial hepatectomy was performed to develop a rat model of liver regeneration. Seven rats of each group were sacrificed at 96 h, and the rest were sacrificed at 144 h after hepatectomy. Liver tissue specimens were collected. SMAD3 expression was detected using real-time PCR and immunohistochemistry. Proliferation of hepatocytes was evaluated by detecting Ki67 by immunohistochemistry. The ratio of liver weight to body weight was determined to observe its role in liver regeneration in vivo.
RESULTS: At 96 h and 144 h after hepatectomy, SMAD3 mRNA expression decreased by 73% and 63% in the SMAD3 shRNA group compared to the shRNA control group. The expression of SMAD3 protein also decreased obviously. More active proliferation of hepatocytes was observed after SMAD3 down-regulation. The liver weight/body weight in the SMAD3 shRNA group was higher than those in the normal saline control group and shRNA control group (96 h: 4.50 ± 0.43 vs 3.97 ± 0.55 vs 3.98 ± 0.40, 144 h: 4.66 ± 0.54 vs 4.15 ± 0.51 vs 4.20 ± 0.34), but there was no statistically significance between them (all P > 0.05).
CONCLUSION: Down-regulation of SMAD3 expression could moderately promote liver regeneration in rats.
- Citation: Zhang Y, Kong HL, Zheng SJ, Liu M, Chen Y, Liu S, Duan ZP. Lentiviral-mediated delivery of shRNA targeting the SMAD3 gene promotes liver regeneration in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3431-3438
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3431.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3431
如何促进持久和强大的肝再生, 对于肝癌肝切除术后、肝衰竭等肝脏疾病的自然康复有着重要意义. 肝再生可分为启动、增生和终止阶段. 研究表明, 在肝再生终止阶段, 转化生长因子-β(transforming growth factor β, TGF-β)和激活素A(Activin A)具有抑制肝细胞增殖, 诱导肝细胞凋亡的作用, 是肝再生的重要的负调控因子[1,2]. TGF-β及Activin A发挥作用, 主要通过SMAD信号通路实现细胞内信号转导, 其中SMAD3是TGF-β和Activin A在SMAD信号通路中共同的关键信号蛋白[3,4]. 如果特异性阻断SMAD3蛋白表达, 有可能同时解除TGF-β和Activin A的作用, 从而起到促进肝细胞增殖, 达到肝再生目的.
小干扰RNA(small interfering RNA, siRNA)是基因功能研究和治疗的高效工具, 可以高效特异的阻断基因表达. siRNA在RNA依赖RNA聚合酶(RdRp)作用下, 以靶mRNA为模板合成dsRNA, 后者可被降解形成新的siRNA; 新生成的siRNA又可进入上述循环, 从而使靶mRNA渐进性减少[5]. 研究表明, siRNA较之单链反义寡核苷酸、核酶和脱氧核酶具有独特的、高效的基因表达调控效果[6-9]. 目前siRNA已应用于抗肝炎病毒、肝纤维化及肝衰竭的治疗研究[10-12].
高效的siRNA导入手段是确保疗效的另一关键, 以HIV-1为基础构建的慢病毒载体系统具有可感染分裂细胞和非分裂细胞、免疫反应小等优点, 还可以通过将其携带的基因片段整合到宿主细胞的基因组, 实现目的基因的稳定表达, 而且感染效率高、免疫原性低, 是具有广阔应用前景的RNAi载体[13]. 本研究中拟使用的pLKO.1慢病毒载体就属于这一系统. 将带RNA pol Ⅲ启动子的shRNA序列插入到载体pLKO.1-Puro-GFP中, 并与包装成分的重组质粒共转染细胞(如人肾293FT细胞), 收获包装细胞上清中具有一次性感染能力而无复制能力的、携带靶shRNA序列的HIV-1载体颗粒, 用来感染靶细胞进行治疗, 可在细胞内表达shRNA, 并进一步裂解为siRNA发挥作用.
在我们前期的研究中, 以大鼠SMAD3为靶基因, 成功筛选了siRNA作用靶位点、并构建了SMAD3 shRNA慢病毒表达系统[14], 在体外显示了显著的抗肝纤维化作用[15]. 本研究拟利用大鼠肝大部切除肝再生模型, 探讨上述SMAD3 shRNA对肝再生的影响, 从而为重型肝炎肝衰竭等疾病治疗提供新的思路.
PCR引物(上海生物化工有限公司合成); RNA提取试剂盒TRIzol Reagant(美国invitrogen公司); TaKaRa RNA PCR Kit(AMV) Ver.3.0(宝生物工程有限公司); SYBR®Premix Ex TaqTM(Perfect Real Time)(宝生物工程有限公司); 荧光定量PCR仪7500(美国ABI公司); Polybrene(美国Sigma公司); SMAD3抗体(美国Cell Signaling公司); Ki67抗体(美国Epitomics公司); 辣根过氧化酶标记羊抗小鼠二抗(北京中杉金桥公司); 辣根过氧化物酶标记兔二抗工作液(北京康为世纪生物科技有限公司); LEICA RM2235超薄切片机(上海徕卡仪器有限公司); CX40RF200光学显微镜(日本OLYMPUS) .
1.2.1 慢病毒的包装和滴定: 我们先前工作中应用PLL3.7-shRNA慢病毒4质粒系统, 已成功筛选、构建了靶向大鼠SMAD3基因的shRNA重组慢病毒[14,15]. SMAD3shRNA靶向的序列为5'-UGGUGCGAGAAGGCGGUCAdTdT-3'(根据Genbank提供的SMAD3基因序列NM_013095, 靶向SMAD3碱基位点289-308). shRNA对照的序列为5'-TTCTCCGAACGTGTCACGT-3'(使用上海吉玛公司提供的ctrl siRNA序列, 该序列已被证实与大鼠和人基因组缺乏序列同源性). 将构建好的载体质粒交给上海吉玛公司, 委托其进行慢病毒大规模包装、滴定.
1.2.2 肝再生模型构建及慢病毒感染: ♂Wistar大鼠60只, 体质量150-200 g(中国军事医学科学院实验动物中心提供). 随机分为3组: SMAD3 shRNA组(20只)、shRNA对照组(20只)、生理盐水对照组(20只), 上述各组通过脾脏注射给予慢病毒, 具体过程为: 大鼠称质量后, 给予10%水合氯醛4 mg/kg麻醉, 备皮. 大鼠仰卧, 四肢固定, 碘酊消毒大鼠腹部脾区, 用剪刀剪开一直径约1.5-2.0 cm的小口, 小心寻找并暴露脾脏, 经脾脏注射给药, SMAD3 shRNA组、shRNA对照组慢病毒注射剂量均为1×108 TU/只. 慢病毒组应用生理盐水稀释至500 μL, 并加入慢病毒感染增强剂Polybrene(使终浓度为8 ng/mL), 生理盐水对照组应用等体积500 μL生理盐水. 注射时可以看到注射点脾脏颜色先发白, 后变成粉红色, 注射后颜色迅速恢复. 96 h后, 将上述各组存活大鼠行肝大部切除术, 建立肝再生模型. 手术方法: 大鼠称质量、麻醉过程同前. 碘酊消毒大鼠腹部. 沿下腹部剪一小口, 后沿此小口向上, 用剪刀将大鼠腹部皮肤及肌肉组织钝性分离, 边分离边剪开皮肤, 后沿腹白线将肌肉层剪开, 止血钳固定两侧皮肤、肌肉, 暴露内脏器官, 暴露内脏器官后, 剪断部分肝上韧带和全部肝下韧带. 用7号线将大鼠肝左叶和中叶固定结扎, 观察肝叶是否淤血, 同时观察另外两叶肝脏的血流情况. 如另外两叶肝脏血供良好, 则将结扎肝叶剪除, 并修剪剩余面. 逐层缝合腹部切口.
1.2.3 标本收集: 肝大部切除术后96 h, SMAD3 shRNA组、shRNA对照组、生理盐水对照组各取大鼠7只, 称质量、麻醉, 经下腔静脉抽血10-15 mL, 分离血清放置于-80 ℃冰箱中保存备检. 进一步暴露腹腔, 取出完整肝脏称质量, 计算肝质量与大鼠体质量比值, 即肝质量/体质量. 取1 cm×1 cm大小肝组织放入40 g/L甲酫溶液中固定, 其余肝组织生理盐水冲洗后剪成200 mg左右的组织块放入冻存管中, 并留取肾、脾、肺、骨骼肌组织, 均储存于-80 ℃冰箱备用. 术后144 h时将各组剩余存活大鼠处死, 称取肝质量并收集标本.
1.2.4 检测指标: (1)实时荧光定量PCR法检测肝组织中SMAD3 mRNA的表达按照TRIzol试剂说明提取肝组织总RNA, TaKaRa逆转录酶进行逆转录合成cDNA, Primer5软件设计目的基因引物. SMAD3引物序列为Up: 5'-GACGCAGGCTCTCCAAACCT-3', Down: 5'-TTGGACAGCAGGCCCAGACA-3', 扩增位置为803-1029碱基位点. GAPDH引物序列为Up: 5'-GCACCACCAACTGCTTAGC-3', Down: 5'-TCCACGATGCCAAAGTTGTCAT-3', 扩增位置为411-650碱基位点. 反应体系20 μL, 设立2个复孔, 按两步法扩增: 预变性: 95 ℃ 30 s; PCR反应: 95 ℃ 5 s, 60 ℃ 30 s, 循环数40次; 反应结束后确认扩增曲线和溶解曲线, 以GAPDH为内参, 计算目的基因SMAD3 mRNA的相对表达量, 计算公式如下: SMAD3 mRNA = Power(2, CtGAPDH-CtSMAD3); (2)免疫组织化学方法检测肝脏SMAD3和Ki67的表达: 将2-3 mm厚肝组织甲醛固定, 石蜡包埋, 按3 μm厚度切片. 石蜡切片常规脱蜡, PBS洗涤, 用0.01 mol/L的枸橼酸缓冲液(pH 6.0)微波加热至92 ℃-96 ℃修复抗原15 min. 3%H2O2甲醇室温孵育15 min, 滴加封闭用正常羊血清工作液, 室温孵育15 min, 倾去, 勿洗. 滴加SMAD3抗体, 抗体浓度为1:200, 4 ℃过夜, PBS洗涤. 滴加辣根过氧化物酶标记的兔二抗工作液, 37 ℃ 15 min, PBS洗涤. 选用DAB显色. 常规乙醇脱水、二甲苯透明, 中性树胶封片保存. 肝组织Ki67免疫组织化学检测步骤同上, 其中Ki67抗体工作浓度为1:100.
统计学处理 计量数据以mean±SD表示, 采用SPSS16.0 for Windows统计软件进行统计处理, 统计方法同一时刻多组间的比较采用单因素方差分析, 若方差不齐, 或某样本不服从正态分布, 选用Kruskal-Wallis秩和检验, 以P<0.05表示差异有统计学意义. 若方差分析或秩和检验结果有统计学意义, 进一步选择Bonferonni、LSD等方法进行两两比较.
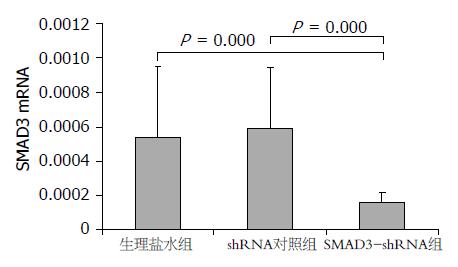
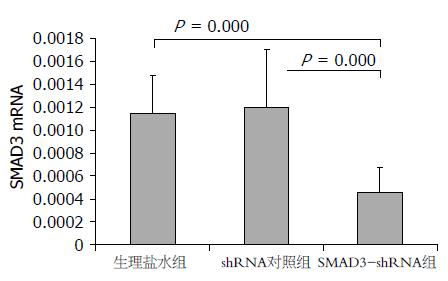
96 h时间点肝脏SMAD3 mRNA表达情况如图1. 因为方差不齐, 选用Kruskal-Wallis秩和检验, 各组间差异具有统计学意义(P = 0.002). 各组间采用非参数检验-2独立样本非参数检验进行两两比较, 结果显示, SMAD3 shRNA组分别和生理盐水对照组、shRNA对照组相比, SMAD3 mRNA表达量明显下降(均P = 0.000<α', α' = 0.05/3), 而shRNA对照组和生理盐水对照组两组间无明显差别(P = 0.539). 144 h时间点肝脏SMAD3 mRNA表达情况见图2, 各组间差异具有统计学意义(P = 0.001). 各组间采用非参数检验-2独立样本非参数检验进行两两比较, 结果显示, SMAD3 shRNA组分别和生理盐水对照组、shRNA对照组相比, SMAD3 mRNA表达量明显下降(均P = 0.000<α', α' = 0.05/3), 而shRNA对照组和生理盐水对照组两组间无明显差别(P = 0.481).
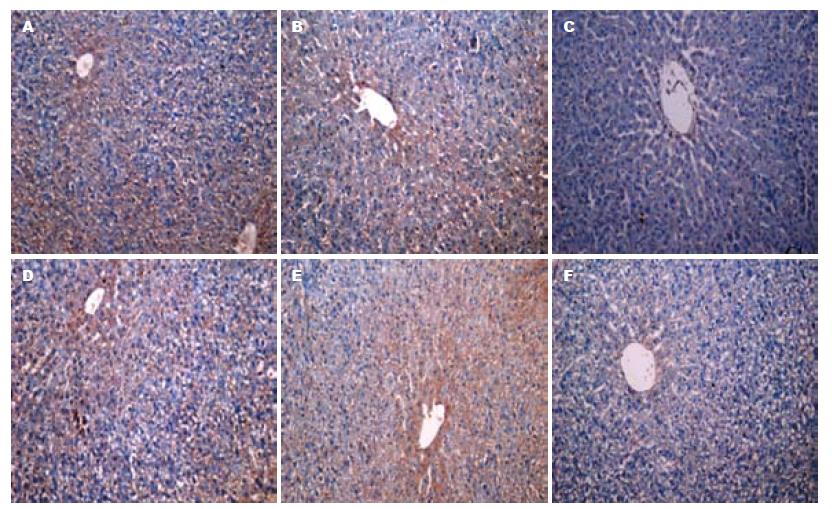
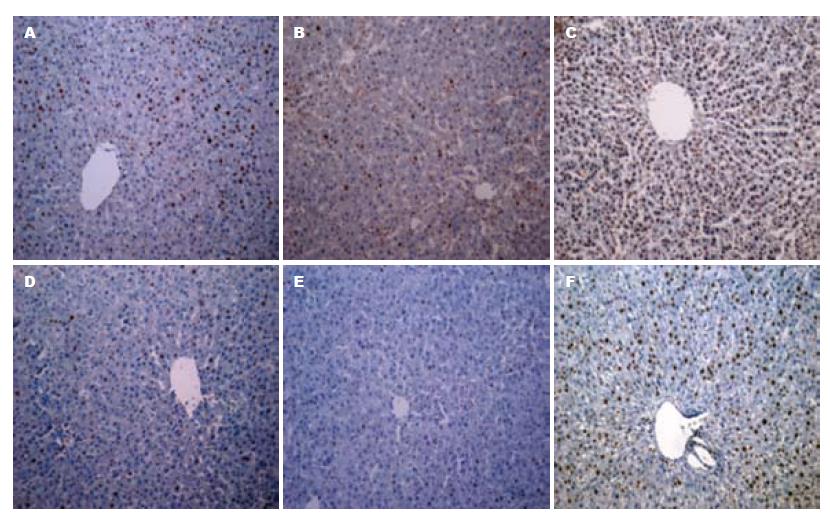
SMAD3多定位于肝细胞胞浆, 免疫组织化学染色为棕黄色. 肝大部切除术造模后96 h和144 h时间点, SMAD3 shRNA组分别和生理盐水对照组、shRNA对照组相比, SMAD3表达被显著抑制(图3). Ki67定位于细胞核, 阳性细胞可见细胞核染色为棕黄色或棕褐色, 与被苏木素衬染成蓝色的阴性细胞核区别明显. 免疫组织化学显示, SMAD3 shRNA组相对于生理盐水对照组和shRNA对照组, 处于细胞增殖期的细胞明显增多, 且96 h时间点处于增殖期的细胞明显多于144 h时间点(图4).
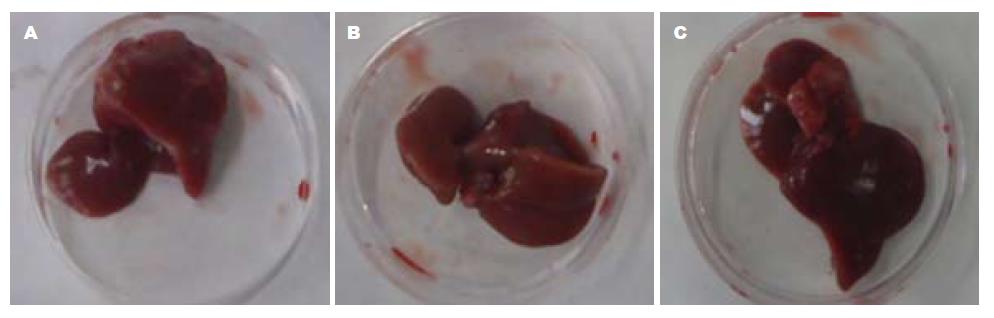
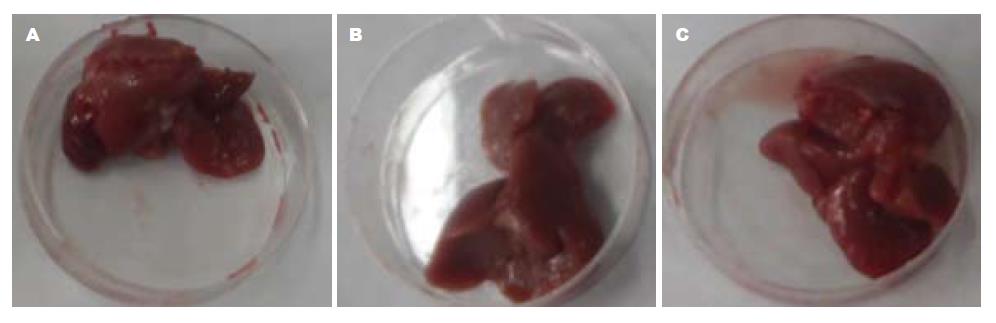
造模后96 h和144 h时间点, SMAD3 shRNA组、shRNA对照组、生理盐水对照组的肝脏均有不同程度增生, 增生的肝脏形状不规则. 144 h时间点各组肝脏基本恢复原有肝脏大小(图5, 图6).
表1显示, 96 h时间点SMAD3 shRNA组肝质量/体质量比值, 分别较生理盐水对照组、shRNA对照组稍增加, 单因素方差分析显示, 各组之间差别无统计学意义(F = 1.726, P = 0.216). 同样如表2显示, 144 h时间点各组之间肝质量/体质量差别无统计学意义(F = 2.001, P = 0.17).
| 分组 | 肝质量(g) | 肝质量/体质量(%) |
| 生理盐水对照组 | 7.07±0.72 | 3.97±0.55 |
| shRNA对照组 | 6.98±0.84 | 3.98±0.40 |
| SMAD3 shRNA组 | 7.69±0.91 | 4.50±0.43 |
| 分组 | n | 肝质量(g) | 肝质量/体质量(%) |
| 生理盐水对照组 | 9 | 7.87±0.76 | 4.15±0.51 |
| shRNA对照组 | 6 | 7.51±0.82 | 4.20±0.34 |
| SMAD3 shRNA组 | 8 | 8.34±0.88 | 4.66±0.54 |
Xu等将大鼠2/3肝大部切除后肝再生分为早期(术后2-6 h)、前期(术后6-24 h)、后期(术后24-36 h)、终止期(术后72-168 h)等4个时期[16-18]. 研究表明, TGF-β在肝再生过程从增生阶段进入终止阶段发挥了重要的作用[19]. 虽然在大鼠2/3肝脏切除术后, TGF-β随着肝再生的启动上调, 但是在肝再生早期肝细胞对TGF-β信号的刺激作用不敏感, 肝脏仍然能持续增生, 其主要原因是肝细胞TGF-β受体(transforming growth factor-β receptor, TGF-βR)表达下调, 导致肝细胞在TGF-β浓度增高的情况下仍能进行增生[20]. 而Activin A在肝再生早期信号减弱, 细胞受体水平下降, 而在肝再生终止阶段表达升高, 提示Activin A也是一个重要的肝再生终止因子[21]. 因此我们选择肝大部切除术后96 h及144 h(肝再生终止阶段中的2个时间点)处死大鼠, 观察阻断TGF-β和Activin A信号转导通路共同的下游信号蛋白SMAD3, 是否能有效解除TGF-β和Activin A对肝再生的终止作用. 本实验中Real-Time PCR和SMAD3免疫组织化学结果表明, 经脾脏注射SMAD3 shRNA能在不同水平有效抑制SMAD3的表达, 其中Real-Time PCR结果显示, shRNA SMAD3组与shRNA对照组相比, SMAD3 mRNA在96 h表达量下降73%, 在144 h下降63%.
Ki-67抗原是一种和细胞增殖密切相关的细胞标志物[22-24], 他只存在于细胞核中, 除G0期外, 其他细胞周期都表达Ki-67, 且半衰期很短, 在有丝分裂期结束后就迅速降解消失, 所以被认为是较为理想的检测细胞增殖活性的指标之一[22,25]. 本研究Ki67免疫组织化学结果显示, 分别和生理盐水对照组、shRNA对照组相比, SMAD3 shRNA组中处于细胞增殖期的细胞明显增多, 说明抑制TGF-β和Activin A共同的下游细胞信号蛋白SMAD3, 可以有效打破TGF-β和Activin A抑制肝细胞增殖的作用. 同时可以看到96 h时间点处于增殖期的细胞明显多于144 h时间点, 表明肝大部切除术后144 h处于增殖阶段的细胞已不多, 肝再生接近终止阶段.
本文通过大鼠残肝质量及与体质量比值的变化发现, 在96 h和144 h 2个时间点, 与生理盐水对照组及shRNA对照组相比, SMAD3 shRNA组肝质量/体质量有上升趋势, 但没有统计学意义. 对于这种结果, 考虑可能原因有: (1)对于TGF-β, 除了SMAD途径外, TGF-β还可通过其他途径参与肝再生的终止过程. 譬如TGF-β还可通过调节JNK/AP-1活性来实现诱导肝细胞凋亡[26]. 也可通过死亡相关蛋白(death-associated protein, Daxx)途径诱导肝细胞凋亡; (2)非TGF-β途径也参与肝再生的终止. 研究发现, 细胞周期素抑制因子, 细胞周期依赖性激酶抑制素(cyclin-dependent kinase inhibitors, CKI)[27,28], 下调IL-6/STAT3信号通路活性的细胞因子信号抑制因子(suppressors of cytokine signalling, SOCS)等[29], 均在肝再生终止阶段均发挥了重要的负调控作用; (3)Boulton等[30]在对IL-1的研究中发现, 2/3肝大部切除术后, IL-l mRNA在肝细胞正进入细胞周期和DNA合成开始启动的术后10 h下调, 而在肝细胞增殖旺盛的术后24-48 h上调, 在肝细胞DNA合成基本完成的术后72 h IL-l mRNA水平又下调. 因此, 有学者认为IL-1是除TGF-β之外的又一个强有力的肝细胞增殖抑制因子.
总之, 肝再生的启动与终止是一个复杂的过程, 本研究通过阻断SMAD3表达, 在大鼠肝大部切除术后96 h和144 h 2个时间点, 观察大鼠残肝质量及与体质量比值的变化发现, 与生理盐水对照组及shRNA对照组相比, SMAD3 shRNA组肝质量/体质量有上升趋势, 但没有统计学意义. 考虑在肝再生终止阶段, 非SMAD的途径和非TGF-β途径也参与了肝再生的终止, 使SMAD3的阻断作用不明显. 促进肝再生还需要从多种因素调控入手, 这需要进一步研究.
感谢赵军、丁美同志等在本试验中给予的大力帮助.
TGF-β和Activin A参与了抑制肝再生的过程, SMAD3是TGF-β和Activin在SMAD信号通路中共同的关键信号蛋白. 用siRNA技术阻断SMAD3表达有可能促进肝再生.
汤华, 研究员, 重庆医科大学感染性疾病分子生物学重点实验室
目前已有大量研究证明, 靶向SMAD3基因的siRNA可抑制肝纤维化, 但其在肝再生中作用鲜见报道.
研究显示, 有效阻断TGF-β或Activin A的作用, 有可能促进肝再生. 小鼠肝脏部分切除后, 注入TGF-β抗体能抑制TGF-β mRNA的表达, 提高了小鼠的存活率; 如果手术前连续注入TGF-β的抗体, 那么肝脏再生速度明显加快. 用Activin A的反义寡核苷酸处理人肝癌细胞株, 刺激了肝细胞增值. follistatin腹腔给药或用腺病毒载体的形式过度表达follistatin, 从而抑制Activin的作用, 导致肝细胞DNA合成增加和正常大鼠肝体积增大.
针对TGF-β和Activin在SMAD信号转导通路中的共同关键信号蛋白SMAD3, 应用shRNA慢病毒来抑制SMAD3表达, 该方面的研究尚未见报道.
该研究为促进肝再生的基因治疗的相关研究提供了新的思路.
本文针对肝再生终止阶段的重要细胞因子TGF-β和Activin, 应用shRNA慢病毒来抑制SMAD3这一共同信号蛋白的表达, 观察其对肝再生的作用, 有一定的创新性和参考价值
编辑: 田滢 电编:闫晋利
| 1. | Zhang YQ, Mashima H, Kanzaki M, Shibata H, Kojima I. Assessment of the role of activin A and transforming growth factor beta in the regulation of AML12 cell growth. Hepatology. 1997;25:1370-1375. [PubMed] [DOI] |
| 2. | Schwarte-Waldhoff I, Volpert OV, Bouck NP, Sipos B, Hahn SA, Klein-Scory S, Lüttges J, Klöppel G, Graeven U, Eilert-Micus C. Smad4/DPC4-mediated tumor suppression through suppression of angiogenesis. Proc Natl Acad Sci U S A. 2000;97:9624-9629. [PubMed] [DOI] |
| 3. | Jones CP, Gregory LG, Causton B, Campbell GA, Lloyd CM. Activin A and TGF-β promote T(H)9 cell-mediated pulmonary allergic pathology. J Allergy Clin Immunol. 2012;129:1000-1010. e3. [PubMed] |
| 4. | Moffatt MF, Gut IG, Demenais F, Strachan DP, Bouzigon E, Heath S, von Mutius E, Farrall M, Lathrop M, Cookson WO. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med. 2010;363:1211-1221. [PubMed] [DOI] |
| 5. | Lipardi C, Wei Q, Paterson BM. RNAi as random degradative PCR: siRNA primers convert mRNA into dsRNAs that are degraded to generate new siRNAs. Cell. 2001;107:297-307. [PubMed] [DOI] |
| 7. | Caplen NJ, Parrish S, Imani F, Fire A, Morgan RA. Specific inhibition of gene expression by small double-stranded RNAs in invertebrate and vertebrate systems. Proc Natl Acad Sci U S A. 2001;98:9742-9747. [PubMed] [DOI] |
| 8. | 夏 云, 林 汝仙, 郑 素军, 张 敏丽, 王 升启. 靶向端粒酶逆转录酶(hTERT)RNAi载体的构建及活性评价. 生物化学与生物物理进展. 2004;31:1079-1084. |
| 10. | Zender L, Hutker S, Liedtke C, Tillmann HL, Zender S, Mundt B, Waltemathe M, Gosling T, Flemming P, Malek NP. Caspase 8 small interfering RNA prevents acute liver failure in mice. Proc Natl Acad Sci U S A. 2003;100:7797-7802. [PubMed] [DOI] |
| 11. | Ying RS, Zhu C, Fan XG, Li N, Tian XF, Liu HB, Zhang BX. Hepatitis B virus is inhibited by RNA interference in cell culture and in mice. Antiviral Res. 2007;73:24-30. [PubMed] [DOI] |
| 12. | George J, Tsutsumi M. siRNA-mediated knockdown of connective tissue growth factor prevents N-nitrosodimethylamine-induced hepatic fibrosis in rats. Gene Ther. 2007;14:790-803. [PubMed] [DOI] |
| 13. | Nishitsuji H, Kohara M, Kannagi M, Masuda T. Effective suppression of human immunodeficiency virus type 1 through a combination of short- or long-hairpin RNAs targeting essential sequences for retroviral integration. J Virol. 2006;80:7658-7666. [PubMed] [DOI] |
| 14. | 陈 鹏, 郑 素军, 王 世美, 张 建军, 邢 欣悦, 张 莹, 刘 梅, 段 钟平. 靶向大鼠Smad3基因的siRNA筛选及其shRNA重组慢病毒的构建. 临床肝胆病杂志. 2011;27:533-537. |
| 15. | 郑 素军, 邢 欣悦, 武 聚山, 王 世美, 张 莹, 韩 源平, 俞 豪, 陈 煜, 刘 梅, 段 钟平. Smad3 shRNA抑制TGFβ1对HSC-T6细胞活化的抗肝纤维化作用. 临床肝胆病杂志. 2012;28:289-295. |
| 16. | Fukuhara Y, Hirasawa A, Li XK, Kawasaki M, Fujino M, Funeshima N, Katsuma S, Shiojima S, Yamada M, Okuyama T. Gene expression profile in the regenerating rat liver after partial hepatectomy. J Hepatol. 2003;38:784-792. [PubMed] [DOI] |
| 17. | Xu CS, Chang CF, Yuan JY, Li WQ, Han HP, Yang KJ, Zhao LF, Li YC, Zhang HY, Rahman S. Expressed genes in regenerating rat liver after partial hepatectomy. World J Gastroenterol. 2005;11:2932-2940. [PubMed] |
| 18. | Sato Y, Igarashi Y, Hakamata Y, Murakami T, Kaneko T, Takahashi M, Seo N, Kobayashi E. Establishment of Alb-DsRed2 transgenic rat for liver regeneration research. Biochem Biophys Res Commun. 2003;311:478-481. [PubMed] [DOI] |
| 19. | Nakamura T, Ueno T, Sakamoto M, Sakata R, Torimura T, Hashimoto O, Ueno H, Sata M. Suppression of transforming growth factor-beta results in upregulation of transcription of regeneration factors after chronic liver injury. J Hepatol. 2004;41:974-982. [PubMed] [DOI] |
| 20. | Chari RS, Price DT, Sue SR, Meyers WC, Jirtle RL. Down-regulation of transforming growth factor beta receptor type I, II, and III during liver regeneration. Am J Surg. 1995;169:126-131; discussion 131-132. [PubMed] [DOI] |
| 21. | Oe S, Lemmer ER, Conner EA, Factor VM, Levéen P, Larsson J, Karlsson S, Thorgeirsson SS. Intact signaling by transforming growth factor beta is not required for termination of liver regeneration in mice. Hepatology. 2004;40:1098-1105. [PubMed] [DOI] |
| 22. | Soares A, Govender L, Hughes J, Mavakla W, de Kock M, Barnard C, Pienaar B, Janse van Rensburg E, Jacobs G, Khomba G. Novel application of Ki67 to quantify antigen-specific in vitro lymphoproliferation. J Immunol Methods. 2010;362:43-50. [PubMed] [DOI] |
| 23. | Zhang Y, Zhang Y, Bone RN, Cui W, Peng JB, Siegal GP, Wang H, Wu H. Regeneration of pancreatic non-β endocrine cells in adult mice following a single diabetes-inducing dose of streptozotocin. PLoS One. 2012;7:e36675. [PubMed] [DOI] |
| 24. | Rahmanzadeh R, Hüttmann G, Gerdes J, Scholzen T. Chromophore-assisted light inactivation of pKi-67 leads to inhibition of ribosomal RNA synthesis. Cell Prolif. 2007;40:422-430. [PubMed] [DOI] |
| 25. | Schmidt SC, Schumacher G, Klage N, Chopra S, Neuhaus P, Neumann U. The impact of carbon dioxide pneumoperitoneum on liver regeneration after liver resection in a rat model. Surg Endosc. 2010;24:1-8. [PubMed] [DOI] |
| 26. | Granado-Serrano AB, Martín MA, Bravo L, Goya L, Ramos S. Quercetin modulates NF-kappa B and AP-1/JNK pathways to induce cell death in human hepatoma cells. Nutr Cancer. 2010;62:390-401. [PubMed] [DOI] |
| 27. | Poon RY, Toyoshima H, Hunter T. Redistribution of the CDK inhibitor p27 between different cyclin.CDK complexes in the mouse fibroblast cell cycle and in cells arrested with lovastatin or ultraviolet irradiation. Mol Biol Cell. 1995;6:1197-1213. [PubMed] |
| 28. | Iavarone A, Massagué J. Repression of the CDK activator Cdc25A and cell-cycle arrest by cytokine TGF-beta in cells lacking the CDK inhibitor p15. Nature. 1997;387:417-422. [PubMed] [DOI] |
| 29. | Riehle KJ, Dan YY, Campbell JS, Fausto N. New concepts in liver regeneration. J Gastroenterol Hepatol. 2011;26 Suppl 1:203-212. [PubMed] [DOI] |