修回日期: 2012-12-04
接受日期: 2012-12-17
在线出版日期: 2012-12-18
目的: 观察外周及延脑内侧网状结构注射大黄素、胃电起搏对新西兰白兔胃电的影响, 探讨大黄素对胃肠运动的作用机制.
方法: 采用外周注射及延脑内侧网状结构(P7、P8.5、P9.5、P11)脑立体定位微量注射大黄素、电刺激胃起步点, 胃浆膜双极四导联同步记录的方法, 分析胃体及胃窦部胃电的平均频率、相位差、负相位比率、波形对应率、幅度等指标.
结果: 外周注射大黄素胃体1(P = 0.031)、胃体2(P = 0.047)频率减慢, 胃体4(P = 0.035)波形对应率降低. 胃起搏可有效驱动胃电频率: 胃体1(P = 0.001)、胃体2(P = 0.021)频率明显加快, 胃体3相位差减小(P = 0.037), 胃体2负相位比率升高(P = 0.007), 胃体3(P = 0.001)、胃窦(P = 0.046)波形对应率降低. 大黄素对于胃起搏引起的效应并无作用, 但胃起搏可部分抑制大黄素引起的频率减慢. 中枢不同部位微量注射大黄素的作用: P7: 胃体2(P = 0.026)频率明显减慢; P8.5: 胃体1(P = 0.045)频率明显减慢, 阿托品可"翻转"大黄素引起的频率变慢效应; P9.5: 胃窦(P = 0.029)频率减慢; 而P11: 胃体1(P = 0.011)频率明显加快. 对照组中枢注射生理盐水, P7: 胃体2的频率加快(pH 8.5), 其余部位胃电没有变化.
结论: 胃起步点起搏对胃电的驱动效应明显. 外周注射大黄素对兔胃电主要起抑制作用, 而中枢注射大黄素在不同的部位表现出不同的效应.
引文著录: 黄伟锋, 张慧, 欧阳守, 卢春敬. 大黄素对兔胃电的影响及其作用机制. 世界华人消化杂志 2012; 20(35): 3417-3423
Revised: December 4, 2012
Accepted: December 17, 2012
Published online: December 18, 2012
AIM: To observe the effect of emodin on rabbit gastric electric activity (GEA) by microinjecting emodin in the medial reticular formation (MRF) of the medulla oblongata (MO) and injecting emodin in external system, and to discuss the possible mechanisms responsible for the effect of emodin on gastrointestinal movement.
METHODS: Rabbits were treated by intravenously injecting emodin in external system and microinjecting emodin in the MRF of MO, and giving electrical stimulation with a gastric pacemaker. Four pairs of bipolar Ag-AgCl electrodes were positioned under the serosa along the gastric greater curve to record GEA synchronously, and one pair of Pt stimulating electrodes were used for gastric pacing. The microinjection and stimulation of MRF were carried out using a brain stereo-localizer. Tested parameters included frequency (F), phase difference (PD), ratio of negative PD (RNPD) and corresponding rate of waves (CRW).
RESULTS: The normal frequency of GEA ranged from 3.48 to 3.77 cycles per minute (cpm) two hours after surgery, which could be driven by gastric pacing. The frequency of GEA at corpus 1 (P = 0.001) and corpus 2 (P = 0.021) and the RNPD of corpus 2 (P =0 .007) were increased, and the PD of corpus 3 (P = 0.037) and the CRW of corpus 3 (P = 0.001) and corpus 4 (P = 0.046) were decreased after pacing. Intravenous injection of emodin could decrease the frequency of corpus 1 (P = 0.031) and corpus 2 (P = 0.047) and the CRW of corpus 4 (P = 0.035), but had no effect on gastric electrical stimulation-driven GEA. The effects of emodin could be partly reversed by gastric pacing. Microinjection of 7 μL emodin could decrease the frequency of corpus 2 in P7 (P = 0.026), the frequency of corpus 1 in P8.5 (P = 0.045), which could be reversed by atropine, the frequency of antrum in P9.5 (P = 0.029), and greatly increased the frequency of corpus 1 in P11 (P = 0.011). In the control group, microinjection of 0.9% saline in P8.5, P9.5 and P11 had no effect on the GEA, except the frequency of corpus 2 in P7, which was increased (pH 8.5).
CONCLUSION: Gastric pacing had notable "driven effects" on the GEA. The GEA could be greatly inhibited by intravenous injection of emodin. The frequency and PD of the GEA were decreased by microinjection of emodin in MRF of nuclei raphe magnus (P7-P9.5). But in the P11, the frequency of the GEA was increased.
- Citation: Huang WF, Zhang H, Ou-Yang S, Lu CJ. Effect of emodin on rabbit gastric electric activity and mechanisms involved. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3417-3423
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3417.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3417
中药大黄(rhubarb)是中医临床常用的泻下药物, 他能抑菌、抗炎、抗氧化、保护肝肾、抑制血小板聚集、改善微循环、抗肿瘤等[1-5], 具有较好的临床应用价值. 经研究证实大黄素有很好的促胃肠动力的作用[6]. 对于大黄素促进胃肠动力的机制研究目前主要集中在通过升高胞内Ca2+浓度[7], 抑制钾通道[8], 抑制Na+, K+-ATP酶等途径, 激素、神经肽在大黄素促进胃肠动力方面也起到一定的作用[9-13]. 延脑内侧网状结构作为中枢神经系统一个很重要且很特殊的部位, 在调节胃肠道功能方面起重要作用[14,15]. 延脑内侧网状结构结构复杂, 其中中缝核区主要含有中缝大核(nucleus raphe magnus, Rm)、中缝苍白核(nucleus raphe palliduo, Rpa)、中缝隐核、中缝巨细胞核等多种核团. 延脑内侧网状结构存在着可使胃电产生兴奋、抑制、兴奋/抑制3种类型变化的结构[16-18]. 本实验考察大黄素对兔胃电活动的影响, 探讨大黄素对胃电活动调控的作用机制, 进而为临床新疗法及新药的开发提供理论依据.
大黄素购自宝鸡市虹源生物科技有限公司, 用DMSO助融(终浓度<0.1%), 终浓度为1 mg/mL, 用HCl调整PH值至8.5. 硫酸阿托品注射液、氯醛糖、乌拉坦等为国产分析纯. 健康新西兰白兔35只, 雌雄不限, 体质量2.0 kg±0.2 kg[中国生旺实验动物养殖有限公司, 生产许可证号: SCXK(沪)2002-0011].
1.2.1 手术: 术前禁食18 h以上, 可自由饮水. 耳缘静脉注射2%氯醛糖(40 mg/kg)与20%乌拉坦(0.5 g/kg)混合液. 腹部剪毛后, 从剑突下2 cm沿腹白线作一约10 cm的纵行切口, 尽量避开血管, 钝性分离, 暴露大部分胃. 胃浆膜下植入双极电极, 共埋5对. 第一对为刺激电极, 白金丝自制成针形, 埋于胃起步点上方, 负极在尾端, 正极在头端. 另外四对为记录电极, 为Ag-AgCl针形电极, 直径1 mm, 分别埋在胃起步点下方(胃体1)、胃大弯处(胃体2)、胃大弯与胃窦之间(胃体3)和胃窦(胃体4). 每对电极的双极间距离大约3-5 mm, 沿着胃环形肌方向与纵形肌相垂直, 用缝线作2点固定. 将兔头部固定于脑立体定位仪(日本成茂)上, 剪去颅顶毛. 用微型电钻在颅顶延人字缝, 分别在中缝大核(P7、P8.5、P9.5、P11)钻出4个小洞(尽量不要弄破脑膜, 使脑部少出血)以备微注射器的插入.
1.2.2 实验记录: (1)胃体部实验: 连接4对胃体记录电极到MP100WSW十六导生物信号采集分析系统, 动物术后恢复2-3 h后, 开始记录胃电, 作为正常对照. 耳缘静脉给予大黄素(4 mg/kg), 记录和观察此时胃电(同时设生理盐水组做对照). 然后以正弦波刺激胃体, 记录和观察此时的胃电. 待动物胃电恢复正常后, 先以正弦波刺激胃体, 再在耳缘静脉给予大黄素, 记录观察此时胃电; (2)脑部实验: 动物固定于脑立体定位仪, 按脑立体定位图谱分别在P7、P8.5、P9.5、P11插入注射器后待动物胃电稳定后记录一段胃电作为对照(应考虑脑注射器的插入对中缝核团的机械性刺激的影响). 待胃电恢复正常后, 在脑部通过微量注射器注射微量大黄素(生理盐水对照), 观察并记录1 h胃电变化. 在大黄素的有效作用时间内微量注射硫酸阿托品继续观察和记录胃电变化. 脑部实验全部结束后, 再在部分动物的脑刺激电极通以阳极电流损毁, 耳缘静脉注射含1%亚铁氰化钾溶的5%甲醛溶液. 待第2日刺激部位脑组织固定后, 做组织切片, 显微镜下观察刺激电极的真实位置(呈普鲁士兰的反应点).
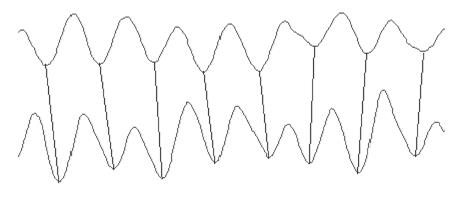
1.2.3 观察参数: (1)相位差: 四导同时记录胃起步点(胃体1)、胃体2、胃体3、胃窦部胃电, 以同一波形在该导出现时相对于起步点出现时的时间差计算. 如果远端波形落后于起步点者为正相位差, 先于起步点者为负相位差, 单位: s(图1); (2)波形对应率: 各导记录的波形与起步点记录的波形, 互相对应的波数占整体出现波数的比值; (3)负相位比率: 在每个记录中, 负相位差出现的次数占该记录中相位差总个数的比率; (4)平均频率: 稳定记录15 min平均每分钟出现波形的个数; (5)幅度(峰-峰, P-P)值: 选择稳定记录15 min的波形, 由Acqknowledge3.7自动处理生成, 本实验仅作效应类型参考, 不作统计学处理.
统计学处理 各组实验数据以mean±SD表示, 差异显著性检验用配对t检验, P<0.05为差异有统计学意义.
术后2 h恢复后的正常胃电频率为3.48-3.77 cpm, 与以往的实验相同. 相位差均为正值, 各项指标均正常(表1, 图2).
| 频率 | 相位差 | 负相位比率 | 波形对应率 | |
| 胃体1 | 3.60±0.36 | - | - | 0.91±0.08 |
| 胃体2 | 3.69±0.48 | 0.46±2.50 | 0.41±0.30 | 0.86±0.09 |
| 胃体3 | 3.48±0.33 | 1.03±3.89 | 0.37±0.32 | 0.84±0.11 |
| 胃窦 | 3.77±0.45 | 0.25±2.55 | 0.42±0.27 | 0.87±0.09 |
外周耳缘静脉注射大黄素(4 mg/kg)后胃体1(P = 0.031)、胃体2(P = 0.047)频率明显减慢, 胃窦(P = 0.035)波形对应率下降, 相位差和负相位比率变化不明显(表2). 注射大黄素对兔胃电主要起抑制作用.
外周注射生理盐水对照, 胃电频率、相位差等各项参数均未有明显变化(数据没有显示).
胃起步点给予正弦波刺激(胃起搏)后"驱动"效应明显(表3), 胃体1(P = 0.001)、胃体2(P = 0.021)频率明显加快, 胃体3相位差减小(P = 0.037), 胃体2负相位比率升高(P = 0.007), 胃体3(P = 0.001)、胃窦(P = 0.046)波形对应率降低.
从表4可以看出胃起搏后外周注射大黄素(4 mg/kg)对胃电活动没有显著影响.
| 频率 | 相位差 | 负相位比率 | 波形对应率 | |||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 3.93±0.40 | 3.90±0.57 | - | - | - | - | 0.90±0.09 | 0.92±0.08 |
| 胃体2 | 3.71±0.48 | 3.66±0.45 | 0.22±3.18 | 0.61±2.83 | 0.44±0.26 | 0.45±0.21 | 0.77±0.12 | 0.79±0.12 |
| 胃体3 | 4.09±0.68 | 3.96±0.65 | -0.75±2.21 | -0.27±2.34 | 0.58±0.27 | 0.53±0.26 | 0.85±0.09 | 0.85±0.09 |
| 胃窦 | 3.91±0.50 | 3.84±0.56 | 0.08±2.84 | -0.08±2.68 | 0.49±0.20 | 0.50±0.20 | 0.83±0.12 | 0.82±0.11 |
在耳缘静脉注射大黄素(4 mg/kg)的同时给予电刺激(表5), 兔胃体的频率均有所增大(胃体2: P = 0.001, 胃体3: P = 0.012), 但胃窦频率减小, 胃体相位差减小而胃窦相位差增大, 波形对应率几乎无变化. 可见胃起搏在胃体能恢复大黄素产生的抑制作用, 但在胃窦无此作用, 胃窦部仍维持大黄素的效应.
P7注射大黄素胃体部胃电频率多下降(表6), 以胃体2为著(P = 0.026), 相位差增大, 负相位比率降低, 波形对应率降低, 但对胃窦部胃电频率的作用似以兴奋为主. P7注射生理盐水后胃体2的频率明显加快(P<0.05)(数据没有显示), 这可能是由于本实验中未考虑pH值的影响, 将生理盐水pH值上调至8.5, 与大黄素的pH一样所致. 其余各导均无统计学意义.
| 频率 | 相位差 | 负相位比率 | 波形对应率 | |||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 3.62±0.31 | 3.60±0.35 | - | - | - | - | 0.92±0.07 | 0.92±0.09 |
| 胃体2 | 3.70±0.41 | 3.56±0.29a | 0.45±2.74 | 0.91±3.25 | 0.41±0.23 | 0.38±0.25 | 0.88±0.08 | 0.86±0.09 |
| 胃体3 | 3.55±0.32 | 3.49±0.26 | 0.45±3.28 | 1.45±4.00 | 0.37±0.27 | 0.31±0.28 | 0.87±0.07 | 0.86±0.10 |
| 胃窦 | 3.67±0.33 | 3.83±0.47 | 0.11±2.33 | 0.95±3.06 | 0.43±0.23 | 0.37±0.26 | 0.87±0.09 | 0.89±0.10 |
P8.5注射大黄素后胃体1频率明显减慢(P = 0.045), 其余3导无显著意义(表7), 此外注射大黄素后, 各导相位差减少, 负相位比率升高, 波形对应率下降但无统计学意义. 从表8可知, P8.5注射阿托品后, 胃体1频率增快(P = 0.032), 说明阿托品可"翻转"大黄素引起的频率变慢效应. P8.5注射生理盐水, 各导参数改变均没有统计学意义(数据没有显示).
| 频率 | 相位差 | 负相位比率 | 波形对应率 | |||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 3.70±0.36 | 3.62±0.42a | - | - | - | - | 0.93±0.07 | 0.91±0.10 |
| 胃体2 | 3.72±0.43 | 3.71±0.38 | 1.37±2.90 | 0.84±2.48 | 0.35±0.25 | 0.39±0.24 | 0.87±0.09 | 0.84±0.10 |
| 胃体3 | 3.63±0.36 | 3.65±0.44 | 1.31±3.51 | 0.43±3.42 | 0.32±0.25 | 0.39±0.30 | 0.83±0.11 | 0.83±0.10 |
| 胃窦 | 3.84±0.36 | 3.84±0.37 | 0.42±2.59 | -0.01±2.10 | 0.44±0.22 | 0.45±0.23 | 0.86±0.09 | 0.85±0.11 |
| 频率 | 相位差 | 负相位比率 | 波形对应率 | |||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 3.43±0.28 | 3.65±0.27a | - | - | - | - | 0.83±0.07 | 0.89±0.07 |
| 胃体2 | 3.76±0.42 | 3.83±0.34 | 1.10±1.98 | 1.21±1.87 | 0.34±0.21 | 0.34±0.15 | 0.77±0.08 | 0.84±0.07 |
| 胃体3 | 3.81±0.52 | 3.65±0.28 | 1.19±1.95 | 1.39±2.36 | 0.28±0.19 | 0.25±0.14 | 0.80±0.07 | 0.82±0.07 |
| 胃窦 | 4.03±0.31 | 3.85±0.48 | 0.79±1.57 | 1.77±2.01 | 0.43±0.19 | 0.31±0.17 | 0.78±0.09 | 0.80±0.07 |
P9.5注射大黄素除胃体2外, 胃体1、3和胃窦(P = 0.029)频率减慢. 其他参数改变没有统计学意义(表9). P9.5注射生理盐水, 各导参数改变均没有统计学意义(数据没有显示).
| 频率 | 相位差 | 负相位比率 | 波形对应率 | |||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 3.67±0.42 | 3.59±0.44 | - | - | - | - | 0.95±0.06 | 0.94±0.07 |
| 胃体2 | 3.63±0.35 | 3.66±0.44 | 0.10±2.95 | 1.27±3.05 | 0.38±0.28 | 0.35±0.29 | 0.88±0.09 | 0.89±0.10 |
| 胃体3 | 3.56±0.37 | 3.52±0.33 | 1.16±4.01 | 0.23±4.04 | 0.32±0.31 | 0.43±0.36 | 0.88±0.08 | 0.87±0.09 |
| 胃窦 | 3.82±0.39 | 3.67±0.25a | 0.53±2.08 | 0.06±2.43 | 0.42±0.26 | 0.44±0.24 | 0.90±0.07 | 0.87±0.10 |
P11注射大黄素除胃体3频率变慢外, 其余胃电频率变快(其中胃体1: P = 0.011), 相位差增大, 负相位比率均略降低, 但无统计学意义(表10). 说明P11微注射大黄素对胃电的影响与前几个脑平面有所不同. P11注射生理盐水, 各导参数改变均没有统计学意义(数据没有显示).
| 频率 | 相位差 | 负相位比率 | 波形对应率 | |||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 3.67±0.39 | 3.82±0.46a | - | - | - | - | 0.90±0.08 | 0.94±0.08 |
| 胃体2 | 3.76±0.38 | 3.81±0.53 | 1.24±2.88 | 1.62±2.99 | 0.39±0.27 | 0.37±0.28 | 0.87±0.07 | 0.86±0.07 |
| 胃体3 | 3.69±0.46 | 3.61±0.35 | 1.24±3.86 | 1.25±3.30 | 0.37±0.27 | 0.35±0.28 | 0.85±0.08 | 0.84±0.08 |
| 胃窦 | 3.84±0.39 | 3.92±0.39 | 0.96±2.06 | 1.18±1.68 | 0.41±0.19 | 0.38±0.17 | 0.87±0.10 | 0.87±0.11 |
实验中新西兰白兔正常胃电频率为3.48-3.77 cpm, 与以往实验结果相同, 说明在胃体埋植双极电极记录兔胃电的方法是可靠的. 相位差可能是表示胃电传导(扩布)的一个较好的指标. 4导同时记录胃体起步点(胃体1)、胃体2、胃体3和胃窦部胃电, 如果远端波形先于起步点者即为负相位差, 说明胃电传导(扩布)异常, 相位差若由负转正则说明胃电传导转向正常. 本研究不仅证实4导同时记录的正常胃电存在相位差(0.25-1.03 s), 根据以往的实验正常胃电相位差在2 s左右, 两者结果基本一致. 胃起步点电起搏、中枢电刺激、大黄素外周、中枢注射及本实验室前期实验中的多种神经阻断剂, 即中枢和外周诸多因素都可能影响相位差. 脑-肠轴共同对胃电传导(扩布)的精细调节, 是胃肠道正常功能活动的保障[19,20]. 此外, 我们发现, 外周或中枢刺激(胃起步点电起搏、大黄素注射), 致胃电相位差增大(或减小)时, 负相位差比率则降低(升高), 两者呈负相关关系.
胃体起步点起搏后胃体频率明显加快, 相位差减小, 负相位比率升高, 波形对应率降低, 进一步验证了前期的研究, 即胃起步点电起搏对胃电有很好的"驱动效应"[21-23]. 本研究波形变差, 可能是频率过快导致的节律紊乱. 外周注射大黄素胃体频率明显减慢. 胃窦波形对应率降低. 说明大黄素对胃电主要起抑制作用.
中枢神经系统对胃肠运动的调控起重要作用[24-26]. 当体内外环境变化时, 中枢调节能够使胃肠运动与人体各个器官系统之间的活动保持动态平衡、胃肠各段的运动、消化液的分泌、吸收、排泄等功能, 在空间和时间上能保持协调一致[27]. 近年来本课题组作了一系列中枢对胃电相位差的影响的实验: 观察心得安、酚妥拉明等神经阻断剂以及联合电刺激对胰高血糖素造模的胃节律紊乱动物模型相位差的影响, 初步表明以上阻断剂能改变胃电相位差等参数, 提示用于治疗胃节律紊乱综合征(gastric dysrhythmia syndrome, GDS)的可能; 本课题组研究还发现延脑内侧网状结构微量注射5-HT可以抑制胃运动和胃电[28,29]. 延脑内侧网状结构的5-HT递质可能参与中枢对胃电以及胃电起搏的调控. 哈尔滨医大陈香梅等[30]"家兔胃运动及胃电活动变化与Rm内不同药物微量注射的关系"的慢性实验, 在Rm微量注入5-HT、P物质可抑制家兔的胃运动和胃电慢波. Rm微量注入赛庚啶、P物质拮抗剂后可使家兔的胃运动和胃电慢波增强. Rm微量注入吗啡、去甲肾上腺素后对家兔的胃运动和胃电均无影响; Rm微量注入生理盐水(2 μL/min)对胃运动和胃电无影响. 本实验发现P8.5微量注射大黄素后胃体1频率明显减慢, 相位差减小, 当再注射阿托品后可"翻转"大黄素对胃电频率的抑制和相位差降低的效应. P8.5对应的结构是Rm核心部分, 说明Rm可能是大黄素在延脑内侧网状结构中的有效作用部位, 并与胆碱能受体有关. P7-P9.5微量注射大黄素主要起抑制作用(频率减慢)、P11微量注射大黄素则主要起兴奋作用(频率加快); 由于P7、P8.5、P9.5主要位于Rm, 而P11位于Rpa, 故我们推测可能是大黄素在不同的两个核团起不同的作用. 试验中个别动物注射pH 8.5的生理盐水(7 μL)也使胃体频率变快(P7: 胃体2变快), 是否与高pH、注入速度较快、颅内压增高有关有待进一步研究.
总之, 大黄素可通过外周和中枢两条途径起作用, 外周注射大黄素的效应以抑制为主. 本实验数据表明, 在胃体起步点行电起搏后, 胃体和胃窦的跟随效应明显. 另外, 实验发现每当胃电频率加快的同时, 相位差通常发生紊乱、波形对应率较差, 说明频率是影响相位差及波形的一个重要因素. 胃电活动的"跟随"可能有一个"调整"与"适应"的过程, 这对临床电起搏治疗功能性胃肠道疾病无疑具有很好的指导意义. 单纯P7-P9.5中缝大核处微量注射大黄素可抑制胃电, 但在P11中缝苍白核头端则使频率加快. P8.5中枢微量注射阿托品后可翻转大黄素的作用, 切断迷走神经后P8.5再注射大黄素对胃电抑制的影响减弱或转为兴奋, 相位差增大, 负相位比率减小, 提示大黄素在P8.5可能通过胆碱能途径起作用. 胃电相位差增大增大(或减小)时, 负相位差比率则降低(升高), 两者呈负相关关系. 此发现对临床诊断治疗有一定指导意义.
中药大黄是中医临床常用的泻下药物, 他能抑菌、抗炎、抗氧化、保护肝肾、抑制血小板聚集、改善微循环、抗肿瘤等, 具有较好的临床应用价值. 经研究证实大黄素有很好的促胃肠动力的作用.
任超世, 研究员, 中国医学科学院, 中国协和医科大学生物医学工程研究所; 竺亚斌, 研究员, 宁波大学医学院人体解剖与组胚学系
延脑内侧网状结构存在着可使胃电产生兴奋、抑制、兴奋/抑制3种类型变化的结构. 故本文以浆膜胃电各指标(包括独创的相位差指标)为研究对象, 考察中枢和外周注射大黄素对兔胃电活动的影响, 并探讨其作用机制.
大黄素促进胃肠动力的机制研究目前主要集中在通过升高胞内Ca2+浓度, 抑制钾通道, 抑制Na+, K+-ATP酶等途径, 激素, 神经肽在大黄素促进胃肠动力方面也起到一定的作用. 延脑内侧网状结构作为中枢神经系统一个很重要且很特殊的部位, 在调节胃肠道功能方面起重要作用.
以胃浆膜电为研究对象, 观察中枢和外周注射大黄素对胃电的影响及其与胃起搏、中枢电刺激对胃电的相互作用. 进一步证实胃起步点电起搏对胃电有很好的"驱动效应".
以中枢神经为靶点可以作为治疗胃肠道疾病的一个途径, 大黄素可以用于治疗功能性胃肠道疾病.
相位差: 4导同时记录胃起步点(胃体1)、胃体2、胃体3、胃窦部胃电, 以同一波形在该导出现时相对于起步点出现时的时间差计算. 如果远端波形落后于起步点者为正相位差, 先于起步点者为负相位差, 单位: s.
本文选题好, 研究具有一定的新颖性和科学价值.
编辑: 田滢 电编:闫晋利
| 1. | Lu C, Chen Y, Zeng Z. [Research progress of the anti-proliferation effect of emodin on VSMCs]. Zhongguo Zhongyao Zazhi. 2012;37:417-420. [PubMed] |
| 2. | Xia QS, Sun RY, Xiu RJ. [Progress of research on molecular mechanisms in antitumor effect of emodin]. Zhongguo Zhongxiyi Jiege Zazhi. 2009;29:85-88. [PubMed] |
| 3. | Li F, Wang SC, Wang X, Ren QY, Wang W, Shang GW, Zhang L, Zhang SH. [Novel exploration of cathartic pharmacology induced by rhubarb]. Zhongguo Zhongyao Zazhi. 2008;33:481-484. [PubMed] |
| 4. | Xu XC, Lin SZ. [Experimental advance of applying emodin for prevention and treatment of liver diseases]. Zhongguo Zhongxiyi Jiehe Zazhi. 2008;28:91-93. [PubMed] |
| 5. | Srinivas G, Babykutty S, Sathiadevan PP, Srinivas P. Molecular mechanism of emodin action: transition from laxative ingredient to an antitumor agent. Med Res Rev. 2007;27:591-608. [PubMed] [DOI] |
| 7. | 戴 芸. 钙离子在胃肠平滑肌收缩机制中的作用. 国外医学·消化系疾病分册. 2002;22:17-20. |
| 10. | Garay RP. [Cellular mechanisms of smooth muscle contraction]. Rev Mal Respir. 2000;17:531-533. [PubMed] |
| 19. | 张 莉华, 方 步武. 脑肠轴及其在胃肠疾病发病机制中的作用. 中国中西医结合外科杂志. 2007;13:199-201. |