修回日期: 2012-11-22
接受日期: 2012-11-28
在线出版日期: 2012-12-08
目的: 探讨慢性HBV感染者外周血单个核细胞IL-22和IL-17 mRNA表达及其对病情转归的影响.
方法: 以慢性乙型肝炎中度患者33例、重度患者21例、重型肝炎患者16例、乙型肝炎肝硬化患者16例和健康对照10例为研究对象, 采用RT-PCR方法检测患者外周血单个核细胞IL-22和IL-17 mRNA的表达.
结果: CHB中度、CHB重度和肝硬化患者IL-22表达水平无统计学意义, 但均高于健康对照组, 差异有统计学意义(P = 0.000); 而重型肝炎患者IL-22表达水平低于该3组患者, 高于健康对照组, 但差异无统计学意义(P = 0.064). 各组IL-17表达水平相似但均高于健康对照组, 差异有统计学意义(P = 0.000); 重型肝炎患者IL-17表达水平均低于其他3组患者, 与CHB中度患者比较差异有统计学意义(P = 0.014), 与CHB重度和肝硬化患者比较差异无统计学意义(P = 0.172, 0.968).
结论: IL-22的下调不利于肝细胞损伤后的修复, IL-22分泌的增加对减轻肝组织的损伤特别是重型肝炎的恢复可能是有意义的. 慢性HBV感染患者IL-17均明显升高, 提示其可能参与慢性HBV感染肝组织炎症的发生, 且对慢性肝病纤维化起一定作用.
引文著录: 杨智, 陈洪涛, 张毅, 吴诗品. IL-22和IL-17 mRNA在慢性HBV感染者PBMCs中的表达及其意义. 世界华人消化杂志 2012; 20(34): 3380-3384
Revised: November 22, 2012
Accepted: November 28, 2012
Published online: December 8, 2012
AIM: To detect the expression of IL-22 and IL-17 mRNAs in peripheral blood mononuclear cells (PBMCs) from patients with chronic hepatitis B (CHB) infection and to analyze their significance in the pathogenesis of CHB.
METHODS: Thirty-three patients with moderate CHB, 21 patients with severe CHB, 16 patients with liver failure, and 16 cirrhotic patients were enrolled in the study. Ten healthy volunteers were used as controls. RT-PCR method was used to detect the expression of IL-22 and IL-17 mRNAs in PBMCs from these subjects.
RESULTS: IL-22 expression in PBMCs from patients with moderate CHB, severe CHB, or cirrhosis was comparable, but all was higher than that from controls (P = 0.000). IL-22 expression in PBMCs from patients with liver failure was significantly lower than that from other three groups of patients (P = 0.000). IL-17 expression in PBMCs from four groups of patients was higher than that from controls (P = 0.000). IL-17 expression in PBMCs from patients with liver failure was slightly lower than that from other three groups of patients, although no statistical difference was found.
CONCLUSION: Down-regulation of IL-22 is unfavorable to repair of hepatic cells after liver injury. Up-regulation of IL-22 expression may be important in alleviating liver damage. IL-17 levels in patients infected with HBV are increased significantly. IL-17 may participate in the inflammatory process in chronic HBV infection and play an important role in development of liver fibrosis.
- Citation: Yang Z, Chen HT, Zhang Y, Wu SP. IL-22 and IL-17 mRNA expression in PBMCs from patients with chronic hepatitis B virus infection. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3380-3384
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3380.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3380
大量资料表明[1,2], 乙型肝炎病毒(hepatitis B virus, HBV)本身并不引起肝细胞的损害, 肝细胞破坏的主要机制在于机体的免疫学损伤. IL-22和IL-17可同时由Th17细胞分泌, 在各种慢性炎症性患者的损害部位都会上调, 可能在炎症过程中起着相似的作用. IL-22是一种特殊的免疫调节因子, 同IL-10、IL-19、IL-20、IL-24等白介素类似, 具有22%的同源氨基酸序列, 同归为IL-10家族成员[3,4]. 其具有一异源性二聚体受体, 分别由IL-10受体β链(IL-10R2)和IL-22R1两条链组成[3-7], 而IL-22结合的特异性仅由IL-22R1决定. IL-22主要由Th22、Th1和Th17细胞分泌, 作用对象不是免疫细胞, 而是胰腺、皮肤等表达IL-22R1的组织细胞[3,4]. IL-22也作用于肝脏细胞, 但是IL-22对肝脏作用的分子机制到目前为止仍不清楚.
IL-17是一种强大的前炎症细胞因子, 也是炎症反应的微调因子(fine-tuning cytokine), 能够与多种细胞因子产生协同作用以放大炎症反应. IL-17不仅可以诱导多种细胞因子的产生, 同时可以促进多种细胞的成熟与分化. 已有研究[8]证实转化生长因子-β(transforming growth factor-β,TGF-β)、IL-6、IL-1、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等细胞因子在慢性乙型肝炎(chronic hepatitis B, CHB)中有重要的促进纤维化作用. IL-17与这几种细胞因子之间存在着密切的生物学关系. IL-17具有强大的免疫致病性, 可以促进T细胞的激活和刺激成纤维细胞、内皮细胞、巨噬细胞、上皮细胞产生多种致炎因素(包括IL-1、IL-6、TNF-α、NOS-2、金属蛋白酶和化学增活素), 导致炎症的发生[9,10]. 研究发现CHB患者IL-17水平升高, 提示其参与了CHB炎症的发生, 本研究探讨慢性HBV感染者外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)IL-22和IL-17 mRNA的表达及其对病情转归的影响.
86例慢性HBV感染者均来自2011-04/10暨南大学医学院附属深圳市人民医院感染内科病房住院患者, 诊断均符合2000年西安全国第十次病毒性肝炎及肝病学术会议修订的"病毒性肝炎防治方案"标准[11]. 所有患者均除外其他病毒性肝炎、HIV感染、自身免疫性肝炎等. 其中CHB中度患者33例, CHB重度患者21例, 重型肝炎患者16例, 乙型肝炎肝硬化患者16例. 同时以年龄和性别均匹配的健康对照10例, 为来自本科室的健康人群. 淋巴细胞分离液购自天津市GBD公司; RT试剂盒、PCR试剂盒、DNA Marker均购自美国Fermetas公司; 引物由天津金斯瑞公司合成; PCR仪由德国EPPENDORF公司提供; 电泳仪、凝胶成像分析系统由美国BIORAD公司提供.
1.2.1 标本采集和处理: 抽取患者和健康对照人群外周静脉血3-4 mL, 用常规淋巴细胞分层液密度梯度离心法分离PBMCs. 用总RNA提取试剂盒提取总RNA, -20 ℃保存.
1.2.2 PCR引物设计: 根据GeneBank检索的基因序列, 利用Premier 5软件分别设计IL-22、IL-17和β-actin引物(本实验使用β-actin为内部参照系统), 所有引物由天津金斯瑞公司公司合成. IL-22的上游引物序列为: 5'-TCTTGGTACAGGGAGGAGC-3', 下游引物序列为: 5'-CCTATCAGATTGAGGGAAC-3', 扩增片段长度为254 bp. IL-17的上游引物序列为: 5'-GCAGGCACAAACTCATCCAT-3', 下游引物序列为: 5'-GGGCGAAAATGGTTACGAT-3', 扩增片段长度为366 bp. β-actin的上游引物序列为: 5'-CGGGAAATCGTGCGTGACAT-3', 下游引物序列为: 5'-CAGGAAGCAAGGCTGGAAGA-3', 扩增片段长度为186 bp.
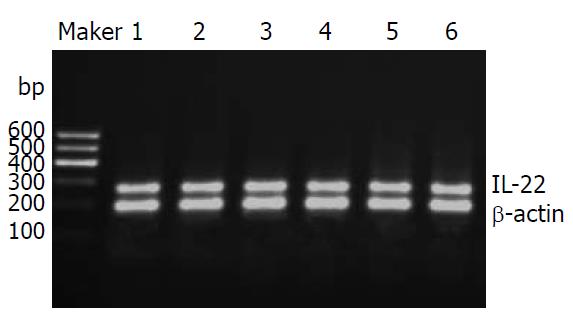
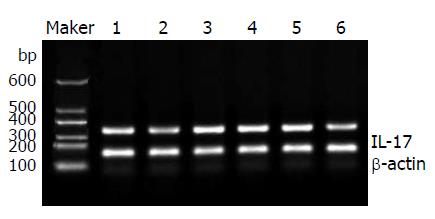
1.2.3 IL-22和IL-17的检测: RT-PCR方法, 以提取的总RNA 12 μL为模板合成cDNA, 以cDNA 为模板分别扩增IL-22和IL-17基因片段, 并以β-actin作为内部参照系统. PCR采用同管扩增法, 反应步骤: 每管先加入目的基因上下游引物各1 μL, 加入内参β-actin的上下游引物各0.1 μmol(1 μL), 进行PCR反应30个循环, 即得PCR产物. PCR反应条件为: 94 ℃, 2 min(启动); 94 ℃, 30 s(变性); 57 ℃, 30 s(退火); 72 ℃, 45 s(延伸); 再从变性开始循环共30次. 72 ℃, 最后一循环延伸5 min. PCR产物在1.5%的琼脂糖凝胶中电泳, 在凝胶成像系统中拍照分析.
统计学处理 所有资料均采用SPSS19.0统计软件分析. 结果的表达采用mean±SD, 2组间均数的比较采用两样本t检验, 多组间的均数比较采用单因素方差分析(one-way analysis of variance, one-way ANOVA), 并进一步行基于方差分析的多重比较(Tamhane's T2法), 相关关系采用Pearson相关性分析. 检测水准为α = 0.05, 采用双侧检验.
研究对象的临床资料见表1.
| 中度CHB | 重度CHB | 重型肝炎 | 乙型肝炎肝硬化 | 健康对照 | |
| n | 33 | 21 | 16 | 16 | 10 |
| 年龄(岁) | 31(16-65) | 32(18-61) | 41(26-64) | 48(27-73) | 35(25-55) |
| 性别(男/女) | 22/11 | 15/6 | 16/0 | 13/3 | 4/6 |
| ALT(U/L) | 260(45-673) | 823(156-1894) | 913(66-2093) | 98(25-464) | - |
| HBV-DNA(copies/mL) | 2.54×107 | 2.92×107 | 6.45×107 | 9.77×106 | - |
| HBeAg阳性(n) | 22 | 16 | 9 | 6 | - |
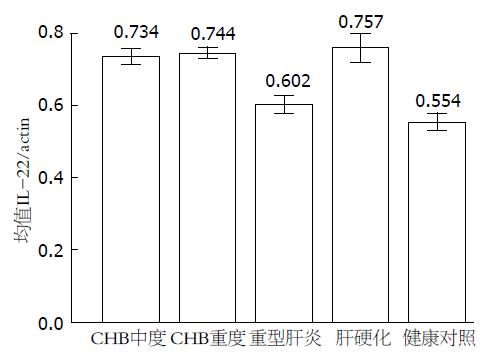
中度、重度CHB患者及肝硬化患者IL-22表达无统计学意义, 但均高于健康对照组(P = 0.000); 而重型肝炎患者IL-22表达水平低于该3组患者, 差异有统计学意义(P = 0.000); 重型肝炎患者IL-22表达水平高于健康对照组, 但差异无统计学意义(P = 0.064, 图1, 2, 表2).
| n | IL-22 | IL-17 | |
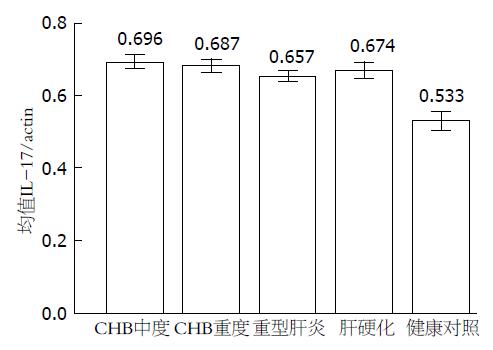
| CHB中度 | 33 | 0.734±0.062 | 0.696±0.049 |
| CHB重度 | 21 | 0.744±0.036 | 0.687±0.043 |
| 重型肝炎 | 16 | 0.602±0.041 | 0.657±0.026 |
| 肝硬化 | 16 | 0.757±0.064 | 0.674±0.039 |
| 健康对照 | 10 | 0.554±0.033 | 0.533±0.036 |
| F值(Welch校正) | 248.033 | 23.982 | |
| P值 | <0.001 | <0.001 |
肝脏是一重要的消化器官, 但同时也具有淋巴样器官的功能[12]. 目前除了IL-22对角化细胞及其他上皮细胞的影响外, 其对肝细胞的影响也逐渐被证明[3-5]. 有研究证明, IL-22在肝损伤中具有直接的保护作用. Radaeva等[13]运用Con-A诱导的肝炎模型(这一模型与大量激活T细胞渗透及IL-22产生相关联), 发现用IL-22预处理可减轻Con-A的效应, 而一起注射Con-A和IL-22中和抗体, 则增强Con-A的效应. Zenewicz等[4]通过缺乏IL-22的小鼠模型, 证实了在急性肝脏炎症时IL-22对肝细胞提供保护作用. 缪晓辉等[6]在研究经IL-22刺激后肝细胞内信号传导变化时发现, IL-22在体外试验中促进了肝细胞分泌IL-6及TNF-α, 而IL-6和TNF-α是肝部分切除后启动、促进肝细胞再生最为主要的细胞因子之一[14-17]. 这些研究均得出类似的实验结果: 在急性肝脏炎症时, IL-22对肝细胞提供保护作用, 有利于肝脏炎症的恢复. 本试验发现, 在慢性HBV感染时, IL-22分泌增加, 表明在慢性HBV感染时IL-22参与肝脏的免疫病理过程. 肝炎急性加重期, 特别是重型肝炎时, IL-22的表达水平明显低于中重度慢性乙型肝炎, 表明IL-22分泌减少可能不利于肝细胞损伤后的修复, 而其分泌的增加对减轻肝组织的损伤特别是重型肝炎的恢复可能是非常有意义的, 在众多影响乙型肝炎的免疫因素中起着一定的作用.
何波等[18]研究发现IL-17在自身免疫性肝炎患者肝组织中的表达有明显升高. 邢直直等[19]研究发现, 与正常对照组相比, 慢性HBV感染者外周血IL-17表达水平升高, 肝硬化组尤其明显. 唐永明等[20]研究发现, 在各种慢性肝病的发病过程中, IL-17均有明显升高, 肝纤维化患者血清中IL-17表达水平与肝纤维化程度及透明质酸、层粘连蛋白、Ⅳ型胶原蛋白水平存在密切关系. 众多研究发现IL-17广泛参与了慢性肝病的发病及抗病毒免疫. IL-17属促炎因子, 在炎性反应、自免疾病、肿瘤和移植排斥中发挥重要作用. 他是一种前炎性细胞因子, 具有强大的招募中性粒细胞,促进多种细胞释放炎性因子等多种生物学作用. 传统免疫学认为, IFN-γ主是Th1细胞分泌, 而Th17和Th1是互相拮抗的Th细胞亚群[21,22]. 本研究发现慢性HBV感染患者IL-17均明显升高, 提示其可能参与慢性HBV感染炎症的发生及促进肝纤维化化的发展. 其中重型肝炎IL-17的表达较其他组低, 可能重型肝炎患者Th1细胞反应增强, IFN-γ表达增加, IFN-γ对Th17有强烈的抑制作用, 使得Th17不能大量繁殖.
研究显示, IL-22和IL-17在各种慢性炎症性疾病患者的损害部位都会上调, 如银屑病、炎症性肠病和类风湿性关节炎等, 他们可能在炎症过程中起着相似的作用. IL-22和IL-17能同时被Th17细胞分泌, 有研究显示, IL-22与IL-17有协同作用促进炎性发应造成组织的损伤, 2者共同表达可以认为是自身攻击性T细胞的标志[23]. Aujla等[24]发现尽管IL-22和IL-17在肺部都调节CXC趋化因子和粒细胞克隆刺激因子的产生, 但仅IL-22能增加肺部上皮细胞的增殖和增加对损伤上皮的抵抗能力. 另有研究[25,26]发现尽管IL-17如同IL-22一样, 在conA诱导的肝脏炎症中被诱导, 但IL-17在疾病的发病机理中未起到可观察到的保护作用, 只有产生IL-22的Th17细胞, 而不是缺乏表达IL-22的Th17细胞具有肝细胞的保护作用. 因此, 尽管IL-22和IL-17被炎症T细胞同时表达, 但他们并非都在慢性HBV感染中起着保护作用: 本研究发现, IL-22和IL-17在慢性肝炎中重度及重型肝炎患者中表达水平均升高, 且在重型肝炎患者的表达水平比其他2组都偏低, 但IL-22的表达与其他2组差别有显著统计学意义, 而IL-17的表达水平与其他2组比较差别无明显统计学意义. 我们推论, IL-22分泌的增加对肝细胞的修复起着一定的作用, 而IL-17未起到明确的肝细胞保护作用. 而IL-22和IL-17在肝硬化患者中的表达水平均升高, 因此2者对肝纤维化的发展均有一定作用: IL-22的作用体现在肝脏炎症急性加重时, 对肝细胞起到保护作用, 使肝脏炎症得以缓解, 但同时使患者清除病毒的能力下降, 从而使病情进入慢性迁延期; IL-17的作用体现在与IFN-γ的相互拮抗作用, 使Th1细胞反应减弱, 病情进入慢性迁延期.
总之, IL-22的下调不利于肝细胞损伤后的修复, IL-22分泌的增加对减轻肝组织的损伤特别是重型肝炎的恢复可能是有意义的. 慢性HBV感染患者IL-17均明显升高, 提示其可能参与慢性HBV感染肝组织炎症的发生, 且对肝病慢性纤维化起着一定作用, 但未起到明确的肝细胞保护作用. IL-22和IL-17可由相同的T细胞(Th17细胞)分泌, 且在各种慢性炎症性疾病患者的损害部位都会上调, 其对慢性HBV感染者的病情转归的作用尚待进一步深入研究.
大量资料表明, 乙型肝炎病毒(HBV)本身并不引起肝细胞的损害, 肝细胞破坏的主要机制在于机体的免疫学损伤. IL-22和IL-17可同时由Th17细胞分泌, 在各种慢性炎症性患者的损害部位都会上调, 可能在炎症过程中起着相似的作用. 本研究探讨慢性HBV感染者外周血单个核细胞IL-22和IL-17 mRNA的表达及其对病情转归的影响.
朱传武, 主任医师, 第五人民医院传染科
IL-22和IL-17可由相同的T细胞(Th17细胞)分泌, 且在各种慢性炎症性疾病患者的损害部位都会上调, 其对慢性HBV感染者的病情转归的作用尚待进一步深入研究.
目前除了IL-22对角化细胞及其他上皮细胞的影响外, 其对肝细胞的影响也逐渐被证明. 有研究证明, IL-22在肝损伤中具有直接的保护作用. 何波等研究发现IL-17在自身免疫性肝炎患者肝组织中的表达有明显升高.
本文探讨了慢性HBV感染者不同临床诊断患者间PBMCs中IL-22和IL-17 mRNA的水平与肝脏损害程度间的关系, 有一定的临床意义.
编辑: 李军亮 电编:闫晋利
| 1. | Lee WM. Hepatitis B virus infection. N Engl J Med. 1997;337:1733-1745. [PubMed] [DOI] |
| 2. | Rehermann B, Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection. Nat Rev Immunol. 2005;5:215-229. [PubMed] [DOI] |
| 3. | Wolk K, Witte E, Witte K, Warszawska K, Sabat R. Biology of interleukin-22. Semin Immunopathol. 2010;32:17-31. [PubMed] [DOI] |
| 4. | Zenewicz LA, Yancopoulos GD, Valenzuela DM, Murphy AJ, Karow M, Flavell RA. Interleukin-22 but not interleukin-17 provides protection to hepatocytes during acute liver inflammation. Immunity. 2007;27:647-659. [PubMed] [DOI] |
| 5. | Trifari S, Kaplan CD, Tran EH, Crellin NK, Spits H. Identification of a human helper T cell population that has abundant production of interleukin 22 and is distinct from T(H)-17, T(H)1 and T(H)2 cells. Nat Immunol. 2009;10:864-871. [PubMed] [DOI] |
| 8. | Casini A, Pinzani M, Milani S, Grappone C, Galli G, Jezequel AM, Schuppan D, Rotella CM, Surrenti C. Regulation of extracellular matrix synthesis by transforming growth factor beta 1 in human fat-storing cells. Gastroenterology. 1993;105:245-253. [PubMed] |
| 10. | Nakae S, Saijo S, Horai R, Sudo K, Mori S, Iwakura Y. IL-17 production from activated T cells is required for the spontaneous development of destructive arthritis in mice deficient in IL-1 receptor antagonist. Proc Natl Acad Sci U S A. 2003;100:5986-5990. [PubMed] [DOI] |
| 13. | Radaeva S, Sun R, Pan HN, Hong F, Gao B. Interleukin 22 (IL-22) plays a protective role in T cell-mediated murine hepatitis: IL-22 is a survival factor for hepatocytes via STAT3 activation. Hepatology. 2004;39:1332-1342. [PubMed] [DOI] |
| 14. | Cressman DE, Greenbaum LE, DeAngelis RA, Ciliberto G, Furth EE, Poli V, Taub R. Liver failure and defective hepatocyte regeneration in interleukin-6-deficient mice. Science. 1996;274:1379-1383. [PubMed] [DOI] |
| 15. | Fausto N. Liver regeneration and repair: hepatocytes, progenitor cells, and stem cells. Hepatology. 2004;39:1477-1487. [PubMed] [DOI] |
| 16. | Trautwein C, Rakemann T, Niehof M, Rose-John S, Manns MP. Acute-phase response factor, increased binding, and target gene transcription during liver regeneration. Gastroenterology. 1996;110:1854-1862. [PubMed] [DOI] |
| 17. | Yamada Y, Kirillova I, Peschon JJ, Fausto N. Initiation of liver growth by tumor necrosis factor: deficient liver regeneration in mice lacking type I tumor necrosis factor receptor. Proc Natl Acad Sci U S A. 1997;94:1441-1446. [PubMed] [DOI] |
| 21. | Afzali B, Lombardi G, Lechler RI, Lord GM. The role of T helper 17 (Th17) and regulatory T cells (Treg) in human organ transplantation and autoimmune disease. Clin Exp Immunol. 2007;148:32-46. [PubMed] [DOI] |
| 22. | Dong C. TH17 cells in development: an updated view of their molecular identity and genetic programming. Nat Rev Immunol. 2008;8:337-348. [PubMed] [DOI] |
| 23. | Zheng Y, Danilenko DM, Valdez P, Kasman I, Eastham-Anderson J, Wu J, Ouyang W. Interleukin-22, a T(H)17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis. Nature. 2007;445:648-651. [PubMed] [DOI] |
| 24. | Aujla SJ, Chan YR, Zheng M, Fei M, Askew DJ, Pociask DA, Reinhart TA, McAllister F, Edeal J, Gaus K. IL-22 mediates mucosal host defense against Gram-negative bacterial pneumonia. Nat Med. 2008;14:275-281. [PubMed] [DOI] |
| 25. | Li J, Qiu SJ, She WM, Wang FP, Gao H, Li L, Tu CT, Wang JY, Shen XZ, Jiang W. Significance of the balance between regulatory T (Treg) and T helper 17 (Th17) cells during hepatitis B virus related liver fibrosis. PLoS One. 2012;7:e39307. [PubMed] [DOI] |
| 26. | Zhang Y, Cobleigh MA, Lian JQ, Huang CX, Booth CJ, Bai XF, Robek MD. A proinflammatory role for interleukin-22 in the immune response to hepatitis B virus. Gastroenterology. 2011;141:1897-1906. [PubMed] [DOI] |