修回日期: 2012-11-02
接受日期: 2012-12-03
在线出版日期: 2012-12-08
目的: 分析miR-106a在肠癌中的表达并研究其在肠癌细胞侵袭中的作用.
方法: 提取52例肠癌手术标本及其癌旁组织中总RNA, PCR法检测miR-106a在肠癌及其癌旁正常组织中的表达量, 分析其与临床病理特征关系, 并进一步采用Transwell侵袭小室检测其在大肠癌细胞侵袭中的作用.
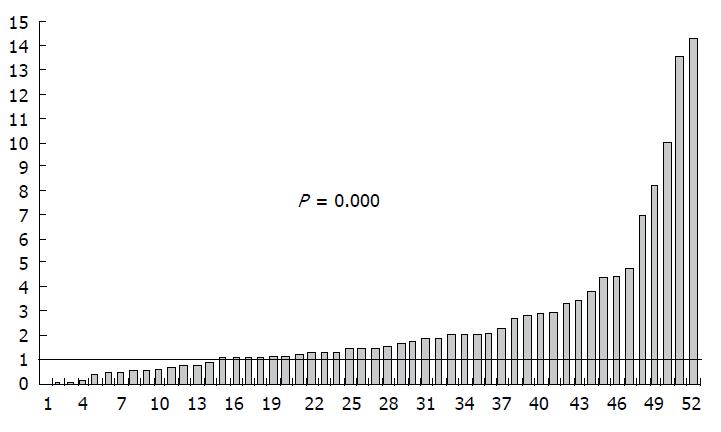
结果: 经2-△△Ct计算, 肠癌组织miR-106a表达量为2.50(0.017-14.269), 其中73%(38/52)大肠癌组织miR-106a高表达(Z = -3.748, P = 0.000), miR-106a的高表达与TNM分期(t = 2.813, P = 0.003)和淋巴结转移(t = -2.635, P = 0.008)有关, TNM分期较高和有淋巴结转移者, miR-106a表达较高. Transwell侵袭小室检测表明, 过表达miR-106a可促进肠癌细胞侵袭作用(均P = 0.000).
结论: miR-106a表达上调可能与大肠癌的发生及其转移相关.
引文著录: 马群英, 王新颖, 李钊, 姜泊, 许岸高. miR-106a在大肠癌中的表达及其与肠癌细胞侵袭的关系. 世界华人消化杂志 2012; 20(34): 3370-3374
Revised: November 2, 2012
Accepted: December 3, 2012
Published online: December 8, 2012
AIM: To assess the clinical significance of expression of miR-106a in colorectal cancer (CRC), and to investigate the effect of miR-106a overexpression on CRC cell invasion.
METHODS: Total RNA was extracted from 52 surgical CRC specimens and matched tumor-adjacent tissue specimens. MiR-106a expression was detected by real-time PCR, and its clinical significance was analyzed. Cell invasion assay was used to study the effect of miR-106a overexpression on CRC cell invasion.
RESULTS: The mean level of miR-106a in CRC tissues, as revealed by the 2-△△Ct method, was 2.50 (0.017-14.269), which was significant higher than that in tumor-adjacent tissues (Z = -3.597, P < 0.01). The expression of miR-106a was correlated with TNM stag (t = 2.813, P = 0.003) and lymph node metastasis (Z = -2.635, P = 0.008). Overexpression of miR-106a induced cell invasion (P = 0.000).
CONCLUSION: Up-regulation of miR-106a may play a role in tumorigenesis and metastasis of colorectal cancer.
- Citation: Ma QY, Wang XY, Li Z, Jiang B, Xu AG. Expression of miR-106a in colorectal cancer and its relation with tumor cell invasion. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3370-3374
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3370.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3370
microRNAs(miRNAs)是一种长为21-25 nt的单链RNA, 在进化上具有高度的保守性. 在动物中, 他们通过与靶标mRNA不完全互补配对抑制蛋白翻译, 调节内源基因表达, 且在基因表达调控中扮演重要角色. 动物中miRNA与靶标mRNA不完全配对结合, 同一miRNA可调控不同mRNA而不影响其完整性. 因而一种miRNA改变, 可影响多种蛋白翻译和信号通道, 参与细胞生长、增殖、分化、凋亡等过程的调控[1-3]. Calin等[4]于2002年首次发表文章, 将miRNAs与癌症联系起来. 随后, 大量研究证实miRNAs可能作为一种新的方法, 应用于肿瘤的筛查、诊断、预后和化疗反应预测等各个方面[5-7]. 本文通过探针法逆转、实时定量PCR检测52例肠癌中miR-106a的表达, 分析其与分期及其他临床病理特征的关系, 研究其在肠癌细胞侵袭中的作用.
惠州中心医院外科手术切除的新鲜肠癌组织及其相应癌旁正常组织52对, 术后经病理检查确证. 组织获得后立即置于-80 ℃超低温冰箱. 所有患者术前均未行放疗、化疗与免疫治疗. TNM分期以美国癌症联合委员会(American joint committee on cancer, AJCC)/国际抗癌联盟(international union against cancer, UICC)结直肠癌TNM分期系统(第六版)为标准. TRIzol试剂、Lipofactmine 2000、OPTI-MEM均购自Invitrogen; miR106a RT Primer、miR106a Real time、U6 RT Primer、U6 Real time、2×PCR TaqMan Universal PCR, TaqManMicroRNA Reverse Transcription kit均购自ABI公司; Matrigel基质胶和8 μm Transwell小室均购自美国BD公司; HCT116和LoVo细胞系购自上海细胞库, 为南方医院消化病实验室细胞培养室保存; 阴性对照和miR-106 mimics购自上海吉玛公司.
1.2.1 组织总RNA提取: -80 ℃超低温冰箱保存组织称取30 mg, 于冰上碾磨器磨碎, 加入1 mL TRIzol试剂, 按说明书操作提取总RNA, Nanodrip(ND-1000, USA)检测RNA溶液A260/280比值及浓度, 取A260/280在1.8-2.1者用于进一步试验.
1.2.2 cDNA合成及Real-time PCR: 取100 ng总RNA按试剂说明书操作逆转录cDNA, 反应条件: 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min. 然后按2×PCR TaqManUniversal PCR试剂盒说明, 以miR-106a和U6第一链为模板, 用miR-106a和U6荧光探针为引物扩增. 以上荧光PCR检测均在ABI PRISM 7500(Applied Biosystems, USA)型荧光定量PCR仪操作完成, 所有反应设立3个复孔, 检测方法为相对定量分析2-△△Ct法.
1.2.3 细胞培养: HCT116和LoVo细胞培养于10%胎牛血清、双抗的RPMI 1640培养基中. 细胞均接种于12孔板中, 细胞密度约30%-50%. 按转染试剂Lipo2000说明书分空白转染组、阴性对照组和miR-106 mimics组3组分别转染. 转染后24 h消化细胞备用.
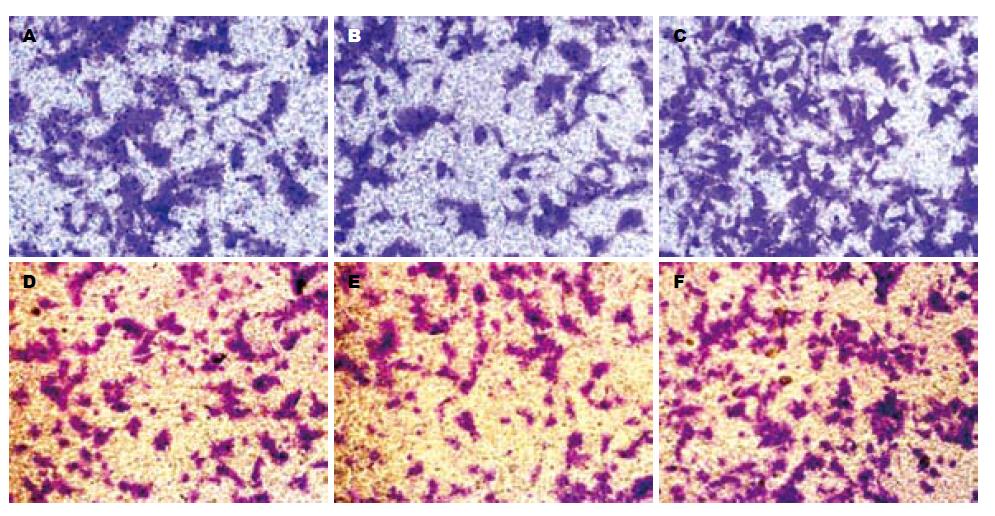
1.2.4 Transwell小室侵袭实验: 冰上融化Matrigel和不含血清的RPMI 1640培养基按1:7混合, 均匀铺于8 μm的Transwell上室面, 不同处理组别细胞培养24 h后消化, 重悬, 接种200 μL无血清培养基稀释的细胞(5×105个/mL), 下室加入含10%FBS的RPMI 1640培养基. 细胞培养36 h后终止培养. 医用棉签擦掉上室内细胞, 重复2次, 4%多聚甲醛固定, 0.1%结晶紫染色, PBS洗净后显微镜下低倍视野观察细胞数, 每小室随机取5个视野, 并记录每个视野细胞数.
统计学处理 用SPSS13.0软件进行. 组织miR-106a数据不符合正态分布, 均采用非参数检验. 配对资料采用配对资料的wilcoxon符号秩和检验(wilcoxon signed-rank test), miRNAs与其他临床病理资料的检验2组之间比较采用Mann-whitney检验, 分析miRNAs与等级变量相关关系采用Jonchheere-Terpstra检验. 细胞实验中多组间比较采用单因素方差分析(one-way analysis of variance, one-way ANOVA), 如方差齐, 多组间两两比较采用Bonferroni法; 如方差不齐, 多组间两两比较采用Tamhane's T2检验. P<0.05为差异有统计学意义.
我们采用TaqManR探针法RT-PCR检测miR-106a表达, 以U6为内参, 2-△△Ct法分析肠癌组织相对癌旁正常组织的相对表达量. miR-106a在73%(38/52)的肠癌组织中高表达; 与癌旁正常组织比较, miR-106a在肠癌组织中的相对表达量为2.50, 高于癌旁正常组织(图1), 差异有统计学意义(Z = -3.748, P = 0.000).
miR-106a的表达在TNM不同分期中表达差异有显著性(t = 2.813, P = 0.003)和淋巴结转移(t = -2.635, P = 0.008). 随着TNM分期越高, miR-106a表达越高. 有淋巴结转移肠癌组织中miR-106a表达明显高于无淋巴结转移标本. miR-106a表达和性别、年龄、肿块位置及组织分化程度无关.
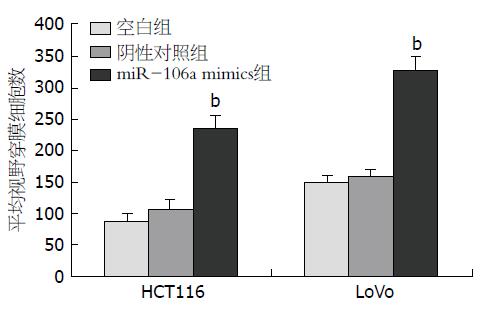
以上结果表明miR-106a表达可能与肠癌的转移有关, 因而进一步采用Transwell小室验证其在细胞侵袭中的作用. 瞬时转染HCT116和LoVo细胞, 转染浓度为50 nmol/L, 转染后24 h进行PCR验证. 结果表明转染miR-106a mimics后miR-106a表达明显增加(均为P<0.01). 转染后细胞侵袭改变(图2, 3)差异有显著性(F值分别为120.631和196.611, P值均为0.000). 进一步行组间比较, 结果显示: 与阴性对照组相比, miR-106a组可促进细胞侵袭, 差异有显著性(均为P = 0.000).
miRNAs是一种广泛存在的调控基因表达的小分子RNA, 可通过调控下游靶基因一癌基因和/或抑癌基因的表达, 参与肿瘤发生、发展, 决定肿瘤细胞的恶性特征, 在肿瘤发生、发展、转归中的起着重要作用. miRNAs的发现及其与肿瘤相关性的初步揭示、补充并丰富了肿瘤的发生机制, 为肿瘤的分子机制学研究提供了新的思路.
microRNA的研究方法有microarray、Northern blot、原位杂交和Real-time PCR.一般microarray被用于miRNA表达谱的筛选. Northern blot也可检测miRNAs表达及大小, 但存在探针敏感性问题. 原位杂交可以还原特定microRNA的细胞定位及相对定量, 但也存在敏感性问题. 而Real-time PCR具有高度的敏感性和特异性. Real-time PCR的化学原理分为探针型和非探针型, 探针型荧光定量PCR是与模板特异性结合的荧光探针反应扩增产物的增加, 特异性更高. 本研究采用Taqman MGB探针检测大肠癌及癌旁组织中miR-106a的表达, 而且以U6为内参, 进一步减少因加样量不齐而带来的结果差异, 以期得到准确的结果.
miRNAs与肠癌的发生发展密切相关. 首先, miRNAs与大肠癌的诊断相关. Ng等[8]发现miR-17-3p和miR-92a可作为肠癌的循环靶标, 其中后者的ROC曲线下面积可达88.5%, 敏感性和特异性分别为: 89%和70%; 更为重要的是, 其可区分胃癌和炎症性肠病. 类似结果在Huang等[7]的研究中得到证实. 该研究中证实miR-92a和miR-29a可把肠癌、腺瘤从正常受试者中区分出来; 其次, miRNAs也与肠癌的预后相关. 其中miR-143与miR-145肿瘤大小呈负相关[9], 被认为是抑癌基因; 另一研究却证实miR-143高表达与差的无疾病进展生存期有关[10]. miR-21的高表达与高TNM分期、淋巴结转移、远处转移、短的无疾病生存期和差的治疗结果有关[9,10].
miR106a的研究较多, 其中胃癌中miR-106a表达增加, 其表达与肿瘤分期、大小、分化、淋巴结及远处转移相关[11]. miR-106a还与肿瘤的预后密切相关. Díaz等[12]分析110例肠癌患者, 发现miR-106a的低表达与短的无疾病生存期和总生存期有关, 而且这种相关关系与分期无关; 星形细胞瘤中miR-106a低表达也与差的患者生存相关[13,14]; 食管鳞状细胞癌中miR-106a在复发患者及肿瘤性死亡患者中表达较低[15]. 可见, miR-106a虽然在大多数肿瘤中高表达, 但其高表达在所研究的肿瘤中均与较长的生存期相关, 可能具有肿瘤抑制作用.
本研究证实miR-106a在大肠癌中高表达, 差别有统计学意义, 且miR-106a的表达与分期正相关, 与淋巴结转移相关; 进一步细胞实验证实miR-106a可促进细胞侵袭, 提示miR-106a可能在大肠癌的发生及转移中具有一定作用. 本研究结果与最近发表的一篇论文类似[16]. 该论文也提示miR-106a高表达与肠癌侵袭转移增加相关; 但文章提示miR-106a高表达与差的生存期相关, 与上述文献结果矛盾, 可能与其生存分析中只分析28例未发生转移的肠癌患者组织有关.
总之, miR-106a在肠癌中高表达, 与分期和细胞侵袭正相关, 似乎具有促癌作用, 而大样本相关生存分析证实其具有肿瘤保护作用, 因而其在肠癌中的作用需进一步研究以确认其具体的作用机制, 以期为将来的临床治疗提供理论基础.
microRNAs是一种21-25 nt长的单链RNA, 在进化上具有高度的保守性, 可抑制蛋白翻译, 调节内源基因表达, 且在基因表达调控中扮演重要角色, 也为癌症的早期筛查、诊断、治疗等方面提供新的理论基础及方法.
李革, 副教授, 延边大学附属医院
2003年Michael等首先发现了大肠癌中新的miRNAs: miR-143和miR-145, 现在大肠癌中研究较多的有100多种miRNAs, 与大肠癌的发生发展及诊治等密切相关. miR-106a在大肠癌中高表达. 但其具体作用机制不详.
Schetter等分析2个队列共197例大肠癌组织miR-106a表达, 发现与癌旁正常组织相比, 肠癌组织中miR-106a的表达增高. Xiao等分析55例胃癌组织和17例非癌组织发现miR-106a在胃癌组织中高表达(1.625倍), 而且其表达水平与肿瘤分期、大小、分化及淋巴结和远处转移相关.
miR-106a在大肠癌中过表达的报道较多, 但其在肠癌中的临床分析及细胞功能学研究较少. 本研究采用RT-PCR、Western blot、Transwell小室侵袭实验检测其在肠癌组织中的表达. 分析其与分期和淋巴结转移的关系. 探索其在细胞侵袭中作用. 具有一定创新性.
miR-106a在肠癌组织中表达高, 与肿瘤组织的分期和淋巴结转移相关, 且过表达miR-106a可促进肠癌细胞的侵袭. 因而miR-106a的表达可能与大肠癌的转移相关, miR-106a可能成为肠癌的分子治疗的靶标之一.
本文设计合理, 有一定的创新性, 结论可信, 论据充分, 具有较高的学术价值.
编辑: 田滢 电编:闫晋利
| 1. | Feng S, Cong S, Zhang X, Bao X, Wang W, Li H, Wang Z, Wang G, Xu J, Du B. MicroRNA-192 targeting retinoblastoma 1 inhibits cell proliferation and induces cell apoptosis in lung cancer cells. Nucleic Acids Res. 2011;39:6669-6678. [PubMed] [DOI] |
| 2. | Li T, Morgan MJ, Choksi S, Zhang Y, Kim YS, Liu ZG. MicroRNAs modulate the noncanonical transcription factor NF-kappaB pathway by regulating expression of the kinase IKKalpha during macrophage differentiation. Nat Immunol. 2010;11:799-805. [PubMed] [DOI] |
| 3. | Esquela-Kerscher A, Trang P, Wiggins JF, Patrawala L, Cheng A, Ford L, Weidhaas JB, Brown D, Bader AG, Slack FJ. The let-7 microRNA reduces tumor growth in mouse models of lung cancer. Cell Cycle. 2008;7:759-764. [PubMed] [DOI] |
| 4. | Calin GA, Dumitru CD, Shimizu M, Bichi R, Zupo S, Noch E, Aldler H, Rattan S, Keating M, Rai K. Frequent deletions and down-regulation of micro- RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci U S A. 2002;99:15524-15529. [PubMed] [DOI] |
| 5. | Cheng H, Zhang L, Cogdell DE, Zheng H, Schetter AJ, Nykter M, Harris CC, Chen K, Hamilton SR, Zhang W. Circulating plasma MiR-141 is a novel biomarker for metastatic colon cancer and predicts poor prognosis. PLoS One. 2011;6:e17745. [PubMed] [DOI] |
| 6. | Cortez MA, Ivan C, Zhou P, Wu X, Ivan M, Calin GA. microRNAs in cancer: from bench to bedside. Adv Cancer Res. 2010;108:113-157. [PubMed] |
| 7. | Huang Z, Huang D, Ni S, Peng Z, Sheng W, Du X. Plasma microRNAs are promising novel biomarkers for early detection of colorectal cancer. Int J Cancer. 2010;127:118-126. [PubMed] [DOI] |
| 8. | Ng EK, Chong WW, Jin H, Lam EK, Shin VY, Yu J, Poon TC, Ng SS, Sung JJ. Differential expression of microRNAs in plasma of patients with colorectal cancer: a potential marker for colorectal cancer screening. Gut. 2009;58:1375-1381. [PubMed] [DOI] |
| 9. | Slaby O, Svoboda M, Fabian P, Smerdova T, Knoflickova D, Bednarikova M, Nenutil R, Vyzula R. Altered expression of miR-21, miR-31, miR-143 and miR-145 is related to clinicopathologic features of colorectal cancer. Oncology. 2007;72:397-402. [PubMed] [DOI] |
| 10. | Kulda V, Pesta M, Topolcan O, Liska V, Treska V, Sutnar A, Rupert K, Ludvikova M, Babuska V, Holubec L. Relevance of miR-21 and miR-143 expression in tissue samples of colorectal carcinoma and its liver metastases. Cancer Genet Cytogenet. 2010;200:154-160. [PubMed] [DOI] |
| 11. | Xiao B, Guo J, Miao Y, Jiang Z, Huan R, Zhang Y, Li D, Zhong J. Detection of miR-106a in gastric carcinoma and its clinical significance. Clin Chim Acta. 2009;400:97-102. [PubMed] [DOI] |
| 12. | Díaz R, Silva J, García JM, Lorenzo Y, García V, Peña C, Rodríguez R, Muñoz C, García F, Bonilla F. Deregulated expression of miR-106a predicts survival in human colon cancer patients. Genes Chromosomes Cancer. 2008;47:794-802. [PubMed] [DOI] |
| 13. | Zhi F, Chen X, Wang S, Xia X, Shi Y, Guan W, Shao N, Qu H, Yang C, Zhang Y. The use of hsa-miR-21, hsa-miR-181b and hsa-miR-106a as prognostic indicators of astrocytoma. Eur J Cancer. 2010;46:1640-1649. [PubMed] [DOI] |
| 15. | Hummel R, Hussey DJ, Michael MZ, Haier J, Bruewer M, Senninger N, Watson DI. MiRNAs and their association with locoregional staging and survival following surgery for esophageal carcinoma. Ann Surg Oncol. 2011;18:253-260. [PubMed] [DOI] |