修回日期: 2012-11-09
接受日期: 2012-11-23
在线出版日期: 2012-12-08
目的: 构建人肠道病毒71型(human enterovirus 71, EV71)VP1-VP4重组融合蛋白表达体系.
方法: 构建EV71 VP1-VP4重组融合蛋白原核表达载体转化大肠杆菌DH5α, 诱导表达融合蛋白VP1-VP4, SDS-PAGE和Western blot法进行鉴定. 用融和蛋白包被ELISA板检测41例已知血清.
结果: 重组片段VP1-VP4测序结果与设计目的片段序列相符, 重组载体构建成功; SDS-PAGE显示融合蛋白约42.8 kDa, 与预期值一致; Western blot提示该融合蛋白可以和EV71 VP1、VP4抗体特异性结合. 融合蛋白包被ELISA板能准确检测出41例血清中16例EV71阳性血清, 与CA16无交叉反应.
结论: 表达的EV71 VP1-VP4融合蛋白具有良好的抗原性, 可作为EV71感染检测抗原, 为EV71诊断试剂和疫苗的研究奠定实验基础.
引文著录: 冷弘, 王娜, 王媛媛, 臧文巧, 李敏, 赵国强. 人肠道病毒71型VP1和VP4的抗原融合表达及鉴定. 世界华人消化杂志 2012; 20(34): 3366-3369
Revised: November 9, 2012
Accepted: November 23, 2012
Published online: December 8, 2012
AIM: To construct a prokaryotic vector expressing human enterovirus 71 (EV71) VP1-VP4 fusion antigen.
METHODS: A prokaryotic expression plasmid carrying the VP1-VP4 fusion gene was constructed and transformed into E. coli DH5α. VP1-VP4 fusion protein was induced to express with IPTG. SDS-PAGE and Western blot were performed to detect VP1-VP4 fusion protein. Purified VP1-VP4 fusion protein was coated onto ELISA plates to detect 41 serum samples for screening EV71 positive serum samples.
RESULTS: The sequence of recombinant VP1-VP4 fragment was the same as the expected sequence, indicating that the recombinant vector was successfully constructed. SDS-PAGE showed that the fusion protein had a molecular weight of 42.8 kDa. Western blot showed that fusion protein can be specifically recognized by VP1 antibody and VP4 antibody. Fusion protein coated onto ELISA plates could accurately detect 16 EV71 positive serum samples from 41 serum samples without cross-reactivity with coxsackievirus16 (CA16).
CONCLUSION: The VP1-VP4 fusion protein has good antigenicity and can be used as a diagnostic antigen to detect EV71 infection. Our results provide a experimental basis for development of EV71 diagnostic kits.
- Citation: Leng H, Wang N, Wang YY, Zang WQ, Li M, Zhao GQ. Construction of a prokaryotic expression vector containing the EV71 VP1-VP4 fusion gene and detection of its expressions. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3366-3369
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3366.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3366
人肠道病毒71型(human enterovirus 71, EV71)属于小RNA病毒科肠道病毒属, 于1974年由Schimidt首次从一些患有中枢神经系统疾病的患者标本中分离并报道[1,2]. EV71主要引起手足口病、疱疹性咽峡炎、无菌性脑炎、脑膜炎以及脊髓灰质炎等多种疾病[3,4]. 近年来, 世界各国EV71爆发流行日趋严重, 传染性强, 传播速度快, 引起科学家们的日益关注. 对EV71所引起的疾病, 目前尚无有效的药物来进行治疗, 疫苗也处于研究阶段[5,6]. 因此, 对EV71的快速检测显得尤为迫切, EV71血清学检测方法的研究受到相关领域科学家的关注. EV71病毒由4种结构蛋白构成其衣壳, 分别为VP1、VP2、VP3、VP4, 其中VP1、VP2、VP3位于衣壳的外表面, VP4位于病毒衣壳的内表面. 研究报道VP2、VP3无明显的免疫原性, VP1和VP4蛋白具有良好的免疫原性[7-9], 因此本文拟采用融合PCR技术将EV71 VP1和VP4基因连接, 导入质粒载体, 并在大肠杆菌中诱导表达VP1-VP4融合蛋白, 预期为EV71诊断试剂的开发和疫苗研制奠定试验基础.
原核表达载体pQE-80L、质粒DNA提取纯化试剂盒、Ni-NTE His·Bind Resin亲和层析树脂(QIAGEN公司); 大肠杆菌DH5α、DNA 凝胶回收试剂盒、限制性内切酶KpnⅠ、Hind Ⅲ, T4 DNA连接酶、DL2000 DNA Marker(大连宝生物公司); Prestained Protein Molecular Weight Marker(Fermentas公司); EV71 VP1和VP4 cDNA克隆来源于本课题组前期工作; EV71 VP1抗体、EV71 VP4抗体(Uniformed Services University of the Health Sciences职慧军博士惠赠); HRP标记的羊抗人IgG(Sigma公司); EV71阳性血清16例, 柯萨奇病毒A16(coxsachie virus 16, CA16)阳性血清5例, 阴性血清20例由洛阳市疾控中心提供.
1.2.1 引物的设计与合成: 参考本课题组前期工作所获得的EV71全基因组序列(Accession No.JN020147)及其他登记序列[10-12], 依据融合PCR技术方法要领, 分别设计2对引物扩增VP1、VP4基因片段, 并在VP4F 5'端引入KpnⅠ酶切位点, 在VP4R、VP1F 5'端分别加上互补的柔性肽(GGGGSG)DNA序列, 在VP1R引入终止密码子和Hind Ⅲ酶切位点. VP4F(5'-GTAGGTACCATGGGGTCACAAGTCTCTACTC-3'); VP4R(5'- ACCCGATCCACCTCCGCCCTTGAGCGGTGGAGCCATCTCA-3'); VP1F(5'-AAGGGCGGAGGTGGATCGGGT GGAGATAGGGTGGCAGATGT-3'); VP1R(5'-CCTAAGCTT AAGAGTGGTGATCGCTGTGCG -3'), 引物由上海生工生物工程有限公司合成.
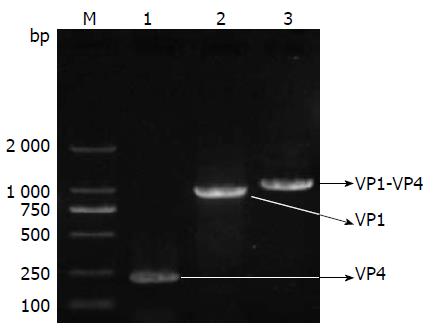
1.2.2 目的基因融合扩增: 常规PCR从EV71 VP1、VP4 cDNA克隆分别扩增VP1、VP4目的序列. 再混合VP1、VP4 PCR产物为模板, 用引物VP4F和VP1R进行融合PCR, 获得由柔性肽基因连接的融合基因片段VP1-VP4, 电泳鉴定.
1.2.3 重组表达载体的构建:KpnⅠ和Hind Ⅲ双酶切融合片段VP1-VP4和pQE-80L原核表达载体, 电泳, 胶回收纯化. 载体pQE-80L和融合片段在T4连接酶作用下, 16 ℃过夜连接后转化大肠埃希菌DH5α, 挑取阳性克隆抽提质粒, KpnⅠ和Hind Ⅲ双酶切电泳鉴定. 重组质粒送上海生工生物工程有限公司测序.
1.2.4 融合蛋白的诱导表达及纯化: 取对数生长期转化菌, 加入异丙基硫代D半乳糖苷(IPTG)至终浓度1 mmol/L, 37 ℃诱导表达6 h, 离心收集菌体, 超声破碎后取上清12%SDS-PAGE电泳, 检测融合蛋白表达情况. 同时将收集的上清液用0.45 μm滤膜过滤, 利用Ni-NTE His·Bind Resin 亲和层析纯化融合蛋白, SDS-PAGE电泳.
1.2.5 Western blot检测融合蛋白: 取未诱导转化菌裂解产物、诱导转化菌裂解产物进行12% SDS-PAGE后转移至PVDF膜上, PBS洗膜3次, 每次5 min, 放入含有5%脱脂奶粉的PBS中封闭2 h. 洗膜后与EV71 VP1、VP4抗体37 ℃孵育1 h, 洗膜, 加入HRP标记的羊抗人IgG孵育1 h, 显色.
1.2.6 包被融合蛋白抗原ELISA法检测待检血清: 调整纯化的融合蛋白浓度为3 μg/mL, 按100 μL/孔4 ℃过夜包被酶标板. 洗板后2%BSA 37 ℃封闭1 h. 用上述包被板检测EV71阳性血清16例, CA16阳性血清5例, 阴性血清20例. 方法: 在180 μL PBS中加入待检血清20 μL/孔, 37 ℃反应45 min; 洗涤3次后加入1:5 000 HRP标记的羊抗人IgG(100 μL/孔), 反应30 min; 洗涤后加入TMB底物(100 μL/孔), 反应15 min, 加终止液终止反应, 450 nm波长测量各孔的吸光度, 换算出个样品抗体浓度, 以>5 ng/L为阳性.
以EV71 VP1、VP4 cDNA克隆为模板分别对VP1、VP4基因进行PCR扩增, 获得长度分别为234 bp、921 bp片段. 对目的基因进行融合扩增后, 获得1 128 bp片段, 电泳结果均与预期相符(图1).
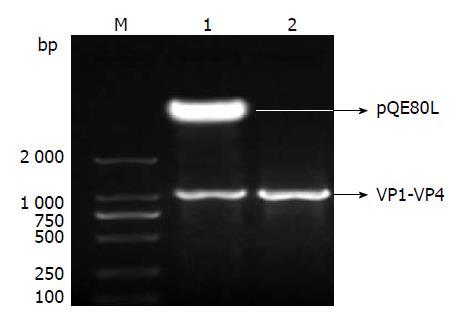
重组质粒pQE-80L-VP1-VP4经KpnⅠ和Hind Ⅲ双酶切后, 电泳出现4.8 kb的载体条带和1 122 bp的融合基因条带(VP1-VP4), 与预期相符(图2), 测序结果与设计目的片段序列相符, 重组载体成功构建.
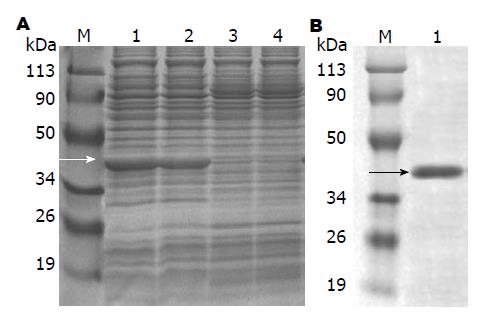
将所构建的重组质粒在最佳诱导条件下进行诱导表达, SDS-PAGE检测表达情况. 结果显示目的蛋白于37 ℃经IPTG诱导呈现高效表达(图3A). 表达产物经Ni柱亲和层析纯化后得到较纯的目的片段, 融合蛋白大小约42.8 kDa左右(图3B).
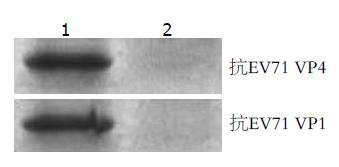
Western blot结果显示, 诱导转化菌裂解产物SDS-PAGE电泳转膜后, 能与EV71 VP1、VP4抗体发生特异性结合而显色, 而未诱导转化菌裂解产物不能与EV71 VP1、VP4抗体发生反应呈融合抗原表达阴性(图4).
用本文所包被融合蛋白抗原ELISA法检测已知EV71阳性血清16例、CA16阳性血清5例, 阴性血清20例(洛阳市疾病控制中心提供). 结果显示, 融合蛋白和16例EV71阳性血清反应阳性, 而不与CA16阳性血清及阴性血清反应. 证明本文所包被融合蛋白抗原ELISA法可以用来作为检测人群EV71感染情况.
EV71感染尚无有效的药物, 疫苗也处于试验阶段, 因此对EV71病原的检测就显得尤其重要, 流行早期快速及时的检测病原, 可以及早发现疫情, 为病源的隔离、切断传播途径、避免病原的扩散赢得时间.
EV71传统的检测方法是对病原体的直接检测, 利用敏感细胞培养病毒, 然后通过中和试验进一步进行病毒型别鉴定. 传统检测方法操作复杂, 周期长, 不适合疫情早期快速诊断. 现代检测方法包括以PCR技术为基础的病毒特异性片段的检测以及血清学检测2种方法[13-15]. PCR相关技术是目前最为快速有效的方法, 但该方法具有较高的灵敏性和特异性的同时又具有标本易污染而产生假阳性等缺点, 且需要专业的仪器设备, 不利于基层医务人员开展工作.
血清学检测的重点在于检测抗原的选取. 由于病毒在感染的不同阶段释放的抗原种类及数量均不相同, 且因侵入机体的差异, 也会导致病毒抗原种类释放的差异, 若采用单一抗原进行检测准确率低, 极易造成漏检; 若构建几种特异性融合抗原进行检测则可以提高检测的准确性和灵敏性. 融合PCR技术采用具有互补末端的引物, 形成具有重叠链的PCR产物, 通过PCR产物重叠链的延伸将不同来源的任意DNA片段连接起来, 为基因重组片段的构建提供了快速简捷的途径.
EV71病毒基因组为单股正链RNA, 具一个开放阅读框, 编码一个多聚蛋白, 该多聚蛋白可进一步加工为VP1、VP2、VP3、VP4 4个结构蛋白及其他功能蛋白质. 其中VP1、VP2和VP3 3个结构蛋白暴露在病毒外壳的表面, VP4结构蛋白包埋在病毒外壳的内部与病毒核心紧密相连[16]. 研究报道VP2、VP3无明显的免疫原性, VP1和VP4蛋白具有良好的免疫原性, 产生高抗体滴度. 故本文以VP1、VP4为目的基因, 利用融合PCR扩增了VP1-VP4融合基因, 载入表达载体pQE-80L后在大肠杆菌细胞中得到表达.
利用所构建的融合蛋白包被酶标板能从41例待检血清中准确检测出16例EV71阳性血清, 提示所构建的融合蛋白可以作为检测EV71的备选抗原. 本文为下一步利用融合蛋白建立有效的EV71血清学检测方法, 并对其特异性和灵敏性进行实验比较奠定试验基础, 也为后续观察VP1、VP4抗原的免疫保护作用、EV71疫苗的开发提供理论支持.
人肠道病毒71型(EV71)主要引起手足口病、疱疹性咽峡炎等多种疾病. 世界各国EV71爆发流行日趋严重, 传染性强, 传播速度快. 在疾病流行早期对病原的检测尤为重要.
任晓峰, 教授, 东北农业大学动物医学学院微生物室
对病原进行检测, 血清学为一种重要的方法, 但单一抗原作为诊断抗原, 极易造成漏检. 融合几种特异性抗原来检测可以提高检测准确性和灵敏性.
本文采用融合PCR技术将EV71 VP1和VP4基因通过柔性肽基因序列连接起来, 导入质粒载体, 并在大肠杆菌中诱导表达VP1-VP4融合蛋白, 为EV71诊断试剂的开发和疫苗研制提供基础.
EV71病毒VP1、VP4结构蛋白具有良好的抗原性, 利用融合PCR将VP1、VP4基因片段连接后导入pQE-80L质粒, 重组质粒在大肠杆菌中得到良好表达.
本文选题新颖, 为EV71的检测提供新的方法和思路, 具有一定的学术价值和应用前景.
编辑: 翟欢欢 电编:闫晋利
| 1. | Solomon T, Lewthwaite P, Perera D, Cardosa MJ, McMinn P, Ooi MH. Virology, epidemiology, pathogenesis, and control of enterovirus 71. Lancet Infect Dis. 2010;10:778-790. [PubMed] [DOI] |
| 2. | McMinn PC. Recent advances in the molecular epidemiology and control of human enterovirus 71 infection. Curr Opin Virol. 2012;2:199-205. [PubMed] [DOI] |
| 3. | Lee TC, Guo HR, Su HJ, Yang YC, Chang HL, Chen KT. Diseases caused by enterovirus 71 infection. Pediatr Infect Dis J. 2009;28:904-910. [PubMed] [DOI] |
| 4. | Bek EJ, McMinn PC. The Pathogenesis and Prevention of Encephalitis due to Human Enterovirus 71. Curr Infect Dis Rep. 2012;14:397-407. [PubMed] [DOI] |
| 5. | Zhang D, Lu J, Lu J. Enterovirus 71 vaccine: close but still far. Int J Infect Dis. 2010;14:e739-e743. [PubMed] [DOI] |
| 6. | Lee MS, Chang LY. Development of enterovirus 71 vaccines. Expert Rev Vaccines. 2010;9:149-156. [PubMed] [DOI] |
| 7. | Xu J, Wang S, Gan W, Zhang W, Ju L, Huang Z, Lu S. Expression and immunogenicity of novel subunit enterovirus 71 VP1 antigens. Biochem Biophys Res Commun. 2012;420:755-761. [PubMed] [DOI] |
| 8. | Kolpe AB, Kiener TK, Grotenbreg GM, Kwang J. Display of enterovirus 71 VP1 on baculovirus as a type II transmembrane protein elicits protective B and T cell responses in immunized mice. Virus Res. 2012;168:64-72. [PubMed] [DOI] |
| 9. | Kiener TK, Jia Q, Lim XF, He F, Meng T, Chow VT, Kwang J. Characterization and specificity of the linear epitope of the enterovirus 71 VP2 protein. Virol J. 2012;9:55. [PubMed] [DOI] |
| 10. | 冷 弘, 卢 欣, 刘 慧涛, 马 云云, 王 媛媛, 马 晶, 郭 茂峰, 李 敏, 赵 国强. 肠道病毒71型河南分离株2株全基因组序列分析. 郑州大学学报(医学版). 2012;47:170-174. |
| 11. | Wang X, Zhu C, Bao W, Zhao K, Niu J, Yu XF, Zhang W. Characterization of full-length enterovirus 71 strains from severe and mild disease patients in northeastern China. PLoS One. 2012;7:e32405. [PubMed] [DOI] |
| 12. | Chang SC, Li WC, Chen GW, Tsao KC, Huang CG, Huang YC, Chiu CH, Kuo CY, Tsai KN, Shih SR. Genetic characterization of enterovirus 71 isolated from patients with severe disease by comparative analysis of complete genomes. J Med Virol. 2012;84:931-939. [PubMed] [DOI] |
| 14. | 马 洪滨, 侯 俊, 李 鲁平, 杨 静, 李 静霞, 刘 爱霞, 徐 军, 聂 为民, 李 伯安, 毛 远丽. 肠道病毒71型血清学检测方法的建立及应用. 解放军医学杂志. 2010;35:239-240. |
| 15. | Wu S, Duan N, Ma X, Xia Y, Yu Y, Wang Z, Wang H. Simultaneous detection of enterovirus 71 and coxsackievirus A16 using dual-colour upconversion luminescent nanoparticles as labels. Chem Commun (Camb). 2012;48:4866-4868. [PubMed] [DOI] |