修回日期: 2012-10-27
接受日期: 2012-11-09
在线出版日期: 2012-12-08
目的: 研究Klotho与β-Catenin蛋白在食管癌与癌旁组织中的表达及其与临床病理特征的关系.
方法: 采用免疫组织化学EnVision二步法, 检测Klotho与β-Catenin蛋白在75对食管鳞状细胞癌与其癌旁组织芯片中的表达情况, 并结合临床病理资料进行统计分析.
结果: Klotho在食管癌中表达的阳性率明显低于癌旁组织(14.9% vs 63.4%, P<0.05), Klotho的表达与TNM分期、浸润深度明显相关(均P<0.05). β-Catenin在食管癌中表达的阳性率明显高于癌旁组织(80.0% vs 16.4%, P<0.05), β-Catenin的表达与淋巴结转移、TNM分期明显相关(均P<0.05). Klotho与β-Catenin在食管癌中的表达成负向关(r = -0.276, P<0.05).
结论: Klotho与β-Catenin在食管鳞状细胞癌与癌旁组织中的表达阳性率不同, 差异均具有显著性, 联合检测癌组织中Klotho与β-Catenin的表达可为食管癌的进展与预后提供重要的参考依据.
引文著录: 汤小伟, 黄曙, 王敏, 季国忠, 范志宁. Klotho与β-Catenin在食管癌组织中的表达及临床意义. 世界华人消化杂志 2012; 20(34): 3305-3309
Revised: October 27, 2012
Accepted: November 9, 2012
Published online: December 8, 2012
AIM: To investigate the clinical significance of expression of Klotho and β-Catenin in esophageal carcinoma.
METHODS: Tissue microarray technique and immunohistochemistry were used to examine Klotho and β-Catenin expression in 75 esophageal carcinoma tissue specimens and matched tumor-adjacent esophageal tissue. Correlations between Klotho and β-Catenin expression and clinical and pathological features were then analyzed.
RESULTS: The positive rate of Klotho expression was significantly lower in esophageal carcinoma tissue than in tumor-adjacent tissue (14.9% vs 63.4%, P < 0.05). The expression of Klotho was correlated with tumor invasion and clinical stage (both P < 0.05). The positive rate of β-Catenin expression was significantly higher in esophageal carcinoma tissue than in tumor-adjacent tissue (80.0% vs 16.4%, P < 0.05). The expression of Klotho was correlated with lymph node metastasis and tumor clinical stage (r = -0.276, P < 0.05).
CONCLUSION: The positive rates of Klotho and β-Catenin expression differed significantly between esophageal carcinoma and tumor-adjacent tissue. Klotho and β-Catenin may be used as important markers for esophageal carcinoma and are helpful for prognosis prediction in esophageal carcinoma.
- Citation: Tang XW, Huang S, Wang M, Ji GZ, Fan ZN. Clinical significance of expression of Klotho and β-Catenin in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3305-3309
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3305.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3305
食管癌是临床最常见的恶性肿瘤之一, 居全球癌症死亡原因的第5位[1]. 对食管癌发生发展的分子机制研究对阐明食管癌发生机制、筛查高风险人群、判断预后及食管癌的基因治疗均具有重要的意义. Klotho是1997年发现与衰老相关的基因[2]. 近年来, 一些学者报道了Klotho在乳腺癌、肺癌、胰腺癌与结肠癌等中具有抑制肿瘤细胞生长与转移, 促进肿瘤细胞凋亡等功能[3]. 而β-Catenin作为Wnt通路中重要的信号分子, 已有研究证实了他与多种恶性肿瘤的发生发展密切相关[4-8]. 但是Klotho与β-Catenin在食管癌中相互作用未见有相关报道. 本研究利用免疫组织化学EnVision二步法检测Klotho与β-Catenin在食管癌与癌旁组织芯片中的表达情况, 探讨食管癌组织中Klotho与β-Catenin的表达与食管癌临床病理特征的关系以及2者的相关性.
食管鳞状细胞癌组织芯片为上海芯超生物技术有限公司产品(编号HEso-Squ150CS-01), 每例芯片的直径为1.5 mm, 厚度为4 μm, 10×16双芯排列, 用统一标准的方法加工[9]. 每片芯片的完整性>95%. 在75例标本中, 男47例, 女18例; 年龄41-81岁, 中位年龄60岁. 参照2000年世界卫生组织推荐的肿瘤分化分级标准, 低分化鳞癌57例, 中、高分化鳞癌18例. 按2002年国际抗癌联盟TNM分期法, Ⅰ期11例, Ⅱ期27例, Ⅲ期27例, Ⅳ期10例. 一抗山羊抗人Klotho与β-Catenin多克隆抗体和相应二抗均购自Santa Cruz公司(产品编号分别为sc-22218和sc-2020), -20 ℃保存, 一抗工作浓度为4 μg/mL. 即用型免疫组织化学EnVision二步法试剂盒购自基因有限公司.
采用免疫组织化学EnVision二步法检测Klotho与β-Catenin蛋白表达情况. 用已知阳性组织切片作阳性对照, 以PBS代替一抗作阴性对照, 按试剂盒说明书进行操作. 结果判定: 据染色强度与阳性细胞比例综合计分, 细胞的染色强度可分为0分(染色阴性), 1分(淡黄色颗粒), 2分(棕黄色颗粒), 3分(褐色颗粒); 阳性细胞比例的评分方法为: 0分(阳性细胞比例≤5%), 1分(5%<阳性细胞比例≤25%), 2分(25%<阳性细胞比例≤50%), 3分(50%<阳性细胞比例≤75%), 4分(75%<阳性细胞比例≤100%). 根据2项乘积的分数分为4级, 分数≤4记为-, 4<分数≤8记为+, 8<分数≤12记为++, 分数>12记为+++. 其中-记为Klotho与β-Catenin表达阴性; +, ++, +++记为Klotho与β-Catenin表达阳性.
统计学处理 采用Spss13.0统计软件进行分析. Klotho与β-Catenin蛋白在食管癌与癌旁组织中表达差异, 以及Klotho与β-Catenin与临床病理特标(性别、年龄、食管癌临床分期、病理分级、淋巴结转移、浸润深度等)的关系采用χ2检验. Klotho与β-Catenin表达阳性率的相互关系采用Spearman等级相关分析, P<0.05表示差异有统计学意义.
组织芯片经免疫组织化学染色后, 光镜下剔除染色效果差, 组织残缺不全的标本, 最后进入统计检测Klotho表达的组织芯片含74例食管癌组织与71例癌旁组织. 检测β-Catenin表达的组织芯片含75例食管癌组织与67例癌旁组织.
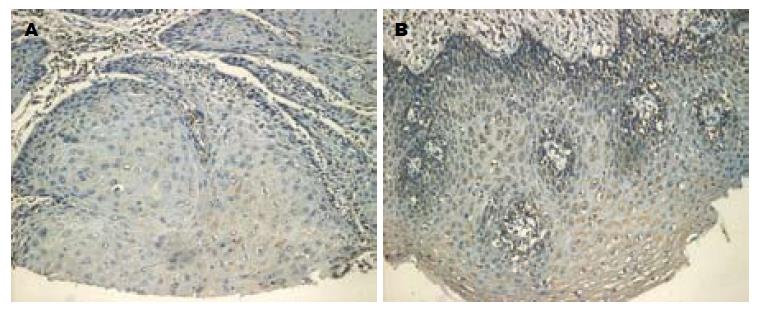
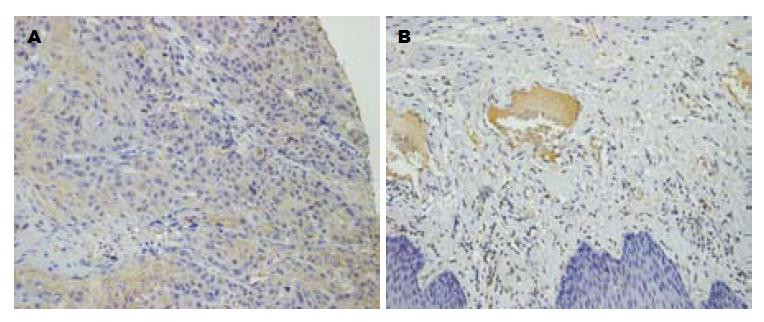
74例食管癌组织中11例Klotho表达阳性(14.9%), 显色部位主要为细胞浆, 63例Klotho表达阴性(85.1%, 图1A). 71例癌旁组织中45例Klotho表达阳性(63.4%, 图1B), 26例Klotho表达阴性(36.6%). 75例食管癌组织中60例β-Catenin表达阳性(80.0%, 图2A), 显色部位主要为细胞浆, 15例β-Catenin表达阴性(20.0%). 67例癌旁组织中11例β-Catenin表达阳性(16.4%), 56例β-Catenin表达阴性(83.6%, 图2B). 经分析Klotho与β-Catenin蛋白在食管癌与癌旁组织中表达差异均有统计学意义(均P<0.05, 表1).
| Klotho | β-Catenin | |||||
| 阳性(%) | 阴性 | P值 | 阳性(%) | 阴性 | P值 | |
| 癌组织 | 11(14.9) | 63 | 0.000 | 60(80.0) | 15 | 0.000 |
| 癌旁组织 | 45(63.4) | 26 | 11(16.4) | 56 | ||
Klotho表达阳性与食管癌患者性别、年龄、病理分级、淋巴结转移无统计学意义, 而与临床分期、浸润深度有密切关系(均P<0.05). β-Catenin表达阳性与食管癌患者性别、年龄、病理分级、浸润深度无统计学意义, 而与临床分期、淋巴结转移有密切关系(P<0.05, 表2).
| 临床病理特征 | Klotho | β-Catenin | ||||
| 阳性 n(%) | 阴性 | P值 | 阳性 n(%) | 阴性 | P值 | |
| 性别 | ||||||
| 男 | 7(63.4) | 49 | 0.468 | 48(81.4) | 8 | 0.055 |
| 女 | 4(36.4) | 13 | 11(18.6) | 7 | ||
| 年龄(岁) | ||||||
| >60 | 7(63.4) | 32 | 0.461 | 31(52.5) | 8 | 0.956 |
| <60 | 4(36.4) | 30 | 28(47.5) | 7 | ||
| 浸润深度 | ||||||
| 未侵及外膜 | 9(81.8) | 29 | 0.046 | 29(50.0) | 10 | 0.078 |
| 侵犯到外膜 | 2(18.2) | 30 | 29(50.0) | 3 | ||
| 病理分级 | ||||||
| Ⅰ级, Ⅱ级 | 10(90.9) | 47 | 0.425 | 44(73.3) | 14 | 0.190 |
| Ⅱ--Ⅲ级,Ⅲ级 | 1(9.1) | 16 | 16(26.7) | 1 | ||
| 淋巴结转移 | ||||||
| 无 | 8(72.7) | 28 | 0.092 | 25(42.4) | 11 | 0.032 |
| 有 | 3(27.3) | 34 | 34(57.6) | 4 | ||
| TNM分期 | ||||||
| 1期+2期 | 9(81.8) | 28 | 0.022 | 27(45.0) | 11 | 0.050 |
| 3期+4期 | 2(18.2) | 35 | 33(55.0) | 4 | ||
Klotho基因于1997年被发现, 最先的研究认为他是一种抗衰老基因, Klotho敲除的老鼠表现出一系列衰老的症状, 如骨质疏松、肺气肿、皮肤萎缩、动脉硬化等[10-16]. 近年来对Klotho的功能研究提示其与恶性肿瘤的发生发展密切相关[17-30]. Lee等[21]将宫颈癌细胞成功转染Klotho基因后, 发现癌细胞的生长明显受限, 凋亡率明显增加, 细胞内的Wnt通路重要的信号分子β-Catenin含量明显减少, c-myc与CCND1明显降低. Wnt/β-Catenin通路已被研究证实在多种恶性肿瘤的发生发展中起促进作用, β-Catenin是该通路中重要的信号分子, Veeramachaneni等[8]研究发现下调β-Catenin的表达能显著抑制食管癌细胞的生长.
本实验通过组织芯片联合免疫组织化学EnVision二步法检测了食管鳞癌及癌旁正常组织中Klotho与β-Catenin蛋白的表达情况, 结果表明食管癌中的Klotho的表达低于癌旁组织, β-Catenin的表达高于癌旁; Klotho的表达还与食管癌的浸润深度、临床分期密切相关, 随着食管癌浸润的加深、临床分期的增高, Klotho的表达阳性率降低. β-Catenin蛋白的表达与食管癌的淋巴结转移、临床分期密切相关, 随着食管癌发生淋巴结转移、临床分级增高, β-Catenin的表达阳性率升高. 这些结果提示食管癌的发生与Klotho的低表达有关, Klotho可能作为一肿瘤抑制因子参与食管癌的进展过程; 而食管癌的发生发展与β-Catenin的高表达有关, β-Catenin可以作为食管癌的促进因子. 并且Klotho与β-Catenin在食管癌组织中表达阳性率的相关分析发现呈负相关, 进一步提示2者在食管癌发生中起着相反的作用, Klotho的低表达与β-Catenin的高表达共同参与了食管癌的发生发展.
综上所述, Klotho在食管癌中低表达, 与食管癌的浸润深度、临床分期密切相关. β-Catenin蛋白在食管癌中高表达, 与食管癌的淋巴结转移、临床分期密切相关. 2者可作为判断食管癌预后的指标, 但Klotho与β-Catenin在食管癌发生发展中相互作用的具体分子机制还需进一步研究.
食管癌是临床最常见的恶性肿瘤之一, 居全球癌症死亡原因的第5位. Klotho是1997年发现与衰老相关的基因. 近年来, 一些学者报道了Klotho在乳腺癌、肺癌、胰腺癌与结肠癌等中具有抑制肿瘤细胞生长与转移, 促进肿瘤细胞凋亡等功能.
陈洪, 副教授, 主任医师, 东南大学附属中大医院消化科
目前, Wnt信号通路的激活在多种恶性肿瘤的发生发展中起重要作用. β-Catenin作为Wnt通路中重要的信号分子, 已有研究证实了他与多种恶性肿瘤的发生发展密切相关. 但是未见Klotho与β-Catenin在食管癌中相互作用的相关报道.
多项研究已经表明Wnt/β-Catenin信号通路的激活在多种恶性肿瘤的发生发展中起重要作用. Lee等将宫颈癌细胞成功转染Klotho基因后, 发现癌细胞的生长明显受限, 凋亡率明显增加, 细胞内的Wnt通路重要的信号分子β-Catenin含量明显减少, 促进细胞增殖的分子c-myc与CCND1明显降低.
本研究报道了Klotho在食管癌中低表达, 与食管癌的浸润深度、临床分期密切相关. β-Catenin蛋白在食管癌中高表达, 与食管癌的淋巴结转移、临床分期密切相关. Klotho在食管癌的发生发展中起抑制作用, 并且在食管癌中Klotho的表达与β-Catenin的表达呈负相关.
Klotho与β-Catenin的表达量可作为判断食管癌预后的指标. 但Klotho与β-Catenin在食管癌发生发展中相互作用的具体分子机制还需进一步研究.
组织芯片: 也称组织微阵列(tissue microarrays), 是生物芯片技术的一个重要分支, 是将许多不同个体组织标本以规则阵列方式排布于同一载玻片上, 进行同一指标的原位组织学研究. 组织芯片技术可以与其他很多常规技术如免疫组织化学(IHC)、核酸原位杂交(ISH)、荧光原位杂交(FISH)、原位PCR等结合应用, 检测一种或多种分子的表达情况等.
Klotho与结肠癌等肿瘤的关系已受关注, 其与β-Catenin在食管癌发生发展中相互作用的关系未见报道. 本文具有较好的创新性.
编辑: 翟欢欢 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Kuro-o M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugi T, Ohyama Y, Kurabayashi M, Kaname T, Kume E. Mutation of the mouse klotho gene leads to a syndrome resembling ageing. Nature. 1997;390:45-51. [PubMed] [DOI] |
| 3. | Kuro-o M. Klotho in health and disease. Curr Opin Nephrol Hypertens. 2012;21:362-368. [PubMed] [DOI] |
| 4. | Lustig B, Behrens J. The Wnt signaling pathway and its role in tumor development. J Cancer Res Clin Oncol. 2003;129:199-221. [PubMed] |
| 5. | Fu L, Zhang C, Zhang LY, Dong SS, Lu LH, Chen J, Dai Y, Li Y, Kong KL, Kwong DL. Wnt2 secreted by tumour fibroblasts promotes tumour progression in oesophageal cancer by activation of the Wnt/β-catenin signalling pathway. Gut. 2011;60:1635-1643. [PubMed] [DOI] |
| 6. | Jones LJ, Veale RB. Redistribution of beta-catenin in response to EGF and lithium signalling in human oesophageal squamous carcinoma cell lines. Cancer Cell Int. 2003;3:13. [PubMed] [DOI] |
| 7. | Kiely B, O'Donovan RT, McKenna SL, O'Sullivan GC. Beta-catenin transcriptional activity is inhibited downstream of nuclear localisation and is not influenced by IGF signalling in oesophageal cancer cells. Int J Cancer. 2007;121:1903-1909. [PubMed] [DOI] |
| 8. | Veeramachaneni NK, Kubokura H, Lin L, Pippin JA, Patterson GA, Drebin JA, Battafarano RJ. Down-regulation of beta catenin inhibits the growth of esophageal carcinoma cells. J Thorac Cardiovasc Surg. 2004;127:92-98. [PubMed] [DOI] |
| 9. | Sanchez-Carbayo M. Antibody microarrays as tools for biomarker discovery. Methods Mol Biol. 2011;785:159-182. [PubMed] [DOI] |
| 10. | Wang Y, Sun Z. Current understanding of klotho. Ageing Res Rev. 2009;8:43-51. [PubMed] [DOI] |
| 11. | Kuro-o M. Klotho and the aging process. Korean J Intern Med. 2011;26:113-122. [PubMed] [DOI] |
| 12. | Razzaque MS. The role of Klotho in energy metabolism. Nat Rev Endocrinol. 2012;8:579-587. [PubMed] [DOI] |
| 13. | Nabeshima Y. Toward a better understanding of Klotho. Sci Aging Knowledge Environ. 2006;2006:pe11. [PubMed] |
| 14. | Kuro-o M. Klotho. Pflugers Arch. 2010;459:333-343. [PubMed] [DOI] |
| 15. | Nabeshima Y. Klotho: a fundamental regulator of aging. Ageing Res Rev. 2002;1:627-638. [PubMed] [DOI] |
| 16. | Kuro-o M. Klotho and aging. Biochim Biophys Acta. 2009;1790:1049-1058. [PubMed] |
| 17. | Wolf I, Levanon-Cohen S, Bose S, Ligumsky H, Sredni B, Kanety H, Kuro-o M, Karlan B, Kaufman B, Koeffler HP. Klotho: a tumor suppressor and a modulator of the IGF-1 and FGF pathways in human breast cancer. Oncogene. 2008;27:7094-7105. [PubMed] [DOI] |
| 18. | Usuda J, Ichinose S, Ishizumi T, Ohtani K, Inoue T, Saji H, Kakihana M, Kajiwara N, Uchida O, Nomura M. Klotho predicts good clinical outcome in patients with limited-disease small cell lung cancer who received surgery. Lung Cancer. 2011;74:332-337. [PubMed] [DOI] |
| 19. | Pan J, Zhong J, Gan LH, Chen SJ, Jin HC, Wang X, Wang LJ. Klotho, an anti-senescence related gene, is frequently inactivated through promoter hypermethylation in colorectal cancer. Tumour Biol. 2011;32:729-735. [PubMed] [DOI] |
| 20. | Lu L, Katsaros D, Wiley A, de la Longrais IA, Puopolo M, Yu H. Klotho expression in epithelial ovarian cancer and its association with insulin-like growth factors and disease progression. Cancer Invest. 2008;26:185-192. [PubMed] [DOI] |
| 21. | Lee J, Jeong DJ, Kim J, Lee S, Park JH, Chang B, Jung SI, Yi L, Han Y, Yang Y. The anti-aging gene KLOTHO is a novel target for epigenetic silencing in human cervical carcinoma. Mol Cancer. 2010;9:109. [PubMed] [DOI] |
| 22. | Doi S, Zou Y, Togao O, Pastor JV, John GB, Wang L, Shiizaki K, Gotschall R, Schiavi S, Yorioka N. Klotho inhibits transforming growth factor-beta1 (TGF-beta1) signaling and suppresses renal fibrosis and cancer metastasis in mice. J Biol Chem. 2011;286:8655-8665. [PubMed] [DOI] |
| 23. | Camilli TC, Xu M, O'Connell MP, Chien B, Frank BP, Subaran S, Indig FE, Morin PJ, Hewitt SM, Weeraratna AT. Loss of Klotho during melanoma progression leads to increased filamin cleavage, increased Wnt5A expression, and enhanced melanoma cell motility. Pigment Cell Melanoma Res. 2011;24:175-186. [PubMed] [DOI] |
| 24. | Chen B, Wang X, Zhao W, Wu J. Klotho inhibits growth and promotes apoptosis in human lung cancer cell line A549. J Exp Clin Cancer Res. 2010;29:99. [PubMed] [DOI] |
| 25. | Wang X, Chen B, Xu W, Liu S, Zhao W, Wu J. Combined effects of klotho and soluble CD40 ligand on A549 lung cancer cells. Oncol Rep. 2011;25:1465-1472. [PubMed] |
| 26. | Abramovitz L, Rubinek T, Ligumsky H, Bose S, Barshack I, Avivi C, Kaufman B, Wolf I. KL1 internal repeat mediates klotho tumor suppressor activities and inhibits bFGF and IGF-I signaling in pancreatic cancer. Clin Cancer Res. 2011;17:4254-4266. [PubMed] [DOI] |
| 27. | Xie B, Zhou J, Yuan L, Ren F, Liu DC, Li Q, Shu G. Epigenetic silencing of Klotho expression correlates with poor prognosis of human hepatocellular carcinoma. Hum Pathol. 2012; Oct 31. [Epub ahead of print]. [PubMed] [DOI] |
| 28. | Laitman Y, Kuchenbaecker KB, Rantala J, Hogervorst F, Peock S, Godwin AK, Arason A, Kirchhoff T, Offit K, Isaacs C. The KL-VS sequence variant of Klotho and cancer risk in BRCA1 and BRCA2 mutation carriers. Breast Cancer Res Treat. 2012;132:1119-1126. [PubMed] [DOI] |
| 29. | Chang B, Kim J, Jeong D, Jeong Y, Jeon S, Jung SI, Yang Y, Kim KI, Lim JS, Kim C. Klotho inhibits the capacity of cell migration and invasion in cervical cancer. Oncol Rep. 2012;28:1022-1028. [PubMed] |
| 30. | Chen B, Ma X, Liu S, Zhao W, Wu J. Inhibition of lung cancer cells growth, motility and induction of apoptosis by Klotho, a novel secreted Wnt antagonist, in a dose-dependent manner. Cancer Biol Ther. 2012;13:1221-1228. [PubMed] [DOI] |