修回日期: 2012-11-09
接受日期: 2012-11-15
在线出版日期: 2012-12-08
目的: 探讨七方胃痛颗粒对幽门螺杆菌(Helicobacter pylori, H. pylori)感染的人胃腺癌AGS细胞三叶因子1(trefoil factor family 1, TFF1)的表达及其细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)/核因子κB(nuclear factor-κB, NF-κB)信号通路的调控机制.
方法: 采用实时荧光定量PCR(RFQ-PCR)法检测TFF1 mRNA的表达, Western blot法检测TFF1、磷酸化ERK及NF-κB蛋白的表达水平; 同时采用U0126抑制ERK信号通路后, 观察AGS细胞TFF1蛋白表达的变化.
结果: 10%、20%、30%浓度七方胃痛颗粒药物血清作用H. pylori感染的AGS后, TFF1 mRNA表达量为271±33、305±23、327±13, 显著高于实验对照组的187±30, (P<0.05); TFF1、p-ERK及NF-κB蛋白表达量分别为271±22、358±31、428±34; 175±9、141±3、107±15; 116.0±2.6、83±2、53.0±6.6; 与实验对组的210±13比较, 差异具有统计学意义(均P<0.05). 加入U0126阻断ERK信号通路后, TFF1蛋白表达量为115±6, 与实验对照组的210±13比较, 差异具有统计学意义(P<0.05).
结论: 七方胃痛颗粒可能通过抑制ERK/NF-κB信号通路参与调控H. pylori诱导的AGS细胞TFF1表达, 促进上皮修复, 是其防治H. pylori诱发胃癌可能的机制之一.
引文著录: 莫喜晶, 曾光, 陈国忠. 七方胃痛颗粒对H. pylori感染的AGS细胞TFF1表达及ERK/NF-κB信号通路的影响. 世界华人消化杂志 2012; 20(34): 3292-3298
Revised: November 9, 2012
Accepted: November 15, 2012
Published online: December 8, 2012
AIM: To investigate the effect of Qifangweitong Granules on the expression of trefoil factor family 1 (TFF1) in human gastric cancer cell line AGS infected by Helicobacter pylori (H. pylori) and the possible regulatory mechanism involved.
METHODS: TAGS cells infected by H. pylori were exposed to Qifangweitong Granules in the presence or absence of U0126, a special inhibitor of ERK1/2 pathway. After treatment, the expression of TFF1 mRNA and protein in H. pylori-infected AGS cells was determined using real-time fluorescent quantitative polymerase chain reaction (RFQ-PCR) and Western blot, respectively.
RESULTS: Treatment with 10%, 20% and 30% Qifangweitong Granules drug serum significantly up-regulated the expression of TFF1 mRNA in AGS cells infected by H. pylori compared to control cells (271 ± 33, 305 ± 23, 327 ± 13 vs 187 ± 30, all P < 0.05). The protein expression of TFF1, p-ERK, and NF-κB in AGS cells treated with 10%, 20% and 30% Qifangweitong Granules drug serum was also significantly higher than that in control cells (TFF1: 271 ± 22, 358 ± 31, 428 ± 34 vs 210 ± 13, all P < 0.05). After blocking the ERK signal transduction pathway, the protein expression of TFF1 was significantly down-regulated compared to the control group (P < 0.05).
CONCLUSION: Treatment with Qifangweitong Granules regulates the expression of TFF1 in Helicobacter pylori-infected AGS cells possibly via the ERK/NF-κB signal transduction pathway.
- Citation: Mo XJ, Zeng G, Chen GZ. Qifangweitong Granules regulates the expression of TFF1 in Helicobacter pylori-infected AGS cells via the ERK/NF-κB signaling pathway. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3292-3298
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3292.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3292
幽门螺杆菌(Helicobacter pylori, H. pylori)感染与胃癌的发生密切相关, 世界卫生组织将其列为胃癌的一级致病因子[1]. H. pylori感染引起的慢性持续胃黏膜损伤的基础上出现萎缩性胃炎, 伴肠上皮化生和/或异型增生, 最终导致胃癌的发生. 三叶因子1(trefoil factor family 1, TFF1)作为胃肠道腔内黏膜及上皮细胞的早期关键修复因子及抑癌因子, 对胃肠道黏膜损伤的修复和胃肠道黏膜的完整性方面起着非常重要的作用, 也是防止损伤持续发展诱导胃癌的关键因子. 细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)是MAPK家族的重要成员, 目前大量的研究表明, ERK信号通路是多数生长因子和细胞因子调控细胞增殖的重要途径[2]. 核因子κB(nuclear factor-κB, NF-κB)是一种重要的核转录调控因子, 广泛存在于各种细胞中, 参与机体免疫应答、炎症反应、细胞凋亡及肿瘤形成过程[3]. 本课题组前期的研究发现, 七方胃痛颗粒对消化性溃疡具有良好的防治作用[4], 动物实验表明其能较好的促进黏膜上皮细胞再生, 增加黏液层厚度, 改善溃疡愈合效果[5], 同时研究表明七方胃痛颗粒能通过改善胃黏膜血流, 减轻腺体的破坏, 逆转胃黏膜腺体萎缩及肠上皮化生[6]. 本研究旨在探讨七方胃痛颗粒对H. pylori感染的人胃腺癌AGS细胞TFF1的表达及ERK/NF-κB信号通路的作用机制.
健康♂SD大鼠, SPF级, 体质量约250 g, 30只, 由广西中医药大学实验动物中心提供. AGS细胞株购自中科院上海细胞库; H. pylori标准株(ATCC43504)购自广州; 七方胃痛颗粒: 红参须10 g、白术10 g、黄芪30 g、茯苓12 g、炙甘草10 g、丹参6 g、木香6 g、黄连6 g 、吴茱萸3 g、白芍30 g、枳实10 g、炒鸡内金10 g, 原料药采用江阴天江药业有限公司生产的免煎中药颗粒, 由广西中医药大学第一附属医院制剂室提供, 将中药颗粒混合搅匀, 灭菌包装, 每小包含生药8 g; FastStart Universal SYBR Green Master(ROX)(Roche, 德国, 以下简称Mix); 总RNA抽提试剂盒(Tiangen公司); 反转录反应试剂盒(Fermentas公司, 美国); Ham's-F12培养基、胎牛血清(Gibico公司); 哥伦比亚血琼脂、脑心浸液(北京路桥公司); 脱脂绵羊血清(广州泌特生物技术有限公司); 鼠抗TFF1单克隆抗体(美国Santa Cruz公司); 兔抗人NF-κB p65抗体(美国Santa公司); P-ERK抗体(Promega公司); HRP标记山羊抗鼠二抗(北京中杉金桥有限公司); ERK抑制剂U0126[7](Sigma公司); BCA蛋白浓度测定试剂盒(Viagene公司); RIPA裂解液(强)碧云天生物工程有限公司. TFF1基因和GRPDH基因PCR引物由上海生工生物工程公司合成. 微需氧产气袋、密闭罐(日本三菱瓦斯化学株式会社); 5804R高速冷冻离心机(德国Eppendorf公司); 荧光定量PCR仪(Eppendorf Realplex, 德国).
1.2.1 细胞株与菌株培养: AGS细胞株在37 ℃、5%CO2饱和湿度条件下置于含10%胎牛血清的Ham's-F12培养基中, 常规培养. 将冻存的H. pylori菌株复苏后, 接种于含10%脱纤维绵羊血的哥伦比亚血琼脂培养基中, 于37 ℃、5%O2、10%CO2、85%N2微需氧条件下培养72 h, 经快速尿素酶、革兰染色等证实为H. pylori.
1.2.2 药物血清制备: 根据对大鼠用药按照动物体表面积以成人用量来折算的方法, 大鼠每日用量为成人剂量的0.018倍[8]. 先将药物用生理盐水稀释, 配制成浓度为2 g/mL的药物混悬溶液对大鼠灌胃, 按照1 mL/100g鼠质量, 2次/d, 连续5 d, 末次灌胃结束后禁食, 1 h后无菌条件下从腹腔采集静脉血, 静置3-4 h, 4 ℃ 3 000 r/min离心20 min, 超净台上分离血清. 将分离得到的血清置于56 ℃水浴中30 min灭活, 0.22 μm滤器过滤, -70 ℃冷藏备用. 实验时加入Ham's-F12培养基分别配制成含100、200、300 mL/L(即10%、20%、30%)药物血清的培养基.
1.2.3 H. pylori感染人胃腺癌AGS细胞: 取增殖活跃的AGS细胞以每板1×106接种于6孔板中. 当细胞贴壁后, 更换不含抗生素的细胞培养液, 用接种环刮取培养基上的H. pylori活菌, 悬于不含抗生素的细胞培养基中, 按紫外分光光度计测得A600值(1A = 2.5×109 CFU/mL), 调整H. pylori细菌密度, 按细菌和细胞数量100:1的比例向培养于6孔板中的AGS细胞中加入菌液, 继续培养24 h.
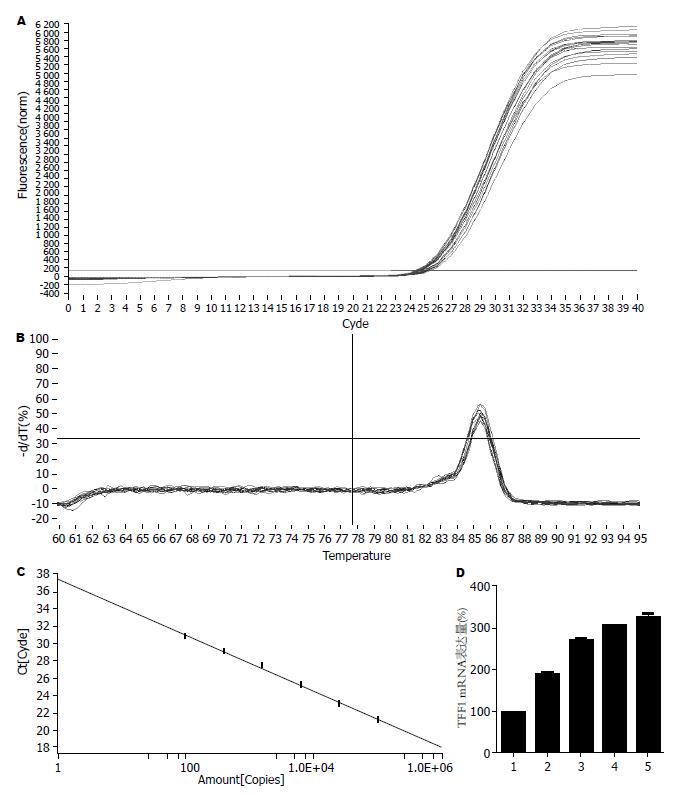
1.2.4 荧光定量PCR检测TFF1 mRNA的表达: 取对数生长期细胞分成5组, 分别加入10%、20%、30%的药物血清预培养4 h, 再按细菌与细胞100:1的比例加入H. pylori共同培养24 h, 同时以常规培养的AGS细胞为正常对照, AGS细胞加H. pylori为实验对照, 荧光定量PCR检测TFF1 mRNA的表达. (1)细胞总RNA的提取: 各组细胞分别加入细胞裂解液800 μL, 用移液器吹打均匀, 再加入预冷的氯仿200 μL, 剧烈震荡15 s, 静置3 min, 4 ℃, 12 000 r/min离心10 min. 小心吸取上层水相, 加入0.5倍体积的无水乙醇, 混匀之后转入吸附柱中4 ℃, 12 000 r/min离心30 s, 弃废液, 向吸附柱中加500 μL去蛋白液4 ℃, 12 000 r/min离心30 s, 弃废液, 向吸附柱中加700 μL漂洗液, 室温静置2 min, 4 ℃, 12 000 r/min离心30 s. 重复漂洗一次. 将吸附柱晾干后加入50 μL RNase-free ddH2O, 室温静置2 min, 4 ℃, 12 000 r/min离心2 min. 测定RNA浓度及纯度(A260/280为1.8-2.0), 置于-80 ℃保存备用; (2)逆转录反应: 将上述提取的总RNA按照逆转录试剂盒的说明书操作逆转录合成cDNA. 取3 μg总RNA, oligo(dT)18 1 μL, 加RNase-free water至总体积为12 μL, 微离心, 于PCR仪中65 ℃孵育5 min, 置冰上, 依次加入5×buffer 4 μL, Rnasin 1 μL, dNTP Mix 2 μL, M-MLV 1 μL, 混匀, 微离心, PCR仪中42 ℃孵育60 min, 70 ℃ 5 min终止反应. 合成的cDNA于-80 ℃保存备用; (3)实时荧光定量PCR反应(RFQ-PCR)TFF1上游引物序列为: 5'-GGAGAACAAGGTGATCTGCG-3', 下游引物序列为: 5'-CCCTTATTTGCACACTGGGA-3', 扩增产物大小为153 bp; GAPDH上游引物序列为: 5'-CTATAAATTGAGCCCGCAGC-3', 下游引物序列为: 5'-GACCAAATCCGTTGACTCCG-3', 扩增产物大小为143 bp. 反应体系(cDNA 1 μL、Mix 10 μL、10 μmol/L上、下游引物各0.6 μL、RNase-free Water 7.8 μL)反应总体积为20 μL进行PCR扩增反应, 反应条件: 95 ℃ 10 min预变性; 95 ℃ 15 s变性; 60 ℃ 1 min退火. 共40个循环; (4)不同样本表达量的测定: 按标准品的体系以及条件分别测定不同样本Ct值, 2-△△Ct计算基因表达的差异.
1.2.5 Western blot: 取对数生长期细胞, 分别加入10%、20%、30%含药药物血清, 预处理2 h, 再按细菌与细胞100:1的比例, 与H. pylori共培养24 h, Western blot检测TFF1、p-ERK及NF-κB蛋白表达. 另AGS细胞先加入10 μmol U0126培养2 h后, 与H. pylori共同培养24 h, Western blot检测TFF1蛋白表达水平. 以上均以常规培养的AGS细胞为正常对照, AGS细胞加H. pylori为实验对照. 各组细胞加入细胞裂解液, 冰上孵育30 min, 细胞裂解物于4 ℃, 14 000 r/min离心15 min, 取上清. BCD分析试剂测定蛋白浓度. 20 μg总蛋白质在SDS聚丙烯酰胺凝胶电泳分离后, 电转移至PVDF膜, 含5%脱脂奶粉的TBST液封闭, 室温震荡 1.5 h, 加一抗4 ℃过夜, HRP标记的二抗, 室温下震荡2 h后, 以1:1加入AB显影液, 用Bio-Rad Gel doc 2000凝胶成像分析系统进行胶片扫描并分析灰度值, 以目的条带与内参灰度值的比值反映蛋白的表达.
统计学处理 采用SPSS13.0统计软件进行统计分析, 计量资料以mean±SD, 多组均数间的比较采用单因素方差分析, 两两比较采用SNK检验, P<0.05表示差异具有统计学意义.
与正常对照组比较, H. pylori感染的AGS细胞TFF1 mRNA表达升高(P<0.05), 与实验对照组比较, 10%、20%、30%药物血清可显著上调H. pylori感染的AGS细胞TFF1 mRNA表达(P<0.05), 且随着药物血清浓度的增加, TFF1 mRNA表达量呈递增趋势(图1).
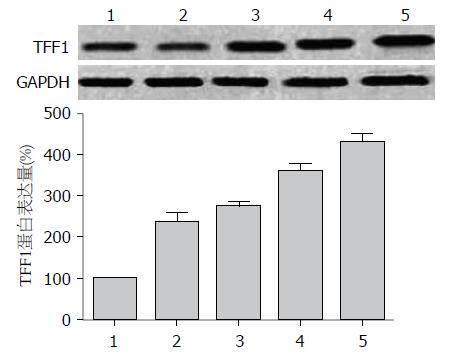
与正常对照组比较, H. pylori感染的AGS细胞TFF1蛋白表达升高(P<0.05), 与实验对照组比较, 10%、20%、30%药物血清可显著上调H. pylori感染的AGS细胞TFF1蛋白表达, 其表达水平随药物浓度增加而逐渐增加, 差异具有统计学意义(P<0.05, 图2).
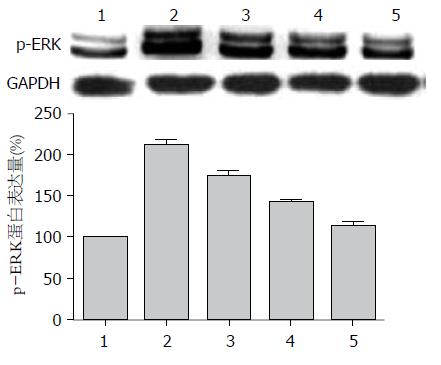
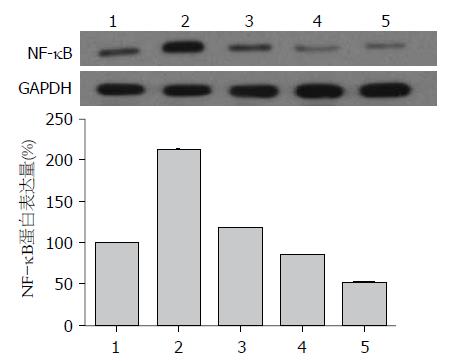
AGS细胞无H. pylori干预时有一定程度的ERK磷酸化水平, H. pylori感染AGS细胞后, p-ERK、NF-κB蛋白表达水平明显升高, 而七方胃痛颗粒药物血清干预后, p-ERK、NF-κB蛋白水平随药物浓度的增加而降低, 与实验对照组比较差异具有统计学意义(P<0.05, 图3, 4).
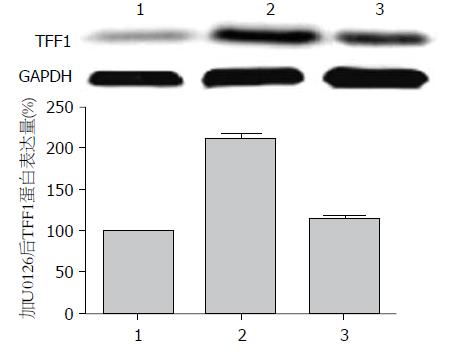
无H. pylori感染的AGS细胞TFF1蛋白仅有少量表达, 与H. pylori共培养后TFF1蛋白表达水平升高, U0126干预后, TFF1蛋白水平下降, 与实验对照组比较, 差异具有统计学意义(P<0.05, 图5).
胃癌的发生与H. pylori有着非常密切的关系, 这已是医疗界的共识. 1994年世界卫生组织将H. pylori列为Ⅰ类致癌因子. 如何快速修复H. pylori感染引起的黏膜损伤是维护胃黏膜屏障、防止黏膜损伤持续发展继而导致癌变的关键. TFF1是三叶肽家族成员之一, 是一类小分子的蛋白肽, 主要在胃黏膜小凹及上皮表达. 1982年由Masiakowski等[9]在雌激素诱导人的乳腺癌细胞系MCF-27中获得. TFF1作为胃肠道腔内黏膜及上皮细胞的早期关键修复因子, 对胃肠道黏膜损伤的修复和胃肠道黏膜的完整性方面起着非常重要的作用. 有研究[10]表明在胃炎及消化性溃疡组织中, TFF1的表达及较正常组织明显升高, 且多发/复合性溃疡TFF1表达较单发消化性溃疡表达升高, 胃黏膜损伤愈重, TFF1表达上调愈明显. Matsuda等[11]体外用H. pylori感染AGS, MKN45及KATOⅢ细胞后研究发现, H. pylori感染的AGS细胞TFF1表达显著上调. 任建林等[12]研究发现, 阿司匹林诱导的兔胃应激性溃疡周围TFF1表达较正常胃黏膜升高, 说明TFF1在胃黏膜保护中发挥了重要作用. Wright等[13]发现消化性溃疡附近区域存在一个特有的解剖结构, 称之为溃疡相关细胞系(ulcer associated cell lineage, UACL). UACL是一种腺样结构, 直接来源于胃肠腺隐窝基部干细胞, 可以不断地产生新细胞迁移到溃疡表面, 促进溃疡修复.
目前临床上对H. pylori的根除治疗主要以三联疗法为主, 也有研究报道[14]以PPI和铋剂为基础加两联抗生素的四联疗法, 但由于耐药及副作用大等问题的出现, 中医中药逐渐成为治疗消化性溃疡的焦点. 消化性溃疡、萎缩性胃炎伴肠上皮化生和(或异型增生)多属中医"胃痛""痞满"范畴, 临床主要表现为上腹不适、饱胀、烧灼痛、胀痛、隐痛、嗳气等, 其主要病机是脾胃虚弱为本, 继而出现气虚血瘀、湿热内生、肝脾不和. 七方胃痛颗粒是在对上述病机的认识上, 根据多年的临床经验总结的复方制剂. 方中红须参、黄芪益气健脾为君, 白术、白芍、丹参、木香、吴茱萸疏肝行气、制酸止痛为臣; 茯苓、枳实、炒鸡内金理气消食为佐. 全方共奏健脾益气、活血化瘀、清热利湿、理气止痛、消化滞胀之功效. 前期动物实验表明其能较好的促进黏膜上皮细胞修复再生, 减轻腺体的破坏, 逆转胃黏膜腺体萎缩及肠上皮化生.
本研究发现, 七方胃痛颗粒药物血清对H. pylori感染的AGS细胞TFF1 mRNA和蛋白的表达具有上调的作用, 并随着药物浓度的增加, 其表达量增加越明显, 这可能是七方胃痛颗粒抑制H. pylori感染, 促进损伤上皮修复, 防治H. pylori诱发胃癌的可能机制之一. 但是七方胃痛颗粒上调TFF1的表达机制还不清楚, 是否与ERK/NF-κB信号通路的参与有关, 我们进行了进一步的研究.
ERK是MAPK家族成员中最早得到证实的转导通路途径, 是由Boulton等[15,16]在20世纪90年代初被分离鉴定的一种蛋白激酶, 主要分为ERK1和ERK2, 统称为ERK1/2, 分子量分别为44 kDa和42 kDa. 各种细胞外信号的刺激因素能促使ERK通路的激活, 活化的ERK进一步活化下游的核转录因子NF-κB、AP-1等, 引起特定蛋白的表达和活性改变. 在多种肿瘤中, ERK具有高水平的磷酸化, 抑制ERK的磷酸化水平能够抑制抑制肿瘤细胞的生长、运动和浸润并可诱导细胞的凋亡[17-20]. 有研究表明[21], 人类胃癌组织中, ERK活性较正常组织高, CagA可以通过激活ERK1/2信号通路而促进正常胃上皮细胞的转化, 提高胃癌发生的危险性, 且ERK的活化在H. pylori诱导的胃癌细胞的转化过程中可能起着重要的作用[22]. NF-κB是一个多功能的核转录因子, 主要由P50/P65异源二聚体构成, 广泛存在于真核细胞中, 在静息状态下存在于胞浆中, 当其受炎症因子等的刺激后背激活, 从胞浆移位进入细胞核内, 调控相应的靶基因的过度或持续表达, 而NF-κB调节的产物又能刺激NF-κB的活化. 目前大量的研究[23-29]表明H. pylori感染可以激活NF-κB, 激活的NF-κB诱导IL-8、TNF-α等炎性因子基因转录而引起慢性活动性炎症. 有研究[30]证实, NF-κB激活诱导的TNF-α的释放, 均参与佛波酯诱导的实验性胃溃疡组织的损伤. 我们的前期研究[31]表明, 在TNF-α等炎症因子的刺激下, 胃黏膜上皮细胞TFF1的表达增加是通过炎症因子活化NF-κB信号通路来实现的. 那么七方胃痛颗粒对H. pylori感染人胃黏膜上皮细胞后TFF1表达增加是否由ERK及其下游转录因子NF-κB信号通路来实现. 我们的实验研究结果显示, H. pylori感染人胃黏膜上皮细胞后ERK磷酸化水平及NF-κB蛋白表达水平上升, 七方胃痛颗粒干预后, 以剂量依赖的方式上调H. pylori感染的AGS细胞TFF1蛋白及下调ERK磷酸化和NF-κB蛋白的表达, 用ERK抑制剂U0126阻断ERK信号通路后, TFF1蛋白表达下降, 说明七方胃痛颗粒对H. pylori感染的AGS细胞TFF1表达的增加有可能是通过抑制ERK/NF-κB信号通路来实现的, ERK/NF-κB信号通路在七方胃痛颗粒调控TFF1表达的作用中起着重要的作用.
由幽门螺杆菌(H. pylori)感染引起的胃黏膜损伤是导致胃癌发生的基础, TFF1基因作为胃肠道腔内黏膜及上皮细胞的早期关键修复因子及抑癌因子, 在胃肠道黏膜损伤修复和完整性方面起着重要作用. 七方胃痛颗粒在促进黏膜上皮细胞修复再生, 减轻腺体的破坏, 逆转胃黏膜腺体萎缩及肠上皮化生方面显示了较好的效果, 但其对TFF1表达的影响和机制尚未明确.
王蔚虹, 教授, 主任医师, 北京大学第一医院消化内科
本研究运用实时荧光定量PCR方法, 从基因转录和蛋白水平来分析七方胃痛颗粒对H. pylori感染胃上皮细胞TFF1表达的作用机制, 阐明该复方中药的作用机制.
本研究从体外活细胞着手, 将H. pylori按100:1感染人胃黏膜上皮细胞共培养, 施以七方胃痛颗粒药物血清及ERK信号通路抑制剂等因素, 观察TFF1基因的表达情况, 为阐明该复方中药治疗作用靶点提供理论依据.
本研究目标明确, 设计合理, 研究方法较先进, 实验数据可靠, 具有创新性, 有一定的科学意义.
编辑: 田滢 电编:闫晋利
| 1. | Zhu Y, Jiang Q, Lou X, Ji X, Wen Z, Wu J, Tao H, Jiang T, He W, Wang C. MicroRNAs up-regulated by CagA of Helicobacter pylori induce intestinal metaplasia of gastric epithelial cells. PloS one. 2012;7:e35147. [PubMed] [DOI] |
| 2. | Vicent S, López-Picazo JM, Toledo G, Lozano MD, Torre W, Garcia-Corchón C, Quero C, Soria JC, Martín-Algarra S, Manzano RG. ERK1/2 is activated in non-small-cell lung cancer and associated with advanced tumours. Br J Cancer. 2004;90:1047-1052. [PubMed] [DOI] |
| 3. | Karin M. Nuclear factor-kappaB in cancer development and progression. Nature. 2006;441:431-436. [PubMed] [DOI] |
| 5. | 邓 嫦, 罗 伟生, 李 桂贤, 唐 梅文. 七方胃痛胶囊(颗粒)对大鼠乙酸胃溃疡愈合质量的影响. 中国中西医结合消化杂志. 2005;13:179-181. |
| 7. | Favata MF, Horiuchi KY, Manos EJ, Daulerio AJ, Stradley DA, Feeser WS, Van Dyk DE, Pitts WJ, Earl RA, Hobbs F. Identification of a novel inhibitor of mitogen-activated protein kinase kinase. J Biol Chem. 1998;273:18623-18632. [PubMed] [DOI] |
| 8. | 徐 平. 实验动物管理与使用操作技术规程. 第1版. 上海: 上海科技出版社 2007; 201. |
| 9. | Masiakowski P, Breathnach R, Bloch J, Gannon F, Krust A, Chambon P. Cloning of cDNA sequences of hormone-regulated genes from the MCF-7 human breast cancer cell line. Nucleic Acids Res. 1982;10:7895-7903. [PubMed] [DOI] |
| 10. | Ren JL, Luo JY, Lu YP, Wang L, Shi HX. Relationship between trefoil factor 1 expression and gastric mucosa injuries and gastric cancer. World J Gastroenterol. 2005;11:2674-2677. [PubMed] |
| 11. | Matsuda K, Yamauchi K, Matsumoto T, Sano K, Yamaoka Y, Ota H. Quantitative analysis of the effect of Helicobacter pylori on the expressions of SOX2, CDX2, MUC2, MUC5AC, MUC6, TFF1, TFF2, and TFF3 mRNAs in human gastric carcinoma cells. Scand J Gastroenterol. 2008;43:25-33. [PubMed] [DOI] |
| 12. | 任 建林, 卢 雅丕, 王 琳, 陈 建民, 施 华秀, 叶 震世, 吴 艳环, 钟 燕, 林 逊汀, 林 辉. TFF1在正常及损伤胃黏膜中的表达改变. 世界华人消化杂志. 2003;11:1809-1810. [DOI] |
| 13. | Wright NA. Migration of the ductular elements of gut-associated glands gives clues to the histogenesis of structures associated with responses to acid hypersecretory state: the origins of "gastric metaplasia" in the duodenum of the specialized mucosa of barrett's esophagus and of pseudopyloric metaplasia. Yale J Biol Med. 1996;69:147-153. [PubMed] |
| 15. | Boulton TG, Yancopoulos GD, Gregory JS, Slaughter C, Moomaw C, Hsu J, Cobb MH. An insulin-stimulated protein kinase similar to yeast kinases involved in cell cycle control. Science. 1990;249:64-67. [PubMed] [DOI] |
| 16. | Boulton TG, Nye SH, Robbins DJ, Ip NY, Radziejewska E, Morgenbesser SD, DePinho RA, Panayotatos N, Cobb MH, Yancopoulos GD. ERKs: a family of protein-serine/threonine kinases that are activated and tyrosine phosphorylated in response to insulin and NGF. Cell. 1991;65:663-675. [PubMed] [DOI] |
| 17. | Ogunwobi OO, Beales IL. Adiponectin stimulates proliferation and cytokine secretion in colonic epithelial cells. Regul Pept. 2006;134:105-113. [PubMed] [DOI] |
| 18. | Sawhney RS, Cookson MM, Omar Y, Hauser J, Brattain MG. Integrin alpha2-mediated ERK and calpain activation play a critical role in cell adhesion and motility via focal adhesion kinase signaling: identification of a novel signaling pathway. J Biol Chem. 2006;281:8497-8510. [PubMed] [DOI] |
| 19. | Dreesen O, Brivanlou AH. Signaling pathways in cancer and embryonic stem cells. Stem Cell Rev. 2007;3:7-17. [PubMed] [DOI] |
| 20. | Fortino V, Torricelli C, Capurro E, Sacchi G, Valacchi G, Maioli E. Antiproliferative and survival properties of PMA in MCF-7 breast cancer cell. Cancer Invest. 2008;26:13-21. [PubMed] [DOI] |
| 21. | Zhu Y, Zhong X, Zheng S, Du Q, Xu W. Transformed immortalized gastric epithelial cells by virulence factor CagA of Helicobacter pylori through Erk mitogen-activated protein kinase pathway. Oncogene. 2005;24:3886-3895. [PubMed] [DOI] |
| 22. | Kacar F, Meteoğlu I, Yasa H, Levi E. Helicobacter pylori-induced changes in the gastric mucosa are associated with mitogen-activated protein kinase (MAPK) activation. Appl Immunohistochem Mol Morphol. 2007;15:224-228. [PubMed] [DOI] |
| 23. | Ferrand J, Lehours P, Schmid-Alliana A, Mégraud F, Varon C. Helicobacter pylori infection of gastrointestinal epithelial cells in vitro induces mesenchymal stem cell migration through an NF-κB-dependent pathway. PLoS One. 2011;6:e29007. [PubMed] [DOI] |
| 24. | Nozaki K, Tanaka H, Ikehara Y, Cao X, Nakanishi H, Azuma T, Yamazaki S, Yamaoka Y, Shimizu N, Mafune K. Helicobacter pylori-dependent NF-kappa B activation in newly established Mongolian gerbil gastric cancer cell lines. Cancer Sci. 2005;96:170-175. [PubMed] [DOI] |
| 25. | Ritter B, Kilian P, Reboll MR, Resch K, DiStefano JK, Frank R, Beil W, Nourbakhsh M. Differential effects of multiplicity of infection on Helicobacter pylori-induced signaling pathways and interleukin-8 gene transcription. J Clin Immunol. 2011;31:60-68. [PubMed] [DOI] |
| 26. | Choi IJ, Fujimoto S, Yamauchi K, Graham DY, Yamaoka Y. Helicobacter pylori environmental interactions: effect of acidic conditions on H. pylori-induced gastric mucosal interleukin-8 production. Cell Microbiol. 2007;9:2457-2469. [PubMed] [DOI] |
| 27. | Suganuma M, Watanabe T, Yamaguchi K, Takahashi A, Fujiki H. Human gastric cancer development with TNF-α-inducing protein secreted from Helicobacter pylori. Cancer Lett. 2012;322:133-138. [PubMed] [DOI] |
| 28. | Isomoto H, Mizuta Y, Miyazaki M, Takeshima F, Omagari K, Murase K, Nishiyama T, Inoue K, Murata I, Kohno S. Implication of NF-kappaB in Helicobacter pylori-associated gastritis. Am J Gastroenterol. 2000;95:2768-2776. [PubMed] |
| 29. | Kim do J, Park KS, Kim JH, Yang SH, Yoon JY, Han BG, Kim HS, Lee SJ, Jang JY, Kim KH. Helicobacter pylori proinflammatory protein up-regulates NF-kappaB as a cell-translocating Ser/Thr kinase. Proc Natl Acad Sci U S A. 2010;107:21418-21423. [PubMed] |
| 30. | Takeuchi T, Miura S, Wang L, Uehara K, Mizumori M, Kishikawa H, Hokari R, Higuchi H, Adachi M, Nakamizo H. Nuclear factor-kappaB and TNF-alpha mediate gastric ulceration induced by phorbol myristate acetate. Dig Dis Sci. 2002;47:2070-2078. [PubMed] [DOI] |
| 31. | Koike T, Shimada T, Fujii Y, Chen G, Tabei K, Namatame T, Yamagata M, Tajima A, Yoneda M, Terano A. Up-regulation of TFF1 (pS2) expression by TNF-alpha in gastric epithelial cells. J Gastroenterol Hepatol. 2007;22:936-942. [PubMed] [DOI] |