修回日期: 2012-09-09
接受日期: 2012-11-07
在线出版日期: 2012-11-28
目的: 研究鞘氨醇激酶1(sphingosine kinase 1, Sphk1)对人结肠癌HT-29细胞生成血管拟态(vasculogenic mimicry, VM)的影响及其可能的机制.
方法: 将人结肠癌HT-29细胞分为Sphk1抑制组、Sphk1激活组、对照组. Sphk1抑制组加入N,N-二甲基鞘氨醇(N,N-dimethyl-D-erythro-sphingosine, DMS)50 μmol/L; Sphk1激活组加入佛波醇-12-豆蔻酸酯-13-乙酸酯(phorbol 12-myristate-13-acetate, PMA)100 nmol/L; 对照组加入等量的培养基. 采用MTT法检测细胞生长增殖; 透射电镜观察细胞形态学变化; Matrigel三维培养法观察VM形成能力; Transwell小室模型观察细胞侵袭迁移能力的变化, QT-PCR、Western blot及ELISA技术检测血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达.
结果: DMS显著抑制细胞的增殖、侵袭、迁移并促进细胞凋亡; 透射电镜可见典型的凋亡特征; 三维培养中不能形成管状VM; 明显减弱VEGF mRNA及蛋白表达. PMA则显著促进HT-29细胞的增殖、侵袭、迁移并抑制细胞的凋亡; 透射电镜可观察到细胞增殖特征; 促进三维培养中管状VM的形成; 明显增强VEGF mRNA及蛋白表达. 对照组、DMS组及PMA组的侵袭细胞数: 112.00±6.25 vs 57.00±8.00, 142.00±5.57; 迁移细胞数: 69.33±4.04 vs 42.00±4.16, 111.00±8.03; VEGF mRNA表达量: 1.000 vs 0.740±0.122, 1.220±0.075; VEGF蛋白表达: 0.39±0.05 vs 0.23±0.02, 0.65±0.06; VEGF蛋白分泌: 103.00±8.96 vs 63.89±8.44, 201.01±17.93, 均P<0.05.
结论: Sphk1可促进HT-29细胞增殖、侵袭、迁移并抑制细胞的凋亡, 诱导VM的形成, 其机制可能是通过增强结肠癌细胞的侵袭迁移能力并促进VEGF表达而发挥作用.
引文著录: 李梦婷, 黄杰安, 周巧, 苏颖洁, 刘诗权, 覃蒙斌. 鞘氨醇激酶1对结肠癌细胞血管生成拟态的影响及其机制. 世界华人消化杂志 2012; 20(33): 3211-3217
Revised: September 9, 2012
Accepted: November 7, 2012
Published online: November 28, 2012
AIM: To investigate the role of sphingosine kinase 1 (Sphk1) in vasculogenic mimicry (VM) formation in human colon cancer cell line HT-29 in vitro.
METHODS: HT-29 cells were divided into three groups and treated with 100 nm/L of phorbol 12-myristate 13-acetate (PMA, Sphk1 activation group), 50 μmol/L of N,N-dimethyl-D-erythro-sphingosine (DMS, suppression group), and equal volume of culture medium (control group), respectively. After treatment, cell proliferation was determined by MTT assay, and cell invasiveness and migration were assessed by Transwell chamber assays. Cell apoptosis was observed by transmission electron microscopy (TEM). VM formation was observed in a three-dimensional culture system. The mRNA and protein expression of vascular endothelial growth factor (VEGF) was evaluated by QT-PCR and Western blot, respectively. The secretion of VEGF was detected by ELISA.
RESULTS: Treatment with DMS significantly suppressed cell proliferation, invasion and migration, promoted apoptosis, down-regulated VEGF mRNA and protein expression and secretion, and did not induce VM formation. In contrast, treatment with PMA significantly promoted cell proliferation, invasion (112.00 ± 6.25 vs 57.00 ± 8.00, 142.00 ± 5.57, both P < 0.05) and migration (69.33 ± 4.04 vs 42.00 ± 4.16, 111.00 ± 8.03, both P < 0.05), suppressed apoptosis, up-regulated VEGF mRNA (1.000 vs 0.740 ± 0.122, 1.220 ± 0.075, both P < 0.05) and protein (0.39 ± 0.05 vs 0.23 ± 0.02, 0.65 ± 0.06, both P < 0.05) expression and secretion (103.00 ± 8.96 vs 63.89 ± 8.44, 201.01 ± 17.93, both P < 0.05), and induced the formation of tubular VM.
CONCLUSION: Sphk1 promotes cell proliferation, invasion and migration, suppresses cell apoptosis, and induces VM formation possibly by up-regulating VEGF expression and secretion in human HT-29 colon cancer cell line.
- Citation: Li MT, Huang JA, Zhou Q, Su YJ, Liu SQ, Qin MB. Sphingosine kinase 1 induces vasculogenic mimicry formation by up-regulating VEGF expression and secretion in human colon cancer cell line HT-29. Shijie Huaren Xiaohua Zazhi 2012; 20(33): 3211-3217
- URL: https://www.wjgnet.com/1009-3079/full/v20/i33/3211.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i33.3211
鞘脂类物质, 特别是神经酰胺(ceramide, Cer), 鞘氨醇以及1-磷酸鞘氨醇(sphingosine-1-phosphate, S1P)在调节肿瘤细胞生长增殖过程中发挥着重要作用, S1P促进细胞增殖并抑制细胞凋亡, 调节血管生成, 而Cer与鞘氨醇则抑制细胞生长, 加速细胞凋亡[1]. 鞘氨醇激酶(sphingosine kinase, Sphk)磷酸化鞘氨醇成S1P, 其中Sphk1是调节S1P/Cer平衡的关键酶[2], 许多研究表明Sphk1/S1P信号传导通路参与肿瘤发生发展[3].
血管拟态(vasculogenic mimicry, VM)是一种由肿瘤细胞变形而构成并能传导血液的管腔样结构[4], 近年在恶性程度高的肿瘤中陆续发现他的存在[4-8], 这种管腔样结构其管壁不是由内皮细胞组成, 却表现出内皮细胞特性, 他的出现与预后不良及高死亡率密切相关[9], 然而, 形成VM的机制目前尚未清楚. 既往研究表明血管内皮生长因子(vascular endothelial growth factor, VEGF)在体外可促进肿瘤细胞排列成管道结构, 抑制VEGF表达可减少VM形成[10,11], 研究发现S1P可通过Gαi/o、PLC、胞内钙通路提高VEGF的转录水平, 并受MAPK、PI-3K、Akt、Erk等分子或信号途经调控[12], Sphk1作为S1P合成的催化酶, 对VEGF的调控以及对结肠癌细胞VM生成的影响目前尚未见报道.
本研究试图通过调控Sphk1的活性, 观察Sphk1对结肠癌细胞株HT-29形成VM的影响及对VEGF表达的影响, 以期探讨Sphk1对VM的形成的作用及其分子机制.
人结肠癌HT-29细胞购自中国科学院细胞库; 佛波醇-12-豆蔻酸酯-13-乙酸酯(phorbol 12-myristate 13-acetate, PMA)及McCOY's 5A培养液购自Sigma-Aldrich公司; 鼠抗人VEGF单克隆抗体和β-actin抗体购自Santa Cruz公司; N,N-二甲基鞘氨醇(N,N-dimethyl-D-erythro-sphingosine, DMS)购自Merck-Calbiochem公司; 四氮唑蓝(MTT)购自北京索莱宝科技有限公司; 逆转录聚合酶链反应(RT-PCR)试剂购自Fermentas公司; TRIzol购自Invirogen公司; 胎牛血清购自Gibco公司; 人工基质Matrigel购自BD Biosciences公司; FastStart universal SYBR Green master(Rox)购自Roche公司; VEGF ELISA试剂盒购自上海依科赛生物制品有限公司; 引物由上海生工生物工程技术服务有限公司合成.
1.2.1 细胞培养: 人结肠癌HT-29细胞株置于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的McCOY's 5A培养液中, 37 ℃、50 mL/L CO2、饱和温度条件下培养. 细胞单层生长, 铺满培养瓶约80%-90%时传代. 传代时常规吸去培养液, 用含0.25%胰蛋白酶消化液消化, 按所需浓度接种.
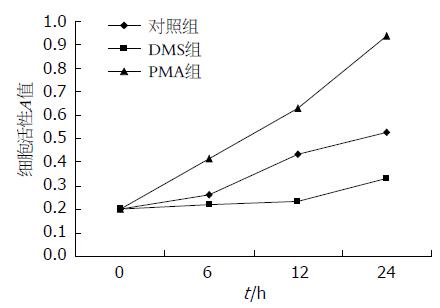
1.2.2 MTT比色法检测细胞增殖活性: 取对数生长期细胞, 接种于96孔培养板, 12 h后细胞贴壁, 分成3组: 分别加入100 nmol/L的PMA(PMA组)和50 μmol/L DMS(DMS组), 以等量培养基代药物为对照, 空白调零孔为无细胞等体积的培养基, 每组设3个复孔, 培养0、6、12、24 h后进行MTT检测. 用酶联免疫检测仪在490 nm波长下测定各孔吸光度(A)值.
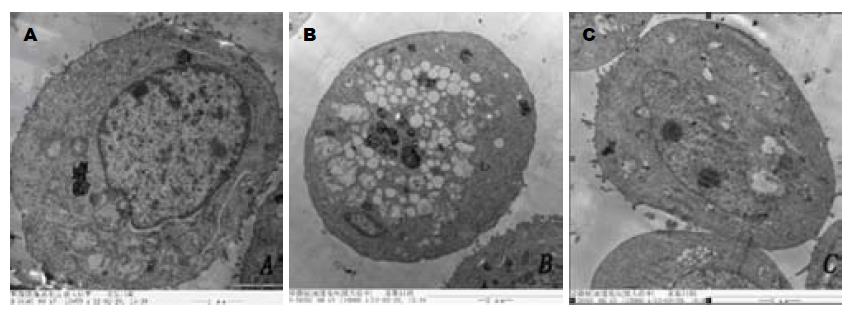
1.2.3 透射电镜超微结构观察: 取对数生长期细胞, 分组同前, 干预24 h后胰酶消化离心收集细胞, 2.5%戊二醛及锇酸固定, 丙酮梯度脱水, 树脂618包埋. LKB-V超薄切片机切片, 透射电镜下观察.
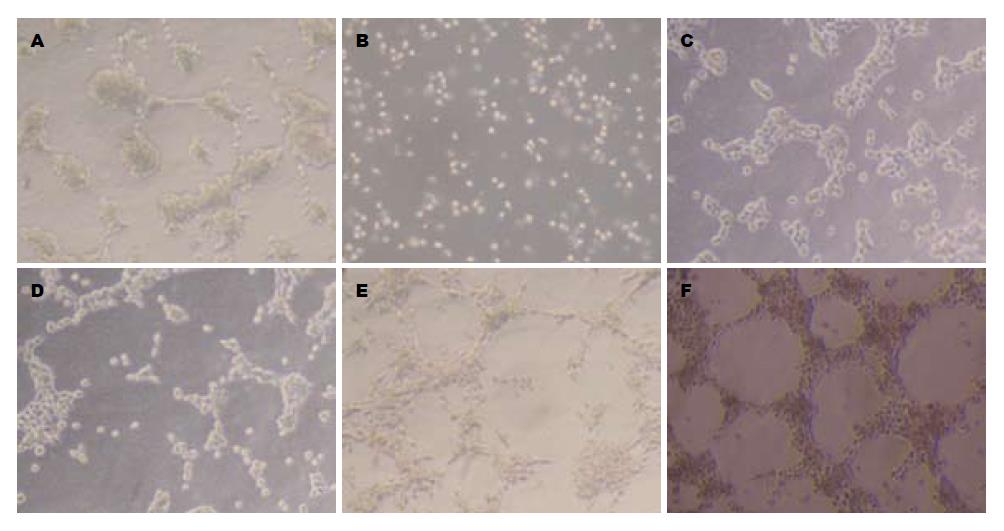
1.2.4 基质胶Matrigel三维培养: 将1 cm×1 cm盖玻片放入24孔培养板底壁后每孔中加入50 μL Matrigel原液, 37 ℃培养箱内温育1 h, 再加入约含1×105个细胞的完全培养基1 mL, 待细胞贴壁后进行分组, 于37 ℃培养0、6、12、24、48 h时, 用倒置显微镜进行观察拍照.
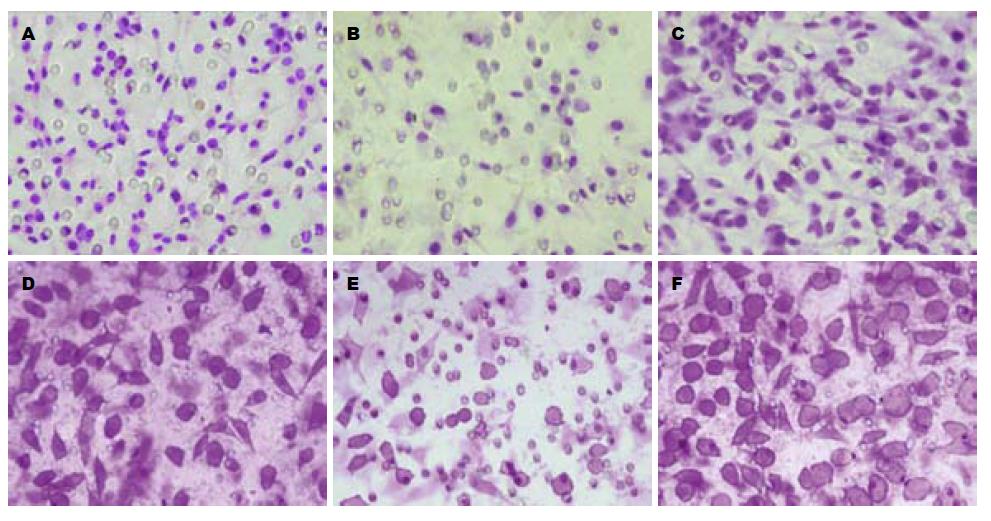
1.2.5 细胞迁移试验: 细胞经Sphk1活性调节剂干预24 h后, 胰蛋白酶消化细胞, 使细胞浓度调整为5×105个/mL, Transwell上室加200 μL细胞悬液, 下室加入600 μL细胞培养基, 37 ℃孵育24 h, 棉签擦去上室上面的非迁移细胞, 移去Transwell, 倒置风干, 0.1%结晶紫37 ℃染色30 min后取出, PBS清洗, 相差显微镜观察并拍照, 每个样片随机取4个视野拍照并计数迁移细胞, 计算平均值, 以空白试剂为对照, 分析数据. 细胞侵袭试验时, 用无血清的冷细胞培养基McCOY's 5A稀释Matrigel胶至8 mg/mL, 取100 μL稀释胶加至Transwell小室后, 细胞药物处理及其余操作均同迁移试验.
1.2.6 QT-PCR检测: Sphk1活性调节剂处理后细胞中VEGF mRNA的表达: 细胞分组处理24 h后采用TRIzol提取细胞总RNA, 用M-MLV逆转录酶合成cDNA. VEGF上游引物5'-CCAGCAGAAAGAGGAAAGAGGTAG-3', 下游引物5'-CCCCAAAAGCAGGTCACTCAC-3', 扩增片段长度133 bp; β-actin上游引物5'-TGACGTGGACATCCGCAAAG-3', 下游引物5'-CTGGAAGGTGGACAGCGAGG-3', 扩增片段长度203 bp. 20 μL PCR反应体系: 2×FastStart universal SYBR Green master (Rox) 10 μL, Rnase Free ddH2O 8 μL, 上、下游引物各0.5 μL, cDNA 1 μL. PCR反应条件: 起始变性95 ℃ 10 min, 95 ℃ 30 s, 60 ℃ 1 min, 重复40个循环; 以β-actin作为管家基因, 针对每个基因的每个样品设3个重复扩增管. 采用相对双Delta Ct法, 公式: 2-△△Ct, 进行定量分析.
1.2.7 Western blot法检测Sphk1活性调节剂处理后细胞中VEGF蛋白的表达: 各组细胞培养24 h后提取总蛋白, 行十二烷硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)并转至PVDF膜上, 5%脱脂牛奶封闭1 h, 加入抗VEGF抗体(1:200), 4 ℃过夜, TBST洗涤3次. 再用荧光标记的二抗杂交1 h, TBST洗涤3次, Odyssey红外荧光扫描成像系统进行扫描分析, 以目的条带与内参条带的灰度值比值作为目的蛋白的相对表达水平.
1.2.8 ELISA检测药物处理后细胞培养液中VEGF蛋白的含量: 按 1×104个细胞/孔接种至96孔板, 待细胞贴壁后在无血清培养基内加入药物进行处理, 作用24 h后收集细胞培养液上清. 倍比释稀标准品, 取100 μL标准品加入标准孔. 取培养基上清100 μL加入待测孔, 37 ℃孵育90 min; 弃液体, 每孔加入350 μL洗涤液, 静置30 s后弃去, 重复洗涤5次, 每孔加入生物素化抗体工作液100 μL, 37 ℃孵育60 min; 弃液体, 洗涤同前, 每孔加入酶结合物工作液100 μL, 37 ℃避光孵育30 min; 弃液体, 洗板同前, 每孔加入显色底物100 μL, 37 ℃避光孵育15 min, 每孔加入终止液100 μL, 混匀后于酶标仪上450 nm波长处测定A值, 570 nm波长校正, 根据标准品浓度及对应A值绘制标准曲线, 计算每孔待测品浓度.
统计学处理 使用统计软件为SPSS13.0, 以上实验均重复3次, 数据以mean±SD差表示. 统计分析采用t检验和单因素方差分析. 以P<0.05为差异有统计学意义.
DMS呈时间依赖性地抑制HT-29的增殖, PMA则呈时间依赖性地诱导HT-29的增殖(图1).
对照组细胞轮廓清晰, 表面有微绒毛, 胞浆丰富, 胞核形态规则, 核膜完整, 染色质分布均匀. DMS组可见典型的凋亡特征: 细胞变圆, 表面微绒毛消失, 胞质空泡化, 染色质浓缩, 边集. PMA组细胞表面有绒毛, 细胞核较大, 核仁明显(2个), 细胞器丰富(图2).
与对照组相比(表1, 图3), DMS抑制Sphk1活性后细胞侵袭与迁移能力明显减弱, 数量减少(P = 0.020, 0.002); PMA激活Sphk1活性后细胞侵袭与迁移能力明显增强, 数量增多(P = 0.013, 0.010).
对照组在三维培养48 h后可初步形成环状结构, 但并不完全形成明显的管形VM(图4A). DMS明显抑制结肠癌细胞的增殖、迁移、变形能力, 三维培养48 h后不能形成管状VM(图4B). PMA作用于结肠癌细胞6 h至24 h, 已可初步形成环状和网络状结构, 而在48 h时则形成明显的管状VM(图4C-F).
DMS降低VEGF mRNA的表达水平并明显抑制VEGF蛋白表达, 而PMA上调VEGF mRNA的表达水平同时明显增强VEGF蛋白表达(表2, 图5). 与对照组相比, DMS组和PMA组的VEGF mRNA拷贝量分别为1.000 vs 0.740±0.122, 1.220±0.075(P = 0.019, 0.006); 与对照组相比, DMS组和PMA组VEGF总蛋白表达强度分别为: 0.23±0.02 vs 0.23±0.02, 0.65±0.06(P = 0.035, 0.012).
| 分组 | 2-△△CT | P值 |
| 对照组 | 1 | |
| DMS组 | 0.740±0.122 | 0.019 |
| PMA组 | 1.220±0.075 | 0.006 |
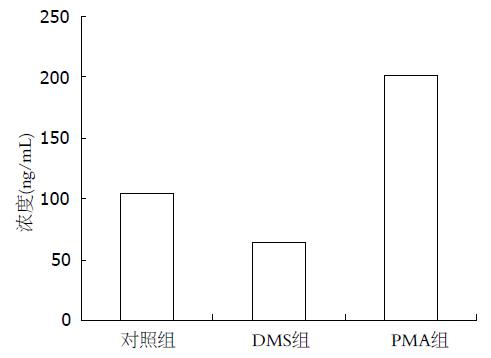
PMA显著促进VEGF的分泌, 而DMS显著抑制VEGF的分泌(图6). 对照组、PMA组和DMS组细胞培养上清液中VEGF分泌量(ng/L)分别为: 103.00±8.96 vs 63.89±8.44, 201.01±17.93(均P = 0.000).
Sphk1/S1P不仅调控正常细胞生命活动, 同时参与肿瘤发生发展、转移过程. Sphk1在胃癌中表达量与淋巴结转移、远处播散及预后不良关系密切[13]. 而抑制Sphk1的表达则能抑制胃癌细胞的增殖[14], 并提高卵巢癌细胞对姜黄素治疗的敏感性[15]. S1P与受体结合后, 激活MAPK、PI-3K、Akt等分子或信号通路来促进内皮细胞增殖、迁移及管腔化形成, 敲除Sphk1基因后, 小鼠在胚胎期由于内皮细胞发育不全而无法生成血管[16]. 血供是肿瘤赖以生存、生长的关键环节, 但目前针对血管内皮细胞靶基因的抗肿瘤血管生成的治疗效果并不理想. 后来研究相继在多种高度侵袭性肿瘤中发现肿瘤细胞在无内皮细胞参与下, 通过自身变形及与细胞外基质相互作用形成环状并具有肿瘤血供作用的图案样网络, 并将其称为VM, VM具有管型和图案样基质型两种类型, 由3个部分组成: 肿瘤细胞、重组的细胞外基质、与宿主的微循环系统的联接部分[4,17-19]. 多个研究证实VM存在实体瘤中: 乳腺癌移植瘤中央区血流与VM-内皮依赖性血管之间相互连接[6], VM作为血液循环的一部分出现在尤文肉瘤中[20], 血液通过渗漏方式进入肿瘤细胞所形成的图案并在其中流通[18], 而脱落的肿瘤细胞则可经过血液循环流到其他部位发生转移. 现有的研究表明VM仅出现在高度侵袭性的肿瘤中, 与转移早、预后差, 生存率低, 复发率高密切相关[9]. 本研究采用化学方法来调节Sphk1的活性, 发现激活Sphk1可增强细胞增殖侵袭迁移能力, 同时在三维培养中可形成管腔样VM, 而抑制Sphk1后细胞侵袭迁移能力变弱, 48 h内不能形成管腔样VM. 激活Sphk1/S1P信号通路不仅增加肿瘤细胞增殖、侵袭迁移能力, 同时可促进VM形成, 在肿瘤细胞生长转移中起重要作用. 之前有研究表明PMA不仅可以促进乳腺癌细胞形成管状结构, 同时上调VEGFR-2及VEGFR-3的表达[21], 而在结肠癌细胞中, Sphk1参与形成VM的机制是否与VEGF相关尚不明确.
VEGF是目前研究最多, 与血管形成关系最密切的促血管生成因子, 在胚胎发育、缺血性疾病和肿瘤血管生成中均发挥着关键调节作用. VEGF亦是调节肿瘤VM形成的一个关键因素: 已有研究以siRNA沉默VEGF基因后证实VEGF在骨肉瘤细胞形成VM过程中起关键作用[22], VEGF-A可在体外促进卵巢癌细胞及肝癌PLC细胞体外形成VM[23,24], 而经VEGF抗体阿伐斯汀(avastin)干预后原可形成VM的乳腺癌细胞则不能再形成VM[21]. VEGF在基因表达及转录水平上受到各种刺激因子影响, 包括缺氧、生长因子、激素、血管源性生长因子等. 研究发现S1P可通过Gαi/o、PLC、胞内钙通路提高VEGF的转录水平, 并受MAPK、Erk、PI-3K、Akt等分子及信号途经调控[12], 而Sphk1是S1P的关键催化酶, 通过调节Sphk1活性进而影响S1P生成. 本研究发现VEGF mRNA表达与蛋白表达随Sphk1活性的增加而增强, 随其减弱而降低, 因此Sphk1的活性不但与VEGF的转录水平而且与蛋白表达密切相关. 在细胞体外三维培养中Sphk1激活后形成VM, 其上清液中VEGF蛋白浓度明显增高, 表明VEGF参与Sphk1调控VM形成.
研究证实VEGF-a→EphA2→MMPs→VM是VM形成的主要途径[23], 基质金属蛋白酶-9(matrix-metalloproteinase- 9, MMP-9)激活VEGFR-2/VEGFR-3来促进乳腺癌细胞管状结构的形成[21]. 另有研究表明在侵袭性黑色素瘤细胞中破坏黏着斑激酶(focal adhesion kinase, FAK)信号可下调ERK1/2磷酸化, 导致尿型酶原激活物(urokinase-type plasminogen activator, UPA)和MMP-2/MT2-MMP下调, 从而抑制VM形成[25]. 我们前期的研究已证实Sphk1与FAK信号通路密切相关, 激活Sphk1可活化ERK1/2通路, 上调MMP-2、MMP-9和UPA的表达和分泌[26,27]. 因此, Sphk1可能通过ERK1/2通路调控VEGF、MMP2及MMP9分泌, 进而促进结肠癌HT-29细胞体外生成VM. Sphk1作为其中的调节关键点, 可成为结肠癌新的治疗靶点.
血管拟态(VM)是由肿瘤细胞变形构成的管腔样结构, 与预后不良及高死亡率密切相关, 形成VM的机制目前尚未清楚; 1-磷酸鞘氨醇(S1P)可调控血管内皮生长因子(VEGF)转录与表达, 而VEGF与VM形成密切相关; 鞘氨醇激酶1(Sphk1)作为S1P合成的催化酶, 对VEGF的调控以及对结肠癌细胞VM生成的影响目前尚未见报道.
卢晓梅, 教授, 研究员, 新疆医科大学第一附属医院临床医学研究院
现有的资料表明, VEGF-a→EphA2→MMPs→VM是VM形成的主要途径, S1P可促进VEGF表达, Sphk1作为调节S1P的关键酶是否可通过调节VEGF进而形成VM尚不清楚.
Heo等研究发现S-1P可通过Gαi/o、PLC、胞内钙通路提高VEGF的转录水平, 并受MAPK、ERK、PI-3K、Akt等分子及信号途经调控; Wang等发现VEGF在VM形成过程中起关键作用, 其作用途径为VEGF-a→EphA2→MMPs→VM; 我们的前期研究证明Sphk1可活化ERK1/2通路, 上调MMP-2、MMP-9和uPA的表达和分泌.
通过调控Sphk1的活性, 观察Sphk1对结肠癌细胞株HT-29形成VM的影响及对VEGF表达的影响, 以期阐明Sphk1对VM的形成的作用及其分子机制.
Sphk1调控VEGF及下游因子可能是VM形成的机制之一, Sphk1作为其中的调节关键点, 可成为结肠癌治疗新的靶点.
该研究有一定的新意, 研究相对完整, 为VM相关机制的研究提供了较为有力的数据支持
编辑: 翟欢欢 电编:鲁亚静
| 1. | Ogretmen B, Hannun YA. Biologically active sphingolipids in cancer pathogenesis and treatment. Nat Rev Cancer. 2004;4:604-616. [PubMed] [DOI] |
| 2. | Liu H, Chakravarty D, Maceyka M, Milstien S, Spiegel S. Sphingosine kinases: a novel family of lipid kinases. Prog Nucleic Acid Res Mol Biol. 2002;71:493-511. [PubMed] [DOI] |
| 3. | Xia P, Gamble JR, Wang L, Pitson SM, Moretti PA, Wattenberg BW, D'Andrea RJ, Vadas MA. An oncogenic role of sphingosine kinase. Curr Biol. 2000;10:1527-1530. [PubMed] [DOI] |
| 4. | Maniotis AJ, Folberg R, Hess A, Seftor EA, Gardner LM, Pe'er J, Trent JM, Meltzer PS, Hendrix MJ. Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry. Am J Pathol. 1999;155:739-752. [PubMed] [DOI] |
| 5. | Cai XS, Jia YW, Mei J, Tang RY. Tumor blood vessels formation in osteosarcoma: vasculogenesis mimicry. Chin Med J (Engl). 2004;117:94-98. [PubMed] |
| 6. | Shirakawa K, Kobayashi H, Heike Y, Kawamoto S, Brechbiel MW, Kasumi F, Iwanaga T, Konishi F, Terada M, Wakasugi H. Hemodynamics in vasculogenic mimicry and angiogenesis of inflammatory breast cancer xenograft. Cancer Res. 2002;62:560-566. [PubMed] |
| 7. | Sood AK, Fletcher MS, Zahn CM, Gruman LM, Coffin JE, Seftor EA, Hendrix MJ. The clinical significance of tumor cell-lined vasculature in ovarian carcinoma: implications for anti-vasculogenic therapy. Cancer Biol Ther. 2002;1:661-664. [PubMed] |
| 8. | Sun B, Zhang S, Zhao X, Zhang W, Hao X. Vasculogenic mimicry is associated with poor survival in patients with mesothelial sarcomas and alveolar rhabdomyosarcomas. Int J Oncol. 2004;25:1609-1614. [PubMed] |
| 9. | Folberg R, Hendrix MJ, Maniotis AJ. Vasculogenic mimicry and tumor angiogenesis. Am J Pathol. 2000;156:361-381. [PubMed] [DOI] |
| 10. | Sun B, Zhang D, Zhang S, Zhang W, Guo H, Zhao X. Hypoxia influences vasculogenic mimicry channel formation and tumor invasion-related protein expression in melanoma. Cancer Lett. 2007;249:188-197. [PubMed] [DOI] |
| 12. | Heo K, Park KA, Kim YH, Kim SH, Oh YS, Kim IH, Ryu SH, Suh PG. Sphingosine 1-phosphate induces vascular endothelial growth factor expression in endothelial cells. B. MB Rep. 2009;42:685-690. [PubMed] [DOI] |
| 13. | Zhuge YH, Tao HQ, Wang YY. [Relationship between sphingosine kinase 1 expression and tumor invasion, metastasis and prognosis in gastric cancer]. Zhonghua Yixue Zazhi. 2011;91:2765-2768. [PubMed] |
| 14. | Xia J, Wu Z, Yu C, He W, Zheng H, He Y, Jian W, Chen L, Zhang L, Li W. miR-124 inhibits cell proliferation in gastric cancer through down-regulation of SPHK1. J Pathol. 2012;227:470-480. [PubMed] [DOI] |
| 15. | Yang YL, Ji C, Cheng L, He L, Lu CC, Wang R, Bi ZG. Sphingosine kinase-1 inhibition sensitizes curcumin-induced growth inhibition and apoptosis in ovarian cancer cells. Cancer Sci. 2012;103:1538-1545. [PubMed] [DOI] |
| 16. | Mizugishi K, Yamashita T, Olivera A, Miller GF, Spiegel S, Proia RL. Essential role for sphingosine kinases in neural and vascular development. Mol Cell Biol. 2005;25:11113-11121. [PubMed] [DOI] |
| 18. | Frenkel S, Barzel I, Levy J, Lin AY, Bartsch DU, Majumdar D, Folberg R, Pe'er J. Demonstrating circulation in vasculogenic mimicry patterns of uveal melanoma by confocal indocyanine green angiography. Eye (Lond). 2008;22:948-952. [PubMed] [DOI] |
| 19. | Zhang S, Guo H, Zhang D, Zhang W, Zhao X, Ren Z, Sun B. Microcirculation patterns in different stages of melanoma growth. Oncol Rep. 2006;15:15-20. [PubMed] |
| 20. | van der Schaft DW, Hillen F, Pauwels P, Kirschmann DA, Castermans K, Egbrink MG, Tran MG, Sciot R, Hauben E, Hogendoorn PC. Tumor cell plasticity in Ewing sarcoma, an alternative circulatory system stimulated by hypoxia. Cancer Res. 2005;65:11520-11528. [PubMed] [DOI] |
| 21. | Karroum A, Mirshahi P, Faussat AM, Therwath A, Mirshahi M, Hatmi M. Tubular network formation by adriamycin-resistant MCF-7 breast cancer cells is closely linked to MMP-9 and VEGFR-2/VEGFR-3 over-expressions. Eur J Pharmacol. 2012;685:1-7. [PubMed] [DOI] |
| 22. | Mei J, Gao Y, Zhang L, Cai X, Qian Z, Huang H, Huang W. VEGF-siRNA silencing induces apoptosis, inhibits proliferation and suppresses vasculogenic mimicry in osteosarcoma in vitro. Exp Oncol. 2008;30:29-34. [PubMed] |
| 23. | Wang JY, Sun T, Zhao XL, Zhang SW, Zhang DF, Gu Q, Wang XH, Zhao N, Qie S, Sun BC. Functional significance of VEGF-a in human ovarian carcinoma: role in vasculogenic mimicry. Cancer Biol Ther. 2008;7:758-766. [PubMed] [DOI] |
| 25. | Hess AR, Postovit LM, Margaryan NV, Seftor EA, Schneider GB, Seftor RE, Nickoloff BJ, Hendrix MJ. Focal adhesion kinase promotes the aggressive melanoma phenotype. Cancer Res. 2005;65:9851-9860. [PubMed] [DOI] |