修回日期: 2012-10-08
接受日期: 2012-11-02
在线出版日期: 2012-11-18
目的: 探讨草苁蓉(boschniakia rossica, BR)乙醇提取物(boschniakia rossica ethanol extract, BREE)对大鼠非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的保护作用及其机制.
方法: 50只SD大鼠随机分为5组, 每组10只. 正常组普通饲料喂养, 模型组和高中低剂量BR组均以改良氨基酸及胆碱缺乏(choline-deficient amino acid-defined, CDAA)的饲料喂养8 wk. 实验第2周始高、中、低剂量BR组分别按大鼠体质量每日给予500、250、125 mg/kg的BREE灌胃. 实验第8周末, 全部大鼠经门静脉采血和取肝组织标本, 常规方法检测血清生化指标, ELISA法测定血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α), 免疫组织化学染色观察肝组织细胞色素P4502E1(CYP 2E1)、α-平滑肌激动蛋白(α-smooth muscle actin, α-SMA)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)及组织基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1, TIMP-1)的表达, HE染色观察肝组织病理变化.
结果: 高剂量BREE组血清丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)和总胆汁酸(total bile acids, TBA)的水平显著低于模型组(41.31±12.32 vs 67.92±1.28, 42.12±6.32 vs 74.12±5.20, 68.20±32.62 vs 129.56±23.12, 均P<0.01); 高剂量BREE血清TNF-α水平显著低于模型组(31.20±2.44 vs 70.04±12.62, P<0.05); 高剂量BREE组肝组织CYP 2E1表达水平显著低于模型组(1.20±0.44 vs 5.30±2.62, P<0.01); 高剂量BREE组血清ALT、AST、TBA、TNF-α和肝组织CYP 2E1表达水平均低于低剂量组(均P<0.05); 模型组肝组织α-SMA、TGF-β1及TIMP-1均呈阳性, 而BR组及正常组均呈阴性; 模型组肝组织呈重度脂肪变性及坏死, 汇管区大量炎症细胞浸润, 而不同剂量BREE组的这些病理改变呈不同程度的改善.
结论: BREE对改良CDAA诱导的大鼠NAFLD有明显的保护作用, 其机制可能与下调肝组织CYP 2E1表达和血清TNF-α有关; BREE对大鼠NAFLD肝组织α-SMA、TGF-β1及TIMP-1的表达有抑制作用, 提示具有抗非酒精性脂肪性肝病纤维化的作用.
引文著录: 张炜煜, 朴熙绪, 金海燕, 李成浩, 金爱花, 韩红梅. 草苁蓉乙醇提取物对大鼠非酒精性脂肪性肝病的保护作用及机制. 世界华人消化杂志 2012; 20(32): 3087-3094
Revised: October 8, 2012
Accepted: November 2, 2012
Published online: November 18, 2012
AIM: To assess the protective effect of boschniakia rossica ethanol extract (BREE) on non-alcoholic fatty liver disease (NAFLD) in rats and explore the possible mechanisms involved.
METHODS: Fifty SD rats were randomly and equally divided into five groups: normal group, model group, and three BREE groups. The normal group was fed a normal diet, and the model group and BREE groups were fed a diet with choline-deficient amino acid-defined (CDAA) for 8 wk to induce NAFLD. From the second week, the three BREE groups were intragastrically administered with high- (500 mg/kg), medium- (250 mg/kg) and low-dose (125 mg/kg) BREE daily. At the end of the 8th week, portal vein blood and liver tissue samples were taken from all the rats. Serum biological parameters were determined routinely, and tumor necrosis factor-α (TNF-α) was determined by ELISA. Expression of CYP 2E1, α-smooth muscle actin (α-SMA), transforming growth factor-β1 (TGF-β1), and tissue inhibitor of metalloproteinase-1 (TIMP-1) in liver tissue were determined by immunohistochemistry, and pathological changes in liver tissues were detected by HE staining.
RESULTS: The levels of alanine aminotransferase, aspartate transaminase, total bile acids, TNF-α in serum and CYP 2E1 expression in liver tissue were lower significantly in the high-dose BREE group than in the model group (41.31 ± 12.32 vs 67.92 ± 1.28, 42.12 ± 6.32 vs 74.12 ± 5.20, 68.20 ± 32.62 vs 129.56 ± 23.12, all P < 0.01; 31.20 ± 2.44 vs 70.04 ± 12.62, P < 0.05; 1.20 ± 0.44 vs 5.30 ± 2.62, P < 0.01), and in the high-dose BREE group than in the low-dose BREE group (all P < 0.05). Expression of α-SMA, TGF-β1 and TIMP-1 was detectable in liver tissue in the model group, but not in the three BREE groups and normal group. Rats of the model group showed severe fatty liver degeneration and necrosis, infiltration of a large number of inflammatory cells in portal area, and varying degrees of improvement of these hepatic pathologic lesions were observed in the BREE groups.
CONCLUSION: BREE has a significant protective effect on CDAA-induced NAFLD in rats possibly via mechanisms related to decreasing expression of liver CYP-2E1 and serum TNF-α levels. The observation that BREE inhibited the expression of α-SMA, TGF-β1 and TIMP-1 in liver tissue in rats with NAFLD suggests that BREE may have anti-non alcoholic liver fibrosis effect.
- Citation: Zhang WY, Piao XX, Jin HY, Li CH, Jin AH, Han HM. Protective effect of boschniakia rossica ethanol extract on nonalcoholic fatty liver disease in rats and mechanisms involved. Shijie Huaren Xiaohua Zazhi 2012; 20(32): 3087-3094
- URL: https://www.wjgnet.com/1009-3079/full/v20/i32/3087.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i32.3087
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)现已成为常见的慢性肝病之一, 通过单纯性脂肪肝, 脂肪性肝炎和肝纤维化过程, 最终可发展成肝硬化和肝癌[1-5], 因此NAFLD防治领域的研究备受国内外关注. 草苁蓉(boschniakia rossica, BR)是一种主要生长在我国长白山地区的贵重药用植物. 近年来研究发现, BR对D-氨基半乳糖诱导的大鼠急性肝损伤和二甲基亚硝胺、猪血清诱导的大鼠肝纤维化具有保护作用[6-8], 但BR对非酒精性脂肪性肝病有无保护作用尚不清楚. 本实验采用改良氨基酸及胆碱缺乏(choline-deficient amino acid- defined, CDAA)饮食诱导的大鼠NAFLD模型, 探讨了BR乙醇提取物(boschniakia rossica ethanol extract, BREE)对NAFLD的保护作用及其部分机制.
1.1.1 BREE制备: BR采自吉林省长白山, 质量约 800 g, 经干燥24 h, 将BR切碎后, 用900 mL/L乙醇回流提取3次/h, 温度为100 ℃, 合并3次滤液, 减压浓缩, 获得提取液, 将提取液用旋转蒸发器和真空干燥离心机减压浓缩, 获得固态BREE. 实验临用前以生理盐水分别配置成不同浓度.
1.1.2 改良氨基酸及胆碱缺乏饲料制备: 参考文献并加以改进[9,10]. 主要成分(g/kg)包括蔗糖400.0, 玉米淀粉128.0, 氢化植物油200.0, 玉米油50.0, 纤维素50.0, 糊精100.0, 酪蛋白10.0, 胱氨酸2.0; NaCl 29, CaHPO4 16.6, MgSO4 1.6, 柠檬酸钾9.9; 并含少量各种维生素, 电解质及矿物质.
1.2.1 实验动物模型及分组: ♀SD大鼠50只 6 wk周龄, 体质量为160-200 g, 清洁级, 由延边大学医学部实验动物中心提供. 饲养温度: 23 ℃±2 ℃; 湿度: 50%±20%; 12 h光照和黑夜循环, 水和食物均为随意摄取. SD大鼠以普通饲料饲养1 wk后, 按体质量随机分为5组(每组10只), 正常对照组以普通饲料喂养, 模型对照组、高、中、低浓度BR以CDAA饲料喂养, 共计8 wk. 实验第2周始, 高、中、低剂量BR组分别按大鼠体质量每日给予500、250、125 mg/kg BREE, 以5 mL生理盐水溶解后灌胃, 模型组与正常组给予5 mL/只生理盐水灌胃. 每周称体质量2次, 调整相应的药物剂量. 第8周末, 所有大鼠禁食水12 h后, 水合氯醛麻醉下, 经门静脉抽血5 mL, 常规制备血清; 取出肝脏并称取质量, 留取肝脏左叶组织2块, 分别制备病理组织标本和免疫组织化学标本.
1.2.2 检测指标及方法: (1)大鼠肝脏指数 = 肝脏湿质量/大鼠体质量×100; (2)血清丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)、总胆汁酸(total bile acids, TBA)用日立7080全自动生化分析仪检测; (3)血清肿瘤坏死因-α(tumor necrosis factor-α, TNF-α)用R and D System公司ELISA检测试剂盒定量检测; (4)肝组织P4502E1(CYP 2E1)的表达采用武汉博士德公司的免疫组织化学试剂盒检测, 结果参照国际标准免疫组织化学质控活度为标准, 分别进行染色强度评分(阴性着色为0分、淡黄色为1分、浅褐色为2分、深褐色为3分)、阳性细胞数量评分(0-25%细胞染色为1分、26%-50%细胞染色为2分、51%-75%细胞染色为3分、76%-100%细胞染色为4分); 细胞染色数量分值和细胞染色强度分值乘积来表示染色指数; (5)α-平滑肌激动蛋白(α-smooth muscle actin, α-SMA)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)及组织基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1, TIMP-1)的表达均采用武汉博士德公司的免疫组织化学试剂盒定性检测; (6)HE染色观察肝脏组织病理学改变, 肝细胞脂肪变性程度和炎症活动程度判断标准按照文献进行[11].
统计学处理 检测结果以mean±SD表示, 用SPSS10.0软件进行数据分析, 各组间比较用t检验, P<0.05差异具有显著性.
2.1.1 BREE对NAFLD大鼠肝指数的影响 模型组的肝脏指数高于正常组(P<0.01); 高、中剂量组肝脏指数低于模型组(P<0.01)和低剂量BREE组(P<0.05, 表1).
2.1.2 BREE对NAFLD大鼠血清ALT、AST及TBA水平的影响 模型组血清ALT、AST和TBA值明显高于正常组, 差异具有显著性(P<0.01); 与模型组比较, 高剂量BREE组血清ALT、AST、TBA和中剂量组的ALT水平明显低于模型组(P<0.01); 高剂量BREE组血清ALT、AST、TBA低于低剂量BREE组(P<0.01, 表2).
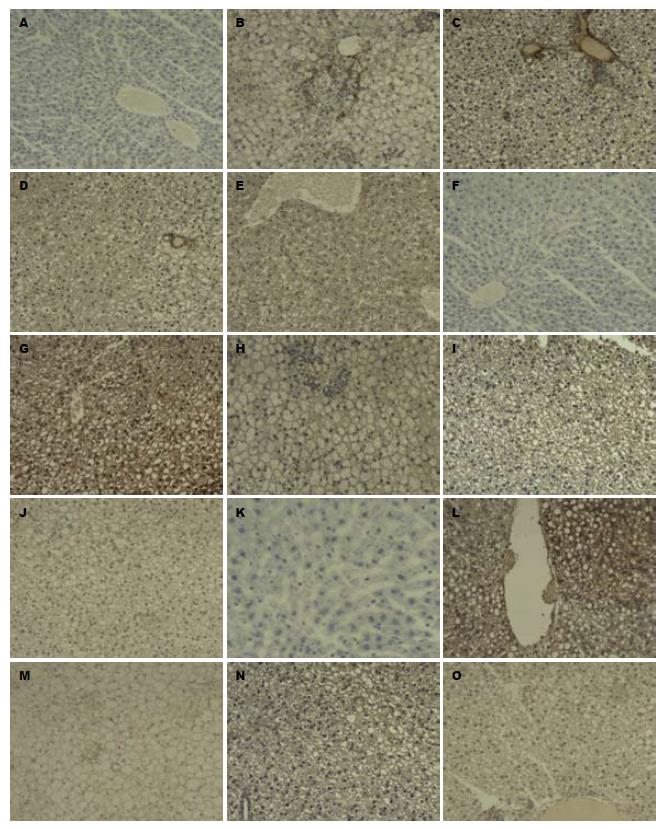
CYP 2E1在正常组大鼠肝脏不表达; 而在模型组肝脏组织中呈高表达; 与模型组比较, 高剂量和中剂量BREE组肝脏CYP 2E1的表达水平降低. 模型组大鼠血清中TNF-α水平明显高于正常组; 高剂量BREE组血清TNF-α水平明显低于模型组和低剂量BREE组, 具有统计学意义(表3).
免疫组织化学检测发现, 模型组大鼠肝组织α-SMA、TGF-β1及TIMP-1呈不同程度的阳性表达, 正常组及不同剂量BREE组均呈阴性(图1). 本实验结果表明, BREE可能具有抗纤维化作用.
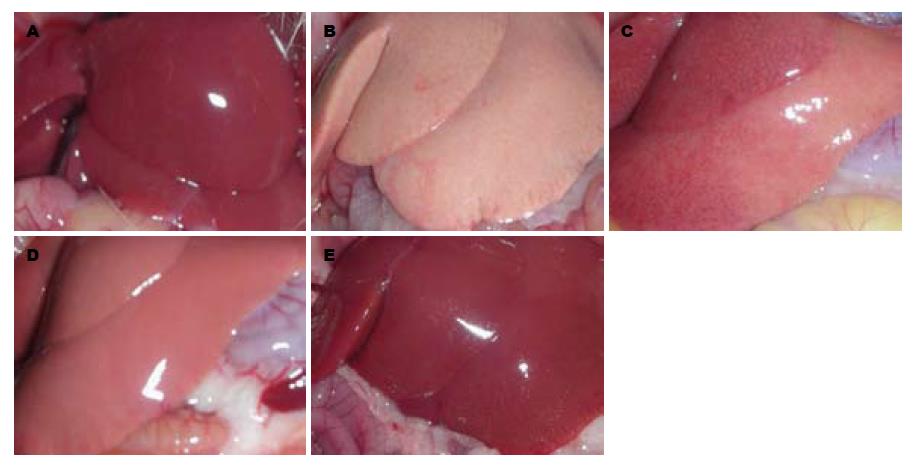
2.4.1 肉眼观察: 正常组大鼠肝脏组织无明显变化. 模型组大鼠肝脏组织体积明显增大, 包膜紧张, 肝脏染色呈黄色, 切边油腻感. 而BREE高、中、低剂量组肝组织情况较模型组有不同程度的改善(图2).
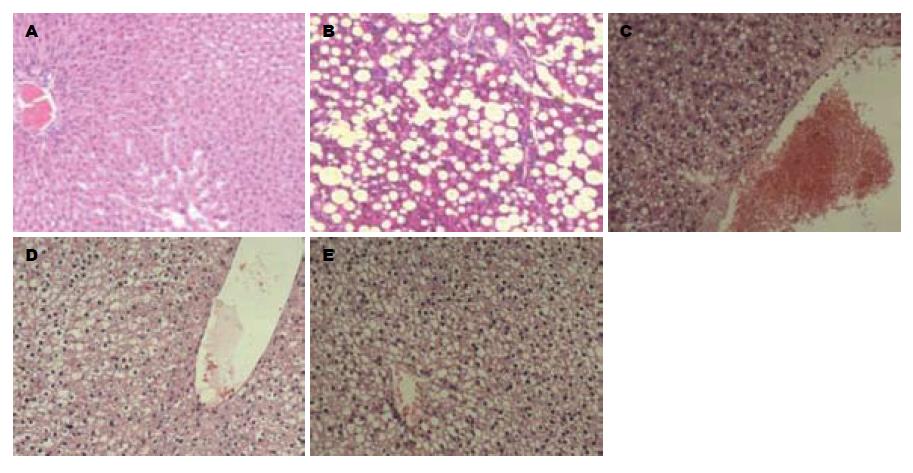
2.4.2 HE染色光镜下观察: 正常组大鼠肝小叶结构完整, 肝索排列规则, 肝细胞形态正常; 模型组大鼠肝脏均出现重度脂肪变性, 肝细胞明显肿大, 胞浆内充满以大泡型为主的脂肪空泡或脂滴, 并伴有肝细胞的变性及坏死, 汇管区大量炎症细胞浸润, 脂肪变性细胞以汇管区周围较明显, 呈极度肿胀, 肝窦狭窄, 未见纤维间隔形成; 不同剂量BREE组与模型组大鼠肝脏比较, 大鼠肝脂肪变性程度和炎症均有不同程度的改善, 其中以高剂量组和中剂量组改善较为显著, 肝细胞变性显著减少, 仅见少许脂肪空泡及点状坏死, 汇管区无明显炎症细胞浸润. 实验结果表明, 与模型组比较, 高、中剂量BREE组大鼠肝脂肪变性程度和炎症均有不同程度的改善; 与低剂量组比较, 高、中剂量BREE组的脂肪变性程度和高剂量BREE组的炎症改善更为明显(表4, 5, 图3).
据报道, 目前全球普通人群中NAFLD的患病率约为17%-33%[12], 约30%的非酒精性脂肪性肝炎在5-10年内发展成肝纤维化, 进而发展成肝硬化甚至肝癌[13,14]. 药物干预是NAFLD防治领域的重要和热门课题[15-19].
本实验采用改良的CDAA建立大鼠NAFLD模型, 观察了不同浓度BREE连续灌胃对大鼠NAFLD的保护作用, 发现高剂量与中剂量BREE组的大鼠血清ALT、AST、TBA水平显著低于模型组, 提示BREE可能具有维持肝细胞膜稳定性的作用. 组织病理学观察也证实高剂量与中剂量BREE能明显减轻肝脏的病理损伤, 明显减轻大鼠肝细胞脂肪变性及炎症程度, 表明BREE对NAFLD有保护作用.
细胞色素P450酶是肝脏主要代谢酶, 其中CYP 2E1在肝细胞物质代谢方面起主要作用. 在非酒精性脂肪性肝病发病过程中CYP2 E1过度表达并起重要作用[20-23]. CYP 2E1的活化使微粒体NADPH依赖的脂质过氧化增强, 并能增加肝组织的氧耗[24]. NAFLD发病过程中, CYP 2E1呈高水平表达, 在反应性氧化产物和脂质过氧化产物产生中具有重要作用, 促进肝细胞的脂肪变性[25-27]. 近年来有文献报道, BREE具有抗脂质过氧化和清除氧自由基的作用[28]. 本实验结果发现, BREE刺激的NAFLD大鼠肝组织CYP 2E1表达显著低于模型大鼠肝组织, 提示BREE对NAFLD的保护作用可能与其降低肝脏CYP 2E1表达, 从而抑制脂质过氧化反应有关. TNF-α是一种主要由单核-巨噬细胞产生的细胞因子, 在机体抗肿瘤, 免疫调节, 组织损伤, 炎性反应等过程中发挥重要作用. 已有较多文献报道TNF-α与肥胖及胰岛素抵抗密切相关[29-33], NAFLD患者内脏脂肪组织中TNF-α显著增多[34], 血清TNF-α水平与NAFLD的肝损伤程度呈正相关[35]. 本实验中NAFLD模型大鼠血清TNF-α水平明显高于正常组, 与文献报道一致, 而高剂量BREE刺激的NAFLD大鼠血清TNF-α水平明显低于模型组, 提示BR对NAFLD的保护作用与其抑制细胞因子TNF-α, 减轻炎症反应有关.
肝星状细胞(hepatic stellate cells, HSCs)是引起肝纤维化的关键细胞, 在NAFLD发生发展中起着重要作用. 当肝脏受损时, 静止状态的HCSs被激活, 活化的HCSs表达α-SMA, 可产生Ⅰ、Ⅲ型胶原蛋白. 活化的HCSs能产生基质金属蛋白酶(matrix metalloprotein-nases, MMP)和TIMP. MMPs在体内参与降解过多合成的基质胶原成分, 主要降解Ⅰ、Ⅲ型胶原; 而TIMPs抑制MMPs的功能, 从而抑制胶原的降解, 促进肝纤维化的发生[36]. 活化的HCSs还可促进肝细胞释放TGF-β1, TGF-β1可进一步促进HSCs增殖和激活, 促进细胞外基质的合成,是最重要的促肝纤维化因子之一[37]. 本实验结果表明, α-SMA、TGF-β1及TIMP-1在NAFLD模型大鼠肝脏组织均呈阳性, 而BREE不同剂量组和正常对照组大鼠肝脏组织均呈阴性. 可能因为实验周期较短, 本实验模型组没有形成肝纤维化, 没能从病理组织学角度证实BR抗非酒精性脂肪性肝纤维化的作用, 但在过去研究中已经证实BR对二甲基亚硝胺诱导和猪血清诱导的大鼠肝纤维化有保护作用, 因此本次实验中BR抑制肝组织α-SMA、TGF-β1及TIMP-1的表达, 可能提示BR具有抗非酒精性脂肪性肝纤维化的作用, 但仍需进一步证实.
非酒精性脂肪性肝病(NAFLD)可经过脂肪性肝炎发展为肝硬化和肝癌, 现已成为威胁人类健康和生命的常见病. 对本病的治疗多强调饮食、运动等生活方式的改善, 尚无安全和有效的治疗药物. 因此, 开发NAFLD防治药物的研究具有重要的临床意义.
张锦生, 教授, 复旦大学上海医学院病理学系
NAFLD的发生首先是由肥胖、糖尿病、高血脂等代谢异常疾病导致肝细胞内脂肪过度堆积, 其次是脂质过氧化和氧化应急破坏肝细胞, 使疾病进展为肝炎, 肝硬化. 针对这些发病的不同环节开发改善代谢的药物和抗氧化药物一直是全世界非酒精性脂肪性肝病治疗领域的热点.
有关BR的药理及治疗肝病的报道提示, BR具有抗自由基作用, 对D-氨基半乳糖诱导的大鼠急性肝损伤和二甲基亚硝胺、猪血清诱导的大鼠肝纤维化有保护作用.
利用胆碱缺乏食物诱导的大鼠动物模型来探讨BR乙醇提取物对NAFLD的药理作用及其相关机制尚属首次.
本研究为开发和利用天然中草药BR防治NAFLD提供了比较重要的实验依据, 有较好的应用前景和实用价值.
细胞色素P4502E1(CYP 2E1): 细胞色素P450是一类在波长450 nm处有吸收峰的含血红素的单链蛋白质, CYP 2E1是细胞色素P450代谢酶家族中的重要一员, 在许多内源性和外源性物质代谢中起重要作用.
本文初步探讨了BR乙醇提取物抗NAFLD的药理机制. 实验设计合理, 资料较完整, 内容有新意, 对临床医师有一定的参考价值.
编辑: 翟欢欢 电编:闫晋利
| 1. | Lam B, Younossi ZM. Treatment options for nonalcoholic fatty liver disease. Therap Adv Gastroenterol. 2010;3:121-137. [PubMed] [DOI] |
| 2. | Bellentani S, Scaglioni F, Marino M, Bedogni G. Epidemiology of non-alcoholic fatty liver disease. Dig Dis. 2010;28:155-161. [PubMed] [DOI] |
| 3. | Bellentani S, Marino M. Epidemiology and natural history of non-alcoholic fatty liver disease (NAFLD). Ann Hepatol. 2009;8 Suppl 1:S4-S8. [PubMed] |
| 4. | Chitturi S, Wong VW, Farrell G. Nonalcoholic fatty liver in Asia: Firmly entrenched and rapidly gaining ground. J Gastroenterol Hepatol. 2011;26 Suppl 1:163-172. [PubMed] [DOI] |
| 5. | Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther. 2011;34:274-285. [PubMed] [DOI] |
| 8. | Wu CS, Piao XX, Piao DM, Jin YR, Li CH. Treatment of pig serum-induced rat liver fibrosis with Boschniakia rossica, oxymatrine and interferon-alpha. World J Gastroenterol. 2005;11:122-126. [PubMed] |
| 9. | 钱 晓武, 范 竹萍, 汪 晓红, 盛 黎, 奚 志峰, 邱 德凯. 改良蛋氨酸胆碱缺乏饮食喂养的非酒精性脂肪性肝炎大鼠模型的建立. 世界华人消化杂志. 2007;15:2983-2989. [DOI] |
| 10. | Tsujimoto T, Kawaratani H, Kitazawa T, Yoshiji H, Fujimoto M, Uemura M, Fukui H. Immunotherapy for nonalcoholic steatohepatitis using the multiple cytokine production modulator Y-40138. World J Gastroenterol. 2009;15:5533-5540. [PubMed] [DOI] |
| 13. | Caldwell S, Argo C. The natural history of non-alcoholic fatty liver disease. Dig Dis. 2010;28:162-168. [PubMed] [DOI] |
| 14. | Bedogni G, Miglioli L, Masutti F, Tiribelli C, Marchesini G, Bellentani S. Prevalence of and risk factors for nonalcoholic fatty liver disease: the Dionysos nutrition and liver study. Hepatology. 2005;42:44-52. [PubMed] [DOI] |
| 15. | Mahady SE, George J. Management of nonalcoholic steatohepatitis: an evidence-based approach. Clin Liver Dis. 2012;16:631-645. [PubMed] [DOI] |
| 16. | Dima A, Marinescu AG, Dima AC. Non-alcoholic fatty liver disease and the statins treatment. Rom J Intern Med. 2012;50:19-25. [PubMed] |
| 17. | Beaton MD. Current treatment options for nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Can J Gastroenterol. 2012;26:353-357. [PubMed] |
| 18. | Ma T, Huang C, Zong G, Zha D, Meng X, Li J, Tang W. Hepatoprotective effects of geniposide in a rat model of nonalcoholic steatohepatitis. J Pharm Pharmacol. 2011;63:587-593. [PubMed] [DOI] |
| 19. | Shi KQ, Fan YC, Liu WY, Li LF, Chen YP, Zheng MH. Traditional Chinese medicines benefit to nonalcoholic fatty liver disease: a systematic review and meta-analysis. Mol Biol Rep. 2012;39:9715-9722. [PubMed] [DOI] |
| 20. | Song HY, Mao ZM, Yang LL, Liu T, Li DF, Zhang L, Ge YL, Zheng PY, Liu P, Zhang XQ. Dangfei liganning capsules attenuate the susceptibility of rat nonalcoholic fatty liver to carbon tetrachloride toxicity. J Tradit Chin Med. 2011;31:327-333. [PubMed] [DOI] |
| 21. | Aubert J, Begriche K, Knockaert L, Robin MA, Fromenty B. Increased expression of cytochrome P450 2E1 in nonalcoholic fatty liver disease: mechanisms and pathophysiological role. Clin Res Hepatol Gastroenterol. 2011;35:630-637. [PubMed] [DOI] |
| 22. | Min AK, Kim MK, Kim HS, Seo HY, Lee KU, Kim JG, Park KG, Lee IK. Alpha-lipoic acid attenuates methionine choline deficient diet-induced steatohepatitis in C57BL/6 mice. Life Sci. 2012;90:200-205. [PubMed] [DOI] |
| 23. | Bell LN, Temm CJ, Saxena R, Vuppalanchi R, Schauer P, Rabinovitz M, Krasinskas A, Chalasani N, Mattar SG. Bariatric surgery-induced weight loss reduces hepatic lipid peroxidation levels and affects hepatic cytochrome P-450 protein content. Ann Surg. 2010;251:1041-1048. [PubMed] [DOI] |
| 24. | Bai J, Cederbaum AI. Overexpression of CYP2E1 in mitochondria sensitizes HepG2 cells to the toxicity caused by depletion of glutathione. J Biol Chem. 2006;281:5128-5136. [PubMed] [DOI] |
| 25. | Leclercq IA, Farrell GC, Field J, Bell DR, Gonzalez FJ, Robertson GR. CYP2E1 and CYP4A as microsomal catalysts of lipid peroxides in murine nonalcoholic steatohepatitis. J Clin Invest. 2000;105:1067-1075. [PubMed] [DOI] |
| 26. | Piao YF, Li JT, Shi Y. Relationship between genetic polymorphism of cytochrome P450IIE1 and fatty liver. World J Gastroenterol. 2003;9:2612-2615. [PubMed] |
| 27. | Kathirvel E, Chen P, Morgan K, French SW, Morgan TR. Oxidative stress and regulation of anti-oxidant enzymes in cytochrome P4502E1 transgenic mouse model of non-alcoholic fatty liver. J Gastroenterol Hepatol. 2010;25:1136-1143. [PubMed] [DOI] |
| 28. | Tsuda T, Sugaya A, Liu YZ, Katoh K, Tanaka H, Kawazura H, Sugaya E, Kusai M, Kohno M. Radical scavenger effect of Boschniakia rossica. J Ethnopharmacol. 1994;41:85-90. [PubMed] [DOI] |
| 29. | Lorenzo M, Fernández-Veledo S, Vila-Bedmar R, Garcia-Guerra L, De Alvaro C, Nieto-Vazquez I. Insulin resistance induced by tumor necrosis factor-alpha in myocytes and brown adipocytes. J Anim Sci. 2008;86:E94-E104. [PubMed] [DOI] |
| 30. | Nieto-Vazquez I, Fernández-Veledo S, Krämer DK, Vila-Bedmar R, Garcia-Guerra L, Lorenzo M. Insulin resistance associated to obesity: the link TNF-alpha. Arch Physiol Biochem. 2008;114:183-194. [PubMed] [DOI] |
| 31. | Shen SC, Chang WC, Chang CL. Fraction from Wax Apple [Syzygium samarangense (Blume) Merrill and Perry] Fruit Extract Ameliorates Insulin Resistance via Modulating Insulin Signaling and Inflammation Pathway in Tumor Necrosis Factor α-Treated FL83B Mouse Hepatocytes. Int J Mol Sci. 2012;13:8562-8577. [PubMed] [DOI] |
| 32. | Bogdanski P, Suliburska J, Grabanska K, Musialik K, Cieslewicz A, Skoluda A, Jablecka A. Effect of 3-month L-arginine supplementation on insulin resistance and tumor necrosis factor activity in patients with visceral obesity. Eur Rev Med Pharmacol Sci. 2012;16:816-823. [PubMed] |
| 33. | Sharma AK, Bharti S, Kumar R, Krishnamurthy B, Bhatia J, Kumari S, Arya DS. Syzygium cumini ameliorates insulin resistance and β-cell dysfunction via modulation of PPAR, dyslipidemia, oxidative stress, and TNF-α in type 2 diabetic rats. J Pharmacol Sci. 2012;119:205-213. [PubMed] [DOI] |
| 34. | Gaddipati R, Sasikala M, Padaki N, Mukherjee RM, Sekaran A, Jayaraj-Mansard M, Rabella P, Rao-Guduru V, Reddy-Duvvuru N. Visceral adipose tissue visfatin in nonalcoholic fatty liver disease. Ann Hepatol. 2010;9:266-270. [PubMed] |
| 35. | Sato N. Central role of mitochondria in metabolic regulation of liver pathophysiology. J Gastroenterol Hepatol. 2007;22 Suppl 1:S1-S6. [PubMed] [DOI] |
| 36. | Benyon RC, Arthur MJ. Extracellular matrix degradation and the role of hepatic stellate cells. Semin Liver Dis. 2001;21:373-384. [PubMed] [DOI] |