修回日期: 2012-10-15
接受日期: 2012-10-23
在线出版日期: 2012-11-08
目的: 分析E-cadherin、β-catenin在幼年性息肉(juvenile polyp, JP)中的表达及在细胞内的分布, 探讨二者在儿童JP形成的作用.
方法: 采用荧光定量PCR和Western blot检测22例JP组织及8例正常肠组织中E-cadherin、β-catenin mRNA和蛋白的表达. 免疫组织化学法检测30例JP组织和10例正常组织中二者的表达状态及分布.
结果: E-cadherin mRNA在JP组织中的表达较正常对照明显下调(1.1526±0.3801 vs 0.4094±0.2305, P<0.05); β-catenin mRNA在JP组与正常组中的表达则无差异(1.7084±0.7467 vs 1.9428±0.8111, P>0.05). Western blot结果显示E-cadherin较正常组低(0.6028±0.1778 vs 0.3257±0.1168, P<0.05); β-catenin在JP组中的表达则上调(0.8010±0.1380 vs 1.2064±0.3587, P<0.05). 免疫组织化学分析结果与Western blot一致, E-cadherin在JP组织中的表达较正常对照组明显下调(102.5155±25.2988 vs 53.5772±15.3205, P<0.05), 阳性染色主要见于上皮细胞膜; β-catenin在JP组织中膜表达比正常对照组明显上升(112.0805±24.9572 vs 260.3554±86.6987, P<0.05), 且在JP组织上皮细胞胞浆及核内亦见阳性着色.
结论: JP组织中E-cadherin的表达下调, 而β-catenin蛋白表达则上调, 且分布发生改变, 二者表达的异常可能是JP的形成的特征之一.
引文著录: 金美芳, 朱雪明, 顾红英, 王兴东, 刘琳, 张闽, 李晓未. E-cadherin、β-catenin在儿童幼年性息肉中的表达及意义. 世界华人消化杂志 2012; 20(31): 3051-3056
Revised: October 15, 2012
Accepted: October 23, 2012
Published online: November 8, 2012
AIM: To detect the expression of E-cadherin and β-catenin mRNAs and proteins in human colorectal juvenile polyps (JP) in children.
METHODS: The expression of E-cadherin and β-catenin mRNAs and proteins in 22 juvenile colorectal polyp specimens and 8 normal colorectal specimens was assayed by real-time PCR and Western blot, respectively. Immunohistochemistry was used to determine the expression and localization of E-cadherin and β-catenin in 30 juvenile colorectal polyp specimens and 10 normal colorectal specimens.
RESULTS: Real-time PCR and Western blot analyses showed that the expression levels of E-cadherin mRNA and protein were significantly lower in juvenile colorectal polyps than in normal colorectal specimens (1.1526 ± 0.3801 vs 0.4094 ± 0.2305, P < 0.05; 0.6028 ± 0.1778 vs 0.3257 ± 0.1168, P < 0.05). Although there was no significant difference in the expression level of β-catenin mRNA between the two groups, the expression of β-catenin was significantly higher in juvenile colorectal polyps than in normal colorectal specimens (0.8010 ± 0.1380 vs 1.2064 ± 0.3587, P < 0.05). Immunohistochemistry indicates that E-cadherin expression was down-regulated in juvenile polyps compared with controls (102.5155 ± 25.2988 vs 53.5772 ± 15.3205, P < 0.05). Positive staining for E-cadherin was predominantly localized on the epithelial cell membrane. The expression of β-catenin was increased in juvenile polyp specimens (112.0805 ± 24 9572 vs 260.3554 ± 86.6987, P < 0.05), and the positive rates of membrane, cytoplasmic and nuclear staining in juvenile polyp tissue was significantly higher than those in normal control tissues.
CONCLUSION: Dysregulation of E-cadherin and β-catenin expression may be an important feature of juvenile colorectal polyps.
- Citation: Jin MF, Zhu XM, Gu HY, Wang XD, Liu L, Zhang M, Li XW. Significance of expression of E-cadherin and β-catenin in juvenile colorectal polyps in children. Shijie Huaren Xiaohua Zazhi 2012; 20(31): 3051-3056
- URL: https://www.wjgnet.com/1009-3079/full/v20/i31/3051.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i31.3051
肠息肉是一类从肠黏膜表面突出到肠腔内的隆起性赘生物, 是引起儿童下消化道出血最常见的原因之一[1], 发生率约1%. 病理上息肉分为幼年性、腺瘤性、炎症性、增生性等4种, 儿童消化道息肉90%以上为幼年性息肉(juvenile polyp, JP)[2], 绝大部分为良性病变, 但也存在着恶变潜能[3,4]. 多数研究认为, 遗传因素在肠息肉的发生中起着重要的作用, 但其发生机制尚不清楚[5]. E-钙粘素(E-cadherin)为一类Ca2+依赖性的细胞间粘附分子, 表达于所有哺乳动物上皮细胞, 对于维持上皮细胞的极性及正常功能、上皮组织形成、多种器官形态发育、控制上皮细胞增生及抑制肿瘤形成至关重要[6]. E-cadherin的表达与上皮细胞的表型密切相关, 事实上E-cadherin的功能性缺失已被公认为上皮间质转化(epithelial-mesenchymaltransition, EMT)的主要标志之一[7]; 而E-cadherin 表达的回升也与间质上皮转化(mesenchymal-epithelial transition, MET)过程中健康上皮细胞数量的恢复相关联[8]. 故E-cadherin 表达状态可直接影响到上皮层功能状态. β-catenin是细胞膜黏附蛋白复合物的成员,也是重要的细胞信号分子, 在上皮型钙黏蛋白(E-cadherin, E-cad)介导的细胞黏附和Wnt信号转导通路中发挥着关键作用. β-catenin在肠干细胞中的过度积聚是导致肠干细胞过度克隆增殖和肠息肉形成的主要因素. 目前国内外针对于儿童JP的研究鲜见, 本实验通过E-cadherin、β-catenin在JP中的表达和分布, 研究他们在JP形成过程中的作用并探讨他们之间的相互关系.
收集苏州大学附属儿童医院2011-08/2012-05儿童JP标本22例(男15例, 女7例; 年龄2-7岁; 结肠5例, 直肠17例)和健康对照者标本8例(男5例, 女3例; 年龄1-8岁; 结肠3例, 直肠5例), 标本切除后立即于液氮中速冻后, 置于-70 ℃冻存, 用于RT-PCR和Western blot实验, 所有标本都经病理证实. 选取苏州大学附属儿童医院病理科2011-06/2012-05儿童JP病例标本30例(男20例, 女10例; 年龄2-11岁; 结肠9例, 直肠21例), 对照正常肠组织病例标本10例(男6例, 女4例; 年龄2-12岁; 结肠5例, 直肠5例). 兔抗人E-cadherin多克隆抗体为美国Bioworld公司产品; 兔抗人β-catenin多克隆抗体购自美国Cell Signaling公司; 兔抗人GAPDH多抗为美国Bioworld公司产品; BCA蛋白定量试剂盒为美国Bio-Rad公司产品; ECL化学发光试剂盒购自美国Pierce公司; 即用型快捷免疫组织化学UltrasensitiveTMS-P试剂盒购自福州迈新生物技术公司; TRIzol为美国Invitrogen公司产品; 逆转录试剂为Promega公司产品; SYBR Green Realtime PCR Master试剂为Roche公司产品; 应用Premier 5.0软件设计引物, 引物由上海英骏生物技术有限公司合成.
E-cadherin上下游引物: 5'-GGGTCTTGCTATGTTGCC-3', 5'-GTTCCGCTCTGTCTTTGG-3'. β-catenin上下游引物: 5'-GCAGCAACAGTCTTACCT-3', 5'-ACAGGACTTGGGAGGTAT-3'. 内参GAPDH上下游引物: 5'-ACAGCAACAGGGTGGTGGAC-3'; 5'-TTTGAGGGTGCAGCGAACTT-3'. 扩增片段长度分别为437、116、252 bp.
1.2.1 RNA提取及RT-PCR: 将息肉及正常肠组织标本放入装有液氮的研钵中充分研磨, 总RNA的提取采用TRIzol一步法, 并测定的浓度、纯度和完整性. 以所得到的总RNA为模板, 使用Promega公司的试剂盒进行逆转录反应, 得到cDNA. 采用GAPDH为内对照, 采用SYBR Green荧光染料试剂进行实时定量PCR扩增. 反应体系包括: SYBR GreenⅠMaster 10 μL, 上下游引物各1 μL, PCR级水6 μL, cDNA模板2 μL, 按上述反应体系加样, 每个样品做3个复孔, 然后将样品置于荧光定量仪上, 根据设定好的程序进行反应, 反应条件为: 95 ℃, 10 min; 95 ℃, 15 s, 60 ℃, 15 s, 72 ℃, 30 s, 72 ℃收集荧光, 共50个循环; 循环结束后做相应的溶解曲线. 运用LightCyler 480自带的软件进行实时数据收集和定量分析.
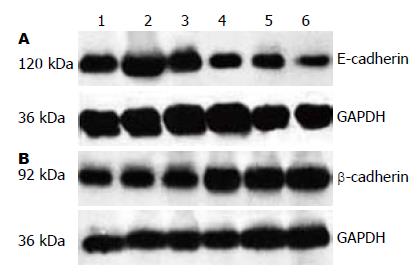
1.2.2 Western blot检测蛋白的表达: 组织中加入蛋白裂解液后在冰上进行匀浆, 充分匀浆裂解30 min后, 12 000 r/min 4 ℃离心15 min后取上清液, 按BCA法测蛋白浓度, 取总蛋白40 μg加上样液于100 ℃加热变性5 min后上样, 90 V稳压SDS-PAGE电泳, 250 mA稳流冰浴电转至PVDF膜, 5%脱脂奶粉室温封闭1 h, 加入相应一抗(E-cadherin 1:1 000, β-catenin 1:1 000, GAPDH 1:2 000), 4 ℃杂交过夜. 次日TBST漂洗5 min×3次后再加HRP标记的二抗(羊抗兔1:4 000)室温孵育1 h, TBST漂洗5 min×3次. ECL化学发光法曝光、显影. Image-Pro Plus软件对感光胶片条带进行累计吸光度IA分析, 以目的条带与内参照条带GAPDH的比值代表目的蛋白的相对表达水平.
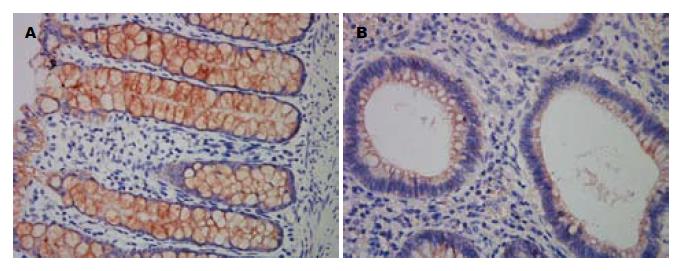
1.2.3 UltrasensitiveTMS-P免疫组织化学染色法检测蛋白的表达和分布: 石蜡切片脱蜡和水化后, 用PBS冲洗3次, 每次3 min. 柠檬酸钠加热法对抗原进行修复. 室温下, 切片置于过氧化酶阻断溶液(试剂A)中孵育10 min, PBS冲洗3次, 每次3 min. 除去PBS液, 每张切片加一滴正常非免疫动物血清(试剂B), 室温孵育10 min. 除去血清, 加一抗4 ℃过夜(E-cadherin 1:200, β-catenin 1:200). 第2天取出后PBS冲洗3次, 每次3 min. 除去PBS液, 加生物素标记二抗(试剂C)室温下孵育10-15 min, PBS冲洗3次, 每次3 min. 除去PBS液, 加链霉菌抗生物素-过氧化物酶溶液(试剂D)一滴, 室温孵育10 min, PBS冲洗3次, 每次3min. 除去PBS液, 加新鲜配制的二氨基联苯胺(diaminobenzidine, DAB)显色溶液, 显微镜下观察3-10 min. 用自来水冲洗后加入苏木素复染, 再用自来水冲洗返蓝. 切片经梯度酒精脱水干燥、二甲苯透明、中性树胶封片, 显微镜下观察、照相. 在相同放大倍数显微图片中, 用图像分析软件(Image-Pro-Plus)测定E-cadherin和β-catenin 在JP组织与正常对照组织中阳性染色的平均累计吸光度(A)值, 与E-cadherin和β-catenin的表达呈正相关.
统计学处理 使用SPSS13.0统计软件包进行数据分析. 所有的结果用mean±SD表示, 所有的相关结果, 在满足方差齐性时, 采用t检验进行两两比较, 方差非齐时, 则采用t'检验. 以P<0.05作为差异有统计学意义.
E-cadherin mRNA在8例健康对照者肠黏膜和22例JP组织中表达分别是1.1526±0.3801和0.4094±0.2305, 两者比较有统计学意义(P<0.05), 而β-catenin mRNA在健康对照者肠黏膜和JP组织中的表达分别为1.7084±0.7467和1.9428±0.8111, 两者比较无统计学意义(P>0.05), E-cadherin mRNA在JP组织中表达下调, β-catenin在JP组与正常组中的表达则无差异.
Western印迹检测发现(图1), 8例健康对照者肠黏膜和22例JP组织中E-cadherin相对累计吸光度值分别是0.6028±0.1778和0.3257±0.1168, 两者比较有统计学意义(P<0.05), 幼JP组织中E-cadherin蛋白的表达明显低于对照组, 而β-catenin在两者中的相对累计吸光度值分别是0.8010±0.1380和1.2064±0.3587, 两者比较有统计学意义(P<0.05), 说明β-catenin蛋白在JP组织中的表达明显上升.
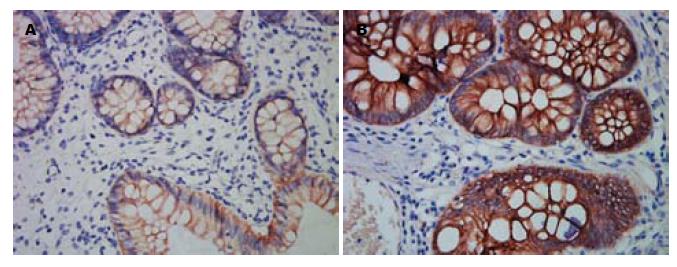
JP组和健康对照组肠黏膜组织切片E-cadherin、β-catenin表达免疫组织化学染色结果(图2, 3). 免疫组织化学染色切片数码图像平均IA值的统计分析显示, 10例正常健康对照者肠黏膜组织和30例JP组织中E-cadherin蛋白表达分别为102.5155±25.2988和53.5772±15.3205, 两者比较有统计学意义(P<0.05) E-cadherin主要表达于细胞膜上(图2). 两组间β-catenin蛋白表达分别为112.0805±24.9572和260.3554±86.6987, 两者比较有统计学意义(P<0.05). 在正常结肠黏膜中, β-catenin阳性染色主要位于细胞膜, 在JP中, 其阳性染色表达于细胞膜、细胞浆及部分细胞核(图3).
JP是儿童时期最常见的肠息肉类型, 大多数患儿确诊年龄为2-5岁, 无痛性便血是其主要临床表现. 典型组织学为有特征性的囊样结构, 可表现为黏液腺充填、固有层增生或大量的炎性细胞浸润. JP多为单发, 但Adolph等[9]报道约50% JP患儿肠道内息肉是多发的. 目前尚无资料表明JP发生与基因突变的关系, 一般认为其生物学行为是良性的. 一项回顾性调查显示, 77例儿童和青春期结肠癌患者中17例有结肠息肉病史, 其中9例为单发息肉[10]. 有个案报道,"JP可转变为腺瘤, JP也可和管状绒毛状腺瘤共存"[3,4]. 表明JP也有恶变潜能, 要引起重视.
E-cadherin为一种钙离子依赖性的、关键性的上皮细胞间粘附分子, 其表达的变化可直接影响上皮细胞的功能状态、组织的形成及对肿瘤的抑制作用[11]. 目前, E-cadherin被公认为上皮细胞的标志物之一, 其表达与上皮细胞的表型相互关联[12,13]. E-cadherin对上皮组织的屏障功能至关重要, 故E-cadherin表达的相对降低可能导致上皮屏障功能的相对减弱, 从而促进病情的加重. 本实验中E-cadherin mRNA和蛋白表达水平在儿童JP中下调, 提示上皮细胞的正常修复效率逐渐降低. 当肠道上皮细胞由于某种原因受损后, 其组织结构功能的完全恢复与否取决于是否存在快速有效的修复反应, 在E-cadherin缺损的条件下, 可能引发组织重塑而形成息肉.
近年来, 分子生物学研究发现, Wnt通路中癌基因、抑癌基因异常与结直肠癌的发生、发展密切相关. β-catenin是这一途径中的关键分子. 其致癌的机制是β-catenin降解障碍致使细胞质内游离的β-catenin积聚, 并进入到细胞核与转录因子T细胞因子(T cell factor, TCF)/LEF结合, 激活下游靶基因c-myc等的转录, 引起细胞增殖和分化失控, 在细胞水平上表现为过度增殖, 在组织水平上表现为肠黏膜上皮转化为腺瘤性息肉[14,15]. 目前国内外针对消化系肿瘤中β-catenin的研究较多, 而针对肠息肉组织特别是JP组织中β-catenin的研究甚少. 在本实验中与正常对照黏膜相比, JP组织中β-catenin mRNA水平无显著差异, 提示JP患者β-catenin蛋白胞浆内异常聚集并非mRNA表达量增高所致. 免疫组织化学分析发现正常肠黏膜中β-catenin阳性染色主要位于细胞膜, 可有部分胞质淡染, 但在JP中, 其阳性染色主要位于细胞质, 并有部分细胞核阳性的出现. 提示β-catenin蛋白的表达和分布的改变与息肉的形成密切相关.
一些试验研究显示, 过表达E-cadherin可以通过其在细胞表面结合β-catenin, 进而减少胞质中的β-catenin而拮抗Wnt信号通路[16]. 反之, E-cadherin下调, β-catenin释放入胞质, 使得胞质中β-catenin积累增多. 本研究中JP组织中E-cadherin的下调导致其β-catenin蛋白表达的增加. 而β-catenin蛋白表达的增加, 即转移到细胞核中, 细胞核中的β-catenin可作为TCF依赖的基因转录激动剂, 激活相应的靶基因的转录. 有报道Slug基因作为E-cadherin基因转录的抑制剂[17,18], 很可能是Wnt信号通路的下游TCF/β-catenin复合体的靶基因. Slug基因被β-catenin激活转录后, 可通过结合E-cadherin基因启动子区的一段回文序列抑制E-cadherin基因的转录, 进而下调E-cadherin的表达[19,20]. 本实验免疫组织化学结果显示在β-catenin JP患者的病变组织中整体异位表达率升高, 胞浆表达阳性率及强度增加, 核表达阳性率增加, 由此推测细胞中的TCF可能被激活, 从而影响E-cadherin的基因表达, 相应地引起蛋白的表达的变化. 总之, E-cadherin和β-catenin相互影响和协调, 共同参与JP的形成和发展, 相关精确机制有待进一步研究.
幼年性息肉(JP)是儿童时期最常见的肠息肉类型, 大多数患儿确诊年龄为2-5岁, 无痛性便血是其主要临床表现. 典型组织学为有特征性的囊样结构, 可表现为黏液腺充填、固有层增生或大量的炎性细胞浸润. JP多为单发, 但Adolph和Bemabe报道约50%JP患儿肠道内息肉是多发的. 目前尚无资料表明JP发生与基因突变的关系, 一般认为其生物学行为是良性的.
王忠裕, 教授, 大连医科大学附属第一医院普通外科二科; 顾国利, 副主任医师, 空军总医院普通外科; 潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院干细胞与组织器官工程研究中心
E-cadherin和β-catenin相互影响和协调, 共同参与JP的形成和发展, 相关精确机制有待进一步研究.
一项回顾性调查显示, 77例儿童和青春期结肠癌患者中17例有结肠息肉病史, 其中9例为单发息肉. 有个案报道, JP可转变为腺瘤, JP也可和管状绒毛状腺瘤共存", 表明JP也有恶变潜能, 要引起重视.
本文进行了E-cadherin和β-catenin在儿童JP组织中表达的研究, 对于了解经典Wnt信号通路在JP发生发展中的意义具有一定的参考意义.
编辑: 李军亮 电编:鲁亚静
| 1. | El-Shabrawi MH, El Din ZE, Isa M, Kamal N, Hassanin F, El-Koofy N, El-Batran G, El-Makarem SA, El-Hennawy A. Colorectal polyps: a frequently-missed cause of rectal bleeding in Egyptian children. Ann Trop Paediatr. 2011;31:213-218. [PubMed] [DOI] |
| 3. | Thakkar K, Alsarraj A, Fong E, Holub JL, Gilger MA, El Serag HB. Prevalence of colorectal polyps in pediatric colonoscopy. Dig Dis Sci. 2012;57:1050-1055. [PubMed] [DOI] |
| 5. | van Hattem WA, Langeveld D, de Leng WW, Morsink FH, van Diest PJ, Iacobuzio-Donahue CA, Giardiello FM, Offerhaus GJ, Brosens LA. Histologic variations in juvenile polyp phenotype correlate with genetic defect underlying juvenile polyposis. Am J Surg Pathol. 2011;35:530-536. [PubMed] [DOI] |
| 6. | Tsanou E, Peschos D, Batistatou A, Charalabopoulos A, Charalabopoulos K. The E-cadherin adhesion molecule and colorectal cancer. A global literature approach. Anticancer Res. 2008;28:3815-3826. [PubMed] |
| 7. | Mohamet L, Hawkins K, Ward CM. Loss of function of e-cadherin in embryonic stem cells and the relevance to models of tumorigenesis. J Oncol. 2011;2011:352616. [PubMed] |
| 8. | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition. J Clin Invest. 2009;119:1420-1428. [PubMed] [DOI] |
| 9. | Adolph VR, Bernabe K. Polyps in children. Clin Colon Rectal Surg. 2008;21:280-285. [PubMed] [DOI] |
| 10. | Hill DA, Furman WL, Billups CA, Riedley SE, Cain AM, Rao BN, Pratt CB, Spunt SL. Colorectal carcinoma in childhood and adolescence: a clinicopathologic review. J Clin Oncol. 2007;25:5808-5814. [PubMed] [DOI] |
| 11. | Chaw SY, Abdul Majeed A, Dalley AJ, Chan A, Stein S, Farah CS. Epithelial to mesenchymal transition (EMT) biomarkers - E-cadherin, beta-catenin, APC and Vimentin - in oral squamous cell carcinogenesis and transformation. Oral Oncol. 2012;48:997-1006. [PubMed] [DOI] |
| 12. | Bambang IF, Xu S, Zhou J, Salto-Tellez M, Sethi SK, Zhang D. Overexpression of endoplasmic reticulum protein 29 regulates mesenchymal-epithelial transition and suppresses xenograft tumor growth of invasive breast cancer cells. Lab Invest. 2009;89:1229-1242. [PubMed] [DOI] |
| 13. | Xie CG, Wei SM, Chen JM, Xu XF, Cai JT, Chen QY, Jia LT. Down-regulation of GEP100 causes increase in E-cadherin levels and inhibits pancreatic cancer cell invasion. PLoS One. 2012;7:e37854. [PubMed] [DOI] |
| 14. | 于 大中, 于 亚男, 田 字彬, 赵 清喜, 孔 心涓, 张 翠萍, 魏 良洲. TFF3和β-catenin在不同大肠黏膜组织中的表达. 世界华人消化杂志. 2011;19:1579-1584. [DOI] |
| 16. | Gottardi CJ, Wong E, Gumbiner BM. E-cadherin suppresses cellular transformation by inhibiting beta-catenin signaling in an adhesion-independent manner. J Cell Biol. 2001;153:1049-1060. [PubMed] [DOI] |
| 17. | Saegusa M, Hashimura M, Kuwata T, Okayasu I. Requirement of the Akt/beta-catenin pathway for uterine carcinosarcoma genesis, modulating E-cadherin expression through the transactivation of slug. Am J Pathol. 2009;174:2107-2115. [PubMed] [DOI] |
| 18. | Conacci-Sorrell M, Simcha I, Ben-Yedidia T, Blechman J, Savagner P, Ben-Ze'ev A. Autoregulation of E-cadherin expression by cadherin-cadherin interactions: the roles of beta-catenin signaling, Slug, and MAPK. J Cell Biol. 2003;163:847-857. [PubMed] [DOI] |