修回日期: 2012-10-10
接受日期: 2012-10-23
在线出版日期: 2012-11-08
目的: 观察甲基转移酶抑制剂5-氮杂-2'-脱氧胞苷(5-Aza-2'-Deoxycytidine, 5-Aza-CdR)对胃癌细胞的作用, 并进一步明确他与传统化疗药5-氟尿嘧啶(5-Fu)之间的相互关系.
方法: 选取野生型P53的胃癌AGS和突变型P53的BGC-823细胞用2.5 µmol/L 5-Aza-CdR分别处理0-96 h, MTT检测5-Aza-CdR处理前后细胞活力的变化. 为了进一步探讨5-Aza-CdR的抗胃癌作用机制, 我们用Annexin Ⅴ检测细胞早期凋亡、caspases活性检测凋亡诱导通路及Western blot检测下游相关蛋白的表达.
结果: 与未用5-Aza-CdR处理的空白对照组细胞相比, 5-Aza-CdR时间依赖性地抑制了胃癌AGS和BGC-823细胞的生长活性(P<0.01). 在探讨其作用机制时我们发现, 5-Aza-CdR的抗胃癌毒性作用是通过诱导肿瘤细胞凋亡实现的. 但细胞的不同P53状态可触发不同的细胞凋亡路径: 在野生型AGS细胞中, 5-Aza-CdR的凋亡机制是通过内源性的凋亡通路(caspase 9)所介导的; 但在BGC-823细胞中, 5-Aza-CdR的促凋亡效应是独立于caspase凋亡路径的, 因为我们并未观察到5-Aza-CdR处理后细胞caspases活性及蛋白表达水平的增加. 尤为有意义的是, 当5-Aza-CdR与5-Fu联合应用后, 他显著增加了AGS和BGC-823细胞对5-Fu的敏感性.
结论: 以上数据明显证明5-Aza-CdR可作为一种卓有成效的抗胃癌药, 特别是他与传统化疗药的协同抗癌效应, 将对5-Aza-CdR未来在临床上的应用提供实践指导意义.
引文著录: 曾珺, 吴杰, 王萍, 张妍. 5-氮杂-2'-脱氧胞苷与5-氟尿嘧啶的协同抗胃癌作用. 世界华人消化杂志 2012; 20(31): 3015-3020
Revised: October 10, 2012
Accepted: October 23, 2012
Published online: November 8, 2012
AIM: To examine the impact of DNA methyltransferase inhibitor 5-aza-2′-deoxycytidine (5-Aza-CdR) on gastric cancer cells and to unveile the interaction between 5-Aza-CdR and conventional chemotherapeutic agent 5-fluorouracil (5-Fu).
METHODS: Gastric cell lines expressing either wild-type P53 (AGS) or mutant-type P53 (BGC-823) were treated with 2.5 µmol/L of 5-Aza-CdR and/or 5-Fu for 0-96 h. Cell viability and proliferation were determined by 3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide (MTT) assay. Cell apoptosis was detected by annexin V staining. The activity of caspases was determined, and expression of downstream molecules was detected by Western blot.
RESULTS: Compared to untreated AGS and BGC-823 cells, treatment with 5-Aza-CdR significantly suppressed cell proliferation and viability in both cell lines in a time-dependent manner (both P < 0.01). In addition, 5-Aza-CdR induced marked apoptosis of AGS and BGC-823 cells in a time-dependent manner. However, the stimulation of distinct apoptotic pathways was largely dependent on P53 status. In AGS cells, 5-Aza-CdR-induced apoptosis was mediated by intrinsic apoptotic pathway which was modified dramatically by caspase 9. In BGC-823 cells expressing mutant P53, 5-Aza-CdR-induced apoptosis was dependent on caspase-independent apoptotic signaling due to the fact that we failed to observe elevated caspase activity or expression. 5-Aza-CdR in combination with 5-FU showed significant synergistic effects in both AGS and BGC-823 cells, implying that 5-Aza-CdR could efficaciously sensitize the responses of both cell lines to 5-Fu.
CONCLUSION: Our findings strongly demonstrate that 5-Aza-CdR is a potential anti-gastric cancer candidate. 5-Aza-CdR and 5-Fu have significant synergistic effects in human gastric cancer cells.
- Citation: Zeng J, Wu J, Wang P, Zhang Y. Synergistic effect of 5-aza-2′-deoxycytidine and 5-fluorouracil in human gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2012; 20(31): 3015-3020
- URL: https://www.wjgnet.com/1009-3079/full/v20/i31/3015.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i31.3015
据统计, 世界每年约有900 000人被诊断为胃癌, 而其中以东亚、南美洲安第斯区域以及东欧的发病率为最高. 在中国, 胃癌作为一种常见的恶性肿瘤, 其发病率及其死亡率总体上仍呈上升趋势. 尽管在过去数年中, 胃癌的治疗较以前有了较大的提高, 但5年生存率仍低于25%, 这一现状驱使科研工作者不断寻求更多新型并且行之有效的治疗手段[1]. 肿瘤学研究发现, 启动子区高甲基化异常是导致许多肿瘤抑制基因表达异常的内在机制. 正是由于DNA甲基化在肿瘤发生发展中的调控作用, 使DNA去甲基化治疗成为抗肿瘤研究领域的热点[2]. 目前, 在DNA甲基化抑制剂, 尤以核苷类似物5-氮杂-2'脱氧胞苷酸(5-Aza-CdR; DAC)的去甲基化作用最为引人关注. 随着基础实验和临床研究的不断深入, 5-Aza-CdR(DAC)通过了FDA的认证, 已逐渐取代传统的化疗药物在临床上得到广泛使用[3]. 尤其是他在治疗造血系统的恶性疾病如: 急性、慢性骨髓性白血病、脊髓发育不良等方面疗效尤为显著[4-7]. 但对实体肿瘤特别是他与传统化疗药物之间的关系, 目前尚处于初级探索阶段[8,9]. 因此, 我们此次的课题是研究5-Aza-CdR对胃癌细胞的作用及其他的确切作用机制; 更为重要的是, 我们期望检测当5-Aza-CdR与传统化疗药联合应用时, 他们之间是否具有协同效用. 通过对上述两方面进行透彻分析, 以期为未来胃癌的治疗提供强有力的理论和现实依据.
人胃癌细胞株AGS和BGC-823(中国典型物培养中心; CCTCC); 5-氮杂-2'-脱氧胞苷酸(5-Aza-CdR); 5-Fu(Sigma公司); DMEM培养基(Gibco公司); 抗体(Santa cruz; Cell signaling).
1.2.1 细胞培养及处理: 将野生型P53胃癌细胞株AGS和突变型BGC-823细胞以适宜密度接种于DMEM培养基中, 分别给予2.5 µmol/L 5-Aza-CdR处理0-96 h. 鉴于5-Aza-CdR药物的不稳定性, 因此每24 h更换新鲜药液1次.
1.2.2 MTT法检测细胞活力: 细胞按每孔1×103细胞密度接种于96孔板, 5-Aza-CdR处理后, 每孔加入终浓度为5 g/L的MTT溶液20 µL, PBS漂洗2次后加入DMSO 150 µL振荡溶解, 置酶标免役检测仪上测定570 nm下的吸光度(A)值. 细胞生存率(%) = (试验组A值-空白对照组A值)/(阴性对照组-空白对照组)×100%.
1.2.3 Annexin Ⅴ/PI双染实验: 收集经过药物分别处理的胃癌AGS和BGC-823细胞, 用冷的PBS洗涤2次后, 依据试剂盒明书处理细胞, 上流式细胞仪检测.
1.2.4 caspases活性检测: caspase-3、8和9活性检测是基于他们分别可以催化底物Ac-DEVD-pNA、Ac-IETD-pNA以及Ac-LEHD-pNA产生黄色的pNA, 从而可以通过测定A值来检测caspase活性. pNA在405 nm附近有强吸收. 具体步骤参照试剂盒说明书(碧云天生物技术公司).
1.2.5 Western blot检测基因蛋白表达: 将5-Aza-CdR处理的细胞用冰PBS洗2次, 加500 µL的裂解液冰上裂解细胞30 min(50 mmon/L NaCl, 50 mmon/L Tris (pH 8.0), 5 mmon/L EDTA, 1% (v/v) NP-40, 1 mmon/L PMSF, 20 µg/mL aprotinin, 25 µg/mL leupeptin). 取50 µg蛋白变性5 min后, 分别行PAGE电泳分离、转膜、封闭、抗体杂交、ECL显影及曝光.
统计学处理 实验数据用均mean±SD表示, 多样本均数比较采用单因素方差分析, 两组均数比较采用t检验, 所有数据均由SPSS11.5统计软件进行处理, P<0.01为差异具有显著性.
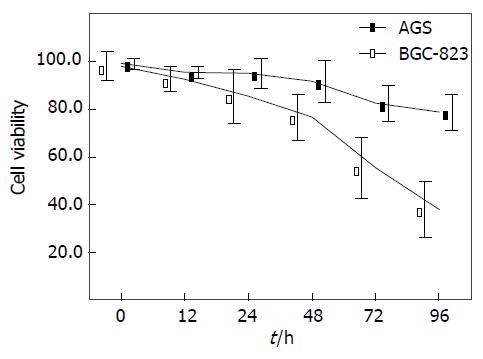
在本次实验中, 我们选取了2种不同P53状态的胃癌细胞株(野生型AGS、突变型BGC-823), 分别用2.5 µmol/L 5-Aza-CdR处理12、24、48、72及96 h. 我们发现, 在AGS细胞中, 随着药物处理时间的不断延长, 愈来愈多的胃癌AGS细胞死亡(P<0.01). 在突变型P53的BGC-823细胞中, 虽然我们仍可检测到细胞生长的抑制率呈现出时间递增效应, 但仅在5-Aza-CdR处理细胞48 h后才较为显著. 9 h后, 细胞存活率表现为79.1%, 与同时间的野生型AGS胃癌细胞存活率38.2%相比差异有显著性(P<0.01, 图1).
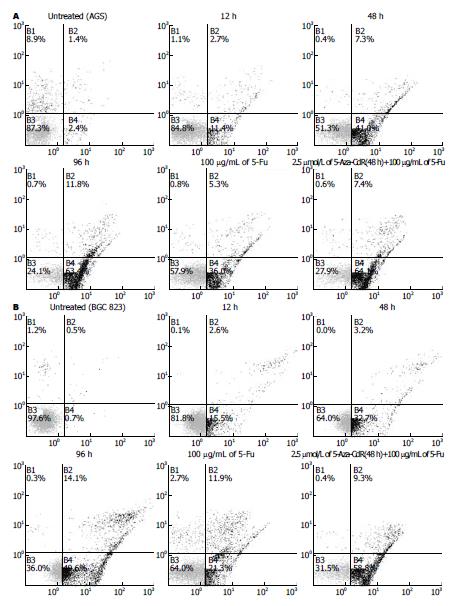
随着5-Aza-CdR处理时间的延长, AGS细胞凋亡率从2.4%显著增加至63.4%(图2A). 在突变型P53的BGC-823细胞中, 我们亦检测到类似的时间依赖效应(图2B). 有趣的是, BGC-823的凋亡高峰仅为49.6%, 比AGS胃癌细胞63.4%相比明显减低. 这一数据与MTT结果相似, 进一步证明了野生型P53的AGS对5-Aza-CdR的敏感性显著强于突变型P53的BGC-823细胞.
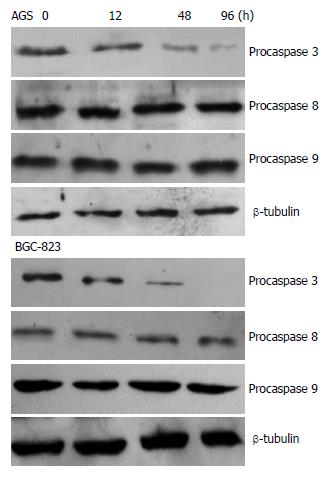
上述的实验结果证明5-Aza-CdR抑制胃癌细胞的作用是通过诱导细胞凋亡而实现的, 但他与caspase通路之间的关系是我们下一步研究的目标. 在AGS细胞中, 我们观察到caspase-3的活性在48和96 h的5-Aza-CdR处理后显著提高, 但12 h和空白对照组的caspase-3活性无明显区别. 而在胃癌BGC-823细胞, 5-Aza-CdR的处理并未活化caspase-3.
目前所知, 凋亡路径分为caspase-8介导的死亡受体通路以及caspase-9介导的线粒体凋亡通路. 为了进一步明确5-Aza-CdR所诱导的AGS细胞凋亡路径, 我们分别检测了caspase-8和caspase-9的活性. 从实验结果来看, 无论是在胃癌AGS或是BGC-823细胞中, caspase-8在5-Aza-CdR处理前后均不受影响. 关于caspase-9的活力, AGS细胞在暴露于5-Aza-CdR 48及96 h后, 其活性显著增加(P<0.01). 与caspase-3活性检测结果相一致, 5-Aza-CdR并未激活BGC-823细胞的caspase-9活性(P>0.05). Western blot的结果验证了上述结论(图3).
在AGS细胞中既然验证到caspase-3和9的激活, 下一步的实验我们应用Z-IETD-FMK(caspase-8抑制剂)和Z-LEHD-FMK(caspase-9抑制剂), 进一步明确5-Aza-CdR所促发的AGS细胞凋亡是由caspase-9调控的. 如图3E所示, Z-IETD-FMK对AGS细胞caspase-3活性无显著影响(P>0.05), 但Z-LEHD-FMK(caspase-9抑制剂)使AGS细胞caspase-3活性降低了1-2倍.
与传统化疗药5-Fu的协同抗癌效应单独用5-Fu(对照组)处理胃癌AGS细胞其早期细胞凋亡率为36%, 当5-Fu与2.5 μmol/L 5-Aza-CdR联合应用后(5-Aza-CdR+5-Fu), 凋亡率显著增加至64.1%. 在BGC-823细胞, 其AnnexinⅤ阳性细胞百分率从对照组(单独5-Fu)作用时的21.3%提升至实验组(5-Aza-CdR+5-Fu)的58.5%.
细胞凋亡(apoptosis), 即细胞程序化死亡(programmed cell death, PCD)是一种参与了生物体许多过程的细胞去除机制, 是由基因编程调控的细胞主动自杀过程. 目前对凋亡机制的研究发现, 细胞凋亡分为caspase依赖和非caspase依赖两部分. 而caspase依赖性凋亡包括由caspases-8介导的外源性(死亡受体)信号通路以及由caspases-9启动的内源性(线粒体)标准凋亡路径[10,11]. 5-Aza-CdR时间依赖性地促进了AGS及BGC-823细胞凋亡, 但两者的凋亡通路存在差异. AGS细胞凋亡是由caspases-9所启动, 从而激活了下游caspase-3的活性. 而在BGC-823细胞中, 5-Aza-CdR可能是通过激活凋亡诱导因子[12,13]而启动caspase非依赖性的凋亡信号通路.
从我们的实验数据分析, 5-Aza-CdR有效地抑制了胃癌细胞的生长, 但在不同的肿瘤细胞株中, 其抗癌活性有所差异. 鉴于5-Aza-CdR的抑制AGS细胞生长活力及诱导凋亡作用方面明显强于BGC-823细胞, 我们有理由相信在胃癌细胞中, 不同细胞株的p53基因表型可决定5-Aza-CdR对肿瘤细胞的敏感性, 即野生型P53细胞株AGS优于P53突变细胞株BGC-823细胞. 与我们本次研究结果相悖, 在突变型p53基因的鼠成纤维细胞株中, 研究者们观察到5-Aza-CdR诱导了更多的细胞发生凋亡[14]. 但Valdez等[15]的实验结论表明, p53基因的抑制可显著影响野生型P53白血病细胞对5-Aza-CdR的敏感性, 这一结论与我们的实验数据不谋而合. 因此, 我们认为在AGS细胞中, 5-Aza-CdR有效地募集了P53蛋白的乙酰化及磷酸化, 进一步启动下游信号通路如细胞周期蛋白P21、P16及P73等, 从而破坏细胞DNA修复机制而诱导细胞发生凋亡. 随着5-Aza-CdR抗癌机制研究的日益深入, 国内外研究者们发现, 除了其促凋亡机制外, 5-Aza-CdR可掺入细胞DNA中与DNA甲基转移酶之间形成共价内收. 这种内收最终导致DNA甲基转移酶的耗尽, 使高甲基化沉默的基因恢复表达[16]. 因此, 在突变型BGC-823细胞中, 5-Aza-CdR的抑癌活性可能涉及细胞DNA的损伤及对甲基转移酶(DNMTs)的抑制. P53状态的改变(p53基因突变)、DNA损伤以及DNA甲基转移酶在5-Aza-CdR的抗胃癌细胞毒性中所扮演的角色将是我们下一步实验研究的重点.
值得一提的是, 5-Aza-CdR与5-Fu联合应用时, 其凋亡作用较单独作用显著增强, 这一发现与既往相关文献相符. 我们相信, 上述协同作用机制与5-Aza-CdR脱甲基化作用恢复某些抑癌基因如MMR、RUNX3等的表达密切相关, 但具体机制仍有待深入.
总之, 一方面, 5-Aza-CdR通过诱导胃癌细胞凋亡而抑制肿瘤细胞的生长增殖, 而细胞的P53状态可直接影响他对肿瘤细胞的反应性. 另一方面, 在5-Aza-CdR与5-Fu联合应用时, 两者可表现出显著的协同抗癌效应. 上述的实验结论将为胃癌的临床基因治疗开辟新的思路.
胃癌作为一种常见的恶性肿瘤, 虽然在过去数年其治疗较以前有了较大程度地提高, 但5年生存率仍低于25%, 这一现状驱使科研工作者不断寻求更多新型并且行之有效的治疗手段. 5-氮杂-2'脱氧胞苷酸(5-Aza-CdR; DAC)作为一种DNA甲基化抑制剂, 可通过脱甲基化作用使沉默的抑癌基因重新表达, 因此已逐渐受到国内外学者的广泛关注.
邹小明, 教授, 哈尔滨医科大学附属第二医院普外二科
目前, 5-Aza-CdR(DAC)已通过FDA的认证, 逐渐取代了传统的化疗药物而在临床上广泛用于造血系统恶性疾病的治疗. 但他对实体肿瘤例如消化系统的恶性肿瘤, 仍然处于初级探索阶段.
在有关实体肿瘤研究方面, 研究者指出5-Aza-CdR可显著抑制肺癌、前列腺癌及肝癌细胞的生长转移, 其作用机制与5-Aza-CdR的脱甲基化作用及促凋亡作用密切相关. 但在不同类型的肿瘤细胞中, 5-Aza-CdR的抗癌效应及其作用机制则不尽相同.
本文证明5-Aza-CdR可显著抑制胃癌细胞的生长活性. 同时, 在野生型P53的肿瘤细胞中, 5-Aza-CdR的抗癌机制是通过caspase依赖性的凋亡通路实现的, 但在突变型的P53胃癌细胞中其作用机制是独立于caspase凋亡路径的.
本文首次采用5-Aza-CdR与传统化疗药5-Fu的联合用药研究, 其结果显示两者具有协同抗胃癌效应, 这一发现将为未来5-Aza-CdR的临床应用指明方向.
5-Aza-CdR与5-Fu联合应用, 增加了抗肿瘤的作用, 对临床上开展新的化疗方案或新的抗肿瘤药物研究有意义.
编辑: 李军亮 电编:鲁亚静
| 1. | Sapari NS, Loh M, Vaithilingam A, Soong R. Clinical potential of DNA methylation in gastric cancer: a meta-analysis. PLoS One. 2012;7:e36275. [PubMed] [DOI] |
| 2. | Chiam K, Centenera MM, Butler LM, Tilley WD, Bianco-Miotto T. GSTP1 DNA methylation and expression status is indicative of 5-aza-2'-deoxycytidine efficacy in human prostate cancer cells. PLoS One. 2011;6:e25634. [PubMed] [DOI] |
| 3. | Gidwani R, Khan ZM, Fenaux P, Beach CL, Pashos CL. A cost-effectiveness analysis of using azacitidine vs. decitabine in treating patients with myelodysplastic syndromes. J Med Econ. 2012;15:145-154. [PubMed] [DOI] |
| 4. | Thudium KE, Ghoshal S, Fetterly GJ, Haese JP, Karpf AR, Wetzler M. Synergism between clofarabine and decitabine through p53R2: A pharmacodynamic drug-drug interaction modeling. Leuk Res. 2012;36:1410-1416. [PubMed] [DOI] |
| 5. | Oki Y, Kondo Y, Yamamoto K, Ogura M, Kasai M, Kobayashi Y, Watanabe T, Uike N, Ohyashiki K, Okamoto S. Phase I/II study of decitabine in patients with myelodysplastic syndrome: A multi-center study in Japan. Cancer Sci. 2012;103:1839-1847. [PubMed] [DOI] |
| 6. | Shin DY, Park YS, Yang K, Kim GY, Kim WJ, Han MH, Kang HS, Choi YH. Decitabine, a DNA methyltransferase inhibitor, induces apoptosis in human leukemia cells through intracellular reactive oxygen species generation. Int J Oncol. 2012;41:910-918. [PubMed] |
| 7. | Marks PW. Decitabine for acute myeloid leukemia. Expert Rev Anticancer Ther. 2012;12:299-305. [PubMed] [DOI] |
| 8. | Cooper SJ, von Roemeling CA, Kang KH, Marlow LA, Grebe SK, Menefee ME, Tun HW, Colon-Otero G, Perez EA, Copland JA. Reexpression of Tumor Suppressor, sFRP1, Leads to Antitumor Synergy of Combined HDAC and Methyltransferase Inhibitors in Chemoresistant Cancers. Mol Cancer Ther. 2012;11:2105-2115. [PubMed] [DOI] |
| 9. | Shang D, Liu Y, Xu X, Han T, Tian Y. 5-aza-2'-deoxycytidine enhances susceptibility of renal cell carcinoma to paclitaxel by decreasing LEF1/phospho-β-catenin expression. Cancer Lett. 2011;311:230-236. [PubMed] [DOI] |
| 10. | Würstle ML, Laussmann MA, Rehm M. The central role of initiator caspase-9 in apoptosis signal transduction and the regulation of its activation and activity on the apoptosome. Exp Cell Res. 2012;318:1213-1220. [PubMed] [DOI] |
| 11. | Estaquier J, Vallette F, Vayssiere JL, Mignotte B. The mitochondrial pathways of apoptosis. Adv Exp Med Biol. 2012;942:157-183. [PubMed] [DOI] |
| 12. | Delavallée L, Cabon L, Galán-Malo P, Lorenzo HK, Susin SA. AIF-mediated caspase-independent necroptosis: a new chance for targeted therapeutics. IUBMB Life. 2011;63:221-232. [PubMed] [DOI] |
| 13. | Khan M, Zheng B, Yi F, Rasul A, Gu Z, Li T, Gao H, Qazi JI, Yang H, Ma T. Pseudolaric Acid B induces caspase-dependent and caspase-independent apoptosis in u87 glioblastoma cells. Evid Based Complement Alternat Med. 2012;2012:957568. [PubMed] |
| 14. | Nieto M, Samper E, Fraga MF, González de Buitrago G, Esteller M, Serrano M. The absence of p53 is critical for the induction of apoptosis by 5-aza-2'-deoxycytidine. Oncogene. 2004;23:735-743. [PubMed] [DOI] |
| 15. | Valdez BC, Li Y, Murray D, Corn P, Champlin RE, Andersson BS. 5-Aza-2'-deoxycytidine sensitizes busulfan-resistant myeloid leukemia cells by regulating expression of genes involved in cell cycle checkpoint and apoptosis. Leuk Res. 2010;34:364-372. [PubMed] [DOI] |
| 16. | Daskalakis M, Blagitko-Dorfs N, Hackanson B. Decitabine. Recent Results Cancer Res. 2010;184:131-157. [PubMed] [DOI] |