修回日期: 2012-10-19
接受日期: 2012-10-29
在线出版日期: 2012-11-08
目的: 研究肝细胞恶性转化过程中胰岛素样生长因子(insulin-like growth factor, IGF)轴中关键信号分子IGF-Ⅱ和IGF-Ⅰ受体(IGF-IR)的动态表达与改变特征.
方法: 采用以2-乙酰氨基芴(2-fluorenylacetamide, 2-FAA)喂饲♂SD鼠诱发肝癌发生, 以病理组织学观察肝细胞形态学改变、免疫组织化学法观察IGF-Ⅱ和IGF-IR表达与定位, 以ELISA法定量肝组织及血IGF-Ⅱ和IGF-IR水平, 以逆转录巢式PCR分析IGF-Ⅱ mRNA和IGF-IR mRNA的转录水平, 扩增片段序列经DNA测序证实.
结果: 诱癌过程中, 肝细胞在形态学上出现细胞颗粒样变性、不典型增生到肝癌的发展过程, 伴随肝组织核酸代谢旺盛, 肝总RNA、IGF-Ⅱ和IGF-IR在转录和蛋白水平上进行性升高; 随肝病理组织学改变, 组间差异显著(F = 13.2, P<0.01). 肝组织IGF-Ⅱ比浓度, 癌变组明显升高, 组间差异显著(F = 48.1, P<0.01), 癌变组明显高于对照组、变性组和癌前组(P<0.01); 血IGF-Ⅱ浓度(nmol/L). 与肝IGF-Ⅱ比浓度(nmol/mg wet liver)呈显著正相关(r = 0.97, t = 5.97, P<0.01). 肝组织和血清IGF-IR浓度改变类似于IGF-Ⅱ, 癌变组明显高于对照组、变性组和癌前组(P<0.01).
结论: IGF-Ⅱ和IGF-IR参与肝细胞恶性转化过程, 其过表达是肝癌发生的早期事件.
引文著录: 董志珍, 严晓娣, 姚敏, 严美娟, 王理, 邱历伟, 吴玮, 姚登福. IGF信号通路关键信号分子的表达与肝细胞恶性转化. 世界华人消化杂志 2012; 20(31): 2992-2999
Revised: October 19, 2012
Accepted: October 29, 2012
Published online: November 8, 2012
AIM: To investigate the dynamic expression of key insulin-like growth factor (IGF) signaling IGF-Ⅱ and IGF-Ⅰreceptor (IGF-IR) during malignant transformation of rat hepatocytes.
METHODS: Hepatoma was induced in male Sprague-Dawley rats with 2-fluorenylacetamide (2-FAA). Morphological changes of the liver were observed, and dynamic changes in the levels of IGF-Ⅱ and IGF-1R in the liver and serum were quantitatively analyzed. The expression and distribution of IGF-Ⅱ and IGF-1R proteins were analyzed by immunohistochemistry. Serum IGF-1R and IGF-II levels were detected by ELISA. Expression of IGF-Ⅱ and IGF-IR mRNAs in the liver was detected by nested RT-PCR and confirmed by DNA sequencing.
RESULTS: After induction with 2-FAA, rat hepatocytes showed granule-like degeneration, atypical hyperplasia, and malignant transformation, and hepatic total RNA, IGF-1R, and IGF-Ⅱ levels significantly increased. The levels of IGF-Ⅱ in the liver (F = 48.1, P < 0.01) and serum (F = 13.2, P < 0.01) were significantly higher in the hepatoma group than in any of other groups. There was a positive relationship (r = 0.97, t = 5.97, P < 0.01) between liver IGF-II (nmol/mg wet liver) and serum IGF-Ⅱ (nmol/L). Similar results were also obtained for IGF-IR in the liver and serum, and IGF-IR expression in the hepatoma group was significantly higher (P < 0.01) than that in any of other groups.
CONCLUSION: IGF-1R and IGF-Ⅱ may participate in hepatocyte canceration. Overexpression of IGF-1R and IGF-Ⅱ might be useful molecular markers for early diagnosis and prognosis of hepatocellular carcinoma.
- Citation: Dong ZZ, Yan XD, Yao M, Yan MJ, Wang L, Qiu LW, Wu W, Yao DF. Association between expression of key insulin-like growth factor signaling molecules and malignant transformation of hepatocytes. Shijie Huaren Xiaohua Zazhi 2012; 20(31): 2992-2999
- URL: https://www.wjgnet.com/1009-3079/full/v20/i31/2992.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i31.2992
肝细胞癌(hepatocellular carcinoma, HCC)是由肝炎病毒(hepatitis B virus, HBV或hepatitis C virus, HCV), 化学致癌物等致癌基因或癌相关基因激活、抗癌基因失活或胚胎期基因活化等诸多因素引起肝细胞发生恶性转化, 经启动、促进、演变多阶段发病过程[1,2], 确切发病机制尚不清楚, 但临床与基础研究资料已证明有多种信号通路介导肝癌的进展[3,4]. 胰岛素样生长因子轴(insulin-like growth factor axis, IGFs)介导的信号转导是生长发育过程中的必要条件, 且与多种恶性肿瘤的形成密切相关[5,6]. IGFs由分泌型配体IGF-Ⅰ和IGF-Ⅱ、细胞膜受体IGF-IR(IGF receptor-Ⅰ)、胰岛素受体(insulin receptor, IR)和IGF-ⅡR(IGF receptor-Ⅱ)及高亲和力IGF结合蛋白(IGF binding protein1-6, IGFBP1-6)组成, 在维持组织稳态, 调节细胞生长、增殖、分化、凋亡以及转化等方面发挥重要作用[7,8].
肝癌发生发展过程中, IGFs轴失衡与肝细胞恶性转化关系密切[9,10]. 该信号通路存在两个至关重要的信号分子, 即IGF-Ⅱ和IGF-Ⅰ受体(IGF-IR). IGF-Ⅱ和IGF-IR结合, 才能发挥生物调节作用, 在人胎肝和肝癌组织中过表达, 成人肝不表达或持极低水平[11]. 针对IGF-Ⅱ和IGF-IR的分子靶向或免疫治疗, 显示具有应用前景[12]. 本文以乙酰氨基芴(2-fluorenylacetamide, 2-FAA)诱发鼠肝细胞发生恶性转化, 动态观察IGFs信号通路中关键信号分子的表达与变化规律, 以探讨该信号通路在肝癌发生过程中的作用与分子机制.
♂SD大鼠54只(SPF, 4-6周龄, 体质量125-150 g, 南通大学实验动物中心)随机分组(6只/组), 任挑2组鼠为对照组, 其余为实验组(含备用组).
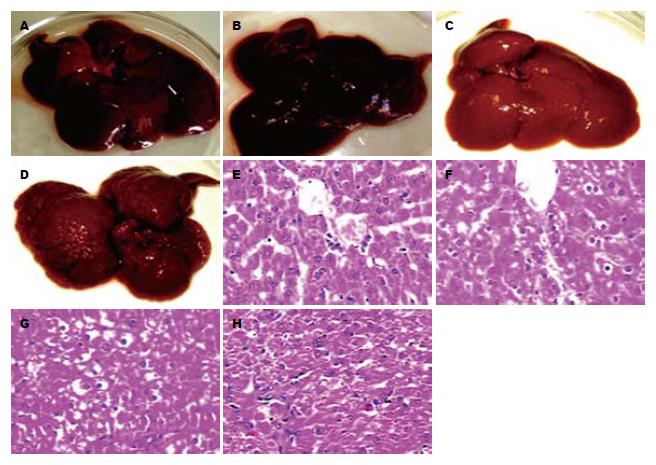
1.2.1 肝癌模型与病理学检查: 对照鼠给予一般颗粒饲料, 其余实验鼠以0.05%的2-FAA(Sigma, USA)粒饲料作恒环境饲养. 实验期间剔除死亡鼠, 以备用鼠补足. 每2周取两只正常鼠及一组实验鼠, 以乙醚轻度麻醉. 从心尖取血5 mL分离血清, 置-20 ℃冰箱保存; 肝组织以40g/L甲醛固定, 作病理学和免疫组织化学染色, 其余组织置-80 ℃保存. 肝组织固定, 脱水、透明、浸蜡、石蜡包埋后, 常规切片后经苏木素-伊红(HE)染色, 光镜(OLYMPUS公司)观察、摄片. 按组织病理学检查分为正常肝细胞组(对照组)、肝细胞变性组(变性组)、肝细胞癌前病变组(癌前组)和肝细胞癌变组(癌变组)进行分析与比较.
1.2.2 肝总RNA提取: 取组织20 mg, 置于经0.1% DEPC水处理过的匀浆器中, 加入1 mL TRIzol, 冰上充分匀浆. 吸1 mL匀浆液至离心管中, 4℃ 15 000 r/min离心10 min. 取上清0.8 mL, 加入0.2 mL氯仿, 震荡2 min, 4 ℃ 10 000 r/min离心10 min. 取上清0.3 mL, 加100%异丙醇0.3 mL, 再加50%异丙醇0.5 mL, 震荡30 s, 4 ℃ 15 000 r/min离心5 min. 弃上清, 加1 mL 750 mL/L乙醇, 轻轻洗涤沉淀. 4 ℃, 15 000 r/min离心5 min. 弃上清, 室温静置3 min, 将乙醇晾干. 加20 μL 0.1%氯化锂溶解沉淀, 50 ℃孵育5 min. 在核酸蛋白分析仪上测定A260/A280和总RNA浓度.
1.2.3 cDNA合成: 总RNA 2 μg, 加随机引物(Oligo-dT18, 0.5 μg/μL)1 μL, 以DEPC水定容至12 μL, 离心5 s, 70 ℃水浴5 min, 冰浴30 s, 再离心5 s; 将PCR管置冰浴, 加试剂: 5×反应缓冲液4 μL, 核酸酶抑制物(20 U/μL)1 μL, dNTP Mix(10 mmol/L)2 μL, 离心5 s, 37 ℃水浴5 min, 冰浴30 s; 加入1 μL M-MuLV逆转录酶(20 U/μL), 终体积为20 μL. 反应混合物37 ℃水浴60 min, 70 ℃10 min.
1.2.4 引物设计: 按基因库鼠IGF-IR(NM052807)和IGF-Ⅱ(NM031511)序列, 以Premier Primer 5.0软件设计引物. 各自巢式PCR引物: 外部(P1和P2)、内部(P3和P4)的核苷酸序列见表1.
| 名称 | 引物序列(5'-3') | 核苷酸位置 | 大小(bp) |
| 鼠IGF-IR | |||
| IGF-IR-P1 | 5'-CTGCGGCGATGAAGAAAAGA-3' | 1038-1057 | 503 |
| IGF-IR-P2 | 5'-TGGAGGTGAAACGGAGAACA-3' | 1521-1540 | |
| IGF-IR-P3 | 5'-ATGCCTTGGTCTCCTTGTCCTT-3' | 1229-1250 | 242 |
| IGF-IR-P4 | 5'-TTTGCTCTGCCGTCCCTTTGTT-3' | 1449-1470 | |
| 鼠IGF-II | |||
| IGF-II-P1 | 5'-GGATCTCAGAACCCAAGAAG-3' | 2168-2187 | 513 |
| IGF-II-P2 | 5'-ACACTGGCAGCAGAAACTAG-3' | 2661-2680 | |
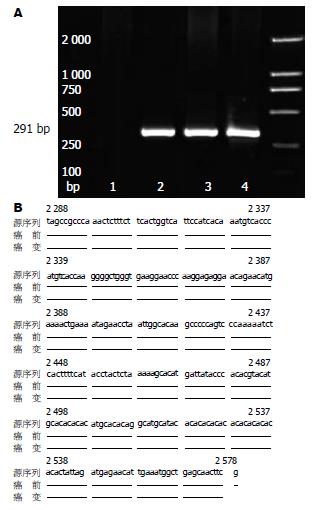
| IGF-II-P3 | 5'-TAGCCGCCCAAACTCTTTCT-3' | 2288-2037 | 291 |
| IGF-II-P4 | 5'-CGAAGTTGCTCAGCCATTTC-3' | 2559-2578 |
1.2.5 巢式聚酶链反应(nested-PCR)扩增: 第1阶段(25 μL): 0.1 μg/μL cDNA 2.0 μL, 10 μmol/L混合引物(P1、P2)2.0 μL, Premix Taq 12.5 μL, 加双蒸水至25 μL, 扩增条件: 94 ℃预变性5 min; 94 ℃变性10 s; 55 ℃复性30 s; 72 ℃延伸1 min; 重复2-4步骤35个循环; 72 ℃延伸 10 min. 第2阶段(25 μL): 第1阶段PCR产物1.0 μL, 10 μmol/L混合引物(P3、P4)2.0 μL, Premix Taq 12.5 μL, 加双蒸水至25 μL, 扩增条件: 94 ℃预变性5 min; 94 ℃变性10 s; 55 ℃复性30 s; 72 ℃延伸1 min; 重复2-4步骤35个循环; 72 ℃延伸10 min; 产物4 ℃保存.
1.2.6 PCR产物电泳及测序分析: 琼脂糖0.375 g, 加25 mL TAE缓冲液[Tris碱242 g、冰乙酸57.1 mL、EDTA(0.5 mol/L, pH 8.0)100 mL(使用时稀释50倍)], 加热沸腾3次. 稍冷却后加10 mg/mL的溴化乙锭(EB)1.5 μL, 浇板、插梳; 电泳槽内加300 mL TAE缓冲液、15 μL EB混匀. 取8 μL PCR产物及1 μL上样缓冲液(0.25 g溴酚蓝、40%蔗糖水溶液100 mL)混匀, 加入泳道孔内. 每板用DNA Ladder 6 μL作DNA分子量标准带. 100 V电泳约30 min. 在320 nm紫外透射仪下摄像. 以1.5%的琼脂糖凝胶电泳分离已扩增片段, 留取含DNA的凝胶, 用MegaBACE DNA序列分析仪进行DNA测序分析, 并与基因源序列进行比较.
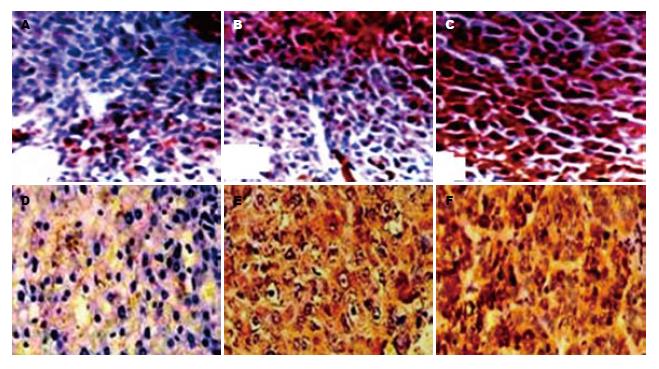
1.2.7 免疫组织化学染色(链霉亲和素-生物素法, SP法): 新鲜肝组织经取材、固定、浸蜡, 组织切片(4 μm)、脱蜡、水化、阻断、修复、封闭非特异性结合; 滴加IGF-Ⅱ或IGF-IR抗体4 ℃过夜, 磷酸盐缓冲液(PBS)漂洗; 滴加生物素标记的各自第二抗体, 孵育; 滴加链霉素抗生物素蛋白-过氧化酶, 孵育; 滴加新鲜配制的四盐酸二氨基联苯胺(DAB)溶液, 显色, 苏木素复染. 乙醇脱水透明、封片. OLYMPUS BX 50光学显微镜观察、摄像. 以0.01 mol/L PBS液(pH = 7.5)分别替代一抗、二抗作阴性对照, 已知表达IGF-Ⅱ或IGF-IR的人肝癌组织作阳性对照. 组织显示棕黄色颗粒为IGF-IR、IGF-Ⅱ表达阳性, 其表达强度: (+), 阳性细胞数为10%-25%; (++), 阳性细胞数为26%-50%; (+++), 阳性细胞数>75%.
1.2.8 肝组织总蛋白提取和测定: 湿质量鼠肝50 mg置于匀浆器中, 加PBS缓冲液1.0 mL匀浆3 min, 4 ℃ 5 000 r/min离心4 min, 取上清, 以BAC法在核酸蛋白分析仪上562 nm处测定其吸光度(A)并计算蛋白浓度.
1.2.9 IGF-Ⅱ和IGF-IR的定量测定: 鼠肝及血IGF-Ⅱ、IGF-IR定量检测, 以ADL公司试剂盒进行定量分析, 严格按试剂盒说明书操作, 根据标准曲线计算浓度.
统计学分析 计量资料以mean±SD表示, 以t检验分析; 计数资料以χ2检验分析, 以P<0.05表示差异有显著性.
经病理组织学检查, 对照鼠肝细胞在诱癌过程中形态学无异常改变发生(对照组, n = 12, 图1A, E); 模型鼠在诱癌过程中肝细胞的病理形态学动态变化见表2. 诱癌早期肝细胞胞浆见颗粒样变性, 偶见大的异型胞核(变性组, n = 18, 图1B, F); 诱癌中期见结节形成趋势, 肝板细胞层次增多, 局灶细胞层次超过3层, 细胞核染色质增粗, 核浆比例增大(癌前组, n = 9, 图1C, G); 诱癌后期鼠肝布满结节, 见肝组织结构消失, 肝细胞排列成巢状、粗条索状, 细胞核中等大, 核染色质增粗, 核浆比例增大, 为高分化HCC(癌变组, n = 9, 图1D, H).
| 分组 | n | 肝细胞病理学形态变化 | |||
| 正常 | 变性 | 癌前 | 癌变 | ||
| 对照组 | 12 | 12 | 0 | 0 | 0 |
| 实验组 | |||||
| 第2周 | 6 | 0 | 6 | 0 | 0 |
| 第4周 | 6 | 0 | 6 | 0 | 0 |
| 第6周 | 6 | 0 | 5 | 1 | 0 |
| 第8周 | 6 | 0 | 1 | 4 | 1 |
| 第10周 | 6 | 0 | 0 | 3 | 3 |
| 第12周 | 6 | 0 | 0 | 1 | 5 |
| 总计 | 48 | 12 | 18 | 9 | 9 |
模型鼠肝细胞IGF-IR和IGF-Ⅱ阳性表达物呈棕黄色颗粒, 在不典型增生区域可见胞核着色; 在肝细胞的坏死区域, 胞浆胞膜着色多见, 阳性细胞多位于汇管区的边缘或近中心静脉区. 诱癌过程中, 肝细胞IGF-Ⅱ(图2A-C)和IGF-IR(图2D-F)表达阳性率随肝组织学形态改变逐渐增高, 癌前病变组和癌变组明显高于正常组, 癌变组也明显高于变性组, 两者的阳性表达经半定量分析总结见表3. 在18例肝细胞变性组中, 有9例IGF-IR表达阳性, 其中有5例表达在中等强度以上; 在9例癌前病变组中, IGF-IR表达8例阳性, 其中5例表达在中等强度以上; 在9例癌变组中, IGF-IR表达9例阳性, 其中8例表达中等强度以上.
诱癌过程中肝细胞出现颗粒变性, 向癌前病变及癌变发展, 肝总RNA呈动态变化, 表现为癌变组>癌前组>变性组>对照组; 总RNA比活性, 癌前组明显高于对照组(P<0.05); 癌变组明显高于对照组、变性组和癌前组(P<0.05); 肝细胞癌变组、绝大部分癌前组及半数变性组可检出图谱清晰的IGF-IR mRNA(242 bp, 图3A)和IGF-Ⅱ mRNA(291 bp, 图4A)扩增区带, 并被测序证实, 与Gene Bank中源序列比较(图3B和图4B), 与IGF-Ⅱ, IGF-IR源序列完全一致, 所测序列中未见变异发生. 肝细胞癌变过程中IGF-IR mRNA和IGF-Ⅱ mRNA阳性率逐渐升高, 癌前组和癌变组检出率明显高于正常组和变性组, 呈正相关关系(r = 0.99, P<0.01, 表3).
诱癌过程中鼠血和肝组织中IGF-Ⅱ和IGF-IR表达水平的定量分析结果见表4. 血和肝IGF-Ⅱ表达, 随肝组织学形态改变呈增高趋势, 表现为癌变组>癌前组>变性组>对照组(F = 13.2, P<0.01). 肝组织IGF-Ⅱ比浓度, 癌变组明显高于对照组(t = 8.94, P<0.01)、变性组(t = 6.88, P<0.01)和癌前组(t = 2.42, P<0.05). 肝组织大量表达IGF-Ⅱ并释放入血, 血IGF-Ⅱ浓度, 呈显著性梯度升高(F = 48.1, P<0.01), 癌变组明显高于对照组(t = 7.41, P<0.01)、变性组(t = 6.76, P<0.01)和癌前组(i = 4.29, P<0.01); 血清与肝IGF-Ⅱ浓度变化呈显著正相关(r = 0.97, t = 5.97, P<0.01). 肝组织IGF-IR比浓度(nmol/mg湿质量肝), 癌变组明显高于对照组、变性组和癌前组(P<0.01); 血IGF-IR浓度癌变组明显高于对照组、变性组和癌前组(P<0.01).
IGF轴在维持组织稳态, 调节细胞生长、增殖、分化、凋亡以及转化等方面发挥重要功能, 他的失衡与肝细胞恶性转化关系密切[13,14]. IGF-Ⅱ生物学作用主要由IGF-IR介导, IGF-Ⅱ与酪氨酸激酶受体IGF-IR结合后启动两条信号转导通路, 即PI3K/Akt和MAPK信号通路, 促进细胞有丝分裂, 诱导细胞增生、转化和抑制凋亡, 促进癌前期肝细胞的异常增殖和分化[15-17]. 本文以2-FAA诱发鼠肝细胞发生恶性转化, 从基因转录和蛋白表达水平上成功地动态观察IGF轴中关键信号分子IGF-IR和IGF-Ⅱ的改变规律, 以探讨其在肝癌发生早期的作用机制.
IGF-IR是细胞表面酪氨酸蛋白激酶受体, 位于染色体15q25-26, 由130-135 kDa的α链和90-95 kDa的β链以α-α, α-β二硫键构成. α亚基位于细胞外是配体结合部位, β亚基为跨膜蛋白, 胞浆侧具有酪氨酸激酶活性. IGF-IR表达于非实质细胞, 包括库否细胞和星型细胞, 使肝细胞对IGF促有丝分裂敏感[18,19]. IGF-IR与IGFs结合, 触发分子间及信号通路的级联反应[20,21]. 动物模型证实肝细胞癌变过程中形态学呈现恶性转化过程: 早期胞浆出现颗粒样变性, 偶见大的异型胞核(变性组); 中期胞核染色质增粗, 核浆比例增大(癌前组); 后期可见肝组织结构消失, 肝细胞排列成巢状、粗条索状, 细胞核中等大, 核染色质增粗, 核浆比例增大, 均为高分化HCC. 按照病理学分类, 将模型鼠分为: 对照、变性、癌前和癌变4组, 分析与比较了肝细胞癌变过程中IGF-Ⅱ和IGF-IR的动态变化. 肝细胞恶性转化发生, 癌变伴核酸大量合成, 引起核酸代谢旺盛, 肝总RNA浓度升高, 癌前组和癌变组检出率明显高于对照组和变性组. 胎儿早期IGF-Ⅱ mRNA 610 kb表达, 而成人为513 kb mRNA表达, 癌变前期胚胎型IGF-Ⅱ基因活化, IGF-Ⅱ过度表达[14,20], 揭示启动已关闭的启动子P3而产生胚胎表型逆转. 组织IGF-Ⅱ mRNA经基因扩增证实, 其升高与HCC分化程度有关, 低分化癌中见较强阳性表达信号. IGF-Ⅱ通过自分泌或旁分泌作用促细胞转化, 刺激DNA合成, 促进有丝分裂, 重现胚胎型IGF-Ⅱ mRNA, 而肝硬变及肝良性肿瘤IGF-Ⅱ mRNA为成年型; 肝IGF-Ⅱ比浓度, 癌变组明显升高, 组间差异显著, 显示肝细胞恶性转化过程中, 核酸代谢旺盛, 胚胎型IGF-Ⅱ和IGF-IR重新活化、转录和高表达是肝癌发生早期的病理学特征[10,20].
IGF-Ⅱ/IGF-IR表达与肝癌细胞分化程度、肝癌发生是否合并肝炎病毒感染等因素有关, 其分化程度越低, 则表达水平就越高. 肝细胞恶性转化, 伴随着IGF-Ⅱ和IGF-IR明显异常[10,20-23]. HCC发生初始阶段升高伴有肝脏脉管区卵圆细胞的出现, 小肝癌中可见强阳性表达. 血与肝IGF-Ⅱ浓度呈显著正相关. 在临床上, 癌前结节及癌旁肝细胞出现胚胎型IGF-Ⅱ表达提示存在癌变倾向, 水平愈高预示肝细胞癌变愈大, 可作为肝细胞癌前病变警示信号[10,11].
HCC是我国常见的恶性肿瘤, 绝大多数HCC都有肝硬化基础, 确诊时已多属中、晚期, 缺乏有效治疗. IGF-Ⅱ和IGF-IR在胚胎发生发展、肝细胞生长和分化过程中起重要作用[24,25]. 从肝细胞恶性转化过程中, 从基因活化与表达水平上, 揭示HCC发生早期IGF-Ⅱ和IGF-IR已过表达, 以此为靶点的体内研究, 可直接通过诱发凋亡和抑制细胞生长来抑制癌细胞进展[26]; 他们的早期表达和与肝细胞恶性转化的紧密联系, 将有助于肝癌诊断、发病机制探讨, 在分子靶向治疗方面具开发前景[27,28].
肝脏是合成和分泌IGF-Ⅱ和IGF-IR的主要器官, IGF-Ⅱ与酪氨酸激酶受体IGF-IR结合, 促进细胞有丝分裂, 诱导转化和抑制凋亡, 促进癌前期肝细胞的异常增殖和分化, IGF-Ⅱ表达高低与肝病严重程度相关.
孟庆华, 教授, 首都医科大学附属北京佑安医院肝病四科
肝组织IGF-Ⅱ/IGF-IR通路在维持组织稳态, 调节细胞生长、增殖、分化、凋亡以及转化等方面发挥重要功能, 对IGF-Ⅱ/IGF-IR通路的研究将有助于肝癌诊断与发病机制探讨, 在分子靶向治疗方面具开发前景.
Yao等报道, 以IGF-Ⅱ特异的小干扰RNA作用于人肝癌细胞株后, 使IGF-Ⅱ活化受阻, 可通过诱导凋亡机制, 十分显著地抑制肝癌细胞增殖, 是肝癌基因治疗的潜在分子靶点.
本研究以化学诱癌法制备肝癌发生的动态模型, 在肝细胞发生恶性转化过程中, 动态观察了IGF信号通路中关键信号分子的表达与改变规律, 在肝癌发生过程中的作用与分子机制.
肝细胞恶性转化和癌变过程中, IGF-Ⅱ和IGF-IR均在肝癌形成早期过表达, 结合临床上常用的血清AFP标志, 有助于肝癌的早期诊断, 另外又可作为肝癌靶向治疗新的分子靶点, 具有开发应用价值.
论文的科学性、创新性和可读性较好.
编辑: 田滢 电编:鲁亚静
| 1. | Aravalli RN, Steer CJ, Cressman EN. Molecular mechanisms of hepatocellular carcinoma. Hepatology. 2008;48:2047-2063. [PubMed] [DOI] |
| 2. | Kew MC. Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma. i. Gastroenterol Hepatol. 2011;26 Suppl 1:144-152. [PubMed] [DOI] |
| 3. | Hoshida Y. Molecular signatures and prognosis of hepatocellular carcinoma. Minerva Gastroenterol Dietol. 2011;57:311-322. [PubMed] |
| 4. | Freise C, Ruehl M, Erben U, Neumann U, Seehofer D, Kim KY, Trowitzsch-Kienast W, Stroh T, Zeitz M, Somasundaram R. A hepatoprotective Lindera obtusiloba extract suppresses growth and attenuates insulin like growth factor-1 receptor signaling and NF-kappaB activity in human liver cancer cell lines. BMC Complement Altern Med. 2011;11:39. [PubMed] [DOI] |
| 5. | Qian J, Yao D, Dong Z, Wu W, Qiu L, Yao N, Li S, Bian Y, Wang Z, Shi G. Characteristics of hepatic igf-ii expression and monitored levels of circulating igf-ii mRNA in metastasis of hepatocellular carcinoma. Am J Clin Pathol. 2010;134:799-806. [PubMed] [DOI] |
| 6. | El Tayebi HM, Salah W, El Sayed IH, Salam EM, Zekri AR, Zayed N, Salem ES, Esmat G, Abdelaziz AI. Expression of insulin-like growth factor-II, matrix metalloproteinases, and their tissue inhibitors as predictive markers in the peripheral blood of HCC patients. Biomarkers. 2011;16:346-354. [PubMed] [DOI] |
| 7. | Ubagai T, Kikuchi T, Fukusato T, Ono Y. Aflatoxin B1 modulates the insulin-like growth factor-2 dependent signaling axis. Toxicol In Vitro. 2010;24:783-789. [PubMed] [DOI] |
| 8. | Scharf JG, Dombrowski F, Ramadori G. The IGF axis and hepatocarcinogenesis. Mol Pathol. 2001;54:138-144. [PubMed] [DOI] |
| 9. | Chen YW, Boyartchuk V, Lewis BC. Differential roles of insulin-like growth factor receptor- and insulin receptor-mediated signaling in the phenotypes of hepatocellular carcinoma cells. Neoplasia. 2009;11:835-845. [PubMed] |
| 10. | Qiu LW, Yao DF, Zong L, Lu YY, Huang H, Wu W, Wu XH. Abnormal expression of insulin-like growth factor-II and its dynamic quantitative analysis at different stages of hepatocellular carcinoma development. Hepatobiliary Pancreat Dis Int. 2008;7:406-411. [PubMed] |
| 11. | 邱 历伟, 姚 登福, 吴 信华, 吴 玮, 苏 小琴, 邹 黎. 肝癌组织IGF-Ⅱ表达与HBV DNA复制及病理学特征的关系. 世界华人消化杂志. 2006;14:1267-1271. [DOI] |
| 12. | Tovar V, Alsinet C, Villanueva A, Hoshida Y, Chiang DY, Solé M, Thung S, Moyano S, Toffanin S, Mínguez B. IGF activation in a molecular subclass of hepatocellular carcinoma and pre-clinical efficacy of IGF-1R blockage. J Hepatol. 2010;52:550-559. [PubMed] [DOI] |
| 13. | Cheng W, Tseng CJ, Lin TT, Cheng I, Pan HW, Hsu HC, Lee YM. Glypican-3-mediated oncogenesis involves the Insulin-like growth factor-signaling pathway. Carcinogenesis. 2008;29:1319-1326. [PubMed] [DOI] |
| 14. | Weng CJ, Hsieh YH, Tsai CM, Chu YH, Ueng KC, Liu YF, Yeh YH, Su SC, Chen YC, Chen MK. Relationship of insulin-like growth factors system gene polymorphisms with the susceptibility and pathological development of hepatocellular carcinoma. Ann Surg Oncol. 2010;17:1808-1815. [PubMed] [DOI] |
| 15. | Breuhahn K, Schirmacher P. Reactivation of the insulin-like growth factor-II signaling pathway in human hepatocellular carcinoma. World J Gastroenterol. 2008;14:1690-1698. [PubMed] [DOI] |
| 16. | Nussbaum T, Samarin J, Ehemann V, Bissinger M, Ryschich E, Khamidjanov A, Yu X, Gretz N, Schirmacher P, Breuhahn K. Autocrine insulin-like growth factor-II stimulation of tumor cell migration is a progression step in human hepatocarcinogenesis. Hepatology. 2008;48:146-156. [PubMed] [DOI] |
| 17. | Alexia C, Bras M, Fallot G, Vadrot N, Daniel F, Lasfer M, Tamouza H, Groyer A. Pleiotropic effects of PI-3' kinase/Akt signaling in human hepatoma cell proliferation and drug-induced apoptosis. Ann N Y Acad Sci. 2006;1090:1-17. [PubMed] [DOI] |
| 18. | Cadoret A, Desbois-Mouthon C, Wendum D, Leneuve P, Perret C, Tronche F, Housset C, Holzenberger M. c-myc-induced hepatocarcinogenesis in the absence of IGF-I receptor. Int J Cancer. 2005;114:668-672. [PubMed] [DOI] |
| 19. | Alexia C, Fallot G, Lasfer M, Schweizer-Groyer G, Groyer A. An evaluation of the role of insulin-like growth factors (IGF) and of type-I IGF receptor signalling in hepatocarcinogenesis and in the resistance of hepatocarcinoma cells against drug-induced apoptosis. Biochem Pharmacol. 2004;68:1003-1015. [PubMed] [DOI] |
| 20. | Lee JY, Han CY, Yang JW, Smith C, Kim SK, Lee EY, Kim SG, Kang KW. Induction of glutathione transferase in insulin-like growth factor type I receptor-overexpressed hepatoma cells. Mol Pharmacol. 2007;72:1082-1093. [PubMed] [DOI] |
| 21. | Aleem E, Nehrbass D, Klimek F, Mayer D, Bannasch P. Upregulation of the insulin receptor and type I insulin-like growth factor receptor are early events in hepatocarcinogenesis. Toxicol Pathol. 2011;39:524-543. [PubMed] [DOI] |
| 22. | 陆 园园, 姚 登福, 吴 信华, 黄 华, 邱 历伟, 吴 玮. 肝癌及癌旁组织IGF-Ⅰ受体表达及临床病理学特征. 南通大学学报(医学版). 2008;28:169-171. |
| 23. | Yao DF, Dong ZZ, Yao M. Specific molecular markers in hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2007;6:241-247. [PubMed] |
| 24. | Lin RX, Wang ZY, Zhang N, Tuo CW, Liang QD, Sun YN, Wang SQ. Inhibition of hepatocellular carcinoma growth by antisense oligonucleotides to type I insulin-like growth factor receptor in vitro and in an orthotopic model. Hepatol Res. 2007;37:366-375. [PubMed] [DOI] |
| 25. | Zhao H, Desai V, Wang J, Epstein DM, Miglarese M, Buck E. Epithelial-mesenchymal transition predicts sensitivity to the dual IGF-1R/IR inhibitor OSI-906 in hepatocellular carcinoma cell lines. Mol Cancer Ther. 2012;11:503-513. [PubMed] [DOI] |
| 26. | Yao WF, Liu JW, Sheng GL, Huang DS. Blockade of IGF-IR exerts anticancer effects in hepatocellular carcinoma. Mol Med Report. 2011;4:719-722. [PubMed] |
| 27. | Lang SA, Moser C, Fichnter-Feigl S, Schachtschneider P, Hellerbrand C, Schmitz V, Schlitt HJ, Geissler EK, Stoeltzing O. Targeting heat-shock protein 90 improves efficacy of rapamycin in a model of hepatocellular carcinoma in mice. Hepatology. 2009;49:523-532. [PubMed] [DOI] |
| 28. | Tomizawa M, Yokosuka O. Picropodophyllin suppresses the proliferation and invasion of hepatocellular carcinoma under serum starvation. Mol Med Report. 2008;1:685-688. [PubMed] |