修回日期: 2012-10-10
接受日期: 2012-10-23
在线出版日期: 2012-11-08
目的: 探索TRAIL基因转染内皮祖细胞对肝癌的治疗作用.
方法: 通过PCR扩增TRAIL基因, 将TRAIL基因与pcDNA3.1载体连接, 采用腺病毒转染入内皮祖细胞中, 并用Western blot进行TRAIL基因的表达鉴定. 建立小鼠皮下移植瘤动物模型, 用携带TRAIL基因的重组腺病毒转染内皮祖细胞, 经尾静脉注射, 同时以生理盐水和空载腺病毒为对照, 分别观察治疗效果.
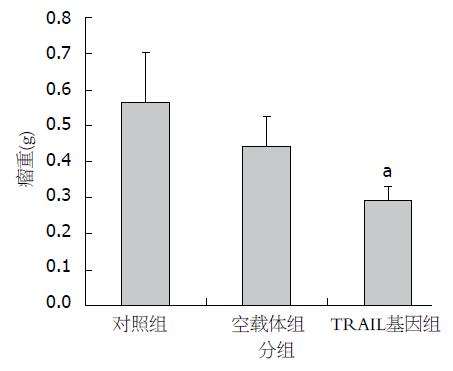
结果: 经酶切及测序鉴定, TRAIL基因与pcDNA3.1的重组质粒构建成功. Western blot检测发现TRAIL基因转染入内皮祖细胞后有表达. 转染TRAIL基因组的抑瘤率为47.77%, 肿瘤体积平均值为0.791 cm3±0.119 cm3, 肿瘤质量平均值为0.29 g±0.04 g, 经统计学分析与对照组有显著性差异.
结论: TRAIL基因成功转染入内皮祖细胞并表达, TRAIL基因转染内皮祖细胞可以明显抑制H22移植瘤的生长, 且无明显不良反应.
引文著录: 袁献温, 葛夏青, 孙喜太, 丁义涛. 内皮祖细胞介导TRAIL基因对小鼠肝细胞癌的治疗作用. 世界华人消化杂志 2012; 20(31): 2986-2991
Revised: October 10, 2012
Accepted: October 23, 2012
Published online: November 8, 2012
AIM: To investigate the influence of intravenous administration of endothelial progenitor cells (EPCs) transfected with the TRAIL gene on the growth of tumors derived from subcutaneously inoculated H22 cells in nude mice to provide a theoretical basis for the treatment of liver cancer.
METHODS: The TRAIL gene was amplified by PCR, cloned into the pcDNA3.1 vector, and transfected into EPCs. The expression of TRAIL protein was detected by Western blot. Mice were inoculated subcutaneously with H22 cells to induce tumor formation. Tumor-bearing mice were randomly divided into three groups and injected via the tail vein with EPCs transfected with the recombinant adenoviral vector carrying the TRAIL gene, the empty vector, and normal saline, respectively.
RESULTS: Restriction enzyme digestion and DNA sequencing analyses indicate that the recombinant plasmid was constructed successfully. TRAIL expression was detected in EPCs transfected with the recombinant adenoviral vector by Western blot. The rate of reduced tumor growth was 47.77% in mice administered with EPCs carrying the TRAIL gene. Tumor volume and weight in the experimental group (0.791 cm3 ± 0.119 cm3, 0.29 g ± 0.04 g) were significantly lower than those in the two control groups (all P < 0.05).
CONCLUSION: The recombinant plasmid carrying the TRAIL gene has been successfully constructed. Intravenous administration of endothelial progenitor cells transfected with the TRAIL gene inhibits the growth of tumors derived from H22 cells in nude mice.
- Citation: Yuan XW, Ge XQ, Sun XT, Ding YT. Intravenous administration of endothelial progenitor cells transfected with the TRAIL gene inhibits the growth of tumors derived from H22 cells in nude mice. Shijie Huaren Xiaohua Zazhi 2012; 20(31): 2986-2991
- URL: https://www.wjgnet.com/1009-3079/full/v20/i31/2986.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i31.2986
肝细胞癌是恶性程度最高的消化系肿瘤之一. 在恶性肿瘤中其发病率居世界第5位, 死亡率居第3位[1]. 我国每年肝癌新发病例数量高达36万, 因肝癌致死人数达35万[2]. 因此, 寻找新的有效的肝癌治疗措施成为目前研究的目标. 内皮祖细胞(endothelial progenitor cells, EPCs)是一类具有游走特性的能定向增殖分化为成熟血管内皮细胞的前体细胞, 主要存在于骨髓, 也存在于外周血和脐带血, 少量存在于心脏、血管、骨骼肌和脂肪组织. 骨髓中含有大量造血干细胞和间充质干细胞, 均可分化为EPCs, 故骨髓中的EPCs含量丰富, 增殖能力强[3]. 1997年, 日本研究者Asahara等[4]初次从人外周血单核细胞分离出CD34和血管内皮细胞生长因子受体-2(vascular endothelial cellgrowth factor, VEGFR-2)均为阳性的单核细胞, 其在体外培养呈梭形, 可形成管腔样结构, 能够表达内皮细胞的特异性抗原, 故命名为EPCs. Hur等[5]从成人外周血中培养出两种类型EPCs, 并将其命名为早期EPCs和晚期EPCs, Schatteman等[6]发现, 早期EPCs对血管起修补作用, 而晚期EPCs因其强大的细胞增殖能力, 在血管生成中起作用. 肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis inducing ligand, TRAIL)是一种Ⅱ型跨膜蛋白, 他可通过特异性结合死亡结构域激发和传导凋亡信号, 从而进一步激活一系列的蛋白酶联反应, 诱导细胞凋亡[7]. TRAIL诱导细胞凋亡不依赖功能性P53的存在, 而且具有肿瘤或转化细胞特异性, 并能够通过旁观者效应对肿瘤细胞进行杀伤, 在肿瘤的免疫监督和抑制转移中也起着重要作用[8]. 虽然TRAIL基因有广谱的抗瘤作用, 但是该基因的应用也存在许多问题, Kruyt等[9]发现虽然TRAIL具有明显的抗肿瘤活性, 但由于系统给药可能存在肝细胞毒性, 其应用受到限制. 使TRAIL仅在肿瘤局部形成高浓度, 是提高疗效、降低毒性的关键. 本课题组一直致力于EPCs的研究, 前期结果[10-12]表明肝细胞癌患者存在EPCs骨髓动员, EPCs参与构建了肝癌的新生血管, 在分布特点上, EPCs主要富集于癌旁组织. 为此我们利用EPCs可特异性地靶向肿瘤细胞内增殖复制的特点, 构建携带人TRAIL基因的重组质粒, 为利用TRAIL重组载体抑制肿瘤生长奠定实验基础[13].
小鼠肝癌细胞H22由本研究所保存; 大肠杆菌E.coli DH5α由本研究所保存; 质粒pcDNA3.1由本研究所保存; 质粒pORF-TRAIL由本研究所保存; 鼠抗人trail抗体购自美国Santa Cruz公司; 羊抗小鼠IgG抗体购自南京布克生物科技有限公司; ECL发光试剂盒购自美国Millipore公司; 限制性内切酶BamHⅠ、HindⅢ、T4连接酶均购自日本Takara公司; PCR试剂盒购自美国MBI公司; 琼脂糖凝胶纯化试剂盒、质粒提取试剂盒均购自美国Biomiga公司; 引物合成及序列测定均由南京金斯瑞生物科技有限公司完成.
1.2.1 PCR扩增TRAIL基因: 引物设计采用软件Primer Premier 5.0进行, 上游引物序列为: 5'-CCAAGCTTATGGCTATGATGGAGGTCCAGGGGGGAC-3', 下游引物序列为5'-CGGGATCCTTAGCCAACTAAAAAGGCCCCGAAAAAACTGG-3', 其中划线部分分别为HindⅢ和BamHⅠ的酶切位点, 此两位点与pcDNA3.1上的相应多克隆位点相吻合. PCR反应为95 ℃预变性5 min, 94 ℃ 1 min, 67 ℃ 1 min, 72 ℃ 1 min, 共30个循环, 再于72 ℃延伸10 min. 然后置于4 ℃终止反应并保存. 取部分PCR产物进行15 g/L琼脂糖凝胶电泳, 判断PCR产物的大小.
1.2.2 重组质粒的构建: 将pcDNA3.1载体和经PCR反应扩增得到的TRAIL产物分别进行BamHⅠ、HindⅢ双酶切, 再按照凝胶纯化试剂盒的说明书进行纯化. 以紫外分光光度计分别测定两种酶切产物的量. 将两种酶切产物用T4连接酶连接, 16 ℃过夜. 以连接产物转化感受态DH5α, 在含有氨苄青霉素的琼脂平板上进行筛选[14,15]. 取阳性克隆进行扩增, 并抽提重组质粒pcDNA3.1/TRAIL.
1.2.3 重组质粒的鉴定: 将重组质粒用BamHⅠ、HindⅢ进行双酶切, 与空载体和PCR产物一起进行琼脂糖凝胶电泳. 同时送南京金斯瑞生物科技有限公司测序鉴定.
1.2.4 Western blot鉴定重组质粒的表达: 将重组质粒经腺病毒转染入小鼠EPCs, 以未转染重组质粒的小鼠EPCs为对照, 分别抽提蛋白, Bradford法测定总蛋白含量, 按每孔60 μg上样, 15%聚丙烯酰胺凝胶(SDS-PAGE)电泳, 再用250 mA电流将凝胶上的蛋白转印至PVDF膜上. 5%脱脂奶粉封闭1 h后, 加一抗(鼠抗人trail, 稀释度为1:1 000), 4 ℃孵育过夜, TBST充分漂洗后加入辣根过氧化酶标记的二抗(羊抗鼠IgG, 稀释度为1:5 000)孵育1 h, 最后经ECL发光, 柯达胶片曝光显影.
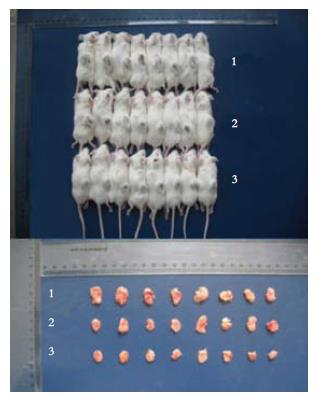
1.2.5 ICR小鼠皮下移植瘤模型的建立及接种: (1)将液氮中冻存的细胞37 ℃水浴中快速解冻; 在超净工作台内, PBS液清洗复苏的细胞两次, 0.2 mL PBS液重新混匀细胞, 接种于ICR小鼠腹腔内; 6 d后, 小鼠腹部肿大, 断颈处死种鼠, 乙醇浸泡后于超净工作台内抽取腹水; 离心抽取的腹水用PBS液清洗细胞2次, PBS液重悬细胞计数, 调整细胞悬液浓度为1×107个/mL; 每只ICR小鼠背部皮下接种0.1 mL; (2)选取肿瘤大小较一致的24只皮下移植瘤ICR小鼠模型, 分为3组, 每组8只, 从移植瘤后第3天开始, 分别经尾静脉注射, 每天注射1次: 第1组对照组加生理盐水; 第2组注入未转染TRAIL的EPCs; 第3组注入转染TRAIL的EPCs.
1.2.6 标本检测: 注射后第10天处死ICR小鼠, 以游标卡尺测量瘤体最长径(a)及最短径(b)一次计算肿瘤体积V(mm3) = 1/6πab2. 进行尸检, 记录瘤组织体积大小, 并计算肿瘤抑制率. 肿瘤抑制率(%) = [1-(实验组平均体积/对照组平均体积)]×100%. 分别采血进行肝肾指标的生化检测. 取瘤称重, 未转染TRAIL组、转染TRAIL组及对照组ICR小鼠均取小块瘤体作HE染色病理组织学检查(由鼓楼医院病理科完成).
统计学处理 结果以mean±SD表示, 数据采用SPSS13.0软件处理, 应用t检验进行统计学分析, 以P<0.05为有统计学意义.
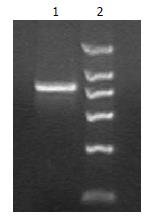
以pORF-TRAIL质粒为模板, 以合成的带有BamHⅠ和HindⅢ酶切位点的序列为引物, PCR扩增TRAIL基因, PCR产物进行1.5%琼脂糖凝胶电泳, 发现大约为850 bp, 与质粒中包含的TRAIL序列大小一致(图1).
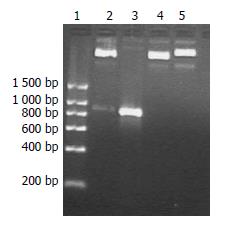
由于质粒及TRAIL基因的PCR产物消化彻底, 且克隆所使用的内切酶为两种不同的酶, 所以最后在氨苄青霉素平板上可见分布均匀、形态大小均一的单个细菌菌落; 而对照平板上未见任何菌落生长. 挑取单个菌落, 扩增后常规提取质粒, 用BamHⅠ和HindⅢ酶双酶切后, 经琼脂糖凝胶电泳显示, 质粒已完全切开, 呈现两条带, 一条为插入片段TRAIL, 另一条为载体切开的片段. 从结果可看出, 两个片段分别对应于空载体和PCR产物的位置, 说明克隆成功(图2).
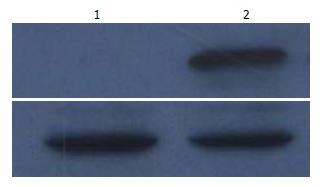
以转染重组质粒的小鼠EPCs作为对照, 检测转染重组质粒的小鼠EPCs中TRAIL蛋白的表达, 发现TRAIL蛋白在转染了重组质粒的小鼠EPCs中表达, 而在未转染的小鼠EPCs中没有发现TRAIL蛋白的表达, 表明TRAIL蛋白可以在小鼠EPCs中表达(图4).
通过肉眼观察可以看出, 对照组和未转染TRAIL基因组小鼠肿瘤体积大于转染TRAIL组小鼠肿瘤体积(图5). 实验结束时各组ICR小鼠体内移植瘤体积、瘤重情况, 表1. 实验结果为: 空载体组的抑瘤率为20.98%, 但经统计学分析与对照组无显著性差异, 转染TRAIL基因组的抑瘤率为47.77%, 与对照组有显著性差异(图6).
| 对照组 | 未转染TRAIL组 | 转染TRAIL组 | |
| 肿瘤体积(cm3) | 1.530±0.225 | 1.279±0.323 | 0.791±0.119 |
| 肿瘤质量(g) | 0.56±0.14 | 0.44±0.08 | 0.29±0.04 |
| 抑瘤率(%) | 20.98 | 47.77 |
基因治疗载体大致可分为病毒型载体和非病毒载体. 在过去的20年里, 使用病毒载体和非病毒载体施行了1500多个基因治疗的临床试验. 然而, 在大多数的例子中, 治疗的效果并不令人满意, 不良反应成为人们关注的主要问题[16]. 病毒型载体系统在体内外实验中使用较多, 主要有逆转录病毒载体、腺病毒载体、慢病毒载体、单纯疱疹病毒载体等[17], 尤其以腺病毒载体的应用更为广泛.
研究发现[18]EPCs不表达MHC, 没有免疫排斥作用, 在体内能够躲避NK细胞的杀伤作用, 且其有靶向性高, 系统毒性低的特点. EPCs可以作为很好的组织工程及基因治疗的载体, 因为他们有良好的分型、广泛的分化潜能以及有效的基因转导能力[19]. 临床研究证实EPCs能够定向归巢于肿瘤组织[20], 利用此特性可将其作为靶向运输至肿瘤组织的基因载体[21]. 由于EPCs具有维持成人血管完整性的生理功能, 所以EPCs不仅可以定向聚集在肿瘤部位, 同时也在缺血组织血管再生方面起到作用[22].
TRAIL是肿瘤坏死因子家族成员之一, 研究表明其具有凋亡诱导活性. 人的TRAIL基因定位于3q26.1-26.2, 在特定蛋白酶水解作用下形成可溶性的TRAIL. TRAIL的活性部分位于第114-281氨基酸处, 而该处即是其胞外结构区C末端, 且第230位的半胱氨酸(cysteine-230)对其活性表达起关键作用. 他通过形成二硫链维持TRAIL的三聚体结构, 三聚体中间定位于Zn离子, 对保持TRAIL的原始结构、稳定性和生物活性十分重要[23]. 在体外TRAIL与死亡受体结合能迅速诱导多种组织来源的转化细胞株、肿瘤细胞株或病毒感染细胞株凋亡. 而诱骗受体因没有完整的胞内死亡结构域, 其不能诱导凋亡, 但能抑制TRAIL诱导的凋亡. 正常细胞表达死亡受体的同时也表达诱骗受体, 可以免受TRAIL诱导的凋亡攻击[24]. 可见TRAIL具有肿瘤选择性凋亡诱导作用.
由于pORF-TRAIL质粒为瞬时表达载体, 无法在体内进一步发挥作用, 因此本实验将TRAIL基因克隆到一个真核表达载体中, 该载体可以稳定转染, 并可以长期表达, 本研究将携带TRAIL基因的腺病毒重组质粒转染入小鼠EPCs中可以检测到TRAIL基因的表达. 此结果为进一步将载体转染至EPCs进行肿瘤的基因治疗奠定了坚实的基础. 本研究进一步通过动物体内实验, 应用于肝癌ICR小鼠皮下移植瘤的治疗. 我们将TRAIL质粒转染EPCs后注入ICR小鼠体内, 使TRAIL在肿瘤局部分泌, 其作用效率明显提高. 实验结果显示, 转染TRAIL组抑瘤率达到47.77%, 表明转染TRAIL组在体内能明显抑制肿瘤生长, 未转染TRAIL组虽然也具有一定的抑瘤效果, 但经统计学分析发现与生理盐水对照组无统计学差异, 可能由于系统误差与个体差异造成.
应用TRAIL转染EPCs治疗肝癌是一种比较安全的方法, 因为: (1) TRAIL能够诱导大多数肿瘤细胞发生凋亡, 而对正常组织及细胞几乎没有毒性作用[25], 所以TRAIL治疗本身就有一定的靶向性; (2)EPCs的靶向性作用: 研究发现循环中的EPCs特异性地参与到肿瘤血管生成中[26]. 使用EPCs作为载体的优点是在肿瘤局部生成基因产物, 将治疗效果仅限于需要受益的器官, 系统的基因产物水平低, 从而减少了系统毒性. 通过对ICR小鼠肝肾功能检测显示, 未转染TRAIL组与转染TRAIL组对肝肾功能无明显影响. 提示TRAIL转染EPCs基因治疗具有一定的安全性, 有临床应用价值.
肝癌在消化系统疾病中恶性程度高, 死亡率高. 外源输注的内皮祖细胞可以定向归巢于肿瘤组织. 内皮祖细胞能够介导TRAIL基因对肝癌进行治疗, 能够为肝癌提供新的治疗思路.
姚登福, 教授, 南通大学附属医院
内皮祖细胞是造血干细胞的一种, 与血管新生及肿瘤发生有着密切的联系.
内皮祖细胞此前的研究集中于血管新生及干细胞相关方面研究, 本文在前期研究基础上将内皮祖细胞作为载体负载TRAIL基因进行肝癌的相关治疗.
TRAIL基因具有广谱的抗肿瘤作用, 内皮祖细胞介导TRAIL基因回输对小鼠肝癌具有治疗作用, 且无不良反应, 为肝癌的治疗提供了理论依据.
本文的科学性、创新性和可读性较好地反映胃肠病学基础研究的水平, 研究显示TRAIL转染EPCs基因治疗肝癌具有一定的安全性和临床应用前景.
编辑: 李军亮 电编:鲁亚静
| 1. | Song HU, Hwang SG. [Prevention of hepatocellular carcinoma]. Korean J Gastroenterol. 2007;49:201-208. [PubMed] |
| 2. | Chen JG, Zhang SW. Liver cancer epidemic in China: past, present and future. Semin Cancer Biol. 2011;21:59-69. [PubMed] [DOI] |
| 3. | Casamassimi A, Balestrieri ML, Fiorito C, Schiano C, Maione C, Rossiello R, Grimaldi V, Del Giudice V, Balestrieri C, Farzati B. Comparison between total endothelial progenitor cell isolation versus enriched Cd133+ culture. J Biochem. 2007;141:503-511. [PubMed] [DOI] |
| 4. | Asahara T, Murohara T, Sullivan A, Silver M, van der Zee R, Li T, Witzenbichler B, Schatteman G, Isner JM. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 1997;275:964-967. [PubMed] [DOI] |
| 5. | Hur J, Yoon CH, Kim HS, Choi JH, Kang HJ, Hwang KK, Oh BH, Lee MM, Park YB. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 2004;24:288-293. [PubMed] [DOI] |
| 6. | Schatteman GC, Dunnwald M, Jiao C. Biology of bone marrow-derived endothelial cell precursors. Am J Physiol Heart Circ Physiol. 2007;292:H1-H18. [PubMed] [DOI] |
| 7. | Finnberg N, El-Deiry WS. TRAIL death receptors as tumor suppressors and drug targets. Cell Cycle. 2008;7:1525-1528. [PubMed] [DOI] |
| 8. | Sedger LM, Glaccum MB, Schuh JC, Kanaly ST, Williamson E, Kayagaki N, Yun T, Smolak P, Le T, Goodwin R. Characterization of the in vivo function of TNF-alpha-related apoptosis-inducing ligand, TRAIL/Apo2L, using TRAIL/Apo2L gene-deficient mice. Eur J Immunol. 2002;32:2246-2254. [PubMed] [DOI] |
| 9. | Kruyt FA. TRAIL and cancer therapy. Cancer Lett. 2008;263:14-25. [PubMed] [DOI] |
| 10. | Yu D, Sun X, Qiu Y, Zhou J, Wu Y, Zhuang L, Chen J, Ding Y. Identification and clinical significance of mobilized endothelial progenitor cells in tumor vasculogenesis of hepatocellular carcinoma. Clin Cancer Res. 2007;13:3814-3824. [PubMed] [DOI] |
| 11. | Zhu H, Shao Q, Sun X, Deng Z, Yuan X, Zhou X, Ding Y. Bone marrow cells: Important role on neovascularization of hepatocellular carcinoma. J Gastroenterol Hepatol. 2012;27:1241-1251. [PubMed] [DOI] |
| 12. | Sun XT, Yuan XW, Zhu HT, Deng ZM, Yu DC, Zhou X, Ding YT. Endothelial precursor cells promote angiogenesis in hepatocellular carcinoma. World J Gastroenterol. 2012;18:4925-4933. [PubMed] [DOI] |
| 16. | Cao H, Molday RS, Hu J. Gene therapy: light is finally in the tunnel. Protein Cell. 2011;2:973-989. [PubMed] [DOI] |
| 17. | Alesci S, Ramsey WJ, Bornstein SR, Chrousos GP, Hornsby PJ, Benvenga S, Trimarchi F, Ehrhart-Bornstein M. Adenoviral vectors can impair adrenocortical steroidogenesis: clinical implications for natural infections and gene therapy. Proc Natl Acad Sci U S A. 2002;99:7484-7489. [PubMed] [DOI] |
| 18. | Mills MH, Faunce TA. Melatonin supplementation from early morning auto-urine drinking. Med Hypotheses. 1991;36:195-199. [PubMed] [DOI] |
| 19. | Stockschlaeder M, Shardakova O, Weber K, Stoldt VR, Fehse B, Giers G, Scharf RE. Highly efficient lentiviral transduction of phenotypically and genotypically characterized endothelial progenitor cells from adult peripheral blood. Blood Coagul Fibrinolysis. 2010;21:464-473. [PubMed] [DOI] |
| 20. | Su Y, Zheng L, Wang Q, Li W, Cai Z, Xiong S, Bao J. Quantity and clinical relevance of circulating endothelial progenitor cells in human ovarian cancer. J Exp Clin Cancer Res. 2010;29:27. [PubMed] [DOI] |
| 21. | Janic B, Arbab AS. The role and therapeutic potential of endothelial progenitor cells in tumor neovascularization. Scientific World Journal. 2010;10:1088-1099. [PubMed] [DOI] |
| 24. | Sanlioglu AD, Korcum AF, Pestereli E, Erdogan G, Karaveli S, Savas B, Griffith TS, Sanlioglu S. TRAIL death receptor-4 expression positively correlates with the tumor grade in breast cancer patients with invasive ductal carcinoma. Int J Radiat Oncol Biol Phys. 2007;69:716-723. [PubMed] [DOI] |
| 25. | Baetu TM, Hiscott J. On the TRAIL to apoptosis. Cytokine Growth Factor Rev. 2002;13:199-207. [PubMed] [DOI] |