修回日期: 2012-09-16
接受日期: 2012-10-08
在线出版日期: 2012-10-28
目的: 研究益生菌对阿司匹林引起的大鼠急性胃黏膜损伤的影响及其机制.
方法: 40只健康♂SD大鼠随机分为4组, 每组10只: 对照组、损伤组、培菲康组和亿活组. 培菲康和亿活组的大鼠分别用相应益生菌制剂灌胃进行预处理, 然后将除对照组以外所有大鼠以150 mg/kg阿司匹林灌胃造成急性胃黏膜损伤; 分别测定各组大鼠的胃黏膜损伤指数(lesion index, LI); 观察大鼠胃黏膜组织学变化; 免疫组织化学法检测各组胃黏膜上皮紧密连接蛋白Occludin的表达情况; 免疫蛋白印迹法(Western blot)检测紧密连接蛋白Occludin和MAPK信号通路中磷酸化p38蛋白的表达量.
结果: 与损伤组相比, 两组益生菌组(培菲康组和亿活组)胃黏膜损伤较损伤组均减轻(18.4±3.69、17.1±3.84 vs 25.8±4.94, P<0.05); 大鼠胃黏膜中的紧密连接蛋白Occludin在损伤组的表达与对照组相比下降(P<0.05), 而在两组益生菌组中的表达则较损伤组增加(P<0.05); 大鼠胃黏膜中磷酸化p38蛋白在损伤组的表达与对照组相比增加(P<0.05), 而在两组益生菌组中的表达则较损伤组下降(P<0.05).
结论: 益生菌制剂培菲康和亿活对阿司匹林引起的大鼠急性胃黏膜损伤均具有明显保护作用, 其机制可能与通过MAPK中的p38信号通路上调胃黏膜上皮黏膜紧密连接蛋白Occludin的表达进而增强了大鼠胃黏膜的物理屏障功能有关.
引文著录: 高欣, 张振玉, 吴海露, 陈菲菲, 杨小兵, 王劲松. 益生菌对阿司匹林致大鼠急性胃黏膜损伤的作用机制. 世界华人消化杂志 2012; 20(30): 2882-2887
Revised: September 16, 2012
Accepted: October 8, 2012
Published online: October 28, 2012
AIM: To determine the protective effect of probiotics on aspirin-induced gastric mucosal lesions in rats.
METHODS: Forty healthy male SD rats were randomly and equally divided into four groups: normal group, injury group, and two probiotics groups (bifico group and bioflor group). Gastric mucosal lesions were induced by gastric gavage of aspirin (150 mg/kg). Rats of probiotics groups were pretreated with probiotics before induction of gastric mucosal lesions. Gastric histological changes were evaluated under a microscope. Immunohistochemistry and Western blot were used to detect the distribution and expression of gastric epithelial tight junction protein occludin. The expression of phosphorylated-p38 (p-p38) was determined by Western blot.
RESULTS: Compared to the injury group, lesion indices were significantly decreased in the probiotics groups (18.4 ± 3.69, 17.1 ± 3.84 vs 25.8 ± 4.94, both P < 0.05). The expression level of occludin in the injury group was decreased significantly compared to the normal group (P < 0.05). However, the expression levels of occludin in the two probiotics groups were significantly higher than that in the injury group (both P < 0.05). Phosphorylation of p38 was more obvious in the injury group than in the normal group (P < 0.05). Pretreatment with probiotics significantly inhibited the phosphorylation of p38 (P < 0.05).
CONCLUSION: Probiotics have a protective effect on aspirin-induced gastric mucosal lesions in rats probably by increasing the expression of tight junction protein occludin via the p38 signaling pathway.
- Citation: Gao X, Zhang ZY, Wu HL, Chen FF, Yang XB, Wang JS. Protective effect of probiotics on aspirin-induced gastric mucosal lesions in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(30): 2882-2887
- URL: https://www.wjgnet.com/1009-3079/full/v20/i30/2882.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i30.2882
阿司匹林为常见的非甾体类抗炎药(nonsteroidal antiinflammatory drugs, NSAIDs), 具有抗血小板凝集的作用, 广泛用于心脑血管疾病的预防. 在长期使用阿司匹林的患者中, 消化性溃疡、消化道出血等胃肠道不良反应发生率明显升高, 已引起了临床医师的关注[1-3]. 临床多用质子泵抑制剂(proton pump inhibitor, PPI)预防, 有研究显示联合质子泵抑制剂有增加急性冠脉综合征(acute coronary syndrome, ACS)患者死亡率和再住院风险[4-8]. 相关研究已经证实, 益生菌对各种原因引起的肠道黏膜损伤具有预防保护作用, 而关于益生菌对胃黏膜损伤尤其是NSAIDs相关性胃黏膜损伤影响的报道较少. 培菲康和亿活均为临床广泛使用的益生菌制剂, 本实验研究培菲康和亿活对阿司匹林引起的大鼠急性胃黏膜损伤的影响, 并初步探讨其作用机制.
清洁级健康♂SD大鼠40只, 体质量200 g±15 g, 由南京医科大学附属南京医院动物实验中心提供, 每日光照12 h, 22 ℃恒温环境下常规饲料喂养. 阿司匹林原料药(批号0702285), 购自山东新华制药股份有限公司; 双歧杆菌三联活菌散(商品名: 培菲康, 批号: 20110726)由上海信谊药厂有限公司馈赠, 每1 g药粉含活菌数不低于5×107 CFU; 布拉氏酵母菌散(商品名: 亿活, 产品批号: 1269)由法国百科达制药厂(BIOCODEX)制造, 深圳市康哲药业有限公司馈赠, 每1 g药粉含活菌数不低于1.3×109 CFU; 临用前阿司匹林、培菲康和亿活分别按每0.03 g、0.21 g和0.25 g溶于2 mL 0.5%羧甲基纤维素钠(carboxyl methyl cellulose, CMC)溶液中, 制成悬浊液. β-actin抗体购自Santa Cruz公司, Occludin、磷酸化p38(p-p38)抗体购自cell signal公司.
1.2.1 动物分组: 将40只大鼠适应性饲养1 wk后, 随机分为对照组、损伤组、培菲康干预组和亿活干预组4组, 每组10只.
1.2.2 动物实验: 实验第1-10天, 对照组、损伤组予2 mL 0.5%CMC溶液进行灌胃, 培菲康干预组和亿活干预组分别予培菲康和亿活溶液2 mL进行灌胃, 2次/d; 第10天灌胃后, 所有大鼠禁食不禁水18 h. 禁食结束后, 对照组予以CMC溶液2 mL灌胃, 其他所有大鼠予阿司匹林溶液2 mL灌胃1次. 阿司匹林灌胃4 h后, 以10%水合氯醛行腹腔注射麻醉处死大鼠, 取胃组织标本.
1.2.3 胃黏膜损伤指数判定: 将大鼠胃组织沿大弯侧剪开后, 以生理盐水洗净展平, 在解剖显微镜(×10)下将所有损伤按Guth[9]标准累积计算损伤指数(Lesion index, LI): 斑点样损伤 = 1分, 损伤直径(长度)<1 mm为2分, 损伤直径(长度)1-2 mm为3分, 损伤直径(长度)2-4 mm为4分, 损伤直径(长度)>4 mm为5分, 宽度>2 mm的损伤积分值×2.
1.2.4 组织学观察: 胃组织经4%中性甲醛固定24 h, 经常规脱水、透明、石蜡包埋切片, HE染色, 光镜下观察.
1.2.5 Occludin免疫组织化学染色: 采用Envision法进行免疫组织化学染色, 观察根据阳性细胞的百分比进行综合判定: 阳性细胞数<10%为阴性(-), 10%-20%为弱阳性(+), 20%-50%为中等阳性(++), > 50%为强阳性(+++).
1.2.6 Western blot检测胃组织Occludin和p-p38蛋白表达水平: 取约100 mg胃黏膜层组织, 加入蛋白裂解液, 4 ℃裂解, 10 000 r/min离心15 min, 取上清为全蛋白提取物. 将蛋白提取物与蛋白上样缓冲液混合, 煮沸5 min, 分装保存于-80 ℃冰箱. 进行SDS-PAGE凝胶电泳, 转膜, 封闭后加入一抗4 ℃过夜. 再加入辣根过氧化物酶标记的二抗, 孵育后ECL法显色于X光片后照相, 以β-actin作为内参, 使用Image J 1.44p软件分析处理. 各组蛋白表达水平均以实际灰度值/β-actin灰度值的比值来表示.
统计学处理 采用SPSSv17.0软件进行处理及分析, 实验数据用mean±SD表示, 多组间比较采用One-way ANOVA分析, 两组间比较采用t检验, P<0.05为差异有统计学意义.
实验中未出现大鼠死亡的情况. 通过胃组织大体和病理切片观察, 对照组大鼠均呈正常胃黏膜表现, 而其他经阿司匹林灌胃的大鼠胃黏膜则观察到不同程度的急性胃黏膜病变, 实验造模成功. 损伤组胃腺部黏膜充血水肿明显, 可见多处条状、点状出血及糜烂形成; 培菲康组和亿活组损伤程度和损伤面积均较损伤组减轻, 胃黏膜呈轻度充血水肿, 仅可见少数小片状及点状出血. 各组大鼠胃黏膜LI见表1. 损伤组可见黏膜结构失去完整性及连续性, 可见大片状坏死病灶, 且深入黏膜深层, 腺体结构破坏, 并可见炎性细胞浸润; 培菲康组和亿活组病变较损伤组减轻, 只在黏膜浅层可见部分小片状坏死病灶, 各层结构排列基本整齐, 未见明显的炎性细胞浸润.
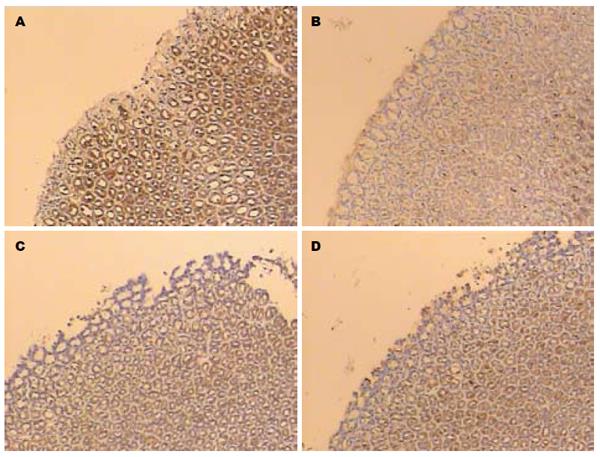
Occludin蛋白连续分布于胃黏膜上皮细胞的边缘, 主要定位于细胞膜和细胞质. 对照组强阳性表达率为90%(9/10); 损伤组蛋白分布不均, 染色较弱, 强阳性表达率均显著低于对照组, 为10%(1/10); 培菲康组和亿活组强阳性表达率较损伤组均增加, 分别为40%(4/10)和50%(5/10) (图1, 表2).
| 分组 | 阳性率分级 | |||
| - | + | ++ | +++ | |
| 对照组 | 0 | 1 | 0 | 9 |
| 损伤组 | 1 | 6 | 2 | 1 |
| 培菲康组 | 0 | 2 | 4 | 4 |
| 亿活组 | 0 | 2 | 3 | 5 |
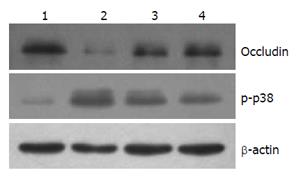
以β-actin为内参, Occludin蛋白条带出现在65 kDa, p-p38蛋白条带出现在38 kDa, 对各条带进行灰度分析发现: Occludin蛋白的Western blot检测结果与免疫组织化学结果一致, 对照组蛋白表达较对照组明显下降(P<0.05), 而两组益生菌组蛋白表达与对照组相比均增加(P<0.05); p-p38蛋白在对照组弱表达, 而在损伤组明显表达增加(P<0.05), 两组益生菌组的表达情况较损伤组均下降(P<0.05, 图2, 表3).
胃肠道黏膜屏障包括物理屏障、化学屏障、免疫屏障和生物屏障. 由包含益生菌在内的微生态系统形成了胃肠道第一道非特异性的生物屏障, 能够控制消化道各种内源性条件致病菌的定植, 同时具有局部和全身的免疫调节作用, 对胃肠道黏膜屏障功能起重要作用.
人体的胃腔由于酸性内环境和胃蠕动, 不利于大多数微生物的定植, 但仍有部分耐酸的菌群能够定植于胃腔, 对维持胃内微生态平衡起重要作用. 在本研究中使用的培菲康为双歧杆菌三联活菌散, 乳酸杆菌为其主要成分之一; 而亿活则是以布拉氏酵母菌为主的活菌散剂. 研究已证实, 乳酸杆菌和酵母菌为胃内的主要常住菌, 是维持胃内微生态平衡的重要力量[10]. 本实验通过大剂量阿司匹林制造大鼠急性胃黏膜损伤的模型, 分别以培菲康和亿活对大鼠进行损伤前预处理, 结果发现经过培菲康或亿活预处理的大鼠胃黏膜损伤程度较损伤组明显减轻.
其他研究者采用不同的菌株, 也证实益生菌对胃黏膜具有保护作用[11-16], 其中Lam等[12]的研究发现, 益生菌能够增强胃黏膜的跨黏膜电阻(transmucosal resistance, TMR), 即益生菌具有直接增强胃黏膜上皮的屏障功能的作用.
胃黏膜物理屏障是构成胃黏膜屏障功能的结构基础, 而紧密连接是物理屏障中重要的组成. 紧密连接复合体包括紧密连接蛋白、黏附因子和桥粒, 紧密连接蛋白Occludin为其中重要的组成之一[17-20]. 我们这前的研究已经证实当人胃黏膜上皮细胞间的紧密连接受到破坏时, Occludin蛋白的表达明显下降[21,22]; 国外学者已经证实益生菌对肠道黏膜屏障功能, 尤其是紧密连接结构具有促进作用[23-25]. 而本实验中的免疫组织化学和Western blot结果提示了益生菌对大鼠胃黏膜组织紧密连接蛋白Occludin的表达具有促进恢复的作用: 胃黏膜被阿司匹林损伤后, Occludin蛋白的表达下降; 而益生菌处理组的下降程度则明显减轻. Occludin蛋白的正常表达对维持的黏膜正常屏障功能具有重要意义, 其表达水平下降可致紧密连接结构和功能异常, 进而影响黏膜物理屏障功能[26]. 因此我们认为, 在胃黏膜损伤过程中益生菌能减轻紧密连接损伤并促进其修复.
p38丝裂原活化蛋白激酶(p38MAPK)是细胞内分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPKs)3条主要信号通路之一. 磷酸化p38(p-p38)是p38蛋白的磷酸化形式, 其表达水平反映了p38蛋白的磷酸化水平. 本研究通过Western blot方法对各组大鼠胃黏膜中p-p38蛋白进行检测, 实验结果提示了p38蛋白磷酸化水平与益生菌胃黏膜保护作用之间存在关联, 胃黏膜损伤时p38蛋白磷酸化增强; 而益生菌的预处理则使p38蛋白磷酸化的程度有所降低. 相关研究也同样证实, p38 MAPK信号通路在调控胃黏膜上皮的损伤及修复过程中起重要作用[27-30], 而且这样的作用与调节黏膜上皮紧密连接蛋白的表达存在密切关系. Oshima等[28]和Kevil等[29]的研究均发现p38 MAPK信号通路调节上皮黏膜细胞间紧密连接蛋白的表达. 结合实验结果, p38 MAPK信号通路参与了本实验中胃黏膜损伤和保护的过程, 具体可能是通过调节紧密连接蛋白Occludin蛋白表达水平而实现的.
总之, 益生菌对胃黏膜损伤的保护作用, 不仅由于其生物屏障的功能, 而且与其增强胃黏膜上皮细胞间紧密连接蛋白Occludin的表达, 从而增强胃黏膜物理屏障功能有关, 可能是通过抑制MAPK中的p38蛋白的磷酸化水平实现的. 本实验只是对益生菌与胃黏膜物理屏障之间的关系进行了初步探索, 两者之间的关联仍需进一步研究证实.
背景资料 人体的胃腔由于酸性内环境和胃蠕动, 不利于大多数微生物的定植, 但仍有部分耐酸的菌群能够定植于胃腔, 对维持胃内微生态平衡起重要作用.
唐世刚, 教授, 湖南省人民医院
研发前沿 相关研究已经证实, 益生菌对各种原因引起的肠道黏膜损伤具有预防保护作用, 而关于益生菌对胃黏膜损伤尤其是非甾体类抗炎药(NSAIDs)相关性胃黏膜损伤影响的报道较少.
Lam等多位研究者已经通过动物实验发现, 益生菌对大鼠胃黏膜损伤具有一定的保护作用.
目前国内关于益生菌对胃黏膜保护的相关报道较少, 该文通过动物实验进行证实, 并对其可能机制进行了初步研究.
本文为益生菌制剂提供了新的的临床应用领域, 为NSAIDs相关性胃黏膜损伤治疗提供了新的思路.
该文设计合理, 实验方法较为经典, 证据可靠, 为活菌制剂在临床应用中提供了客观的实验依据.
编辑: 田滢 电编:闫晋利
| 1. | Lanas A, García-Rodríguez LA, Arroyo MT, Gomollón F, Feu F, González-Pérez A, Zapata E, Bástida G, Rodrigo L, Santolaria S. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut. 2006;55:1731-1738. [PubMed] [DOI] |
| 2. | de Abajo FJ, García Rodríguez LA. Risk of upper gastrointestinal bleeding and perforation associated with low-dose aspirin as plain and enteric-coated formulations. BMC Clin Pharmacol. 2001;1:1. [PubMed] [DOI] |
| 3. | Taha AS, Angerson WJ, Prasad R, McCloskey C, Gilmour D, Morran CG. Clinical trial: the incidence and early mortality after peptic ulcer perforation, and the use of low-dose aspirin and nonsteroidal anti-inflammatory drugs. Aliment Pharmacol Ther. 2008;28:878-885. [PubMed] |
| 4. | Juurlink DN, Gomes T, Ko DT, Szmitko PE, Austin PC, Tu JV, Henry DA, Kopp A, Mamdani MM. A population-based study of the drug interaction between proton pump inhibitors and clopidogrel. CMAJ. 2009;180:713-718. [PubMed] [DOI] |
| 5. | Ho PM, Maddox TM, Wang L, Fihn SD, Jesse RL, Peterson ED, Rumsfeld JS. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome. JAMA. 2009;301:937-944. [PubMed] [DOI] |
| 6. | Gilard M, Arnaud B, Le Gal G, Abgrall JF, Boschat J. Influence of omeprazol on the antiplatelet action of clopidogrel associated to aspirin. J Thromb Haemost. 2006;4:2508-2509. [PubMed] [DOI] |
| 7. | Small DS, Farid NA, Payne CD, Weerakkody GJ, Li YG, Brandt JT, Salazar DE, Winters KJ. Effects of the proton pump inhibitor lansoprazole on the pharmacokinetics and pharmacodynamics of prasugrel and clopidogrel. J Clin Pharmacol. 2008;48:475-484. [PubMed] [DOI] |
| 8. | Fontana P, Senouf D, Mach F. Biological effect of increased maintenance dose of clopidogrel in cardiovascular outpatients and influence of the cytochrome P450 2C19*2 allele on clopidogrel responsiveness. Thromb Res. 2008;121:463-468. [PubMed] [DOI] |
| 9. | Guth PH, Paulsen G. Aspirin-induced gastric injury in the rat: histologic changes and sucralfate cytoprotection. Proc Soc Exp Biol Med. 1987;184:423-428. [PubMed] [DOI] |
| 10. | Coconnier MH, Liévin V, Bernet-Camard MF, Hudault S, Servin AL. Antibacterial effect of the adhering human Lactobacillus acidophilus strain LB. Antimicrob Agents Chemother. 1997;41:1046-1052. [PubMed] |
| 11. | Gotteland M, Cruchet S, Verbeke S. Effect of Lactobacillus ingestion on the gastrointestinal mucosal barrier alterations induced by indometacin in humans. Aliment Pharmacol Ther. 2001;15:11-17. [PubMed] [DOI] |
| 12. | Lam EK, Tai EK, Koo MW, Wong HP, Wu WK, Yu L, So WH, Woo PC, Cho CH. Enhancement of gastric mucosal integrity by Lactobacillus rhamnosus GG. Life Sci. 2007;80:2128-2136. [PubMed] [DOI] |
| 13. | Lam EK, Yu L, Wong HP, Wu WK, Shin VY, Tai EK, So WH, Woo PC, Cho CH. Probiotic Lactobacillus rhamnosus GG enhances gastric ulcer healing in rats. Eur J Pharmacol. 2007;565:171-179. [PubMed] [DOI] |
| 14. | Senol A, Isler M, Karahan AG, Kilic GB, Kuleasan H, Kaya S, Keskin M, Goren I, Saritas U, Aridogan BC. Preventive effect of probiotics and α-tocopherol on ethanol-induced gastric mucosal injury in rats. J Med Food. 2011;14:173-179. [PubMed] [DOI] |
| 15. | Senol A, Işler M, Karahan AG, Kiliç GB, Kuleaşan H, Gören I, Saritaş U, Kaya S, Cırış M, Aktürk O. Effect of probiotics on aspirin-induced gastric mucosal lesions. Turk J Gastroenterol. 2011;22:18-26. [PubMed] [DOI] |
| 16. | Akama F, Nishino R, Makino S, Kobayashi K, Kamikaseda K, Nagano J, Koga Y. The effect of probiotics on gastric mucosal permeability in humans administered with aspirin. Scand J Gastroenterol. 2011;46:831-836. [PubMed] [DOI] |
| 17. | Jankowski JA, Bedford FK, Boulton RA, Cruickshank N, Hall C, Elder J, Allan R, Forbes A, Kim YS, Wright NA. Alterations in classical cadherins associated with progression in ulcerative and Crohn's colitis. Lab Invest. 1998;78:1155-1167. [PubMed] |
| 18. | Kinugasa T, Sakaguchi T, Gu X, Reinecker HC. Claudins regulate the intestinal barrier in response to immune mediators. Gastroenterology. 2000;118:1001-1011. [PubMed] [DOI] |
| 19. | North AJ, Bardsley WG, Hyam J, Bornslaeger EA, Cordingley HC, Trinnaman B, Hatzfeld M, Green KJ, Magee AI, Garrod DR. Molecular map of the desmosomal plaque. J Cell Sci. 1999;112:4325-4336. [PubMed] |
| 20. | Schmitz H, Barmeyer C, Fromm M, Runkel N, Foss HD, Bentzel CJ, Riecken EO, Schulzke JD. Altered tight junction structure contributes to the impaired epithelial barrier function in ulcerative colitis. Gastroenterology. 1999;116:301-309. [PubMed] [DOI] |
| 22. | 高 欣, 吴 海露, 张 振玉, 胡 可伟, 姜 宗丹, 杨 小兵, 王 劲松. 氯吡格雷对大鼠急性胃黏膜损伤愈合的影响及机制. 世界华人消化杂志. 2012;20:861-865. [DOI] |
| 23. | Mennigen R, Nolte K, Rijcken E, Utech M, Loeffler B, Senninger N, Bruewer M. Probiotic mixture VSL#3 protects the epithelial barrier by maintaining tight junction protein expression and preventing apoptosis in a murine model of colitis. Am J Physiol Gastrointest Liver Physiol. 2009;296:G1140-G1149. [PubMed] [DOI] |
| 24. | Anderson RC, Cookson AL, McNabb WC, Park Z, McCann MJ, Kelly WJ, Roy NC. Lactobacillus plantarum MB452 enhances the function of the intestinal barrier by increasing the expression levels of genes involved in tight junction formation. BMC Microbiol. 2010;10:316. [PubMed] [DOI] |
| 25. | Zyrek AA, Cichon C, Helms S, Enders C, Sonnenborn U, Schmidt MA. Molecular mechanisms underlying the probiotic effects of Escherichia coli Nissle 1917 involve ZO-2 and PKCzeta redistribution resulting in tight junction and epithelial barrier repair. Cell Microbiol. 2007;9:804-816. [PubMed] [DOI] |
| 26. | Schulzke JD, Fromm M. Tight junctions: molecular structure meets function. Ann N Y Acad Sci. 2009;1165:1-6. [PubMed] [DOI] |
| 27. | Jia YT, Wei W, Ma B, Xu Y, Liu WJ, Wang Y, Lv KY, Tang HT, Wei D, Xia ZF. Activation of p38 MAPK by reactive oxygen species is essential in a rat model of stress-induced gastric mucosal injury. J Immunol. 2007;179:7808-7819. [PubMed] [DOI] |
| 28. | Oshima T, Miwa H, Joh T. Aspirin induces gastric epithelial barrier dysfunction by activating p38 MAPK via claudin-7. Am J Physiol Cell Physiol. 2008;295:C800-C806. [PubMed] [DOI] |
| 29. | Kevil CG, Oshima T, Alexander JS. The role of p38 MAP kinase in hydrogen peroxide mediated endothelial solute permeability. Endothelium. 2001;8:107-116. [PubMed] [DOI] |
| 30. | Dai C, Zhao DH, Jiang M. VSL#3 probiotics regulate the intestinal epithelial barrier in vivo and in vitro via the p38 and ERK signaling pathways. Int J Mol Med. 2012;29:202-2089. [PubMed] |