修回日期: 2012-01-02
接受日期: 2012-01-19
在线出版日期: 2012-01-28
目的: 研究APPL1蛋白在人结直肠癌组织中的表达情况与临床病理参数的关系.
方法: 收集35例新鲜结直肠癌及27例正常直肠黏膜组织, 采用免疫组织化学SP法和RT-PCR法检测APPL1在结直肠癌组织及正常直肠黏膜组织中的表达. 采用半定量积分分级对该蛋白的表达强弱进行评分.
结果: 免疫组织化学和RT-PCR结果显示, APPL1蛋白在结直肠癌组织以及正常直肠黏膜组织中普遍表达, 但该蛋白和相应的mRNA在癌组织中的表达高于对照组(P<0.05). 在35例结直肠癌组织中, APPL1表达与分化程度、淋巴结转移、TNM分期相关(P<0.05), 与性别、年龄、肿瘤大小、组织学类型无明显相关(P>0.05).
结论: APPL1蛋白在结直肠癌组织中的表达上调, 且该蛋白表达与患者肿瘤的分化程度、淋巴结转移情况以及TNM分期有关. APPL1有可能成为结直肠癌治疗的一个新靶点.
引文著录: 张嫣, 宋敏, 陈新峰, 孟宇. APPL1表达与结直肠癌发生发展的关系及意义. 世界华人消化杂志 2012; 20(3): 253-258
Revised: January 2, 2012
Accepted: January 19, 2012
Published online: January 28, 2012
AIM: To investigate the relationship between expression of adaptor protein containing PH domain, PTB domain and leucine zipper motif 1(APPL1) and clinicopathological parameters of colorectal cancer.
METHODS: Expression of APPL1 protein and mRNA in 35 surgical specimens of colorectal carcinoma (CRC) and 27 normal colorectal tissue specimens was detected by immunohistochemistry and reverse transcription-polymerase chain reaction (RT-PCR), respectively.
RESULTS: The expression of APPL1 in CRC was significantly higher than that in normal mucosa. APPL1 expression was correlated with histological differentiation, lymph node metastasis and TNM stage (all P < 0.05), but not with sex, age, or tumor size (all P > 0.05) in patients with CRC.
CONCLUSION: The expression of APPL1 protein is increased in CRC. APPL1 protein expression is closely related with tumor differentiation, lymph node metastasis and TNM stage in patients with colorectal cancer. APPL1 may be a novel therapeutic target for CRC.
- Citation: Zhang Y, Song M, Chen XF, Meng Y. Expression of adaptor protein containing PH domain, PTB domain and leucine zipper motif 1 in colorectal carcinogenesis. Shijie Huaren Xiaohua Zazhi 2012; 20(3): 253-258
- URL: https://www.wjgnet.com/1009-3079/full/v20/i3/253.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i3.253
结直肠癌发生发展是一个多基因改变和多阶段致癌的复杂过程, 信号转导异常在此过程中占主要地位, 针对胞内信号转导蛋白进行靶向治疗已经成为抗癌治疗的一个重要方法. APPL1(Adaptor protein containing PH domain, PTB domain and leucine zipper motif)又称APPL, DIP13a, 是1999年Mitsuuchi等[1]应用酵母双杂交技术发现与AKT2相互作用的一种细胞内转接蛋白, 他利用不同的结构域与其他多种蛋白分子结合, 如DCC、AR、FSHR、AKT2、Rab5a、脂联素受体(AdipoR1 and AdipoR2)等, 将细胞外信号转导到细胞内, 具有重要的细胞内功能[2-6]. 研究发现, APPL1在结肠癌[2]、前列腺癌[3]、卵巢癌[5]等细胞株中的表达与肿瘤细胞的生长、凋亡密切相关, 但在不同的细胞株中APPL1发挥的作用不十分一致, 是促癌因子还是抑癌因子存在争议. 目前尚无实验证实APPL1在人结直肠癌组织中的表达情况以及APPL1与结直肠癌发生发展的相关性. 本研究通过分析APPL1蛋白在结直肠癌中表达情况与结直肠癌临床病理参数的关系, 初步探讨其在结直肠癌发生发展中的作用以及可能作用机制.
收集郑州大学第一附属医院2011-03/12期间手术切除、经病理证实为结直肠癌的标本35例, 其中结肠癌18例, 直肠癌17例; 男25例, 女10例, 平均年龄57.8岁±11.9岁(39岁-82岁); 组织学类型: 管状腺癌27例、乳头状腺癌3例、黏液腺癌3例、印戒细胞癌2例; 分化程度: 高分化4例、中分化23例、低分化8例; TNM分期: Ⅰ期8例、Ⅱ期22例、Ⅲ期5例、Ⅳ期0例; 淋巴结转移7例, 无淋巴结转移28例; 术前未经过放、化疗; 选取27例痔疮患者的正常大肠黏膜组织标本作为正常对照, 平均年龄42.0岁±8.7岁(26-57岁). 所有标本一分为二, 一组经4%甲醛液固定、石蜡包埋, 5 µm连续切片用于免疫组织化学, 另一组于术后30 min内取出立即投入液氮中用于RT-PCR. 兔抗人APPL1多克隆抗体购自BBI公司; SP免疫组织化学试剂盒购于Invitrogen公司; DAB显色试剂盒购自北京中衫公司; RNA柱式抽提试剂盒购自BBI公司; 逆转录试剂盒来自Fermentas公司.
1.2.1 引物设计及序列: APPL1(350 bp): 上游5'-CATCCAGAAAGAAACAACACCA-3'; 下游5'-CATTAAGGTATCCAGCCTTTCG-3'; β-actin (205 bp): 上游5'-TGACGTGGACATCCGCAAAG-3'; 下游5'-CTGGAAGGTGGACAGCGAGG-3'. 引物由上海生工生物工程有限公司设计合成.
1.2.2 免疫组织化学染色: 常规脱蜡和水化后PBS洗片; 滴加3%H2O2在每张切片上, 室温静置10 min后PBS洗涤; 抗原修复10 min; PBS洗片后滴加APPL1抗体40 µL(1:100), 4 ℃过夜; 第2天PBS洗片后滴加二抗(1:1 500)40 µL, 37 ℃1 h, PBS洗片, DAB显色, 自来水冲洗10 min, 苏木素复染10 s; 常规洗片、脱水、透明、封片, 进行镜检. 每次染色同时设置阴性对照片子(以PBS代替一抗).
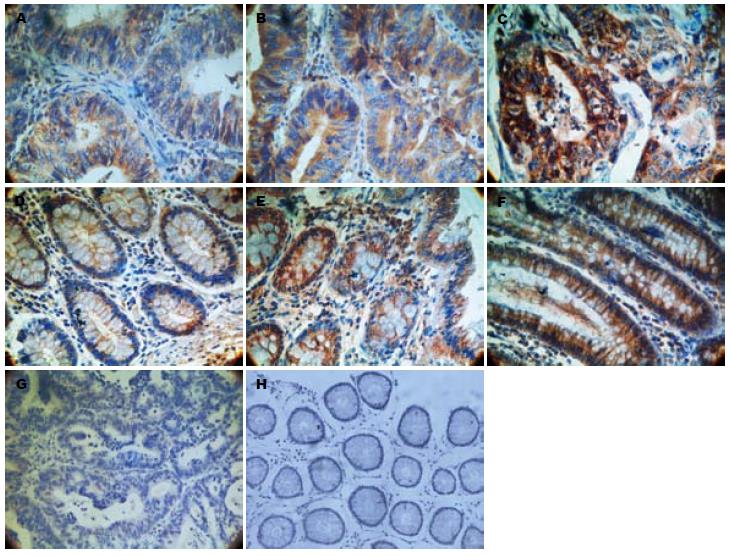
1.2.3 结果判断: APPL1阳性表达为细胞浆染色, 即胞浆内出现棕黄色颗粒. 结果判读采用半定量积分分级, 积分 = 染色细胞比例×染色强度. 染色细胞比例: <5%阴性, 0分; 6-20%弱阳性, 1分; 21-50%阳性, 2分; >50%强阳性, 3分; 染色强度: 无色, 阴性0分; 淡黄色, 弱阳性1分; 棕黄色, 阳性2分; 棕褐色, 强阳性3分; 2种计分相乘, 0分阴性, 1-3分弱阳性, 4-6阳性, 7-9强阳性.
1.2.4 总RNA提取: 采用RNA动物组织柱式一步提取法, 提取大肠癌组织及正常组织细胞内的总RNA; 取3 µL RNA在Nanovue检测仪上测量RNA样本在波长260/280处的吸光度值(以1.8-2.0之间最佳)及RNA的浓度.
1.2.5 逆转录反应: 应用Fermentas逆转录试剂盒, 20 µL体系: 总RNA 1 µg, Oligo-dT 1 µL, 5×Reaction Buffer 4 µL, RiboLockTM-RNase Inhibitor 1 µL, 10 mM dNTP Mix 2 µL, RevertAidTM M-MuLV Reverse Transcriptase 1 µL, 加Nuclease-free Water至20 µL. 反应条件: 65 ℃ 5 min, 42 ℃ 60 min, 70 ℃ 5 min. 逆转录cDNA于-20 ℃保存备用.
1.2.6 聚合酶链式反应: 取逆转录产物cDNA行PCR反应, 应用Fermentas RT-PCR试剂盒, 50 µL体系: DreamTaqTM Green PCR Master Mix(2×) 25 µL, Forward primer 1 µL, Reverse primer 1 µL, cDNA 2 µL, 加Nuclease-free Water至50 µL. 反应参数: 引物94 ℃预变性3 min, 94 ℃变性30 s; 62 ℃退火30 s, 72 ℃延伸30 s(β-actin 94 ℃ 30 s, 76 ℃ 30 s, 72 ℃ 30 s), 进行35个循环, 于72 ℃延伸5 min.
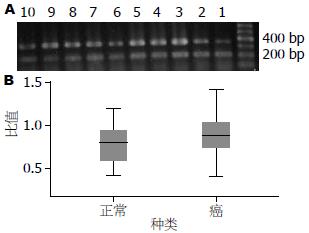
1.2.7 PCR产物鉴定: 取APPL1和β-actin的PCR扩增产物各5 µL行1.5%琼脂糖凝胶电泳, 100 V 30-40 min, 在紫外光下自显影, 用Gel ProAnalyzer软件进行密度半定量分析. 目的基因条带积分吸光度值与内参的比值即为APPL1mRNA的相对表达量.
统计学处理 所有数据均采用SPSS17.0统计软件包完成, 2组及3组等级定性资料的分析, 用秩和检验; 计量资料的检测结果以mean±SD表示, 两组间m RNA的比较采用独立样本t检验, 若不符合方差齐性或正态性, 则按照非参数检验(Kruskal-Wallis test). P<0.05认为差异有统计学意义, P<0.01认为有极显著性差异.
APPL1蛋白在所有结直肠癌腺体细胞以及正常直肠腺体细胞中均有表达, 主要定位于细胞质, 呈淡黄色、棕黄色、棕褐色颗粒状(表1, 2, 图1). 35例结直肠癌组织中APPL1蛋白阳性表达率(包括阳性和强阳性)是88.7%(30/35), 20例正常直肠黏膜组织中APPL1蛋白阳性表达率是51.8%(14/27), 两者差异有统计学意义(P<0.01).
APPL1蛋白与结直肠癌的分化程度(Z = 12.991, P = 0.002)、淋巴结转移情况(Z = -2.264, P = 0.024)及临床TNM分期(Z = -2.264, P = 0.024)相关, 与性别、年龄、肿瘤大小、组织学类型无关(P>0.05, 表3).
| 临床病理因素 | n | APPL1蛋白的表达情况 | Z值 | P值 | ||
| + | ++ | +++ | ||||
| 5 | 21 | 9 | ||||
| 年龄(岁) | 35 | -0.566 | 0.571 | |||
| <60 | 18 | 3 | 9 | 6 | ||
| ≥60 | 17 | 2 | 12 | 3 | ||
| 性别 | ||||||
| 男 | 25 | 4 | 15 | 6 | -0.064 | 0.949 |
| 女 | 10 | 1 | 7 | 2 | ||
| 组织学分型 | ||||||
| 管状、乳头状癌 | 30 | 3 | 19 | 8 | -1.132 | 0.258 |
| 黏液癌、印戒细胞癌 | 5 | 2 | 2 | 1 | ||
| 分化程度 | ||||||
| 高分化 | 4 | 2 | 2 | 0 | 12.991 | 0.002 |
| 中分化 | 23 | 3 | 17 | 3 | ||
| 低分化 | 8 | 0 | 2 | 6 | ||
| 有无淋巴结转移 | ||||||
| 有 | 7 | 1 | 1 | 5 | -2.264 | 0.024 |
| 无 | 28 | 4 | 20 | 4 | ||
| 肿瘤大小 | ||||||
| <5 cm | 26 | 3 | 16 | 7 | -0.604 | 0.546 |
| ≥5 cm | 9 | 2 | 5 | 2 | ||
| TNM分期 | ||||||
| Ⅰ期+Ⅱ期 | 28 | 4 | 20 | 4 | -2.264 | 0.024 |
| Ⅲ期+Ⅳ期 | 7 | 1 | 1 | 5 | ||
在结直肠癌治疗中针对细胞信号的靶向治疗是一个重要方面. 胞内信号蛋白将信号传递到细胞核内的级联通讯网络蛋白产生生物效应, 包括细胞增殖、凋亡以及血管生成, 当这些蛋白发生突变时信号通路失调, 导致细胞发生变化. 因此, 抑制胞内信号蛋白的靶向治疗可以作用于多重靶点, 提高结直肠癌的疗效. 2006年Mao等[6]发现APPL1是脂联素通路上与脂联素受体特异性结合的第1个信号转导分子, 他不仅是与糖脂代谢相关通路上的关键分子, 包括胰岛素通路、脂联素通路、胰岛素与脂联素交互通路, 而且可能参与细胞增殖与凋亡相关的多个通路, 包括AMPK、PI3K-AKT以及EGFR通路等. 因此本实验通过对结直肠癌组织中APPL1蛋白及mRNA的表达进行检测, 初步探讨其与临床病理参数的关系, 为进一步深入研究结直肠癌的发病机制提供实验依据, 为结直肠癌的诊断、治疗以及分子靶向药物的应用提供新的思路.
RT-PCR结果示, 在结直肠癌组织和正常直肠黏膜组织中APPL1 mRNA表达水平差异具有统计学意义, 这表明APPL1在结直肠癌中的表达差异在转录水平上. 免疫组织化学结果示, 在人所有结直肠癌细胞以及正常黏膜细胞中APPL1蛋白均有表达, 并且在癌组织中表达高于正常直肠黏膜组织. 进一步比较APPL1蛋白表达水平与结直肠癌临床病理参数的关系发现, APPL1表达高低与肿瘤分化程度、淋巴结转移、TNM分期相关. 上述结果提示APPL1可能与结直肠癌恶性程度、转移以及预后密切相关.
目前关于APPL1基因的研究还相对较少, 而其与结直肠癌的相关研究尚无报道. 既往研究发现, 磷脂酰肌醇激酶3-激酶(PI3K)激活蛋白激酶B(Akt)(PI3K/Akt)途径信号传导通路在结直肠癌发生发展中发挥重要作用, 他可以诱导肿瘤细胞增殖[7]、调节细胞生长周期[8]、促进血管形成[9]以及促进结直肠癌的侵袭和转移[10]. 徐怡顺等[11]证实, 在结直肠癌组织中, PI3K、Akt表达阳性率明显高于癌旁组织; Schenck等[12]证实: APPL1可以和Akt结合增加其对底物的敏感性, 促进细胞存活, 下调APPL1, 细胞凋亡数量增加; 因此, 结合本实验结果我们推测结直肠癌中过表达的APPL1可能与过表达的Akt蛋白相互作用, 通过PI3K/Akt途径促进肿瘤细胞增殖. 近年来脂联素(Adiponectin, 脂肪细胞分泌的一种生物活性因子)与结直肠癌的关系已成为国内外研究的热点. 研究发现, 脂联素在结直肠癌患者循环血液中表达明显低于正常人[13], 并且与结直肠癌的发生发展密切相关, 因此可能成为治疗结直肠癌新的靶点[14]. 脂联素通过调控脂联素受体表达抑制细胞增殖[15]或者通过某些信号分子抑制肿瘤血管生成[16]. APPL1是与脂联素受体结合的信号转导蛋白, 他参与脂联素对腺苷酸激活蛋白激酶(AMPK)和丝裂原活化蛋白激酶(MAPK)信号通路的调节[6,17]. MAPK/ERK信号转导通路是细胞内重要的促增殖和抗凋亡通路, 在细胞的增殖、分化和凋亡中起着重要作用[18]. Lee等[19]发现APPL1参与脂联素受体通过Src/Ras激活ERK1/2促进细胞增殖过程; 下调APPL1, 脂联素受体诱导ERK1/2活化程度降低; Williams等[20]证实脂联素受体在结直肠癌组织中表达明显高于正常直肠黏膜组织, 脂联素可能通过调节脂联素受体数量发挥抑癌作用; 徐怡顺等[11]证实: ERK1/2在结直肠癌组织中表达明显高于癌旁组织; Baba等[21]证实: ERK1/2在激活状态下AMPK抑制肿瘤生成作用消失; 因此, 结合以上研究提示, 在结直肠癌组织中过表达APPL1可能通过与过表达的脂联素受体通过某种机制相互作用, 激活ERK1/2抑制AMPK磷酸化从而促进肿瘤细胞增殖. 最近, Guo等[22]发现表皮生长因子受体(EGFR)在结直肠癌中表达水平高于正常肠黏膜组织, Lee等[23]发现, 过表达的APPL1蛋白可以增强EGFR在细胞内的稳定性, 延缓EGFR蛋白在胞内降解, 从而促进细胞增殖. 因此, 结合本实验结果推测结直肠癌中EGF激活EGFR信号通路后, 过表达的APPL1蛋白可能通过提高EGFR胞内的蛋白表达水平, 刺激结直肠癌细胞的生长与增殖.
总之, 本实验首次证实了APPL1 mRNA以及蛋白水平在人结直肠癌组织及正常直肠黏膜组织中的表达情况, 研究结果初步证实APPL1蛋白与结直肠癌的发生发展相关, 他可能通过PI3K/Akt、AMPK-ERK、Ras-ERK、EGFR等通路在结直肠癌的发生发展中发挥潜在的致癌作用, 可能成为治疗结直肠癌的新靶点, 具体机制有待进一步研究.
APPL1作为一种细胞内转接蛋白, 广泛存在于人体的各个组织, 他不仅是与糖脂代谢相关通路上的关键分子, 而且可能参与细胞增殖与凋亡相关的多个通路. 已有报道其可能参与了多种肿瘤的发生, 但APPL1蛋白及其mRNA在结肠癌中的表达情况却鲜有报道.
高国全, 教授, 中山大学中山医学院生化系
目前, 脂联素与结直肠癌的关系已成为国内外研究的热点, 和该分子相关的信号转导通路研究成为肿瘤学研究的热点. APPL1作为与脂联素受体结合的第1个信号转导蛋白, 越加受到研究者关注.
Schenck等发现APPL1可以和Akt结合增加其对底物的敏感性, 促进细胞存活, 下调APPL1, 细胞凋亡数量增加; Lee等发现APPL1参与脂联素受体介导的通过Src/Ras激活ERK1/2促进细胞增殖的过程; 下调APPL1, 脂联素受体诱导ERK1/2活化程度降低.
本实验首次证实了APPL1蛋白和mRNA在结直肠癌组织以及正常肠黏膜组织中的表达情况, 为进一步深入研究结直肠癌的发病机制提供实验依据, 为结直肠癌的分子靶向治疗提高可能的作用靶点.
本文检测了APPL1在结直肠癌组织及正常肠黏膜组织中的表达情况, 分析其与结直肠癌临床病理特征的关系, 为信号转导蛋白在结直肠癌发生发展中的作用提供理论依据, 并为结直肠癌的诊断及治疗提供了新的思路.
脂联素: 是近年来发现一种脂肪细胞分泌的生物活性因子, 具有降糖、增加胰岛素敏感性、抗炎、抗动脉粥样硬化以及抗血管生成等作用. 他可能通过抑制巨噬细胞分泌TNF-a或者调节癌基因和抑癌基因的表达抑制肿瘤生长, 也可能通过重要信号分子抑制肿瘤细胞的增殖以及肿瘤血管的生成.
本研究设计较为合理并得出较为可靠的结论, 具有一定的临床研究意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Mitsuuchi Y, Johnson SW, Sonoda G, Tanno S, Golemis EA, Testa JR. Identification of a chromosome 3p14.3-21.1 gene, APPL, encoding an adaptor molecule that interacts with the oncoprotein-serine/threonine kinase AKT2. Oncogene. 1999;18:4891-4898. [PubMed] [DOI] |
| 2. | Liu J, Yao F, Wu R, Morgan M, Thorburn A, Finley RL, Chen YQ. Mediation of the DCC apoptotic signal by DIP13 alpha. J Biol Chem. 2002;277:26281-26285. [PubMed] [DOI] |
| 3. | Yang L, Lin HK, Altuwaijri S, Xie S, Wang L, Chang C. APPL suppresses androgen receptor transactivation via potentiating Akt activity. J Biol Chem. 2003;278:16820-16827. [PubMed] [DOI] |
| 4. | Nechamen CA, Thomas RM, Cohen BD, Acevedo G, Poulikakos PI, Testa JR, Dias JA. Human follicle-stimulating hormone (FSH) receptor interacts with the adaptor protein APPL1 in HEK 293 cells: potential involvement of the PI3K pathway in FSH signaling. Biol Reprod. 2004;71:629-636. [PubMed] [DOI] |
| 5. | Zhao Z, Liu XF, Wu HC, Zou SB, Wang JY, Ni PH, Chen XH, Fan QS. Rab5a overexpression promoting ovarian cancer cell proliferation may be associated with APPL1-related epidermal growth factor signaling pathway. Cancer Sci. 2010;101:1454-1462. [PubMed] [DOI] |
| 6. | Mao X, Kikani CK, Riojas RA, Langlais P, Wang L, Ramos FJ, Fang Q, Christ-Roberts CY, Hong JY, Kim RY. APPL1 binds to adiponectin receptors and mediates adiponectin signalling and function. Nat Cell Biol. 2006;8:516-523. [PubMed] [DOI] |
| 7. | Johnson SM, Gulhati P, Arrieta I, Wang X, Uchida T, Gao T, Evers BM. Curcumin inhibits proliferation of colorectal carcinoma by modulating Akt/mTOR signaling. Anticancer Res. 2009;29:3185-3190. [PubMed] |
| 8. | Wang L, Cao XX, Chen Q, Zhu TF, Zhu HG, Zheng L. DIXDC1 targets p21 and cyclin D1 via PI3K pathway activation to promote colon cancer cell proliferation. Cancer Sci. 2009;100:1801-1808. [PubMed] [DOI] |
| 9. | Greijer AE, Delis-van Diemen PM, Fijneman RJ, Giles RH, Voest EE, van Hinsbergh VW, Meijer GA. Presence of HIF-1 and related genes in normal mucosa, adenomas and carcinomas of the colorectum. Virchows Arch. 2008;452:535-544. [PubMed] [DOI] |
| 10. | Liao CH, Sang S, Ho CT, Lin JK. Garcinol modulates tyrosine phosphorylation of FAK and subsequently induces apoptosis through down-regulation of Src, ERK, and Akt survival signaling in human colon cancer cells. J Cell Biochem. 2005;96:155-169. [PubMed] [DOI] |
| 11. | 徐 怡顺, 周 建平, 袁 联文. PI3K、Akt、ERK1/2在结直肠癌中的表达及其临床意义. 湖南师范大学学报(医学版). 2009;6:27-32. |
| 12. | Schenck A, Goto-Silva L, Collinet C, Rhinn M, Giner A, Habermann B, Brand M, Zerial M. The endosomal protein Appl1 mediates Akt substrate specificity and cell survival in vertebrate development. Cell. 2008;133:486-497. [PubMed] [DOI] |
| 13. | Wei EK, Giovannucci E, Fuchs CS, Willett WC, Mantzoros CS. Low plasma adiponectin levels and risk of colorectal cancer in men: a prospective study. J Natl Cancer Inst. 2005;97:1688-1694. [PubMed] [DOI] |
| 14. | Gialamas SP, Petridou ET, Tseleni-Balafouta S, Spyridopoulos TN, Matsoukis IL, Kondi-Pafiti A, Zografos G, Mantzoros CS. Serum adiponectin levels and tissue expression of adiponectin receptors are associated with risk, stage, and grade of colorectal cancer. Metabolism. 2011;60:1530-1538. [PubMed] [DOI] |
| 15. | Kim AY, Lee YS, Kim KH, Lee JH, Lee HK, Jang SH, Kim SE, Lee GY, Lee JW, Jung SA. Adiponectin represses colon cancer cell proliferation via AdipoR1- and -R2-mediated AMPK activation. Mol Endocrinol. 2010;24:1441-1452. [PubMed] [DOI] |
| 16. | Man K, Ng KT, Xu A, Cheng Q, Lo CM, Xiao JW, Sun BS, Lim ZX, Cheung JS, Wu EX. Suppression of liver tumor growth and metastasis by adiponectin in nude mice through inhibition of tumor angiogenesis and downregulation of Rho kinase/IFN-inducible protein 10/matrix metalloproteinase 9 signaling. Clin Cancer Res. 2010;16:967-977. [PubMed] [DOI] |
| 17. | Sugiyama M, Takahashi H, Hosono K, Endo H, Kato S, Yoneda K, Nozaki Y, Fujita K, Yoneda M, Wada K. Adiponectin inhibits colorectal cancer cell growth through the AMPK/mTOR pathway. Int J Oncol. 2009;34:339-344. [PubMed] |
| 18. | Maemura K, Shiraishi N, Sakagami K, Kawakami K, Inoue T, Murano M, Watanabe M, Otsuki Y. Proliferative effects of gamma-aminobutyric acid on the gastric cancer cell line are associated with extracellular signal-regulated kinase 1/2 activation. J Gastroenterol Hepatol. 2009;24:688-696. [PubMed] [DOI] |
| 19. | Lee MH, Klein RL, El-Shewy HM, Luttrell DK, Luttrell LM. The adiponectin receptors AdipoR1 and AdipoR2 activate ERK1/2 through a Src/Ras-dependent pathway and stimulate cell growth. Biochemistry. 2008;47:11682-11692. [PubMed] [DOI] |
| 20. | Williams CJ, Mitsiades N, Sozopoulos E, Hsi A, Wolk A, Nifli AP, Tseleni-Balafouta S, Mantzoros CS. Adiponectin receptor expression is elevated in colorectal carcinomas but not in gastrointestinal stromal tumors. Endocr Relat Cancer. 2008;15:289-299. [PubMed] [DOI] |
| 21. | Baba Y, Nosho K, Shima K, Meyerhardt JA, Chan AT, Engelman JA, Cantley LC, Loda M, Giovannucci E, Fuchs CS. Prognostic significance of AMP-activated protein kinase expression and modifying effect of MAPK3/1 in colorectal cancer. Br J Cancer. 2010;103:1025-1033. [PubMed] [DOI] |
| 22. | Guo GF, Cai YC, Zhang B, Xu RH, Qiu HJ, Xia LP, Jiang WQ, Hu PL, Chen XX, Zhou FF. Overexpression of SGLT1 and EGFR in colorectal cancer showing a correlation with the prognosis. Med Oncol. 2011;28 Suppl 1:S197-S203. [PubMed] [DOI] |
| 23. | Lee JR, Hahn HS, Kim YH, Nguyen HH, Yang JM, Kang JS, Hahn MJ. Adaptor protein containing PH domain, PTB domain and leucine zipper (APPL1) regulates the protein level of EGFR by modulating its trafficking. Biochem Biophys Res Commun. 2011;415:206-211. [PubMed] [DOI] |