修回日期: 2011-12-30
接受日期: 2012-01-19
在线出版日期: 2012-01-28
胃癌是世界上导致癌症相关死亡的主要原因之一. 虽然普遍认为幽门螺杆菌感染是导致胃癌发生的重要原因, 但胃癌发生的确切机制尚未被阐明. 癌症的发生、发展主要与细胞生存和死亡信号的平衡相关, 致癌物质和炎症因子能活化大多数细胞的生存信号, 从本质上促成肿瘤的形成. 核转录因子-kappaB(NF-κB)是细胞主要的生存信号之一, 近年来在一些细胞学和动物模型实验中均发现NF-κB的活化与胃癌发生和化疗抵抗等过程密切相关, 抑制NF-κB的活化可提高胃癌细胞对化疗药物的敏感性. 本文对NF-κB转录途径在胃癌演进中的机制以及其靶向治疗的相关进展综述如下.
引文著录: 刘静, 刘冰熔, 刘婷. NF-κB与胃癌的靶向治疗研究进展. 世界华人消化杂志 2012; 20(3): 181-186
Revised: December 30, 2011
Accepted: January 19, 2012
Published online: January 28, 2012
Gastric cancer is a main cause of cancer death worldwide. Despite the knowledge that Helicobacter pylori constitutes the main cause of gastric cancer, the mechanisms for gastric carcinogenesis are still elucidated. Cancer development and progression depend on the balance between cell survival and death signals. Common cell survival signaling pathways are activated by carcinogens as well as by inflammatory cytokines, which contribute substantially to tumorigenesis. Nuclear factor-kappaB (NF-κB) is a major cell survival signal. Recent studies with cell culture systems and animal models have certified the links between NF-κB and gastric carcinogenesis and resistance to chemotherapy. Inhibition of NF-κB activation can enhance the sensitivity of cancer cells to chemotherapeutic drugs. In this review, we summarize recent progress in understanding the role of the NF-κB pathway in gastric cancer development as well as in modulating NF-κB for gastric cancer prevention and therapy.
- Citation: Liu J, Liu BR, Liu T. NF-κB and targeted therapy of gastric cancer: recent research progress. Shijie Huaren Xiaohua Zazhi 2012; 20(3): 181-186
- URL: https://www.wjgnet.com/1009-3079/full/v20/i3/181.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i3.181
胃癌是世界上导致癌症相关死亡最常见的恶性肿瘤之一. 胃癌的发病机制十分复杂且与多因素相关, 细胞内信号转导通路失调是一种主要的致病机制. 致癌物质和炎症因子能活化大多数细胞的生存信号, 从而导致肿瘤形成. 核转录因子-kappaB是细胞主要的生存信号之一, 他的活化与胃癌演进、化疗抵抗等过程密切相关.
近些年, 人们在胃癌的化学治疗上取得很大进步, 例如对5-氟尿嘧啶(5-FU)的认识更加深刻, 奥沙利铂和伊立替康作为辅助治疗药物[1]以及贝伐单抗和西妥昔单抗等靶向治疗药物[2,3]的发现等. 然而, 由于对化疗药物耐受等原因, 进展期胃癌患者的生存率并未明显提高, 因此需要新的方法来代替和补充当前的治疗. 了解NF-κB在胃癌中的生物学意义, 对其活性进行选择性调控, 将其作为肿瘤治疗的新靶点, 或许能为包括胃癌在内的肿瘤治疗开辟一条新途径.
许多实验研究表明, 在胃癌等许多恶性肿瘤组织、细胞株及动物模型中能检测到NF-κB的异常活化[4-6]. Camp等[4]研究发现5-FU和SN-38可诱导胃癌细胞株AGC和NCI-N87中NF-κB的活化, 用腺病毒IκBα超抑制物(Ad.IκBα-SR)预处理细胞后, 可明显提高化疗药物诱导的凋亡和生长抑制. Li等[7]研究发现NF-κB在胃癌的4种细胞系 AGC、MKN28、MKN45、SGC7901中均可被组成性活化, 但其活化程度不同. Yamanaka等[6]应用免疫组化方法在63个胃癌手术切除标本中检测到21人细胞核内高表达NF-κB/p65, 最高为61%; 42人低表达, 最低为1%, 且发现p65的组成性活化与胃癌的预后相关. NF-κB在不同胃癌组织和细胞株之间的活化存在差异, 在NF-κB信号通路明显活化的胃癌细胞系和病例中, 化疗耐药与之密切相关, 因此, 抗NF-κB治疗可能成为胃癌治疗的新方法.
近些年的研究阐明幽门螺杆菌(Helicobacter pylori, H. pylori)与宿主间相互作用是引起胃炎和胃癌的主要原因. H. pylori感染的毒力因素很多, 其中细胞毒素相关抗原A(CagA)和细胞毒素相关基因致病岛(cagPAI)在胃癌发展过程中扮演从细菌至癌蛋白衍生的角色. cagPAI编码约30个基因, 其中一些组成Ⅳ型分泌系统, 介导CagA蛋白和肽聚糖(PGN)进入细胞质. CagA进入细胞质后通过各种途径干扰和破坏细胞极性、通透性及增殖等[8,9].
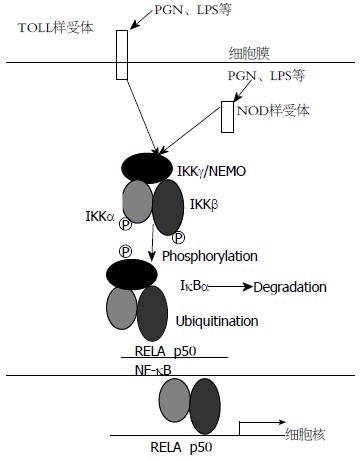
H. pylori感染内皮细胞后能活化多种致癌通路, 主要包括NF-κB、激活物蛋白-1、磷脂酰肌醇-3-激酶、信号转导与转录活化因子3、Wnt/β-catenin和环氧化酶2、促分裂原活化蛋白激酶等[10-13]. 其中NF-κB的活化在胃黏膜炎症和肿瘤形成过程中起着关键作用. H. pylori感染细胞后, 可通过结合Toll样受体[14]和NOD样受体活化NF-κB通路[15](图1). 活化的NF-κB可调节各种炎症因子和生长因子的表达, 促进细胞生长、抑制凋亡、改变细胞间黏附和迁移、诱导基因突变等过程进而促成胃癌的发生. 此外, H. pylori可诱导胃黏膜上皮细胞的后生修饰, 例如DNA异常甲基化[16]、组蛋白乙酰化[17]等, 这些在致癌性转化中十分重要.
NF-κB活化后既有促凋亡作用, 又有抗凋亡作用. 一方面NF-κB通路活化可上调促凋亡蛋白如Fas、c-myc、p53、IkappaB、死亡受体4和死亡受体5等[18-21]的表达, 进而促进细胞凋亡; 另一方面, NF-κB活化后还可以上调抑凋亡蛋白的表达如肿瘤坏死因子受体相关因子TRAF1和TRAF2、细胞凋亡蛋白抑制物c-IAP和c-IAP2、Fas相关性死亡结构域蛋白样白介素转变酶抑制蛋白、Bcl-XL、A20等[22], 进而抑制细胞凋亡. 此外, 还能够通过抑制Jun氨基末端激酶的活性抑制凋亡[23]. NF-κB的活化在调节肿瘤细胞生存、抑制凋亡过程中起到十分关键的作用, 抑制NF-κB在胃癌中的活化来提高化疗药诱导的凋亡将是一条可行的途径.
肿瘤细胞同正常细胞一样, 其生长需要血液提供氧气和营养物质. 由肿瘤细胞、巨噬细胞、中性粒细胞等产生的单核细胞化学吸引蛋白-1、IL-8和血管内皮生长因子等[24-26]与肿瘤血管形成密切相关, NF-κB的活化可调节这些血管生长因子的表达. Gutierrez-Orozco等[25]用绿茶和黑茶提取物抑制胃癌细胞AGC中NF-κB的活化后, IL-8的分泌水平下调, 表现出一定的抗血管生成作用. 用SN50抑制NF-κB在人胃癌SGC7901裸鼠移植瘤模型中活化后, 可检测到肿瘤微血管密度减少[27]. 此外, 研究发现NF-κB转录活化可调节环氧化酶2和低氧诱导转录因子-1在胃癌细胞中的表达, 从而促进血管的生成[28,29]. 以上均表明NF-κB的活化与胃癌血管生成密切相关.
许多研究表明NF-κB通路的活化可促进胃癌和其他肿瘤的生长. 细胞周期蛋白D(Cyclin Ds)是调节细胞周期的关键蛋白, 他包括3个家族成员(Cyclin D1、D2、D3), NF-κB可通过结合Cyclin Ds的启动子调节其表达. Manikandan等[30]报道NF-κB在胃癌中活化后能促进cyclin D1和cyclin B等的表达, 调节胃癌的生长. NF-κB活化后还可以调节胃癌细胞产生一些促进细胞增殖的生长因子, 如肝细胞生长因子、粒细胞集落刺激因子、成骨蛋白[31-33]等. 然而, 目前国内外尚无关于NF-κB活化后下调癌细胞增殖的相关报道.
NF-κB活化后促进多种基因表达参与胃癌进展. 研究表明, 基质金属蛋白酶(matrix metalloproteinases, MMPs)参与细胞外基质、基底膜和黏附分子以及一些蛋白酶抑制剂的降解. NF-κB活化后可上调MMP-2、MMP-7和MMP-9等的表达, 其表达与胃癌的浸润和转移相关[33,34]. Yang等[34]研究发现, 尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, uPA)启动子中含有NF-κB结合位点, NF-κB活化促进该基因表达. uPA和相应受体uPAR结合后将纤维蛋白溶酶原转化成纤维蛋白溶酶, 降解基底膜而促进肿瘤细胞的浸润和转移. NF-κB活化后还可调节胃癌细胞中细胞间黏附分子1、内皮白细胞黏附分子1、血管细胞黏附分子1[35-37]等的表达, 研究证明这些分子可介导癌细胞穿透血管壁, 与胃癌的转移和扩散密切相关. 此外, NF-κB通路活化可促进上皮间质转化, 为胃癌细胞的浸润和转移提供条件[38]. 上述均说明在胃癌的进展过程中NF-κB发挥了重要作用.
由于在大多数癌细胞中NF-κB通路普遍被活化, 他又与肿瘤的发生、发展密切相关, 抑制NF-κB在肿瘤细胞内的活化可能取得一定的抗肿瘤作用. 在肿瘤细胞中, 仅仅抑制NF-κB的活化不足以引起显著的细胞凋亡. 因此, 大多数实验研究主要致力于抑制NF-κB的活性能否增强肿瘤细胞对化疗和放疗的敏感性. NF-κB的抑制剂可作用于此通路中的不同位点来靶向调节NF-κB的活性, 其调节靶点主要包括IKK的活性、IκB降解、NF-κB核转录与DNA结合等. 作用于上述靶点的各种抑制剂多数已被证明对胃癌治疗有效, 用于胃癌研究的NF-κB抑制剂见表1.
| 药物 | 作用机制 | 参考文献 |
| BAY-11-7082 | 抑制κB磷酸化 | [39] |
| BAY-11-7085 | 同上 | [40] |
| 硼替佐米 | 抑制κBα降解 | [42] |
| MG-132 | 同上 | [43] |
| PDTC | 抑制IKK激酶活力 | [7] |
| 清除活性氧中间产物 | ||
| NAC | 同上 | [39] |
| SN50 | 阻断NF-κB的核转录 | [27] |
| E2F1 | 同上 | [27] |
| DHMEQ | 同上 | [44] |
| 欧甘菊 | 抑制NF-κB的DNA结合力 | [41] |
| 舒林酸 | 抑制IκBα的磷酸化 | [45] |
| 阿司匹林 | 抑制IκBα的磷酸化 | [46] |
| 抑制IKKβ的活力 | ||
| COX-2抑制剂 | 抑制IκBα的磷酸化和降解 | [47] |
| 抑制Rel/p65的核转录 | ||
| GC | 抑制IκB的磷酸化和降解 | [25] |
| 抑制p65的乙酰化 | ||
| 姜黄素 | 抑制IκB的降解 | [48] |
| 环孢素A | 抑制NF-κB的核转录 | [49] |
| 抑制NF-κB的DNA结合力 | ||
| 他克莫司 | 同上 | [49] |
由于IKK活化在整个NF-κB通路活化过程中起到关键的作用, 所以他是抑制NF-κB活化的主要分子靶点之一. 在胃癌治疗中被发现和证实有效的IKK抑制剂包括BAY-11-7082和BAY-11-7085等[39,40]. 这些物质或是直接结合IKK激酶抑制其活力, 或是通过阻断IKK活化的上游信号间接抑制IKK活化. 体内外研究均表明, IKK抑制剂与各种化疗药物联合应用可提高胃癌对化疗药物的敏感性.
蛋白酶体抑制剂通过干扰IκB蛋白降解过程实现对NF-κB通路的抑制. 硼替佐米是第1个被FDA和欧洲医学协会批准用于临床治疗多发性骨髓瘤的药物. Nakata等[41]研究发现硼替佐米能显著抑制NF-κB在胃癌细胞株和裸鼠移植瘤模型中的活化. Yu等[42]也发现多柔比星和依托泊苷可诱导胃癌细胞SGC-7901中NF-κB的活化, 用MG-132抑制NF-κB活化后可明显增加化疗药物诱导的凋亡.
抗氧化剂抑制NF-κB活化的机制尚不十分清晰, 有研究认为其在NF-κB活化通路的不同水平发挥抑制作用, 如抑制IKK激酶的活性、减少NF-κB的核移位、清除活性氧中间产物等. 研究表明抗氧化剂吡咯烷二硫氨基甲酸(PDTC)和N-乙酰-1-半胱氨酸(NAC)均可抑制胃癌细胞株中NF-κB的活化[7,39]. 研究发现用PDTC抑制胃癌细胞株中NF-κB的活化后, 细胞的增殖能力明显下降.
IκB降解后, 抑制NF-κB的核转录是阻断NF-κB信号通路活化的另一种战略. 应用于胃癌研究的NF-κB核转运抑制剂主要包括SN50、E2F1、脱氢甲基还氧醌霉素(DHMEQ)[43]等. 孙家磊等[27]研究发现SN50可通过抑制NF-κB活化明显增加胃癌细胞SGC-7901裸鼠移植瘤模型的凋亡. 此外, Sohma等[44]研究发现欧甘菊可通过调节NF-κB的DNA结合能力抑制胃癌细胞中NF-κB的活化.
非甾体类抗炎药和糖皮质激素是NF-κB信号通路的潜在抑制剂, 在有关胃癌的研究中, 舒林酸、阿司匹林和COX-2抑制剂等[45-47]均可抑制胃癌细胞中NF-κB的活化, 他们或通过抑制炎症反应间接抑制NF-κB活化, 或者通过作用于NF-κB通路活化的调节靶点直接抑制其活化. 天然的抗炎药如没食子酸(GC)[25]、姜黄素[48]等也可作用于NF-κB通路的不同靶点进而抑制NF-κB在胃癌中的活化. 国内外尚没有关于糖皮质激素抑制胃癌细胞中NF-κB活性的相关报道. 此外, 免疫抑制剂环孢素A和他克莫司被研究发现可抑制胃腺癌细胞内NF-κB的活化[49]. 在有关化学预防和化疗敏感性的实验中, 这些药物与抗癌药物的联合已被广泛研究并被证明有效 .
比起前面提及的NF-κB通路抑制剂, 直接作用于NF-κB信号通路的某一元件的基因治疗是一种准确有效的方法. 刘冰熔等[4,50]研究发现三氧化二砷和5-FU可诱导胃癌细胞内NF-κB活化, 感染Ad-IκBαM可通过抑制胃癌细胞NF-κB的活性增强上述药物诱导的凋亡. 研究发现siRNA分子通过干扰IKKα和IKKβ的活性提高胃癌对化疗的敏感性[5,51]. Sakamoto等[52]将鼠胃黏膜上皮细胞IKKβ基因敲除后给予甲基亚硝基脲诱导胃癌的发生, 发现模型组较对照组相比有显著的细胞凋亡. 以上均表明NF-κB基因靶向治疗可有效抑制胃癌细胞生长, 然而, 怎样将靶向基因转移到癌细胞内, 仍是当前面临的难题.
上述的NF-κB通路抑制剂有一些已经应用于临床治疗, 由于NF-κB信号通路在机体的各种生理过程中起到十分复杂的作用, 广泛抑制其活性后, 一些毒副作用是不可避免的. 例如, 硼替佐米可抑制蛋白酶体, 但是蛋白酶体不仅仅降解IκB, 他还会对其他的生理过程产生严重的影响.
分子靶向治疗是肿瘤治疗史上继手术、放化疗后临床采用的具有诱人发展前景的治疗方法. NF-κB通路的活化与胃癌的发生及演进的各个环节密切相关, 因此靶向阻断NF-κB通路将有一定的抗癌作用, 我们有理由假设NF-κB信号转导通路可以作为胃癌治疗的一个靶点. 然而, 由于NF-κB通路在机体正常细胞内具有很重要的生理功能, 尤其在免疫细胞中, 广泛抑制其活化会导致机体产生严重的不良反应. 相信随着NF-κB在肿瘤细胞中活化机制的逐渐阐明, 可以通过应用生物标记指示NF-κB抑制剂的作用靶点, 筛选出靶向调节恶性肿瘤细胞内NF-κB活性的新药物. 在胃癌的临床化疗和靶向治疗中应用有效的NF-κB抑制剂值得期待.
胃癌的发病机制十分复杂且与多因素相关, 细胞内信号转导通路失调是一种主要的致病机制. NF-κB信号通路活化与胃癌发生发展机制密切相关.
谭晓冬, 副教授, 中国医科大学附属盛京医院
NF-κB是细胞主要的生存信号之一, 近年来在一些细胞学和动物模型实验中均发现NF-κB的活化与胃癌的发生和化疗抵抗密切相关, 抑制NF-κB的活化可提高胃癌细胞对化疗药物的敏感性.
许多实验研究表明, 在胃癌等许多恶性肿瘤组织、细胞株及动物模型中能检测到NF-κB的异常活化. Li等研究发现NF-κB在胃癌的4种细胞系AGC、MKN28、MKN45、SGC7901中均可被组成型活化.
本文主要总结了最近几年研究的新进展, 客观分析了NF-κB与胃癌发生、发展的关系, 并展望了其研究前景.
本文提出了NF-κB信号转导通路可作为胃癌治疗的一个新靶点, 为胃癌治疗提出一条新的治疗途径, 靶向阻断NF-κB通路将对胃癌的治疗有一定的作用.
本文较全面地综述了NF-κB信号通路活化与胃癌发生发展机制的相关性, 具有较好的科学性和学术价值, 可读性强.
编辑: 张姗姗 电编:闫晋利
| 1. | Peinert S, Grothe W, Stein A, Müller LP, Ruessel J, Voigt W, Schmoll HJ, Arnold D. Safety and efficacy of weekly 5-fluorouracil/folinic acid/oxaliplatin/irinotecan in the first-line treatment of gastrointestinal cancer. Ther Adv Med Oncol. 2010;2:161-174. [PubMed] |
| 2. | El-Rayes BF, Zalupski M, Bekai-Saab T, Heilbrun LK, Hammad N, Patel B, Urba S, Shields AF, Vaishampayan U, Dawson S. A phase II study of bevacizumab, oxaliplatin, and docetaxel in locally advanced and metastatic gastric and gastroesophageal junction cancers. Ann Oncol. 2010;21:1999-2004. [PubMed] [DOI] |
| 3. | Han SW, Oh DY, Im SA, Park SR, Lee KW, Song HS, Lee NS, Lee KH, Choi IS, Lee MH. Phase II study and biomarker analysis of cetuximab combined with modified FOLFOX6 in advanced gastric cancer. Br J Cancer. 2009;100:298-304. [PubMed] [DOI] |
| 4. | Camp ER, Li J, Minnich DJ, Brank A, Moldawer LL, MacKay SL, Hochwald SN. Inducible nuclear factor-kappaB activation contributes to chemotherapy resistance in gastric cancer. J Am Coll Surg. 2004;199:249-258. [PubMed] [DOI] |
| 5. | Chao X, Zao J, Xiao-Yi G, Li-Jun M, Tao S. Blocking of PI3K/AKT induces apoptosis by its effect on NF-κB activity in gastric carcinoma cell line SGC7901. Biomed Pharmacother. 2010;64:600-604. [PubMed] [DOI] |
| 6. | Yamanaka N, Sasaki N, Tasaki A, Nakashima H, Kubo M, Morisaki T, Noshiro H, Yao T, Tsuneyoshi M, Tanaka M. Nuclear factor-kappaB p65 is a prognostic indicator in gastric carcinoma. Anticancer Res. 2004;24:1071-1075. [PubMed] |
| 7. | Li Q, Yu YY, Zhu ZG, Ji YB, Zhang Y, Liu BY, Chen XH, Lin YZ. Effect of NF-kappaB constitutive activation on proliferation and apoptosis of gastric cancer cell lines. Eur Surg Res. 2005;37:105-110. [PubMed] [DOI] |
| 8. | Lee IO, Kim JH, Choi YJ, Pillinger MH, Kim SY, Blaser MJ, Lee YC. Helicobacter pylori CagA phosphorylation status determines the gp130-activated SHP2/ERK and JAK/STAT signal transduction pathways in gastric epithelial cells. J Biol Chem. 2010;285:16042-16050. [PubMed] [DOI] |
| 9. | Zeaiter Z, Huynh HQ, Kanyo R, Stein M. CagA of Helicobacter pylori alters the expression and cellular distribution of host proteins involved in cell signaling. FEMS Microbiol Lett. 2008;288:227-234. [PubMed] [DOI] |
| 10. | Tabassam FH, Graham DY, Yamaoka Y. Helicobacter pylori activate epidermal growth factor receptor- and phosphatidylinositol 3-OH kinase-dependent Akt and glycogen synthase kinase 3beta phosphorylation. Cell Microbiol. 2009;11:70-82. [PubMed] [DOI] |
| 11. | Nagy TA, Frey MR, Yan F, Israel DA, Polk DB, Peek RM. Helicobacter pylori regulates cellular migration and apoptosis by activation of phosphatidylinositol 3-kinase signaling. J Infect Dis. 2009;199:641-651. [PubMed] [DOI] |
| 12. | Franco AT, Israel DA, Washington MK, Krishna U, Fox JG, Rogers AB, Neish AS, Collier-Hyams L, Perez-Perez GI, Hatakeyama M. Activation of beta-catenin by carcinogenic Helicobacter pylori. Proc Natl Acad Sci U S A. 2005;102:10646-10651. [PubMed] [DOI] |
| 13. | Bronte-Tinkew DM, Terebiznik M, Franco A, Ang M, Ahn D, Mimuro H, Sasakawa C, Ropeleski MJ, Peek RM, Jones NL. Helicobacter pylori cytotoxin-associated gene A activates the signal transducer and activator of transcription 3 pathway in vitro and in vivo. Cancer Res. 2009;69:632-639. [PubMed] [DOI] |
| 14. | Allison CC, Kufer TA, Kremmer E, Kaparakis M, Ferrero RL. Helicobacter pylori induces MAPK phosphorylation and AP-1 activation via a NOD1-dependent mechanism. J Immunol. 2009;183:8099-8109. [PubMed] [DOI] |
| 15. | Kumar Pachathundikandi S, Brandt S, Madassery J, Backert S. Induction of TLR-2 and TLR-5 expression by Helicobacter pylori switches cagPAI-dependent signalling leading to the secretion of IL-8 and TNF-α. PLoS One. 2011;6:e19614. [PubMed] [DOI] |
| 16. | Nardone G, Compare D, De Colibus P, de Nucci G, Rocco A. Helicobacter pylori and epigenetic mechanisms underlying gastric carcinogenesis. Dig Dis. 2007;25:225-229. [PubMed] [DOI] |
| 17. | Ding SZ, Fischer W, Kaparakis-Liaskos M, Liechti G, Merrell DS, Grant PA, Ferrero RL, Crowe SE, Haas R, Hatakeyama M. Helicobacter pylori-induced histone modification, associated gene expression in gastric epithelial cells, and its implication in pathogenesis. PLoS One. 2010;5:e9875. [PubMed] [DOI] |
| 18. | Han JC, Zhang KL, Chen XY, Jiang HF, Kong QY, Sun Y, Wu ML, Huang L, Li H, Liu J. Expression of seven gastric cancer-associated genes and its relevance for Wnt, NF-kappaB and Stat3 signaling. APMIS. 2007;115:1331-1343. [PubMed] [DOI] |
| 19. | Zhu BS, Xing CG, Lin F, Fan XQ, Zhao K, Qin ZH. Blocking NF-κB nuclear translocation leads to p53-related autophagy activation and cell apoptosis. World J Gastroenterol. 2011;17:478-487. [PubMed] [DOI] |
| 20. | Shibata W, Takaishi S, Muthupalani S, Pritchard DM, Whary MT, Rogers AB, Fox JG, Betz KS, Kaestner KH, Karin M. Conditional deletion of IkappaB-kinase-beta accelerates helicobacter-dependent gastric apoptosis, proliferation, and preneoplasia. Gastroenterology. 2010;138:1022-34. e1-e10. [PubMed] |
| 21. | Maldonado ME, Bousserouel S, Gossé F, Lobstein A, Raul F. Implication of NF-κB and p53 in the expression of TRAIL-death receptors and apoptosis by apple procyanidins in human metastatic SW620 cells. Biomedica. 2010;30:577-586. [PubMed] |
| 22. | Luo JL, Kamata H, Karin M. IKK/NF-kappaB signaling: balancing life and death--a new approach to cancer therapy. J Clin Invest. 2005;115:2625-2632. [PubMed] [DOI] |
| 23. | Bark H, Choi CH. PSC833, cyclosporine analogue, downregulates MDR1 expression by activating JNK/c-Jun/AP-1 and suppressing NF-kappaB. Cancer Chemother Pharmacol. 2010;65:1131-1136. [PubMed] [DOI] |
| 24. | Niu J, Azfer A, Zhelyabovska O, Fatma S, Kolattukudy PE. Monocyte chemotactic protein (MCP)-1 promotes angiogenesis via a novel transcription factor, MCP-1-induced protein (MCPIP). J Biol Chem. 2008;283:14542-14551. [PubMed] [DOI] |
| 25. | Gutierrez-Orozco F, Stephens BR, Neilson AP, Green R, Ferruzzi MG, Bomser JA. Green and black tea inhibit cytokine-induced IL-8 production and secretion in AGS gastric cancer cells via inhibition of NF-κB activity. Planta Med. 2010;76:1659-1665. [PubMed] [DOI] |
| 26. | Xie TX, Xia Z, Zhang N, Gong W, Huang S. Constitutive NF-kappaB activity regulates the expression of VEGF and IL-8 and tumor angiogenesis of human glioblastoma. Oncol Rep. 2010;23:725-732. [PubMed] |
| 27. | 孙 家磊, 朱 宝松, 龚 巍, 张 鹏, 郁 立衍, 赵 奎, 邢 春根. LY294002联合SN50对裸鼠胃癌模型肿瘤细胞生长和凋亡的影响. 中华胃肠外科杂志. 2011;14:364-267. |
| 28. | Lazăr D, Tăban S, Ardeleanu C, Simionescu C, Sporea I, Cornianu M, Vernic C. Immunohistochemical expression of the cyclooxygenase-2 (COX-2) in gastric cancer. The correlations with the tumor angiogenesis and patients' survival. Rom J Morphol Embryol. 2008;49:371-379. [PubMed] |
| 29. | Nam SY, Ko YS, Jung J, Yoon J, Kim YH, Choi YJ, Park JW, Chang MS, Kim WH, Lee BL. A hypoxia-dependent upregulation of hypoxia-inducible factor-1 by nuclear factor-κB promotes gastric tumour growth and angiogenesis. Br J Cancer. 2011;104:166-174. [PubMed] [DOI] |
| 30. | Manikandan P, Vinothini G, Vidya Priyadarsini R, Prathiba D, Nagini S. Eugenol inhibits cell proliferation via NF-κB suppression in a rat model of gastric carcinogenesis induced by MNNG. Invest New Drugs. 2011;29:110-117. [PubMed] [DOI] |
| 31. | Fan S, Gao M, Meng Q, Laterra JJ, Symons MH, Coniglio S, Pestell RG, Goldberg ID, Rosen EM. Role of NF-kappaB signaling in hepatocyte growth factor/scatter factor-mediated cell protection. Oncogene. 2005;24:1749-1766. [PubMed] [DOI] |
| 32. | Kitoh Y, Saio M, Gotoh N, Umemura N, Nonaka K, Bai J, Vizkeleti L, Torocsik D, Balazs M, Adany R. Combined GM-CSF treatment and M-CSF inhibition of tumor-associated macrophages induces dendritic cell-like signaling in vitro. Int J Oncol. 2011;38:1409-1419. [PubMed] [DOI] |
| 33. | Kang MH, Oh SC, Lee HJ, Kang HN, Kim JL, Kim JS, Yoo YA. Metastatic function of BMP-2 in gastric cancer cells: the role of PI3K/AKT, MAPK, the NF-κB pathway, and MMP-9 expression. Exp Cell Res. 2011;317:1746-1762. [PubMed] [DOI] |
| 34. | Yang MD, Lai KC, Lai TY, Hsu SC, Kuo CL, Yu CS, Lin ML, Yang JS, Kuo HM, Wu SH. Phenethyl isothiocyanate inhibits migration and invasion of human gastric cancer AGS cells through suppressing MAPK and NF-kappaB signal pathways. Anticancer Res. 2010;30:2135-2143. [PubMed] |
| 36. | Liu FR, Jiang CG, Li YS, Li JB, Li F. Cimetidine inhibits the adhesion of gastric cancer cells expressing high levels of sialyl Lewis x in human vascular endothelial cells by blocking E-selectin expression. Int J Mol Med. 2011;27:537-544. [PubMed] |
| 37. | Shin J, Kim J, Ryu B, Chi SG, Park H. Caveolin-1 is associated with VCAM-1 dependent adhesion of gastric cancer cells to endothelial cells. Cell Physiol Biochem. 2006;17:211-220. [PubMed] [DOI] |
| 38. | Maier HJ, Schmidt-Strassburger U, Huber MA, Wiedemann EM, Beug H, Wirth T. NF-kappaB promotes epithelial-mesenchymal transition, migration and invasion of pancreatic carcinoma cells. Cancer Lett. 2010;295:214-228. [PubMed] [DOI] |
| 39. | Kim MH, Yoo HS, Kim MY, Jang HJ, Baek MK, Kim HR, Kim KK, Shin BA, Ahn BW, Jung YD. Helicobacter pylori stimulates urokinase plasminogen activator receptor expression and cell invasiveness through reactive oxygen species and NF-kappaB signaling in human gastric carcinoma cells. Int J Mol Med. 2007;19:689-697. [PubMed] |
| 40. | Ray A, Dhar S, Ray BK. Transforming growth factor-beta1-mediated activation of NF-kappaB contributes to enhanced ADAM-12 expression in mammary carcinoma cells. Mol Cancer Res. 2010;8:1261-1270. [PubMed] [DOI] |
| 41. | Nakata W, Hayakawa Y, Nakagawa H, Sakamoto K, Kinoshita H, Takahashi R, Hirata Y, Maeda S, Koike K. Anti-tumor activity of the proteasome inhibitor bortezomib in gastric cancer. Int J Oncol. 2011;39:1529-1536. [PubMed] |
| 42. | Yu LL, Dai N, Yu HG, Sun LM, Si JM. Akt associates with nuclear factor kappaB and plays an important role in chemoresistance of gastric cancer cells. Oncol Rep. 2010;24:113-119. [PubMed] [DOI] |
| 43. | Mino K, Ozaki M, Nakanishi K, Haga S, Sato M, Kina M, Takahashi M, Takahashi N, Kataoka A, Yanagihara K. Inhibition of nuclear factor-kappaB suppresses peritoneal dissemination of gastric cancer by blocking cancer cell adhesion. Cancer Sci. 2011;102:1052-1058. [PubMed] [DOI] |
| 44. | Sohma I, Fujiwara Y, Sugita Y, Yoshioka A, Shirakawa M, Moon JH, Takiguchi S, Miyata H, Yamasaki M, Mori M. Parthenolide, an NF-κB inhibitor, suppresses tumor growth and enhances response to chemotherapy in gastric cancer. Cancer Genomics Proteomics. 2011;8:39-47. [PubMed] |
| 45. | Yasui H, Adachi M, Imai K. Combination of tumor necrosis factor-alpha with sulindac augments its apoptotic potential and suppresses tumor growth of human carcinoma cells in nude mice. Cancer. 2003;97:1412-1420. [PubMed] [DOI] |
| 46. | Redlak MJ, Power JJ, Miller TA. Prevention of deoxycholate-induced gastric apoptosis by aspirin: roles of NF-kappaB and PKC signaling. J Surg Res. 2008;145:66-73. [PubMed] [DOI] |
| 47. | Wong BC, Jiang X, Fan XM, Lin MC, Jiang SH, Lam SK, Kung HF. Suppression of RelA/p65 nuclear translocation independent of IkappaB-alpha degradation by cyclooxygenase-2 inhibitor in gastric cancer. Oncogene. 2003;22:1189-1197. [PubMed] [DOI] |
| 48. | Yu LL, Wu JG, Dai N, Yu HG, Si JM. Curcumin reverses chemoresistance of human gastric cancer cells by downregulating the NF-κB transcription factor. Oncol Rep. 2011;26:1197-1203. [PubMed] |
| 49. | Beppu K, Morisaki T, Matsunaga H, Uchiyama A, Ihara E, Hirano K, Kanaide H, Tanaka M, Katano M. Inhibition of interferon-gamma-activated nuclear factor-kappa B by cyclosporin A: A possible mechanism for synergistic induction of apoptosis by interferon-gamma and cyclosporin A in gastric carcinoma cells. Biochem Biophys Res Commun. 2003;305:797-805. [PubMed] [DOI] |
| 51. | Sethi G, Sung B, Aggarwal BB. Nuclear factor-kappaB activation: from bench to bedside. Exp Biol Med (Maywood). 2008;233:21-31. [PubMed] [DOI] |
| 52. | Sakamoto K, Hikiba Y, Nakagawa H, Hayakawa Y, Yanai A, Akanuma M, Ogura K, Hirata Y, Kaestner KH, Omata M. Inhibitor of kappaB kinase beta regulates gastric carcinogenesis via interleukin-1alpha expression. Gastroenterology. 2010;139:226-238. e6. [PubMed] |