修回日期: 2012-09-10
接受日期: 2012-10-16
在线出版日期: 2012-10-18
目的: 检测脂联素受体1(adiponectin receptors 1, R1)和R2在人结直肠癌组织、腺瘤组织、癌旁组织中的表达情况与临床病理特征的关系及3种组织中R1和R2的关联性.
方法: 采用免疫组织化学SP法检测51例新鲜结直肠癌组织, 42例结直肠腺瘤组织, 35例癌旁组织中脂联素受体R1和R2的表达.
结果: 免疫组织化学结果显示R1在人结直肠癌组织中表达高于腺瘤组织(P = 0.047), 结直肠癌组织中表达高于癌旁组织(P = 0.002), 腺瘤组织中的表达高于癌旁组织(P = 0.042). R2在人结直肠癌组织中表达高于腺瘤组织(P = 0.035), 结直肠癌组织中表达高于癌旁组织(P = 0.002), 腺瘤组织中表达高于癌旁组织(P = 0.046). 在3种组织中, R1与R2的表达无关联性(P>0.05). 在51例结直肠癌组织中脂联素受体表达与分化程度、淋巴结转移、TNM分期相关(均P<0.05), 与性别、年龄、肿瘤大小、组织学类型无明显相关(P>0.05).
结论: 脂联素受体在人结直肠癌组织、腺瘤组织、癌旁组织中普遍表达, 且在结直肠癌组织中的表达最高, 腺瘤次之. 脂联素受体表达与分化程度、淋巴结转移、TNM(tumor regional lymph node and metastasis)分期有关. 脂联素受体有可能成为结直肠癌治疗的一个新靶点.
引文著录: 宋敏, 畅婕, 孟宇, 李磊. 脂联素受体在结直肠癌和结直肠腺瘤组织中表达. 世界华人消化杂志 2012; 20(29): 2845-2850
Revised: September 10, 2012
Accepted: October 16, 2012
Published online: October 18, 2012
AIM: To investigate the relationship between expression of adiponectin receptors R1 and R2 and clinicopathological parameters in colorectal cancer and colorectal adenomas.
METHODS: Expression of adiponectin receptors R1 and R2 in surgical specimens of colorectal carcinoma (n = 51), colorectal adenomas (n = 42), and normal colorectal mucosa (n = 35) was detected by immunohistochemistry.
RESULTS: The expression of adiponectin receptors R1 and R2 was significantly higher in colorectal carcinoma than in colorectal adenomas (P = 0.047, 0.035), and in colorectal adenomas than in normal colorectal mucosa (P = 0.042, 0.046). Expression of adiponectin receptors was significantly correlated with histological differentiation, lymph node metastasis, and TNM stages (all P < 0.05), but not with other clinicopathological features including sex, age, tumor size.
CONCLUSION: Adiponectin receptors R1 and R2 are expressed in both colorectal carcinoma and normal colorectal mucosa. Expression of adiponectin receptors R1 and R2 is enhanced in colorectal cancer and adenomas. Adiponectin receptor expression closely correlates with tumor differentiation, lymph node metastasis and TNM stage in patients with colorectal cancer. Adiponectin receptors may become new targets for colorectal cancer treatment.
- Citation: Song M, Chang J, Meng Y, Li L. Expression of adiponectin receptors R1 and R2 in colorectal carcinoma and colorectal adenoma. Shijie Huaren Xiaohua Zazhi 2012; 20(29): 2845-2850
- URL: https://www.wjgnet.com/1009-3079/full/v20/i29/2845.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i29.2845
恶性肿瘤已经严重危害人类健康, 致死率在我国占据首位. 肿瘤的发生发展是一个多基因改变和多步骤致癌的复杂过程. 一般认为, 正常细胞从增生发展到恶性肿瘤是个逐渐演变的过程: 一般增生→不典型增生→癌变. 以结直肠癌为例, 由于结直肠癌大多数来自原先存在的腺瘤, 即所谓的腺瘤腺癌顺序(adenoma-carcinoma sequence). 此过程需要较长的时间, 所以早期阻断结直肠癌发展成为治疗的有效方法. 相关流行病学显示, 肥胖是结直肠癌这种肥胖相关性肿瘤的危险因子. 脂联素是一种由脂肪细胞特异分泌的内源性生物活因性子, 广泛分布于人体多种组织细胞中, 与冠心病、糖尿病、高血压、肿瘤等多种疾病密切相关[1-3]. 具有调节糖脂代谢、改善胰岛素抵抗[4]、抗炎[5]、抗动脉粥样硬化[6]及抗肿瘤的作用. 脂联素通过与脂联素受体结合而发挥作用. 脂联素受体(adiponectin receptors)由Yamauchi等[7]在人类和小鼠体内首次克隆出来的. 其抗肿瘤机制可能与其直接作用于肿瘤细胞, 同时抗血管生成, 诱导肿瘤细胞凋亡相关. 近几年关于脂联素及其受体与结直肠癌[8]、乳腺癌[9]、子宫内膜癌[10]、食管癌[11]、胃癌[12]、前列腺癌[13]、肾细胞癌[14]等几种恶性肿瘤的相关关系及其作用机制的研究取得了较大的进展, 但对结直肠癌癌前病变的研究甚少. 本实验通过分析脂联素受体在结直肠癌及结直肠腺瘤伴不典型增生组织中表达的情况及其与临床病理学联系, 初步探讨脂联素受体在结直肠癌发生发展中的作用, 为诊断及治疗结直肠癌提供新的思路和理论基础.
收集郑州大学第一附属医院2012-03/2012-06期间手术切除并经病理证实的人结直肠癌标本51例, 其中结肠癌28例, 直肠癌23例; 男30例, 女21例, 平均年龄47.8岁±11.9岁(24岁-82岁); 组织学类型: 管状腺癌15例、乳头状腺癌13例、黏液腺癌13例、印戒细胞癌10例; 分化程度: 高分化10例、中分化13例、低分化26例; TNM分期:Ⅰ期9例、Ⅱ期24例、Ⅲ期16例、Ⅳ期2例; 淋巴结转移14例, 无淋巴结转移37例; 术前未经过放、化疗, 并且排除高血压、糖尿病、冠心病等; 人结直肠腺瘤42例, 其中管状腺瘤19例、绒毛状腺瘤16例、管状绒毛腺瘤7例; 同时选取35例人结直肠癌旁组织作为正常对照, 平均年龄39.0岁±8.7岁(24-57岁).
1.2.1 脂联素受体R1和R2的检测: 3组新鲜结直肠组织标本均经40 g/L甲醛固定后石蜡包埋, 5 µm厚度连续切片用于免疫组织化学. 兔抗人脂联素受体1(adiponectin receptors1, R1)和R2多克隆抗体购自上海生物工程有限公司, SP试剂盒和DAB显色试剂盒购自北京中杉金桥生物技术有限公司. 切片常规脱蜡, 高压抗原修复, 血清封闭, 滴加一抗, R1抗体按1∶300稀释, R2抗体按1∶250稀释, 4 ℃过夜, 滴加二抗, 显色封片, 用已知的结直肠癌阳性切片做阳性对照, 以PBS代替一抗作阴性对照.
1.2.2 结果判断: 脂联素受体阳性表达即在细胞浆内可出现棕黄色颗粒. 结果判读采用半定量积分分级, 积分 = 染色细胞比例×染色强度. 染色细胞比例: <5%为阴性, 0分; 6-20%为弱阳性, 1分; 21-50%为阳性, 2分; >50%为强阳性, 3分; 染色强度: 无色为阴性0分; 淡黄色为弱阳性1分; 棕黄色为阳性2分; 棕褐色为强阳性3分; 2种计分相乘, 0分阴性, 1-3分弱阳性, 4-6阳性, 7-9强阳性.
统计学处理 采用SPSS17.0统计软件包进行数据处理. 应用χ2检验比较3组患者结直肠组织中R1和R2表达的差异及与临床病理特征的关系, 应用列联系数分析3组患者结直肠组织中R1和R2表达的关联性, 检验水准α = 0.05.
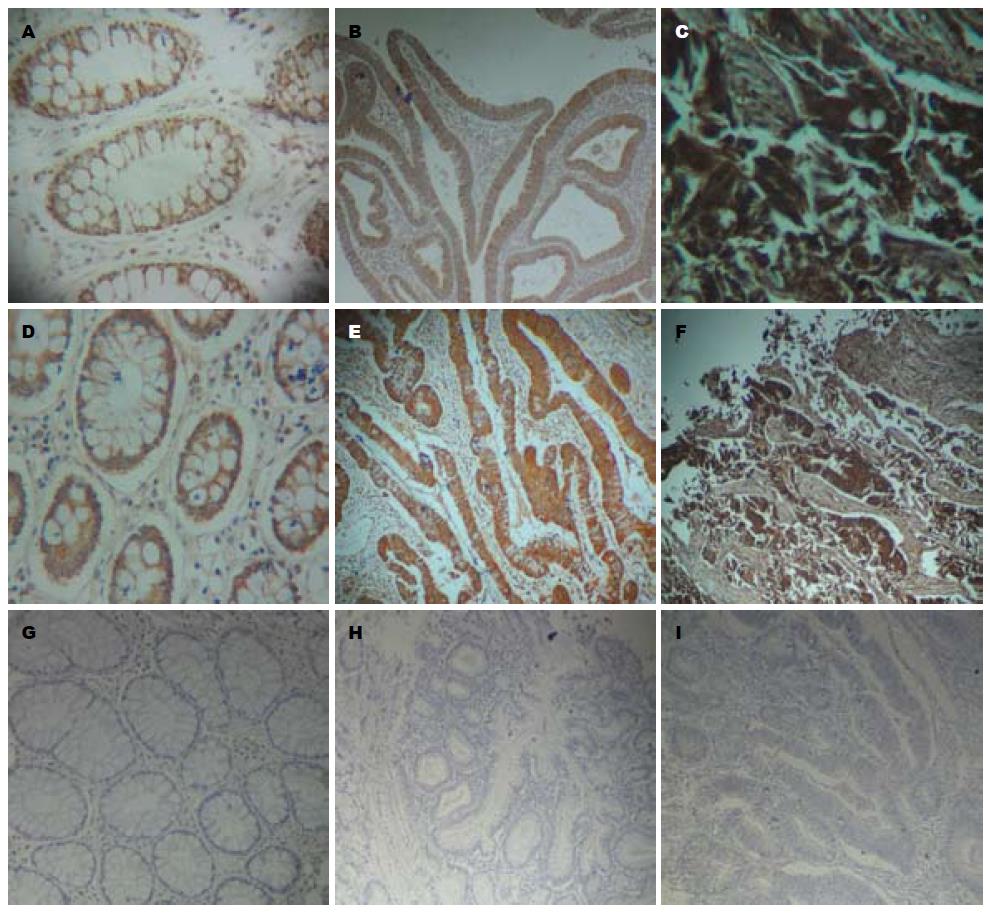
R1在所有结直肠癌、结直肠腺瘤以及正常直肠腺体上皮细胞中均有表达, 主要定位于细胞质, 呈淡黄色、棕黄色、棕褐色颗粒状(图1A-I). 3组结直肠组织中R1的表达(图1A-F). 其中51例结直肠癌组织中R1强阳性表达率是49.0%(25/51), 阳性表达率是19.6%(10/51), 弱阳性表达率是15.7%(8/51), 阴性表达率是15.7%(8/51); 42例结直肠腺瘤组织中R1强阳性表达率是21.4%(9/42), 阳性表达率是35.7%(15/42), 弱阳性表达率是19.0%(8/42), 阴性表达率是23.8%(10/42); 35例正常黏膜组织中R1强阳性表达率是14.3%(5/35), 阳性表达率是17.1%(6/35), 弱阳性表达率是48.6%(17/35), 阴性表达率是20.0%(7/35), 3组结直肠组织差异有统计学意义(P = 0.002, 表1).
| 分组 | n | 阳性(%) | P值 | ||
| + | ++ | +++ | |||
| 结直肠癌 | 44 | 3(6.8) | 16(36.4) | 23(52.3) | |
| 结直肠腺瘤 | 36 | 9(25.0) | 17(47.2) | 9(25.0) | 0.002 |
| 正常组织 | 26 | 12(46.2) | 10(38.5) | 3(11.5) | |
3组结直肠组织中R2的表达(图1D-F), 其中51例结直肠癌组织中R2的强阳性表达率是45.1%(23/51), 阳性表达率是21.6%(11/51), 弱阳性表达率是19.6%(10/51), 阴性表达率是13.7%(7/51); 42例结直肠腺瘤组织中R2强阳性表达率是16.7%(7/42), 阳性表达率是40.5%(17/42), 弱阳性表达率是21.4%(9/42), 阴性表达率是21.4%(9/42); 35例正常黏膜组织中R1强阳性表达率是17.1%(6/35), 阳性表达率是20.0%(7/35), 弱阳性表达率是40.0%(14/35), 阴性表达率是22.9%(8/35), 3组结直肠组织差异有统计学意义(P = 0.039, 表2).
| 分组 | n | 阳性(%) | P值 | ||
| + | ++ | +++ | |||
| 结直肠癌 | 44 | 7(15.9) | 16(36.4) | 20(45.5) | |
| 结直肠腺瘤 | 36 | 11(30.6) | 15(41.7) | 6(16.7) | 0.039 |
| 正常组织 | 26 | 10(38.5) | 6(23.1) | 7(26.9) | |
R1和R2表达与结直肠癌的分化程度(P = 0.005)、淋巴结转移情况(P = 0.001)及临床TNM分期(P = 0.001)相关, 与性别、年龄、肿瘤大小、组织学类型无关(P>0.05, 表3). 并分析3种组织中R1和R2表达的关联性无统计学意义(P>0.05).
| 临床病理因素 | n | R1 | χ2值 | P值 | R2 | χ2值 | P值 | ||
| 阳性 | 阴性 | 阳性 | 阴性 | ||||||
| 年龄(岁) | |||||||||
| <60 | 27 | 23 | 4 | 0.033 | 0.085 | 18 | 4 | 0.649 | 0.421 |
| >60 | 24 | 20 | 4 | 26 | 3 | ||||
| 性别 | |||||||||
| 男 | 30 | 25 | 5 | 0.053 | 0.818 | 27 | 3 | 1.781 | 1.182 |
| 女 | 21 | 18 | 3 | 16 | 5 | ||||
| 组织学分型 | |||||||||
| 管状腺癌 | 15 | 13 | 2 | 5.789 | 0.122 | 12 | 3 | 0.457 | 0.928 |
| 乳头状癌 | 13 | 12 | 1 | 11 | 2 | ||||
| 黏液腺癌 | 13 | 12 | 1 | 11 | 2 | ||||
| 印戒细胞癌 | 10 | 6 | 4 | 9 | 1 | ||||
| 分化程度 | |||||||||
| 高分化 | 10 | 4 | 6 | 17.636 | 0.001 | 5 | 5 | 10.429 | 0.005 |
| 中分化 | 13 | 12 | 1 | 12 | 1 | ||||
| 低分化 | 26 | 25 | 1 | 24 | 2 | ||||
| 有无淋巴结转移 | |||||||||
| 有 | 14 | 9 | 5 | 5.853 | 0.016 | 8 | 6 | 10.772 | 0.001 |
| 无 | 37 | 34 | 3 | 35 | 2 | ||||
| 肿瘤大小 | |||||||||
| <5 cm | 22 | 21 | 1 | 3.631 | 0.057 | 18 | 4 | 0.182 | 0.670 |
| >5 cm | 29 | 22 | 7 | 25 | 4 | ||||
| TNM分期 | |||||||||
| Ⅰ期和Ⅱ期 | 33 | 31 | 2 | 10.886 | 0.001 | 32 | 1 | 11.324 | 0.001 |
| Ⅲ期和Ⅳ期 | 18 | 10 | 8 | 11 | 7 | ||||
脂联素作为一种由脂肪细胞特异分泌的内源性生物活性分子, 其受体分为两种结构: AdipoR1和AdipoR2, 分布于许多组织细胞中, 由于脂联素的敏感性不同, 所以不同的脂联素与不同的脂联素受体结合以发挥相应的功能. 这种结合不仅与糖和脂肪的代谢过程相关, 而且与结直肠癌的发生和进展有密切联系. 在既往研究中, Yoneda等[15]应用免疫组织化学的方法、RT-PCR和Western blot检测正常结肠组织和结肠癌组织黏膜中脂联素受体的表达, 发现脂联素受体Rl和R2的表达同时存在于正常结肠上皮细胞和结肠癌细胞中. 同样Williams等[12]用RT-PCR法和免疫组织化学的方法检测收集的40例结直肠癌组织标本和12例癌旁组织标本, 发现脂联素受体在正常组织中的表达显著低于结肠癌组织中的表达. 本实验设计用免疫组化方法检测51例新鲜结直肠癌组织, 42例结直肠腺瘤伴不典型增生组织, 35例癌旁组织中脂联素受体R1和R2的表达, 创新点在于研究结直肠癌癌前病变中脂联素受体的表达, 监测结直肠癌的腺瘤腺癌顺序中脂联素受体的表达并做一连续性分析. 结果发现3种组织中均有不同程度的脂联素受体表达, 其中R1在人结直肠癌组织中表达高于腺瘤组织, 结直肠癌组织中表达高于癌旁组织, 腺瘤组织中的表达高于癌旁组织. R2在人结直肠癌组织中表达高于腺瘤组织, 结直肠癌组织中表达高于癌旁组织, 腺瘤组织中表达高于癌旁组织. 此次研究结果和既往研究结果部分一致, 但在癌前病变中的研究具体更加重要的意义, 脂联素受体在结直肠腺瘤腺癌发展过程中, 表达随组织的不同呈现渐进性的反应增高, 推测此为循环中脂联素水平下降的一种应激表现, 为机体的一种保护机制, 这种保护机制对癌前病变的诊断和癌症早期治疗都有重要的作用. 本实验的缺陷在于没有具体量化脂联素受体的表达水平, 为诊断结直肠癌和结直肠腺瘤提供依据.
通过进一步统计学比较脂联素受体与结直肠癌临床病理参数关系发现, 其与肿瘤分化程度、淋巴结转移、TNM分期相关, 与性别、年龄、肿瘤大小、组织学类型无明显相关. 这一结果与免疫组织化学实验结果相一致, 说明淋巴结转移和肿瘤分化程度决定了肿瘤的TNM分期, 决定了患者的5年生存率. 期别越高, 脂联素受体的表达水平越高. 这种反应性的增高, 有助于刺激机体分泌脂联素, 那么脂联素与脂联素受体结合是怎么对结直肠组织起到保护作用的呢? 生理浓度的脂联素(5-30 µg/mL)与脂联素受体结合后, 可以活化细胞内信号转导通路从而抑制细胞的增殖和促进细胞的凋亡, 包括ERKl/2(extrallular signal regulated protein kinase)、腺苷酸活化激酶(AMPK)和C-jun氨基末端激酶(C-Jun N-terminal kinases, JNK)的磷酸化[12]. ERKI/2是由ras和raf激活的一种丝裂原激活蛋白激酶(MAPK). ERKl/2的磷酸化激活能促进细胞的增殖和细胞的迁移[16]. 由于乳腺癌细胞ERKI/2的磷酸化被脂联素抑制, 从而促进细胞凋亡和抑制细胞增殖[17,18]. 激活的AMPK主要通过增加细胞ATP的消耗和抑制其产生参与细胞代谢, 从而对特异酶和转录调节有直接效应. 结肠HT-29细胞被活化的AMPK诱导凋亡[19]. JNK是MAPK家族成员之一, 能被各种细胞因子激活, 同时也能够磷酸化和激活转录因子C-jun. 在各种生理病理条件下, JNK参与细胞增生和凋亡调控, 同时在肿瘤的发展中也发挥着作用. 最近研究发现在乳腺癌中脂联素阻断JNK的激活, 促进其细胞凋亡[20]. 通过现有的研究发现, 脂联素可以通过脂联素受体活化ERKI/2、AMPK、JNK的磷酸化, 激活下游的信号转导, 参与结直肠癌及其他肥胖相关肿瘤的发生. 另外脂联素还能够抑制新生血管的形成. Man等[21]发现脂联素与其受体结合后能够有效的抑制肿瘤血管生成, 同时下调其下的信号通路. Bråkenhielm等[22]在试验中发现线粒体凋亡反应被脂联素激活后, 导致血管内皮细胞凋亡, 明显抑制了小鸡的绒毛膜尿囊膜和小鼠角膜中新生血管的形成. 同时在动物实验中, 通过给T241有纤维肉瘤的小鼠模型瘤内注射脂联素, 数周后发现肿瘤的体质量、体积明显减少60%. 通过利用乳腺癌细胞MDA-MB-231传染雌性裸鼠从而诱导乳腺癌模型, 在此过程中的前7-14 d, 给予脂联素重组体或腺病毒介导表达的脂联素, 发现肿瘤细胞的数目、大小明显下降[23]. 用裸鼠皮下接种胃癌细胞AZ521, 并且局部注射脂联素可以明显抑制胃癌细胞AZ521的生长. 同样腹腔内注射脂联素可以抑制AZ521细胞的腹腔内转移[24]. 通过现有研究发现在结直肠腺瘤腺癌的发展中, 脂联素通过与受体结合能够有效的抑制新生血管的生成, 在抗肿瘤的治疗中也起到了至关重要的作用.
总之, 脂联素及其受体具有抑制细胞增殖, 促进细胞凋亡及抗血管生成的作用, 可能会成为一种新的有效的抗肿瘤因子. 但是目前抗肿瘤机制还不是完全清楚, 有待进一步的研究. 由于脂联素及其受体在各个肿瘤中的作用, 我们可以大胆想象, 是否可以研究以脂联素为基础的短肽, 通过模仿脂联素及其受体的行为做适当的临床开发应用于癌症治疗, 并且将癌症的治疗提前到癌前病变. 由于其在多种肿瘤发病和治疗中的潜在作用将为癌症的预防与早期诊断提供新的思路, 为临床治疗提供理论基础.
食管异物为临床常见急症之一, 可发生于任何年龄, 患者多有吞咽困难、胸痛、消化道出血等上消化道症状, 食管异物一旦出现需尽早处理, 严重时可出现食管穿孔、食管气管瘘、纵隔感染等并发症. 随着内镜技术的不断进步完善, 内镜下治疗食管异物已经取代外科手术已成为食管异物治疗的首选方案.
蓝宇, 教授, 北京积水潭医院消化科
内镜治疗过程中如何选择合理的器械和操作方式, 为目前食管异物临床研究关注重点, 诸如透明帽等器械对食管异物取出成功率的影响尚无定论, 需进一步研究. 此外, 关于食管异物患者的临床特点等问题, 尚缺少详实的临床资料报道.
目前食管异物内镜下治疗文章报道较多, 而关于食管异物患者自身临床特点的文章较少. 本文结合食管异物治疗等方面进展, 回顾性分析了8年来256名食管异物患者的基本资料、异物性质、治疗措施及疾病转归等, 同时介绍了内镜下食管异物治疗方法.
该文总结分析食管异物患者临床特点, 包括不同年龄段患者异物种类及患者食管基础病的特点, 并介绍内镜治疗方法, 对临床诊疗有一定参考价值.
该文为8余年数据的回顾性总结, 数据较详实, 有代表性, 对临床诊疗有一定参考价值.
编辑: 翟欢欢 电编:鲁亚静
| 1. | Waki H, Yamauchi T, Kamon J, Ito Y, Uchida S, Kita S, Hara K, Hada Y, Vasseur F, Froguel P. Impaired multimerization of human adiponectin mutants associated with diabetes. Molecular structure and multimer formation of adiponectin. J Biol Chem. 2003;278:40352-40363. [PubMed] [DOI] |
| 2. | Xia K, Guo L, Zhao Z, Md Sayed AS, Li F, Yang T. Plasma level of adiponectin in coronary heart disease patients combined with abnormal glucose metabolism. Zhongnan Daxue Xuebao Yixueban. 2012;37:179-184. |
| 3. | Summer R, Walsh K, Medoff BD. Obesity and pulmonary arterial hypertension: Is adiponectin the molecular link between these conditions? Pulm Circ. 2011;1:440-447. [PubMed] [DOI] |
| 4. | Ashwal R, Hemi R, Tirosh A, Gordin R, Yissachar E, Cohen-Dayag A, Rosenberg A, Karasik A, Blüher M, Kanety H. Differential expression of novel adiponectin receptor-1 transcripts in skeletal muscle of subjects with normal glucose tolerance and type 2 diabetes. Diabetes. 2011;60:936-946. [PubMed] [DOI] |
| 5. | Guo C, Ricchiuti V, Lian BQ, Yao TM, Coutinho P, Romero JR, Li J, Williams GH, Adler GK. Mineralocorticoid receptor blockade reverses obesity-related changes in expression of adiponectin, peroxisome proliferator-activated receptor-gamma, and proinflammatory adipokines. Circulation. 2008;117:2253-2261. [PubMed] [DOI] |
| 6. | Ueno H, Koyama H, Shoji T, Monden M, Fukumoto S, Tanaka S, Otsuka Y, Mima Y, Morioka T, Mori K. Receptor for advanced glycation end-products (RAGE) regulation of adiposity and adiponectin is associated with atherogenesis in apoE-deficient mouse. Atherosclerosis. 2010;211:431-436. [PubMed] [DOI] |
| 7. | Yamauchi T, Kamon J, Ito Y, Tsuchida A, Yokomizo T, Kita S, Sugiyama T, Miyagishi M, Hara K, Tsunoda M. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature. 2003;423:762-769. [PubMed] [DOI] |
| 8. | Byeon JS, Jeong JY, Kim MJ, Lee SM, Nam WH, Myung SJ, Kim JG, Yang SK, Kim JH, Suh DJ. Adiponectin and adiponectin receptor in relation to colorectal cancer progression. Int J Cancer. 2010;127:2758-2767. [PubMed] [DOI] |
| 9. | Jeong YJ, Bong JG, Park SH, Choi JH, Oh HK. Expression of leptin, leptin receptor, adiponectin, and adiponectin receptor in ductal carcinoma in situ and invasive breast cancer. J Breast Cancer. 2011;14:96-103. [PubMed] [DOI] |
| 11. | Howard JM, Beddy P, Ennis D, Keogan M, Pidgeon GP, Reynolds JV. Associations between leptin and adiponectin receptor upregulation, visceral obesity and tumour stage in oesophageal and junctional adenocarcinoma. Br J Surg. 2010;97:1020-1027. [PubMed] [DOI] |
| 12. | Williams CJ, Mitsiades N, Sozopoulos E, Hsi A, Wolk A, Nifli AP, Tseleni-Balafouta S, Mantzoros CS. Adiponectin receptor expression is elevated in colorectal carcinomas but not in gastrointestinal stromal tumors. Endocr Relat Cancer. 2008;15:289-299. [PubMed] [DOI] |
| 13. | Beebe-Dimmer JL, Zuhlke KA, Ray AM, Lange EM, Cooney KA. Genetic variation in adiponectin (ADIPOQ) and the type 1 receptor (ADIPOR1), obesity and prostate cancer in African Americans. Prostate Cancer Prostatic Dis. 2010;13:362-368. [PubMed] [DOI] |
| 14. | Chou SH, Tseleni-Balafouta S, Moon HS, Chamberland JP, Liu X, Kavantzas N, Mantzoros CS. Adiponectin receptor expression in human malignant tissues. Horm Cancer. 2010;1:136-145. [PubMed] [DOI] |
| 15. | Yoneda K, Tomimoto A, Endo H, Iida H, Sugiyama M, Takahashi H, Mawatari H, Nozaki Y, Fujita K, Yoneda M. Expression of adiponectin receptors, AdipoR1 and AdipoR2, in normal colon epithelium and colon cancer tissue. Oncol Rep. 2008;20:479-483. [PubMed] |
| 16. | Roberts PJ, Der CJ. Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer. Oncogene. 2007;26:3291-3310. [PubMed] [DOI] |
| 17. | Cong L, Gasser J, Zhao J, Yang B, Li F, Zhao AZ. Human adiponectin inhibits cell growth and induces apoptosis in human endometrial carcinoma cells, HEC-1-A and RL95 2. Endocr Relat Cancer. 2007;14:713-720. [PubMed] [DOI] |
| 18. | Dos Santos E, Benaitreau D, Dieudonne MN, Leneveu MC, Serazin V, Giudicelli Y, Pecquery R. Adiponectin mediates an antiproliferative response in human MDA-MB 231 breast cancer cells. Oncol Rep. 2008;20:971-977. [PubMed] |
| 19. | Kim YM, Hwang JT, Kwak DW, Lee YK, Park OJ. Involvement of AMPK signaling cascade in capsaicin-induced apoptosis of HT-29 colon cancer cells. Ann N Y Acad Sci. 2007;1095:496-503. [PubMed] [DOI] |
| 20. | Grossmann ME, Nkhata KJ, Mizuno NK, Ray A, Cleary MP. Effects of adiponectin on breast cancer cell growth and signaling. Br J Cancer. 2008;98:370-379. [PubMed] [DOI] |
| 21. | Man K, Ng KT, Xu A, Cheng Q, Lo CM, Xiao JW, Sun BS, Lim ZX, Cheung JS, Wu EX. Suppression of liver tumor growth and metastasis by adiponectin in nude mice through inhibition of tumor angiogenesis and downregulation of Rho kinase/IFN-inducible protein 10/matrix metalloproteinase 9 signaling. Clin Cancer Res. 2010;16:967-977. [PubMed] [DOI] |
| 22. | Bråkenhielm E, Veitonmäki N, Cao R, Kihara S, Matsuzawa Y, Zhivotovsky B, Funahashi T, Cao Y. Adiponectin-induced antiangiogenesis and antitumor activity involve caspase-mediated endothelial cell apoptosis. Proc Natl Acad Sci U S A. 2004;101:2476-2481. [PubMed] [DOI] |
| 23. | Wang Y, Lam JB, Lam KS, Liu J, Lam MC, Hoo RL, Wu D, Cooper GJ, Xu A. Adiponectin modulates the glycogen synthase kinase-3beta/beta-catenin signaling pathway and attenuates mammary tumorigenesis of MDA-MB-231 cells in nude mice. Cancer Res. 2006;66:11462-11470. [PubMed] [DOI] |
| 24. | Ishikawa M, Kitayama J, Yamauchi T, Kadowaki T, Maki T, Miyato H, Yamashita H, Nagawa H. Adiponectin inhibits the growth andperitoneal metastasis of gastric cancel"through its specific membrane receptorsAdipoRl and AdipoR2. Cancer Sci. 2007;98:1120-1127. [PubMed] [DOI] |