修回日期: 2012-08-12
接受日期: 2012-09-15
在线出版日期: 2012-10-08
目的: 探讨下丘脑弓状核(arcuate nucleus, ARC)注射Ghrelin对糖尿病胃轻瘫(diabetic gastroparesis, DGP)大鼠胃运动的调控作用.
方法: 240只Wistar大鼠按数字表法随机分为10个大组(每组24只): 对照组(C)、生理盐水组(NS)、Ghrelin低剂量组(L)、Ghrelin高剂量组(H)、高剂量Ghrelin合并D-Lys3-GHRP-6(DLS)组(H+D)、糖尿病胃轻瘫大鼠组(DGP)、生理盐水DGP组(DGP+NS)、Ghrelin低剂量DGP组(DGP+L)、Ghrelin高剂量DGP组(DGP+H)和高剂量Ghrelin合并D-Lys3-GHRP-6 DGP组(DGP+H+D). 采用腹腔注射链脲佐菌素(STZ)制作糖尿病大鼠模型; 荧光免疫组织化学染色方法观察糖尿病大鼠下丘脑ARC中Ghrelin受体(GHS-R)表达变化; 逆转录聚合酶链反应(RT-PCR)和实时荧光定量PCR(real-time PCR)进一步检测GHS-R mRNA在糖尿病大鼠ARC中表达变化; 采用在体胃运动记录方法, 观察下丘脑ARC注射Ghrelin对糖尿病大鼠胃运动的影响.
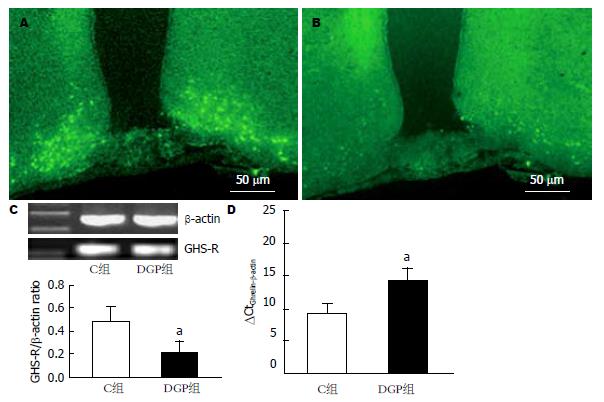
结果: 在DGP大鼠ARC中GHS-R免疫阳性细胞数(10.0/mm2±2.1/mm2)和mRNA相对含量(GHS-R1a/β-actin: 0.48±0.13)与正常大鼠(3.0/mm2±0.7/mm2, 0.21±0.10)比较均显著降低(P<0.05). 正常清醒大鼠胃运动幅度为8.14 g±1.58 g, 频率为5.18/min±0.61/min. 下丘脑ARC微量注射0.05 nmol和0.5 nmol Ghrelin, 胃运动幅度呈量效依赖性增加(L: 14.6 g±2.2 g vs NS: 8.14 g±1.58 g, P<0.05; H: 22.28 g±4.10 g vs NS: 8.14 g±1.58 g, P<0.01, vs L: 14.6 g±2.2 g, P<0.05), 胃收缩频率明显加快(L: 7.45/min±0.87/min vs NS: 5.18/min±0.61/min, P<0.05; H: 10.98/min±1.03/min vs NS: 5.18/min±0.61/min, P<0.01; vs L: 7.45/min±0.87/min, P<0.05). DGP大鼠胃运动幅度明显下降(2.21 g±0.89 g vs 8.14 g±1.58 g, P<0.05), 收缩频率明显降低(1.81/min±0.23/min vs 5.18/min±0.61/min, P<0.05). 下丘脑ARC微量注射0.5 nmol Ghrelin, DGP大鼠胃运动幅度显著增加(5.04 g±1.11 g vs 2.14 g±0.23 g, P<0.05), 收缩频率明显加快(3.81/min±0.43/min vs 1.80/min±0.19/min, P<0.05). GHS-R阻断剂D-Lys3-GHRP-6可完全阻断Ghrelin此作用.
结论: 糖尿病大鼠胃运动障碍可能与下丘脑GHS-R表达减少有关; Ghrelin在ARC参与糖尿病大鼠胃轻瘫的调控, 该作用可能通过GHS-R实现.
引文著录: 侯滕菲, 徐珞. 下丘脑弓状核Ghrelin对糖尿病大鼠胃运动的影响. 世界华人消化杂志 2012; 20(28): 2665-2671
Revised: August 12, 2012
Accepted: September 15, 2012
Published online: October 8, 2012
AIM: To study the effect of Ghrelin microinjected into the hypothalamic arcuatus nucleus (ARC) on gastric motility in rats with diabetic gastroparesis (DGP).
METHODS: Two hundred and forty Wistar rats were randomly divided into 10 groups: control group (C), saline group (NS), low-dose Ghrelin group (L), high-dose Ghrelin group (H), high-dose Ghrelin plus D-Lys6-GHRP-6 (DLS) group (H+D), DGP group (DGP), saline-treated DGP group (DGP+NS), low-dose Ghrelin-treated DGP group (DGP+L), high-dose Ghrelin-treated DGP group (DGP+H), high-dose Ghrelin plus D-Lys6-GHRP-6 (DLS)-treated DGP group (DGP+H+D). A rat diabetic model was established by intraperitoneal injection of streptozotocin (STZ). Fluorescent immunohistochemistry, reverse transcription-polymerase chain reaction (RT-PCR) and real-time quantitative polymerase chain reaction (real-time PCR) were performed to evaluate the protein and mRNA expression of Ghrelin receptor (GHS-R) in the ARC of rats. The effect of Ghrelin injection into ARC on gastric motility was observed.
RESULTS: The number of GHS-R immunoreactive neurons and the relative level of GHS-R mRNA/β-actin in the ARC of normal rats were 10.0/mm2 ± 2.1/mm2 and 0.48 ± 0.13, while in DGP rats the values decreased to 3.0/mm2 ± 0.7/mm2 and 0.21 ± 0.10 (both P < 0.05). Microinjection of 0.05 or 0.5 nmol Ghrelin into the ARC could increase the amplitude of gastric motility in a dose-dependent manner (L: 14.6 g ± 2.2 g vs NS: 8.14 g ± 1.58 g, P < 0.05; H: 22.28 g ± 4.10 g vs NS: 8.14 g ± 1.58 g, P < 0.01; NS: 8.14 g ± 1.58 g vs L: 14.6 g ± 2.2 g, P < 0.05), and the frequency of gastric motility was also increased significantly (L: 7.45/min ± 0.87/min vs NS: 5.18/min ± 0.61/min, P < 0.05; H: 10.98/min ± 1.03/min vs NS: 5.18/min ± 0.61/min, P < 0.01; H: 10.98/min ± 1.03/min vs L: 7.45/min ± 0.87/min, P < 0.05). In DGP rats, gastric motility decreased with an enhanced amplitude (2.21 g ± 0.89 g vs 8.14 g ± 1.58 g, P < 0.05) and an increased frequency (1.81/min ± 0.2/min vs 5.18/min ± 0.61/min, P < 0.05). The administration of 0.5 mmol Ghrelin into the ARC could increase gastric motility in DGP rats (amplitude: DGP + H: 5.04 g ± 1.11 g vs DGP + NS: 2.14 g ± 0.23 g or DGP + L: 3.58 g ± 1.11 g, P < 0.05; frequency: DGP + H: 3.81/min ± 0.43/min vs DGP + NS: 1.8/min ± 0.19/min or DGP + L: 2.3/min ± 0.29/min, P < 0.05). The GHS-R antagonist, D-Lys3-GHRP-6, could totally block the effects of Ghrelin.
CONCLUSION: Gastric motility disorder in diabetic rats is partly caused by decreased expression of GHS-R in the hypothalamus. Ghrelin could regulate the genesis of DGP through the GHS-R in the ARC.
- Citation: Hou TF, Xu L. Ghrelin microinjected into the hypothalamic arcuatus nucleus regulates gastric motility in a diabetic rat model. Shijie Huaren Xiaohua Zazhi 2012; 20(28): 2665-2671
- URL: https://www.wjgnet.com/1009-3079/full/v20/i28/2665.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i28.2665
Ghrelin是1999年由日本科学家Kojima等[1]在小鼠和人体的胃内分泌细胞和下丘脑弓状核中发现的一种由28个氨基酸组成的脑肠肽, 这是第一个被发现的生长激素促分泌素受体(growth-hormone secretagogues, GHSs-R)的内源性配体, 其主要分布于胃内分泌细胞、下丘脑、腺垂体、脑干以及心脏等外周组织. 在鼠脑, GHS-R主要位于腺垂体及下丘脑多个核团, 如室旁核(paraventricular nucleus, PVN)、弓状核等[2]. Ghrelin生物学作用十分广泛, 可调节生长激素(growth hormone, GH)、催乳素、肾上腺素等多种激素的释放[3,4], 参与摄食和能量代谢活动[5], 刺激胃动力和胃酸分泌等[6]. 新近研究发现, Ghrelin与胃肠道运动关系密切, 可加速小肠转运, 改善术后肠梗阻, 促进消化间期小肠移行性复合肌电活动(migrating myoelectric complex, MMC)[7,8]. 1958年Kassander[9]将以胃平滑肌收缩力减低、胃排空延迟为特点的糖尿病患者并发的胃动力障碍命名为糖尿病性胃轻瘫(diabetic gastroparesis, DGP). DGP发病机制尚未阐明, 通常伴有胃电起搏功能异常及胃部平滑肌细胞的形态学异常[10]. Pöykkö等[11]发现2型糖尿病患者血浆Ghrelin水平明显低于正常人, 提示Ghrelin可能参与DGP的发病. 中枢神经系统内注射Ghrelin可增加胃肠道运动, 减少胃排空时间, 激发胃部出现空腹样收缩[12,13]. Qiu等[14,15]进一步研究发现, 在体外Ghrelin促进DGP大鼠胃肌条的收缩能力. 目前国内外尚未见中枢注射Ghrelin对DGP大鼠胃运动的研究, 本研究通过荧光免疫组织化学、RT-PCR、real-time PCR等技术, 观察DGP大鼠模型下丘脑GHS-R蛋白和mRNA表达变化以及记录下丘脑ARC注射Ghrelin对DGP大鼠模型胃运动幅度和频率的影响, 探讨Ghrelin在DGP大鼠发病中的作用机制, 为临床治疗提供理论依据.
兔抗Ghrelin多克隆抗体(美国Chemicon公司); FITC交联的羊抗兔IgG(美国Jackson Immunoresearch公司); 激光共聚焦显微镜(日本Biorad公司); 硫酸仲丁巴比妥(美国Sigma公司); 链脲佐菌素(STZ)(美国sigma-aldrich company)Ghrelin(美国American Peptide Company, INc); Ghrelin受体拮抗剂D-Lys3-GHRP-6(美国Anaspec公司); RNeasy Micro Kit(美国QIAGEN公司, Cat. No. 74004); 逆转录试剂盒(美国MBI公司); RM6240BD型多道生理信号采集处理系统(成都仪器厂); 引物由上海生工合成, GHS-R序列如下: forward 5'-GAGATCGCTCAGATCAGCCAGTAC-3' and reverse 5'-TAATCCCCAAACTGAGGTTCTGC-3', GenBank accession No. AB001982[16]; β-actin序列如下: forward 5'-AACGGTCTCACGTCAGTGTA-3' and reverse 5'-GTATCCACGGCATAGATGGT-3', GenBank accession No. NM_031144.
1.2.1 造模及分组: 健康♂9周龄Wistar大鼠252只购自青岛市药品检验所, 体质量200-300 g, 置于室温25 ℃左右, 12/12 h昼夜循环光照条件下生活, 自由饮水. 所有动物实验均符合《青岛大学实验动物保护和使用管理办法》. 参照Gangula等[17]实验模型的方法制作糖尿病病理模型. 造模前先更换笼具, 禁食(不禁水)12 h; 造模组动物(202只大鼠)腹腔注射新鲜配制1%STZ液, 注射剂量为55 mg/kg, 第8天再行第2次腹腔注射同等剂量1%STZ液, 正常组大鼠相应腹腔注射0.1 mol/L柠檬酸缓冲液, 注射剂量为1 mL/只. 正常组大鼠相应腹腔注射0.1 mol/L柠檬酸缓冲液, 注射剂量为1 mL/只. 第2次STZ注射后6 wk各组大鼠尾尖采血测空腹血糖(fasting blood glucose, FBG), 同时观察大鼠每日摄食量和症状, 选取符合DGP模型标准, 即FBG>16.7 mmol/L同时伴有腹部胀大、体质量减轻等胃轻瘫症状的大鼠[18]. 61.4%的大鼠在第2次注射链脲佐菌素后6 wk左右出现了胃轻瘫的症状, 本研究随机选取其中120只. 将符合模型要求的实验动物按数字表法随机分为10个大组(每组24只): 对照组(C)、生理盐水组(NS)、Ghrelin低剂量组(0.05 nmol)(L)、Ghrelin高剂量组(0.5 nmol)(H)、高剂量Ghrelin合并D-Lys3-GHRP-6(DLS)组(H+D)、糖尿病胃轻瘫大鼠组(DGP)、生理盐水DGP组(DGP+NS)、Ghrelin低剂量DGP组(DGP+L)、Ghrelin高剂量DGP组(DGP+H)和高剂量Ghrelin合并D-Lys3-GHRP-6 DGP组(DGP+H+D).
1.2.2 荧光免疫组织化学染色: 大鼠灌注固定, 取脑组织, 行冰冻切片(20 µm). 组织切片经4%正常羊血清/0.5%Triton X-100/PBS孵育2 h, 与兔抗Ghrelin(1:300稀释)抗体孵育, 4 ℃过夜. 加入异硫氰酸荧光素(fluorescein isothiocyanate, FITC)交联的羊抗兔IgG(1:50稀释), 置于黑暗湿盒内孵育2 h(避光), 切片经0.01 mol/L PBS冲洗, 甘油/PBS封片剂封片, 激光共聚焦显微镜下观察免疫阳性细胞. 以正常羊血清代替一抗为阴性对照, 其他步骤同前.
1.2.3 总RNA的提取: 新鲜大鼠脑部冰冻切片, 参照Paxion-Watson大鼠脑图谱, 选取下丘脑ARC明显的切片, 显微镜下取ARC核团组织, 用RNeasy Micro Kit提取总RNA, Eppendorf紫外线分光光度计测定RNA浓度和纯度.
1.2.4 RT-PCR和real-time PCR法: 取总RNA 3 µL(1 µg/µL), 以Oligo dT为引物, 按逆转录试剂盒说明书进行逆转录反应得到ss-cDNA. 以ss-cDNA为模板, 加入TaqDNA聚合酶和GHS-R1a特异性引物, β-actin作为内参, 常规PCR进行扩增. PCR产物经1.4%琼脂糖凝胶电泳, Image Tool软件(University of Texas at San Antonio)分析结果.
real-time PCR以ss-cDNA作为待测样本, 用GHS-R1a和β-actin引物扩增, 扩增反应用SYBR GreenⅠ定量PCR试剂盒和5700型定量PCR仪完成. 扩增条件: 95 ℃ 1 min; 95 ℃ 30 s, 54 ℃ 15 s, 72 ℃ 15 s(40个循环). 随之观察该PCR产物的熔解曲线(94 ℃ 0 s, 55 ℃ 15 s, 94 ℃ 0 s; 温度变化速度为0.1 ℃/s), 并由电脑自动分析系统进行定量分析. 以不含SS-cDNA模板的PCR反应体系设为阴性对照.
1.2.5 下丘脑ARC埋置套管: 术前动物禁食15-20 h, 80 g/L水合氯醛(30 mg/kg)腹腔注射麻醉. 用牙科钻在颅骨表面钻孔, 清除脑膜, 参照Paxion-Watson大鼠脑图谱, 将自制不锈钢套管置入右侧ARC(AP: 2.12-4.30 mm, LR: 0.2-0.5 mm, H: 9.80-10.30 mm), 牙托粉固定. 将一小螺丝钉固定于颅骨表面, 用502胶和自凝牙托粉固定套管, 并置入不锈钢内芯防止阻塞. 实验结束后, 用微量注射器经套管注射1 µL滂胺天蓝, 灌注固定, 快速断头取脑, 同一固定液浸泡24 h, 作50 µm系列冠状切片, 对照图谱观察微量注射套管尖端的定位, 位置不正确者弃去.
1.2.6 核团内微量注射: 微量注射器吸取待注射药物轻插入套管, 其尖端伸出2 mm进入核团, 3 min内缓慢注射完毕, 留针3 min.
1.2.7 应力传感器(应变片)植入术: 术前动物禁食15-20 h, 硫酸仲丁巴比妥腹腔注射麻醉(100-150 mg/kg). 距幽门十二指肠连接0.5 cm处, 将记录胃平滑肌收缩运动的应力传感器缝贴于胃窦浆膜面, 导线经皮下隧道引至颈后, 穿出体外[19]. 术后2 d待动物恢复正常饮食, 无任何疼痛和应激反应, 即可进行实验.
1.2.8 记录胃运动: 动物禁食15-20 h, 自由饮水. 实验时, 将大鼠置于特制鼠笼内适应环境1 h. 用RM-46胃运动记录仪连续描记胃运动曲线. 以注射前测定胃运动幅度或频率值为正常值, 注射后不同时间点测定胃运动幅度和频率的效应值, 据此换算成不同时间点的变化率. 变化率 = (效应值-正常值)/正常值×100%. 计算出处理后2、7、12、17、22和27 min等不同时间点胃运动频率和波幅的变化率.
统计学处理 数据用mean±SD表示, 用SPSS16.0统计软件进行分析. 用ANOVA法比较各组数据, 两组均数比较采用两独立样本t检验. 以P<0.05为差别有显著性统计学意义.
荧光免疫组织化学研究显示, 在正常和DGP大鼠下丘脑ARC中均有GHS-R1a免疫阳性细胞的表达, 但DGP大鼠ARC GHS-R1a表达明显降低(10.0/mm2±2.1/mm2vs 3.0/mm2±0.7/mm2, n = 5; P<0.05; 图1A和B). RT-PCR研究结果显示, 在预期的217 bp处有一明显cDNA条带, 即下丘脑ARC有GHS-R1a mRNA的表达, 且DGP大鼠GHS-R1a mRNA表达量与正常对照组比较明显降低(GHS-R1a/β-actin: 0.48±0.13 vs 0.21±0.10, n = 5; P<0.05, 图1C). real-time PCR研究结果进一步显示, 与C组大鼠相比DGP组大鼠下丘脑ARC中GHS-R1a mRNA表达明显减少(P<0.05, 图1D), 表现为达到循环阈值的循环次数明显增加(△CtGhrelin-GAPDH: 9.22±1.45 vs 14.11±2.09).
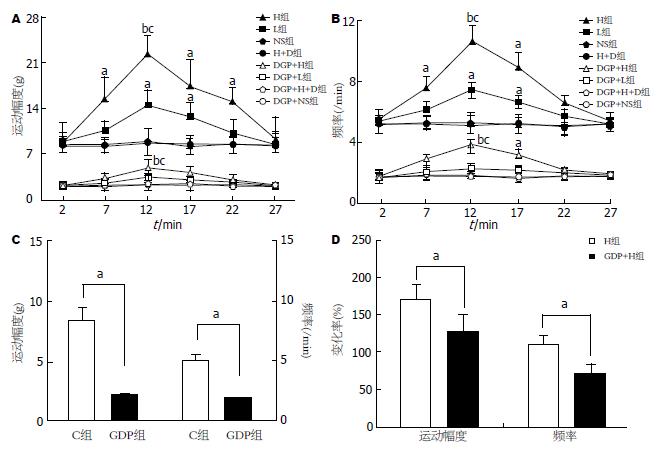
正常清醒大鼠胃运动幅度为8.14 g±1.58 g, 频率为5.18/min±0.61/min. 而糖尿病大鼠与正常大鼠相比, 胃运动明显下降(P<0.05, 图2C, 图3D), 表现为运动幅度显著降低(2.21 g±0.89 g), 运动频率显著减慢(1.81/min±0.23/min).
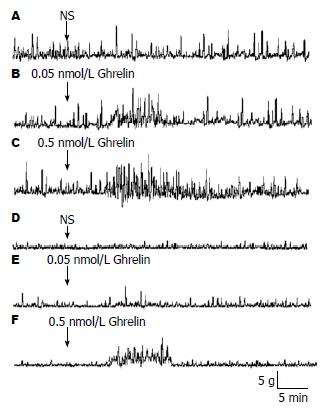
正常大鼠下丘脑ARC分别微量注射不同剂量Ghrelin(0.05 nmol, 0.5 nmol), 胃运动幅度在注射后7 min已有增加, 12 min时变化最为明显, 且增加幅度呈显著量效依赖关系(L: 14.6 g±2.2 g vs NS: 8.14 g±1.58 g, P<0.05; H: 22.28 g±4.10 g vs NS: 8.14 g±1.58 g, P<0.01, vs L: 14.6 g±2.2 g, P<0.05, 图2A和图3A-C); 其胃运动幅度变化率分别为78.00%±15.07%和171.71%±18.40%(图2D). ARC分别注射0.05 nmol和0.5 nmol Ghrelin后, 胃运动频率也明显加快(L: 7.45/min±0.87/min vs NS: 5.18/min±0.61/min, P<0.05; H: 10.98/min±1.03/min vs NS: 5.18/min±0.61/min, P<0.01; vs L: 7.45/min±0.87/min, P<0.05, 图2B).
DGP大鼠下丘脑ARC微量注射0.05 nmol Ghrelin, 胃运动幅度(3.58 g±1.11 g)和频率(2.30/min±0.29/min)有轻度增加趋势, 但与DGP+NS组(2.14 g±0.23 g, 1.80/min±0.19/min)相比无统计学意义(P>0.05); 而注射0.5 nmol Ghrelin, 大鼠胃运动显著增强(图2A和图3F), 表现为运动幅度明显增加(DGP+H: 5.04 g±1.11 g vs DGP+NS: 2.14 g±0.23 g和DGP+L: 3.58 g±1.11 g, P<0.05, 图2A), 运动频率明显加快(DGP+H: 3.81/min±0.43/min vs DGP+NS: 1.80/min±0.19/min和DGP+L: 2.30/min±0.29/min, P<0.05, 图2B), 注射后12 min时最大变化率分别为129.09%±22.02%和73.18%±11.29%(P<0.05, 图2D).
本实验发现正常大鼠下丘脑ARC内有GHS-R免疫阳性神经元的表达, 而DGP大鼠ARC GHS-R免疫阳性神经元的表达明显减少; ARC微量注射Ghrelin均可使正常和DGP大鼠胃运动增强, 但在DGP大鼠, 该效应较正常大鼠明显减弱.
ARC是下丘脑基底部的一个重要核团, 有着十分广泛的传入和传出联系, 从弓状核发出的纤维可到达蓝斑、中缝大核、迷走神经背核等部位, 传入弓状核的纤维可来自中缝核、蓝斑、弧束核等部位, 这些核团均参与摄食、胃肠道运动等与能量代谢有关的功能调节. 另外, ARC内神经元可表达多种蛋白, 包括与能量代谢相关的galanin-like peptide(GALP)、NPY和可卡因-安非他明调节转录肽(cocaine-andamphetamine- regulatedtranscript, CART)等蛋白[20,21]. 因此, 下丘脑是调节消化功能的重要中枢, 其在胃肠道运动调节中具有重要地位和作用.
2001年Shuto等[22]在大鼠ARC中发现Ghrelin受体GHS-R的存在, 并在2002年通过反义寡核苷酸抑制GHS-R 1a基因, 达到控制摄食和降低脂肪的效果[23]. 本实验结果也显示, 正常大鼠ARC中存在GHS-R免疫阳性细胞和mRNA表达, 且进一步发现, 在DGP大鼠ARC中, GHS-R免疫阳性细胞明显减少, mRNA表达明显降低. 这说明发生DGP时, 不仅血浆中Ghrelin水平下降[24,25], 中枢神经系统中Ghrelin受体的表达也减少, 从而产生明显的胃肠动力减弱.
已有研究发现, 静脉注射Ghrelin可促进胃肠运动以缓解症状[24,25]; 脑室内注射Ghrelin可促进摄食和增加体质量[26]. 本实验中发现, 正常大鼠下丘脑ARC中微量注射Ghrelin, 胃运动幅度和运动频率均呈剂量依赖性增强, 这表明ARC内Ghrelin对胃运动具有兴奋性作用. Gherlin的受体是一种G蛋白耦联受体, 分为Ⅰa和Ⅰb两型. 在大鼠脑内, GHS-R1a除了腺垂体, 主要分布在下丘脑的多个核团, ARC是GHS-R1a mRNA表达最多的核团之一, 而GHS-R1b在脑内的分布远较GHS-R1a局限[27]. 一般来说, GHS-R1a主要与Ghrelin结合传递信息, 而GHS-R1b主要作用是调控GHS-R1a与Ghrelin的结合能力[28]. 因此推测, ARC内注射Ghrelin对胃运动的调控作用, 主要是通过作用于ARC内神经元上GHS-R1a而实现的. 进一步将GHS-R1a阻断剂DLS与Ghrelin共同注射入ARC内, Ghrelin增强胃运动的作用消失. 体外实验也证实, Ghrelin可激活ARC神经元, 其可增加生长激素释放素神经元内的钙离子浓度[29]. Kohno等[30]发现, Ghrelin可通过腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)通路增强ARC中NPY神经元内钙离子浓度. 因此我们推测, ARC中注射Ghrelin促进胃运动的机制之一可能为Ghrelin与受体GHS-R1a结合后激活多条信号通路, 引起神经和体液通路的信号变化, 最终实现胃运动增强.
本研究发现, DGP大鼠胃运动幅度和频率明显减弱, 且ARC中注射Ghrelin后12 min时胃运动幅度和频率变化率也显著低于正常对照组. 推测该作用一方面可能是因为ARC中Ghrelin受体GHS-R表达量减少, 导致结合Ghrelin量下降; 另一方面, 根据Maejima等[31]实验结果推测, 胰岛素抑制Ghrelin活化的NPY神经元内钙离子信号, 糖尿病时Ghrelin与受体结合后可能激活钙离子信号能力下降, 而导致Ghrelin作用效果降低.
总之, 大鼠ARC中有GSH-R表达, 且发生DGP时GSH-R表达明显减少. 在DGP大鼠胃运动减弱, ARC注射Ghrelin可明显增加DGP大鼠胃运动, 但该作用明显低于对正常大鼠的效应.
糖尿病是最常见的内分泌代谢疾病, 已成为严重危害人类健康的主要疾病之一. 糖尿病胃轻瘫是其并发症之一, 目前机制尚不明确, 推测与自主神经病变、糖代谢和内分泌功能紊乱和微循环障碍有关. Ghrelin作为体内主要脑肠肽之一, 具有刺激胃动力和胃酸分泌等作用.
许文燮, 教授, 博士生导师, 上海交通大学基础医学院
近年来的很多研究证实, 糖尿病患者血浆Ghrelin水平明显低于正常人, 提示Ghrelin可能参与糖尿病胃轻瘫的发病; Ghrelin具有促进摄食和胃肠运动的功能, 且中枢神经系统注射Ghrelin显著增加胃肠运动, 因此展现出良好前景和临床应用价值.
Ghrelin通过外周组织和中枢神经系统中受体GHS-R发挥调节胃肠运动和其他激素的作用; 糖尿病性胃轻瘫症状以胃平滑肌收缩力减低、胃排空延迟为特点, 通常伴有胃电起搏功能异常及胃部平滑肌细胞的形态学异常, 2型糖尿病患者血浆Ghrelin水平明显低于正常人.
本文主要创新点为研究DGP大鼠模型, 通过荧光免疫组织化学、RT-PCR技术, 观察下丘脑GHS-R蛋白和mRNA表达变化观察以及记录下丘脑ARC注射Ghrelin对DGP大鼠模型胃运动幅度和频率的影响, 发现DGP大鼠ARC中GHS-R减少, Ghrelin作用减弱.
本研究提示Ghrelin及其受体GHSR在DGP大鼠发病中的作用机制, 为临床治疗和预防糖尿病性胃轻瘫提供新的药物靶点, 扩展了临床上糖尿病胃轻瘫的治疗途径.
本文研究糖尿病大鼠下丘脑弓状核中GHS-R表达变化, 并进一步中枢微量注射Ghrelin刺激胃肠运动, 具有一定的临床研究意义.
编辑: 李军亮 电编:鲁亚静
| 1. | Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999;402:656-660. [PubMed] [DOI] |
| 2. | Hou Z, Miao Y, Gao L, Pan H, Zhu S. Ghrelin-containing neuron in cerebral cortex and hypothalamus linked with the DVC of brainstem in rat. Regul Pept. 2006;134:126-131. [PubMed] [DOI] |
| 3. | Nagaya N, Kojima M, Uematsu M, Yamagishi M, Hosoda H, Oya H, Hayashi Y, Kangawa K. Hemodynamic and hormonal effects of human ghrelin in healthy volunteers. Am J Physiol Regul Integr Comp Physiol. 2001;280:R1483-R1487. [PubMed] |
| 4. | Riley LG, Hirano T, Grau EG. Rat ghrelin stimulates growth hormone and prolactin release in the tilapia, Oreochromis mossambicus. Zoolog Sci. 2002;19:797-800. [PubMed] [DOI] |
| 5. | Kang KS, Yahashi S, Matsuda K. Central and peripheral effects of ghrelin on energy balance, food intake and lipid metabolism in teleost fish. Peptides. 2011;32:2242-2247. [PubMed] |
| 6. | Yakabi K, Kawashima J, Kato S. Ghrelin and gastric acid secretion. World J Gastroenterol. 2008;14:6334-6338. [PubMed] [DOI] |
| 7. | Edholm T, Levin F, Hellström PM, Schmidt PT. Ghrelin stimulates motility in the small intestine of rats through intrinsic cholinergic neurons. Regul Pept. 2004;121:25-30. [PubMed] [DOI] |
| 8. | Trudel L, Tomasetto C, Rio MC, Bouin M, Plourde V, Eberling P, Poitras P. Ghrelin/motilin-related peptide is a potent prokinetic to reverse gastric postoperative ileus in rat. Am J Physiol Gastrointest Liver Physiol. 2002;282:G948-G952. [PubMed] |
| 9. | Kassander P. Asymptomatic gastric retention in diabetics (gastroparesis diabeticorum). Ann Intern Med. 1958;48:797-812. [PubMed] |
| 10. | Ali T, Hasan M, Hamadani M, Harty RF. Gastroparesis. South Med J. 2007;100:281-286. [PubMed] [DOI] |
| 11. | Pöykkö SM, Kellokoski E, Hörkkö S, Kauma H, Kesäniemi YA, Ukkola O. Low plasma ghrelin is associated with insulin resistance, hypertension, and the prevalence of type 2 diabetes. Diabetes. 2003;52:2546-2553. [PubMed] [DOI] |
| 12. | Tebbe JJ, Tebbe CG, Mronga S, Ritter M, Schäfer MK. Central neuropeptide Y receptors are involved in 3rd ventricular ghrelin induced alteration of colonic transit time in conscious fed rats. BMC Gastroenterol. 2005;5:5. [PubMed] [DOI] |
| 13. | Asakawa A, Ataka K, Fujino K, Chen CY, Kato I, Fujimiya M, Inui A. Ghrelin family of peptides and gut motility. J Gastroenterol Hepatol. 2011;26 Suppl 3:73-74. [PubMed] [DOI] |
| 14. | Qiu WC, Wang ZG, Wang WG, Yan J, Zheng Q. Gastric motor effects of ghrelin and growth hormone releasing peptide 6 in diabetic mice with gastroparesis. World J Gastroenterol. 2008;14:1419-1424. [PubMed] [DOI] |
| 15. | Qiu WC, Wang ZG, Wang WG, Yan J, Zheng Q. Therapeutic effects of ghrelin and growth hormone releasing peptide 6 on gastroparesis in streptozotocin-induced diabetic guinea pigs in vivo and in vitro. Chin Med J (Engl). 2008;121:1183-1188. [PubMed] |
| 16. | Nakahara K, Hayashida T, Nakazato M, Kojima M, Hosoda H, Kangawa K, Murakami N. Effect of chronic treatments with ghrelin on milk secretion in lactating rats. Biochem Biophys Res Commun. 2003;303:751-755. [PubMed] [DOI] |
| 17. | Gangula PR, Mukhopadhyay S, Pasricha PJ, Ravella K. Sepiapterin reverses the changes in gastric nNOS dimerization and function in diabetic gastroparesis. Neurogastroenterol Motil. 2010;22:1325-1331, 1325-1331. [PubMed] |
| 18. | Showkat Ali M, Tiscareno-Grejada I, Locovei S, Smiley R, Collins T, Sarosiek J, McCallum R. Gender and Estradiol as Major Factors in the Expression and Dimerization of nNOSα in Rats with Experimental Diabetic Gastroparesis. Dig Dis Sci. 2012; Jun 10. [Epub ahead of print]. [PubMed] [DOI] |
| 19. | Guan Y, Tang M, Jiang Z, Peeters TL. Excitatory effects of motilin in the hippocampus on gastric motility in rats. Brain Res. 2003;984:33-41. [PubMed] [DOI] |
| 20. | Lawrence C, Fraley GS. Galanin-like peptide (GALP) is a hypothalamic regulator of energy homeostasis and reproduction. Front Neuroendocrinol. 2011;32:1-9. [PubMed] [DOI] |
| 21. | Simpson KA, Martin NM, Bloom SR. Hypothalamic regulation of food intake and clinical therapeutic applications. Arq Bras Endocrinol Metabol. 2009;53:120-128. [PubMed] [DOI] |
| 22. | Shuto Y, Shibasaki T, Wada K, Parhar I, Kamegai J, Sugihara H, Oikawa S, Wakabayashi I. Generation of polyclonal antiserum against the growth hormone secretagogue receptor (GHS-R): evidence that the GHS-R exists in the hypothalamus, pituitary and stomach of rats. Life Sci. 2001;68:991-996. [PubMed] [DOI] |
| 23. | Shuto Y, Shibasaki T, Otagiri A, Kuriyama H, Ohata H, Tamura H, Kamegai J, Sugihara H, Oikawa S, Wakabayashi I. Hypothalamic growth hormone secretagogue receptor regulates growth hormone secretion, feeding, and adiposity. J Clin Invest. 2002;109:1429-1436. [PubMed] |
| 24. | Chen CY, Fujimiya M, Laviano A, Chang FY, Lin HC, Lee SD. Modulation of ingestive behavior and gastrointestinal motility by ghrelin in diabetic animals and humans. J Chin Med Assoc. 2010;73:225-229. [PubMed] [DOI] |
| 25. | Murray CD, Martin NM, Patterson M, Taylor SA, Ghatei MA, Kamm MA, Johnston C, Bloom SR, Emmanuel AV. Ghrelin enhances gastric emptying in diabetic gastroparesis: a double blind, placebo controlled, crossover study. Gut. 2005;54:1693-1698. [PubMed] [DOI] |
| 26. | Faulconbridge LF, Cummings DE, Kaplan JM, Grill HJ. Hyperphagic effects of brainstem ghrelin administration. Diabetes. 2003;52:2260-2265. [PubMed] [DOI] |
| 27. | Guan XM, Yu H, Palyha OC, McKee KK, Feighner SD, Sirinathsinghji DJ, Smith RG, Van der Ploeg LH, Howard AD. Distribution of mRNA encoding the growth hormone secretagogue receptor in brain and peripheral tissues. Brain Res Mol Brain Res. 1997;48:23-29. [PubMed] [DOI] |
| 28. | Laviano A, Molfino A, Rianda S, Fanelli FR. The Growth Hormone Secretagogue Receptor (GHS-R). Curr Pharm Des. 2012; May 23. [Epub ahead of print]. [PubMed] [DOI] |
| 29. | Mori K, Kim J, Sasaki K. Electrophysiological effect of ghrelin and somatostatin on rat hypothalamic arcuate neurons in vitro. Peptides. 2010;31:1139-1145. [PubMed] [DOI] |
| 30. | Kohno D, Sone H, Minokoshi Y, Yada T. Ghrelin raises [Ca2+]i via AMPK in hypothalamic arcuate nucleus NPY neurons. Biochem Biophys Res Commun. 2008;366:388-392. [PubMed] [DOI] |
| 31. | Maejima Y, Kohno D, Iwasaki Y, Yada T. Insulin suppresses ghrelin-induced calcium signaling in neuropeptide Y neurons of the hypothalamic arcuate nucleus. Aging (Albany NY). 2011;3:1092-1097. [PubMed] |