修回日期: 2012-08-21
接受日期: 2012-09-03
在线出版日期: 2012-09-28
目的: 探讨脐带间充质干细胞(umbilical cord mesenchymal stem cells, UCMSCs)与胰岛细胞联合移植对胰岛活性与功能促进作用.
方法: 50只链脲佐菌素(streptozotocin, STZ)诱导的SD大鼠随机分为4组移植于肾包膜下, (1)500个胰岛移植组; (2)1×106个UCMSCs与500个胰岛细胞联合移植组; (3)1×106个UCMSCs组; (4)假手术(空白)对照组, 仅于肾包膜下注入0.3 mL生理盐水; 术后测血糖水平、葡萄糖耐量试验(glucose tolerance test, GTT)、血清胰岛素水平以及达正常血糖水平率(以血糖浓度≤11.1 mmol/L标准为正常)至28 d.
结果: 联合移植组术后血糖水平最低, 血清胰岛素水平更高, 达正常血糖浓度率优于其他3组, 在术后14 d GTT较其他3组好, 血清胰岛素水平较其他3组好, 血糖水平、血清胰岛素水平、GTT水平UCMSCs组与对照组间均无统计学差异, 单纯UCMSCs组无1例动物血糖水平达正常.
结论: 间充质干细胞与胰岛联合移植能有效提高胰岛细胞活性与功能.
引文著录: 周燕娜, 朱从元, 李建平. 脐带间充质干细胞联合移植对胰岛活性与功能的影响. 世界华人消化杂志 2012; 20(27): 2601-2607
Revised: August 21, 2012
Accepted: September 3, 2012
Published online: September 28, 2012
AIM: To examine the effect of co-transplantation of islets and umbilical cord mesenchymal stem cells (UCMSCs) on graft activity and function in rats.
METHODS: Streptozotocin-induced diabetic Sprague-Dawley (SD) rats were divided into four groups, with (1) 500 islets, (2) 1 to 5×106 UCMSCs, (3) 500 islets and 1 to 5×106 UCMSCs; and (4) normal saline transplanted under the kidney capsule, respectively. All rats were evaluated for blood glucose, serum insulin, glucose tolerance, and the rate of normoglycaemia (blood glucose ≤ 11.1 mmol/L) up to postoperative day 28.
RESULTS: Blood glucose was lowest and serum insulin was highest in the islet+UCMSCs group relative to the islet only group (both P < 0.05). The rate of normoglycaemia was better in the co-transplantation group than in the islet only group (P < 0.05). However, there were no differences in the parameters detected between the sham operation group and UCMSCs alone group, and no normoglycemic rats were found in the UCMSCs alone group.
CONCLUSION: Co-transplantation of umbilical cord mesenchymal stem cells with islets is associated with enhanced islet graft activity and function.
- Citation: Zhou YN, Zhu CY, Li JP. Co-transplantation of islets and umbilical cord mesenchymal stem cells improves graft activity and function in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(27): 2601-2607
- URL: https://www.wjgnet.com/1009-3079/full/v20/i27/2601.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i27.2601
自2000年Shapiro等[1]报道7例1型糖尿病(type 1 diabetes mellitus, T1DM)患者通过胰岛移植治疗获得成功以来, 胰岛移植以其手术风险小, 移植成功后可暂时脱离外源性胰岛素, 且能时时控制血糖, 迅速成为T1DM的研治热点[2]. 但由于移植后营养因子缺乏以及炎症介导的免疫反应, 导致胰岛细胞存活率低下, 使得移植后3-5年内仍需注射小剂量的胰岛素, 很大程度上影响其进一步应用[3-5]. 间充质干细胞(mesenchymal stem cells, MSC)是一类具有多种分化潜能的祖细胞, 其与胰岛细胞联合, 分泌多种因子发挥营养活化功能和免疫调控作用, 促进胰岛活性和功能[6-9], 因而成为研治T1DM的新突破口. 体外研究表明, MSC与胰岛细胞共培养, 能分泌诸如血管内皮生长因子A(vascular endothelial growth factor-A, VEGF-A)、肝细胞生长因子(hepatocyte growth factor, HGF)等多种营养因子促进胰岛细胞活性和功能[6,7], 还能通过释放可溶性因子或免疫抑制因子来直接或间接调控T细胞相关受体或配体, 达到抑制T细胞的活化与增殖[8], 另外还能通过调控调节性T细胞(regulatory T cells, Tregs)来发挥免疫调控作用[9]. 其中脐带间充质细胞(umbilical cord mesenchymal stem cells, UCMSCs)因其分离培养易取、低免疫原性、低移植物抗宿主病(graft-versus-host disease, GVHD)以及能有效避免伦理争议而备受亲睐[10,11]. 本实验以成年♂SD大鼠为研究对象, 通过UCMSCs与胰岛联合移植, 重点研究体内联合移植效果.
成年近交封闭群SD大鼠(清洁级), ♂, 体质量200-250 g, 由扬州大学比较医学中心提供, 动物合格证号SCXK(苏)2007-0001; 所有动物实验经过当地伦理委员会批准, 对动物的处置方法符合动物伦理学要求. 胰蛋白酶抑制剂、胶原酶V、Histopaque-1077、DTZ和锥虫蓝(美国Sigma公司), HBSS和RPMI-1640(美国Gibco公司), Tryple消化酶(美国Invitrogen公司), ELISA试剂盒(武汉博士德生物工程有限公司), 成人间质干细胞成软骨诱导分化完全培养基(广州赛业生物科技有限公司), 茜素红染液(上海杰美基因医药科技有限公司), 油红O染液(上海杰美基因医药科技有限公司), Alcian Blue Solution染液(广州赛业生物科技有限公司), HERA cell 240i CO2培养箱(美国Thermo scientific公司), TT CASY细胞分析仪(德国INNOVATIS AG公司), 流式细胞仪(美国BectonDickinson公司)
1.2.1 糖尿病模型的建立: 禁食12 h, 按50 mg/kg剂量腹腔一次性注射链脲佐菌素(streptozotocin, STZ)(用前溶于柠檬酸盐缓冲液, pH≤4.5), 造模后每3 d测1次血糖, 血糖连续2次≥19.4 mmol/L(350 mg/dL), 具有多饮、多食、多尿, 且体质量减轻者为造模成功, 作为移植受体.
1.2.2 UCMSCs提取与分离: (1)组织贴块法培养UCMSCs: 脐带标本采集前, 征得医学伦理会同意及经产妇知情同意, 产妇已做艾滋病病毒抗体、乙型肝炎病毒抗体、丙型肝炎病毒抗体、梅毒螺旋体抗体、支原体等检测. 脐带取自正常足月剖宫产健康婴儿, 截取10 cm长度的脐带, 两端丝线结扎, 浸泡于含DMEM保存瓶中, 标本采集后4 ℃保存, 24 h内完成实验. 在超净台中用750 mL/L乙醇消毒脐带表面2-3 min, 去除脐带两端, 生理盐水充分洗涤残留的血液, 将脐带剪成2 cm小段再次漂洗, 剖开脐带, 剔除脐静脉、脐动脉, 剥离华通氏胶. 将华通氏胶剪成1 mm3大小组织块, 加入含100 mL/L胎牛血清的培养基, 接种T75培养瓶内, 放入37 ℃、50 mL/L CO2培养箱中培养, 用倒置显微镜每天观察细胞生长情况, 细胞融合达80%-90%时进行传代操作; (2)UCMSCs传代和扩增: 当T75培养瓶中细胞贴壁生长至融合80%-90%后, 去除培养基, 生理盐水洗涤细胞一遍, 加入Tryple酶3 mL, 轻轻摇动培养瓶, 使消化液流遍所有细胞表面, 倒置显微镜下观察, 见细胞间隙增大, 胞质回缩, 轻轻拍打培养瓶, 细胞呈圆形漂起, 加入等体积培养基终止酶消化. 1 300 r/min离心5 min后, 去除上清, 加入细胞培养基按1:3的比例进行传代; (3)UCMSCs冻存: 存细胞前一天更换培养液, 用Tryple酶消化细胞, 收集细胞到离心管中, 计数, 以1 300 r/min离心5 min, 取出离心后的离心管, 去除上清, 加入细胞冻存液, 使冻存液中细胞密度2×106/mL-5×106/mL, 用吸管轻轻吹打使细胞均匀, 分装, 每冻存管1.5 mL液体. 密封冻存管, 标记后置于4 ℃冰箱10 min, 装入程序降温盒中, 转移至-80 ℃冰箱过夜, 24 h内移入液氮容器中; (4)UCMSCs复苏: 从液氮罐中取出冻存管, 立即转入37 ℃水浴锅中快速溶化, 管口向上, 轻轻摇晃至冻存管中固体融化, 乙醇消毒瓶口, 在离心管中使用20 mL DMEM稀释冻存液, 1 300 r/min离心5 min, 弃上清, 重复DMEM洗一次, 将复苏细胞转移至细胞培养瓶中培养; (5)UCMSCs表型的测定: 用流式细胞仪对P2代脐带MSCs表面特异性抗原进行检测, Tryple酶消化待检细胞, PBS洗涤3次, 制成1×106/m的细胞悬液, 将待检细胞样品分为每管0.1 mL加入CD14-FITC、CD45-FITC、CD79a-APC、CD90-APC、CD34-PE、CD73-PE、CD105-PE、HLA-DR-PE一抗, 4 ℃避光孵育30 min, PBS洗涤后调整终体积400 μL, 流式细胞仪上机测定各类抗原的表达率. 其中CD14、CD45、CD34、CD79α为脐带MSC阴性指标; HLA-DR为脐带MSC免疫原性指标; CD73、CD90、CD105为脐带MSC阳性指标.
1.2.3 胰岛的分离和纯化及活性鉴定: 参照李建平等[12]的方法, 腹腔注射乌拉坦(120 mg/kg)麻醉大鼠, 暴露胰腺组织, 夹闭十二指肠开口端, 26号留置针近心端胆总管插管并固定, 经留置针注入胶原酶10 mL(1 mg/mL)充分膨胀胰腺, 分离下胰腺, 放于含HBSS(5 mL, 38 ℃)的50 mL离心管中, 38 ℃水浴静置消化10-13 min后, 振荡胰腺成泥沙状, 迅速加入含100 mL/L胎牛血清的冷1640液终止消化, 30目细胞筛网过滤后离心洗涤3次(4 ℃, 1 000 r/min, 2 min), 沉淀用15 mL的Histopaque-1077重悬, 再缓慢加入10 mL HBSS离心(4 ℃, 2 000 r/min, 20 min), 收集两界面间的悬浮物, 加入含20 mL/L胎牛血清的冷1640液离心洗涤2次(4 ℃, 1 000 r/min, 3 min), 沉淀用含100 mL/L胎牛血清的1640液配制成1 mL细胞悬液. 体外胰岛活性鉴定方法参见胡浩等[13]方法, 胰岛于1640培养基中37 ℃过夜培养后放于3个含有0.5 mL低糖液(1.67 mmol/L)和3个含有0.5 mL高糖液(16.7 mmol/L)的1.5 mL离心管中, 每管20个, 37 ℃、50 mL/L CO2的条件下培养1 h, 吸取上清测定胰岛素水平. 胰岛功能用刺激指数(stimulation index, SI)反映, 即用高糖刺激释放的胰岛素与低糖刺激释放的胰岛素的比率表示. 纯化后立即挑选100-250 μm当量的胰岛500个, 与1×106 U CMSCs混在一起, 立即移于左肾被膜下.
1.2.4 细胞移植: 移植分为4个组: (1)胰岛移植组(500个直径大小100-250 μm胰岛细胞: n = 15); (2)脐带间充质干细胞组(1-5×106脐带间充质干细胞: n = 15); (3)脐带间充质干细胞组(1-5×106脐带间充质干细胞与500个胰岛细胞: n = 12); (4)对照组(同样的方法在肾被膜下注入0.3 mL生理盐水: n = 8)
1.2.5 胰岛功能测定: 术后1 d始尾静脉采血测血糖, 第1周每天测血糖, 2-3 wk隔天测血糖. 以血糖水平≤11.1 mmol/L为血糖正常. 禁食10 h以上, 以2.0 mg/kg体质量腹腔注射葡萄糖, 分别测0、15、30、60、90、120 min血糖水平, 即葡萄糖耐量试验(glucose tolerance test, GTT). 血糖测量由罗氏Accu-Chek Performa血糖仪完成. 采用尾静脉采血, 1 300 r/min离心5 min, 收集0、1、3、5、7、14、21、28 d, 用Elisa法测定血清胰岛素水平.
统计学处理 所有结果均用mean±SD表示, 不同组间比较用两因素方差分析(two way-ANOVA)进行统计学处理, 有效率用Kaplan-Meier法进行统计学分析, 所有数据均由PASW Statistics18.0(SPSS18.0)统计软件完成, P<0.05为差异有统计学意义.
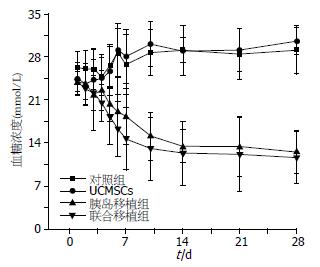
术后, 联合移植组与单纯胰岛移植组、空白对照组、UCMSCs组血糖浓度比较, 显著降低(P = 0.002, <0.001, <0.001, 图1, 表1).
| 时间(d) | 空白对照组 | UCMSCs组 | 胰岛移植组 | 联合移植组 |
| 1 | 26.30±2.58 | 24.44±2.60 | 23.91±1.64 | 24.10±2.42 |
| 2 | 26.04±2.94 | 23.63±3.31 | 23.61±2.59 | 22.89±2.73 |
| 3 | 25.96±3.36 | 24.23±5.00 | 21.78±5.72 | 22.15±2.85 |
| 4 | 24.78±3.05 | 24.56±3.87 | 22.54±3.20 | 20.51±2.98 |
| 5 | 26.61±3.45 | 25.63±3.99 | 20.29±2.70 | 18.28±4.56 |
| 6 | 28.66±3.93 | 29.14±4.31 | 19.06±2.79 | 16.27±4.51 |
| 7 | 26.75±4.90 | 28.08±4.34 | 18.29±4.56 | 14.67±5.09 |
| 10 | 28.68±3.77 | 30.07±3.64 | 15.06±3.91 | 13.04±5.10 |
| 14 | 29.16±2.05 | 29.02±4.02 | 13.41±2.69 | 12.33±5.18 |
| 21 | 28.46±4.12 | 29.07±3.46 | 13.39±4.82 | 12.09±6.03 |
| 28 | 29.15±3.93 | 30.56±2.19 | 12.51±3.49 | 11.65±4.27 |
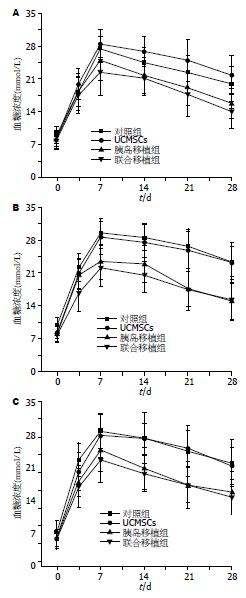
术后第7天, 联合移植组与单纯胰岛移植组、空白对照组、UCMSCs组相比血糖浓度降低(P = 0.057, <0.001, <0.001, 图2A, 表2). 术后第14天, 联合移植组与单纯胰岛移植组、空白对照组、UCMSCs组相比血糖浓度也降低(P = 0.049, <0.001, <0.001, 图2B, 表3). 术后第28天, 血糖浓度变化, 联合移植组与单纯胰岛移植组、空白对照组、UCMSCs组相比血糖浓度同样降低(P = 0.456, <0.001, <0.001, 图2C, 表4).
| 时间(min) | 空白对照组 | UCMSCs组 | 胰岛移植组 | 联合移植组 |
| 0 | 9.65±1.65 | 8.00±1.92 | 8.04±1.31 | 7.81±1.65 |
| 15 | 18.08±4.16 | 20.73±2.69 | 17.11±2.75 | 16.72±3.79 |
| 30 | 24.85±3.28 | 27.88±2.07 | 21.77±3.42 | 20.99±4.27 |
| 60 | 27.34±2.44 | 29.24±2.55 | 25.50±4.07 | 21.53±4.92 |
| 90 | 24.05±3.56 | 27.07±3.40 | 20.53±4.83 | 17.78±5.26 |
| 120 | 22.09±3.66 | 23.82±3.41 | 16.46±4.80 | 13.51±4.26 |
| 时间(min) | 空白对照组 | UCMSCs组 | 胰岛移植组 | 联合移植组 |
| 0 | 9.78±1.69 | 8.33±1.33 | 8.01±1.76 | 7.85±1.62 |
| 15 | 22.23±3.01 | 20.90±3.27 | 20.61±3.20 | 16.75±3.91 |
| 30 | 29.51±2.59 | 28.70±3.87 | 23.39±3.71 | 22.11±4.03 |
| 60 | 28.55±2.83 | 27.45±4.01 | 22.93±3.92 | 20.57±3.71 |
| 90 | 26.70±3.08 | 25.84±4.49 | 17.59±3.75 | 17.42±4.45 |
| 120 | 23.36±3.22 | 23.19±4.33 | 14.97±3.93 | 15.24±4.45 |
| 时间(min) | 空白对照组 | UCMSCs组 | 胰岛移植组 | 联合移植组 |
| 0 | 9.33±2.19 | 7.92±1.91 | 7.94±1.55 | 7.96±1.80 |
| 15 | 23.58±3.26 | 21.19±3.76 | 19.04±2.81 | 18.30±4.18 |
| 30 | 29.11±3.39 | 28.29±4.41 | 25.49±4.25 | 23.65±4.46 |
| 60 | 27.76±4.97 | 27.67±2.98 | 21.87±4.18 | 20.78±3.57 |
| 90 | 25.20±5.02 | 25.78±3.53 | 18.53±4.66 | 18.55±3.41 |
| 120 | 22.84±4.66 | 22.41±3.62 | 17.15±4.16 | 16.18±3.43 |
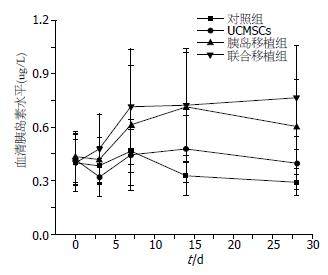
联合移植组与单纯胰岛移植组、空白对照组、UCMSCs组相比血清胰岛素水平升高(P = 0.002, <0.001, <0.001, 图3, 表5).
| 时间(d) | 空白对照组 | UCMSCs组 | 胰岛移植组 | 联合移植组 |
| 0 | 0.40±0.16 | 0.42±0.14 | 0.43±0.14 | 0.40±0.13 |
| 3 | 0.38±0.11 | 0.32±0.11 | 0.42±0.13 | 0.48±0.20 |
| 7 | 0.47±0.12 | 0.44±0.20 | 0.61±0.34 | 0.72±0.32 |
| 14 | 0.33±0.11 | 0.48±0.19 | 0.71±0.31 | 0.72±0.32 |
| 28 | 0.29±0.07 | 0.40±0.15 | 0.60±0.27 | 0.77±0.29 |
胰岛移植作为治疗T1DM的有效方法, 因其手术风险小, 移植成功后可暂时脱离外源性胰岛素, 且能时时控制血糖因而广泛应用于科研和临床[1,2]. 而胰岛移植后营养因子缺乏和炎症介导的免疫反应使得胰岛细胞存活低下, 导致胰岛移植应用受限[14]. 生理状况下, 胰岛细胞由致密的毛细血管网所包绕, 尽管这些毛细血管网只占整个胰腺组织的1%-2%, 但血流量却占到整个胰腺的5%-10%[15,16]. 足够的血流量对维持胰岛细胞功能有着极为重要的作用, 但胰岛细胞分离是去血管的, 移植后新生血管网再生要14 d[17], 使得这段时间成为早期胰岛成活的关键. 体外研究表明MSC可通过免疫调节与营养活性来发挥促胰岛活性与功能的目的.
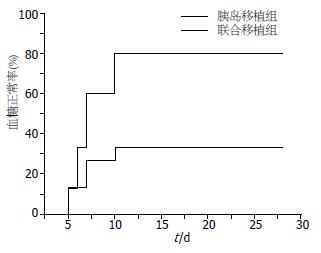
本实验中, 联合移植组血糖浓度降低程度血清胰岛素水平以及达正常血糖水平动物比率均优于单纯胰岛移植组. 在移植初期, 由于营养因子缺乏与炎症反应, 使得胰岛细胞大量破坏, 因而出现胰岛移植组血糖出现短暂上升, 而随着胰岛细胞毛细血管网的再生, 胰岛逐渐发挥其活性与功效, 血糖浓度得以控制, 进而下降; 而对于联合移植组, 早期UCMSCs即可黏附在胰岛细胞上, 即不影响胰岛细胞血量又能抑制炎症细胞反应增生[18], 因而血糖未出现明显升高. 在新生血管网形成后(14 d左右), 胰岛细胞的活性功能逐渐稳定, 因而在血糖浓度上表现相对平稳. 尽管Kang等[19]认为MSC单独作用能发挥降血糖作用, 但Rackham等[20]持相反的观点, 本实验结果与Rackham类似, 在28 d内单纯UCMSCs组未发现UCMSCs有降血糖作用. 血清胰岛素水平也能反映体内胰岛的功能, 在移植后3 d, 由于胰岛细胞大量破坏, 血清胰岛素水平也相应较低, 联合移植组胰岛素水平也有所下降, 不过程度相对较低, 对应于图2中血清胰岛素水平在3 d左右短暂的降低. 对于降血糖有效率比较, 胰岛移植组血糖正常时间慢, 稳定在14 d左右, 这与文献报道新生毛细血管网形成时间一致, 而联合移植组, 血糖正常时间早, 10 d左右即达稳定, 亦说明UCMSCs对胰岛活性与功能有良好促进作用. 而对于GTT试验, 7 d和28 d联合移植组与胰岛移植组间无统计学差异, 而14 d联合移植组糖耐量恢复较胰岛移植组好, 这与Sakata等[21]报道有所不同, Sakata等[21]用骨髓与胰岛细胞联合移植, 术后第7 d GTT联合移植组效果好于胰岛移植组, 而14 d与28 d两者无统计学差异, 其差异可能由于MSC来源不同而导致其作用差异, 其作用机制仍需进一步研究和阐明.
另外对于MSC的诱导分化, 尽管MSC能诱导分化为骨、软骨、脂肪组织以及胰岛样细胞[22], 但其均需在特定的条件下诱导, 且短时间期内一般认为不会诱导分化为其他细胞[21], 因此本实验未对其诱导分化进行检测. 下一步, 我们将从营养活性和免疫调控机制方面来探讨UCMSCs促进胰岛活性与功能作用.
总之, UCMSCs与胰岛体内联合移植, 能有效促进胰岛活性与功能.
胰岛移植为治疗1型糖尿病这一全球性难题提供了新希望, 但由于移植后营养因子缺乏以及炎症介导的免疫反应, 导致胰岛细胞存活率低下, 使得移植后3-5年内仍需注射小剂量的胰岛素, 很大程度上影响其进一步应用.
黄昆, 教授, 华中科技大学同济药学院; 于珮, 主任医师, 天津医科大学代谢病医院
目前国内外对于干细胞联合应用于糖尿病研究主要集中在诱导分化, 免疫调控和营养活性3方面, 后两者是通过体外共培养或体内联合移植来实现.
国外学者Jung等人将胰岛细胞与骨髓来源间充质干细胞体外共培养与胰岛细胞单独培养比较, 结果显示共培养组胰岛细胞活性优于单独组.
本文主要通过体内脐带间充质干细胞与胰岛细胞联合移植来研究其对促进胰岛活性与功能方面的作用.
本文将脐带间充质干细胞与胰岛细胞联合移植, 为临床治疗1型糖尿病提供了研究方向.
本研究探讨了脐带间充质干细胞联合移植对提高胰岛活性与功能的作用, 有一定研究意义.
编辑: 李军亮 电编:闫晋利
| 1. | Shapiro AM, Lakey JR, Ryan EA, Korbutt GS, Toth E, Warnock GL, Kneteman NM, Rajotte RV. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 2000;343:230-238. [PubMed] [DOI] |
| 2. | Vardanyan M, Parkin E, Gruessner C, Rodriguez Rilo HL. Pancreas vs. islet transplantation: a call on the future. Curr Opin Organ Transplant. 2010;15:124-130. [PubMed] [DOI] |
| 3. | Shapiro AM, Ricordi C, Hering BJ, Auchincloss H, Lindblad R, Robertson RP, Secchi A, Brendel MD, Berney T, Brennan DC. International trial of the Edmonton protocol for islet transplantation. N Engl J Med. 2006;355:1318-1330. [PubMed] [DOI] |
| 4. | Lee BW, Lee M, Chae HY, Lee S, Kang JG, Kim CS, Lee SJ, Yoo HJ, Ihm SH. Effect of hypoxia-inducible VEGF gene expression on revascularization and graft function in mouse islet transplantation. Transpl Int. 2011;24:307-314. [PubMed] [DOI] |
| 5. | Ryan EA, Paty BW, Senior PA, Bigam D, Alfadhli E, Kneteman NM, Lakey JR, Shapiro AM. Five-year follow-up after clinical islet transplantation. Diabetes. 2005;54:2060-2069. [PubMed] [DOI] |
| 6. | Zhao Y, Mazzone T. Human cord blood stem cells and the journey to a cure for type 1 diabetes. Autoimmun Rev. 2010;10:103-107. [PubMed] [DOI] |
| 7. | Park KS, Kim YS, Kim JH, Choi B, Kim SH, Tan AH, Lee MS, Lee MK, Kwon CH, Joh JW. Trophic molecules derived from human mesenchymal stem cells enhance survival, function, and angiogenesis of isolated islets after transplantation. Transplantation. 2010;89:509-517. [PubMed] |
| 8. | Ding Y, Xu D, Feng G, Bushell A, Muschel RJ, Wood KJ. Mesenchymal stem cells prevent the rejection of fully allogenic islet grafts by the immunosuppressive activity of matrix metalloproteinase-2 and -9. Diabetes. 2009;58:1797-1806. [PubMed] [DOI] |
| 9. | Zhao Y, Lin B, Darflinger R, Zhang Y, Holterman MJ, Skidgel RA. Human cord blood stem cell-modulated regulatory T lymphocytes reverse the autoimmune-caused type 1 diabetes in nonobese diabetic (NOD) mice. PLoS One. 2009;4:e4226. [PubMed] [DOI] |
| 10. | Francese R, Fiorina P. Immunological and regenerative properties of cord blood stem cells. Clin Immunol. 2010;136:309-322. [PubMed] [DOI] |
| 11. | Mabed M. The potential utility of bone marrow or umbilical cord blood transplantation for the treatment of type I diabetes mellitus. Biol Blood Marrow Transplant. 2011;17:455-464. [PubMed] [DOI] |
| 12. | 李 建平, 胡 浩, 季 沅, 万 春晓. 胰导管保护法提高胰岛获取量的实验研究. 南京医科大学学报(自然科学版). 2008;28:1433-1436. |
| 13. | 胡 浩, 李 建平. 胰导管保护法提高大鼠胰岛获取量和功能的研究. 中华肝胆外科杂志. 2010;16:867-869. |
| 15. | Kuroda M, Oka T, Oka Y, Yamochi T, Ohtsubo K, Mori S, Watanabe T, Machinami R, Ohnishi S. Colocalization of vascular endothelial growth factor (vascular permeability factor) and insulin in pancreatic islet cells. J Clin Endocrinol Metab. 1995;80:3196-3200. [PubMed] [DOI] |
| 16. | Lifson N, Lassa CV, Dixit PK. Relation between blood flow and morphology in islet organ of rat pancreas. Am J Physiol. 1985;249:E43-E48. [PubMed] |
| 17. | Menger MD, Yamauchi J, Vollmar B. Revascularization and microcirculation of freely grafted islets of Langerhans. World J Surg. 2001;25:509-515. [PubMed] [DOI] |
| 18. | Duprez IR, Johansson U, Nilsson B, Korsgren O, Magnusson PU. Preparatory studies of composite mesenchymal stem cell islets for application in intraportal islet transplantation. Ups J Med Sci. 2011;116:8-17. [PubMed] [DOI] |
| 19. | Kang HM, Kim J, Park S, Kim J, Kim H, Kim KS, Lee EJ, Seo SI, Kang SG, Lee JE. Insulin-secreting cells from human eyelid-derived stem cells alleviate type I diabetes in immunocompetent mice. Stem Cells. 2009;27:1999-2008. [PubMed] [DOI] |
| 20. | Rackham CL, Chagastelles PC, Nardi NB, Hauge-Evans AC, Jones PM, King AJ. Co-transplantation of mesenchymal stem cells maintains islet organisation and morphology in mice. Diabetologia. 2011;54:1127-1135. [PubMed] [DOI] |
| 21. | Sakata N, Chan NK, Chrisler J, Obenaus A, Hathout E. Bone marrow cell cotransplantation with islets improves their vascularization and function. Transplantation. 2010;89:686-693. [PubMed] [DOI] |
| 22. | Gluckman E. History of cord blood transplantation. Bone Marrow Transplant. 2009;44:621-626. [PubMed] [DOI] |