修回日期: 2012-08-14
接受日期: 2012-09-04
在线出版日期: 2012-09-28
目的: 采用基因沉默和慢病毒转染技术, 沉默人肝癌细胞HepG2中特异蛋白3(specificity protein 3, Sp3)的表达, 观察沉默Sp3基因后的肝细胞的增殖能力变化.
方法: 采用Sp3-siRNA慢病毒转染人肝癌细胞HepG2, 通过免疫印迹法和PCR技术检测Sp3的表达以验证转染效果, 通过MTT检测细胞生长曲线和流式细胞技术测定细胞周期.
结果: Western blot实验表明, 实验组的Sp3表达量明显少于空白组和阴性对照组(0.37±0.08 vs 0.83±0.17, 0.66±0.13, F = 8.442, 均P<0.05). RT-PCR也得到相同的结果(0.47±0.05 vs 0.74±0.08, 0.70±0.16, F = 7.322, 均P<0.05). MTT实验结果显示, 与空白对照和阴性对照组相比, 实验组细胞在48、72和96 h时的增殖明显受到抑制(0.28±0.18 vs 0.34±0.19, 0.35±0.07, F = 3.888; 0.57±0.11 vs 0.84±0.05, 0.74±0.08, F = 12.721; 0.72±18.1 vs 0.98±0.05, 0.93±0.9, F = 6.342, 均P<0.05). 流式细胞术结果显示实验组细胞主要分布在G1期.
结论: RNAi沉默Sp3基因导致人肝癌HepG2细胞体外增殖能力下降.
引文著录: 陆会平, 李佳, 莫伟嘉, 冯振博. RNAi沉默Sp3基因对肝癌HepG2细胞增殖的影. 世界华人消化杂志 2012; 20(27): 2595-2600
Revised: August 14, 2012
Accepted: September 4, 2012
Published online: September 28, 2012
AIM: To investigate the effect of RNA interference (RNAi)-mediated gene silencing of specificity protein 3 (Sp3) on the proliferation of human hepatocellular carcinoma HepG2 cells.
METHODS: HepG2 cells were infected with a lentivirus expressing Sp3-siRNA, and the expression of Sp3 mRNA and protein was determined by semi-quantitative reverse transcription polymerase chain reaction (RT-PCR), and Western blot and immunohistochemistry. Cell growth was evaluated by methyl thiazolyl tetrazolium (MTT) assay, and cell cycle progression was analyzed by flow cytometry.
RESULTS: Compared to control cells, the expression levels of Sp3 mRNA and protein were significantly lower in HepG2 cells transfected with the Sp3-siRNA (mRNA: 0.47 ± 0.05 vs 0.74 ± 0.08, 0.70 ± 0.16, F = 7.322, all P < 0.05; protein: 0.37 ± 0.08vs 0.83 ± 0.17, 0.66 ± 0.13, F = 8.442, all P < 0.05). MTT assay showed that the growth of cells transfected with the Sp3-siRNA was slower at 48 , 72 and 96 h (0.28 ± 0.18 vs 0.34 ± 0.19, 0.35 ± 0.07, F = 3.888; 0.57 ± 0.11 vs 0.84 ± 0.05, 0.74 ± 0.08, F = 12.721; 0.72 ± 18.1 vs 0.98 ± 0.05, 0.93 ± 0.9, F = 6.342, all P < 0.05). Flow cytometry analysis showed that the percentage of cells in G1 phase increased in cells transfected with the Sp3-siRNA.
CONCLUSION: Sp3 may play an important role in the growth of human hepatic cancer cells, and RNAi-induced Sp3 down-regulation could inhibit the growth of HepG2 cells in vitro.
- Citation: Lu HP, Li J, Mo WJ, Feng ZB. RNAi-mediated down-regulation of Sp3 gene expression inhibits proliferation of HepG2 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(27): 2595-2600
- URL: https://www.wjgnet.com/1009-3079/full/v20/i27/2595.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i27.2595
Sp3是一种核转录因子, 属于Sp(Specificity protein)家族成员之一, 是继Sp1后发现的具有与之相同的DNA结合区的转录调节因子, 和Sp1一样广泛存在于哺乳动物细胞中, 是众多基因的基本转录因子, 参与许多细胞功能, 包括细胞增殖和凋亡等. 目前发现许多疾病和癌症都存在Sp1和Sp3异常调节[1]. 有研究表明Sp1蛋白在人胰腺癌[2]、乳腺癌[3]和甲状腺癌[4]中高表达. 而Sp3和Sp1在DNA结合区有90%的同源序列, 且与同样的DNA顺式作用元件结合, 二者均在哺乳动物细胞中普遍表达, Sp3在肿瘤中(如肝癌)的表达却鲜有报道. 肝癌是世界三大癌症之一, 具有发病率高、致死率高、目前尚无有效治疗方法等特点. Sp3在肝癌中的表达情况是否跟其在胰腺癌、乳腺癌和甲状腺癌中的表达一样, 其对肝癌的发生发展起着怎样的作用, 目前尚无文献报道. 因此, 本研究应用RNA干扰(RNA interference, RNAi)技术, 观察沉默Sp3基因后对人肝癌细胞系HepG2细胞增殖的影响, 为肝癌分子靶向治疗研究打下基础.
HepG2肝癌细胞购自中国科学院上海生物细胞研究所; 慢病毒质粒的构建和包装购自上海吉凯公司; DMEM完全培养基(高糖)购自南京凯基生物科技公司; 胎牛血清购自杭州四季青公司; 流式细胞术检测细胞周期试剂盒购自南京凯基生物科技公司; 细胞总蛋白提取试剂盒购自美国Pierce Biotechnology公司; 细胞总RNA提取试剂盒购自Roche公司; 逆转录试剂盒购自Fermentas公司; 兔抗人Sp3抗体购自Biolegen公司; 山羊抗兔二抗购自Santa Cruz公司; BCA蛋白浓度测定试剂盒购自碧云天公司.
1.2.1 细胞培养: 人肝癌细胞系HepG2培养于含10%新生牛血清的高糖DMEM培养基, 37 ℃、50 mL/L CO2条件下培养. 细胞分3组: 实验组(Sp3-siRNA慢病毒转染组)、阴性对照组(空载质粒组)和空白对照组(未转染组).
1.2.2 细胞转染: 转染过程按照吉凯公司转染说明书进行, 转染前8 h将人肝癌细胞系HepG2转种于24孔板, 每孔种细胞数为1.5×104个/孔; 8 h后, 细胞融合率达到30%-50%即进行转染; 转染MOI为50, 每孔液体总体积为500 μL; 转染10 h后换含10%新生牛血清的高糖DMEM培养; 转染84 h后荧光最强, 收获细胞.
1.2.3 MTT法分析细胞增殖: 将对数生长期的各组细胞接种于96孔板, 2×103/孔, 每组细胞均做5个复孔; 分别于种板后24、48、72、96 h加入20 μL MTT溶液; 继续培养4 h后, 小心吸尽培养液, 每孔加入150 μL DMSO; 酶标仪检测490 nm处吸光度(A)值, 绘制生长曲线.
1.2.4 细胞周期检测: 细胞经胰酶消化后, 计数板计数细胞, 每管取1×106个细胞; 预冷的PBS洗细胞3次, 最后一次1 000 r/min, 离心1 min, 去上清; 每管加入100 μL RNase, 37 ℃水浴30 min; 每管再加入500 μL PI染液, 室温避光孵育30 min; 流式细胞仪上机检测, 实验重复3次.
1.2.5 Western blot分析蛋白表达: 按照Pierce公司细胞总蛋白提取试剂盒说明书提取细胞总蛋白, 测定浓度后, 取50 μg蛋白样品, 加入上样缓冲液煮沸5 min变性后上样电泳; 100 mA电流条件下转膜90 min, 5%脱脂奶粉室温封闭2 h, 4 ℃孵育一抗(Sp3一抗稀释度为1:1 000)过夜; 次日用TBST洗膜10 min/次×3次, 室温孵育二抗(二抗稀释度均为1:10 000)1 h; TBST洗膜10 min/次×3次, ECL发光, 柯达胶片曝光显影; 胶片拍照后用Quantity One软件分析图像及数据.
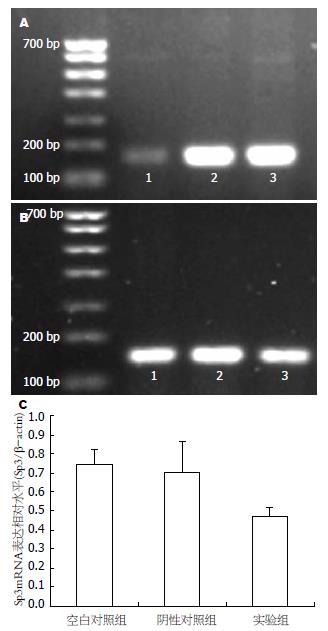
1.2.6 RT-PCR检测基因表达: 应用Primer Primer 5.0软件设计引物, (1)Sp3: Forward, GCTTGCACCTGTCCCAACTGTA; Reverse, CTCCAGAATGCCAACGCAGA; (2)β-actin: Forward, GCACCACACCTTCTACAATGAGC; Reverse, GGATAGCACAGCCTGGATAGCAAC. 引物均由美国Invitrogen公司合成. 按Roche公司总RNA提取试剂盒说明书完成细胞总RNA的提取, 各取总RNA 1 μg逆转录得到cDNA, 以β-actin为内参, 进行PCR反应: 95 ℃预变性3 min; 95 ℃变性30 s, 54 ℃退火30 s, 72 ℃延伸1 min; 72 ℃再延伸7 min, 4 ℃, Sp3为30个循环, β-actin为25个循环. PCR产物以18 g/L琼脂糖凝胶电泳, 核酸染料染色. 应用Bio-Rad凝胶成像系统分析, PCR产物量以光密度/面积表示, 以Sp3产物量/β-actin产物量的比值为最终结果, 重复3次.
统计学处理 应用SPSS13.0统计软件进行统计学分析, 采用ANOVA单因素方差分析, 并用LSD法进行两两比较, 结果用mean±SD表示, 检验水准α = 0.05, 以P<0.05为差异有统计学意义.
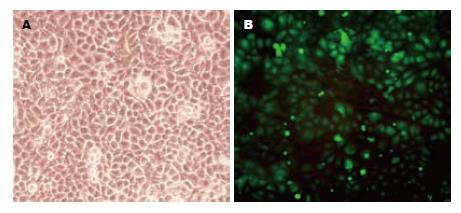
实验组和阴性对照组在转染后24、36、48、60、72、84、96 h使用荧光显微镜进行观察, 2组均见有荧光蛋白表达, 在转染84 h后细胞荧光表达强度最强, 约占细胞总数的90%(图1).
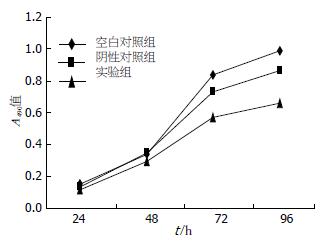
与空白对照组和阴性对照组相比, 实验组细胞490 nm处的A值在转染后24 h差异无统计学意义(0.10±0.05 vs 0.14±0.02, 0.13±0.06, F = 1.211, 均P>0.05), 但在48、72和96 h时差异有统计学意义(0.28±0.18vs 0.34±0.19, 0.35±0.07, F = 3.888; 0.57±0.11 vs 0.84±0.05, 0.74±0.08, F = 12.721; 0.72±18.1 vs0.98±0.05, 0.93±0.9, F = 6.342, 均P<0.05). 由此可见, 实验组细胞生长明显受到抑制(图2).
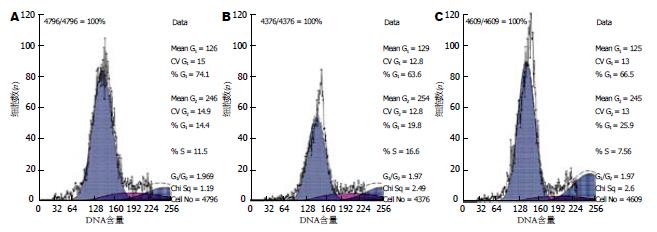
与空白对照组相比, 实验组G1期细胞比例明显增多(0.74±0.01 vs 0.64±0.03, F = 36.367, P<0.05). 而与阴性对照组相比, 实验组G1期细胞比例无明显变化(0.63±0.03 vs 0.62±0.02, F = 36.367,P>0.05). 相比空白对照组和阴性对照组, 实验组G2期细胞比例明显减少(0.14±0.01 vs 0.25±0.01, 0.21±0.02, F = 36.165, 均P<0.05, 图3).
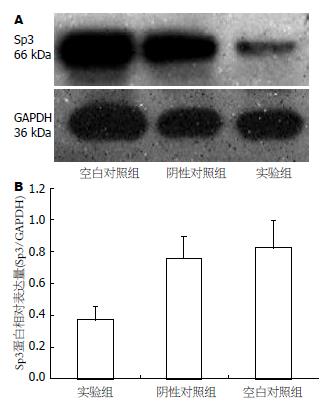
Western blot检测结果显示相对阴性对照组和空白对照组, 实验组Sp3蛋白表达水平降低(0.37±0.08 vs 0.83±0.17, 0.66±0.13, F = 8.442, 均P<0.05, 图4).
相对阴性对照组和空白对照组, 实验组Sp3 mRNA表达受到抑制(0.47±0.05 vs0.74±0.08, 0.70±0.16, F = 7.322, 均P<0.05, 图5).
Sp3是一种DNA结合蛋白, 是众多基因的基本转录因子, 隶属SP家族, 可与基因的启动子、增强子等顺式作用元件, 如GC盒和GT/CACCC盒结合而调节基因转录, 并参与许多细胞功能, 包括细胞增殖和凋亡. 目前认为Sp3蛋白对基因的转录具有抑制和激活的双重作用[5,6], 特别是在Sp1存在的情况下起抑制因子作用[7]. 体外研究表明, Sp3在含有多个Sp结合位点的启动子区中不能与Sp1发挥协同激活作用[8], 而在某些基因的启动子区, Sp3可以发挥比Sp1更强的转录激活作用[9], 因此目前多数学者认为, Sp3的抑制作用与启动子和细胞的种类相关[8-10].
RNA干扰已成为基因功能研究和肿瘤基因治疗的一种重要手段. 目前常用的RNAi实验方法有两种: 直接转染双链siRNA和载体(质粒或慢病毒)表达发夹RNA[11]. RNAi最主要的功能在于可以调节和关闭基因的表达, 进而调控细胞的各种高级生命活动. 而siRNA是指RNAi过程中在细胞内产生的长约21-25个核苷酸(nt)的小双链RNA分子, 是RNAi作用机制的重要中间效应分子. 已有人工合成的siRNA, 具有明显高效敲除相应基因的mRNA的效果[12].
鉴于目前尚无Sp3在肝癌中的表达情况及其对肝癌细胞生长和增殖的影响的报道, 本研究利用慢病毒为载体, 采用慢病毒转染法, 将Sp3-siRNA质粒转入人肝癌细胞系HepG2细胞中, 探讨通过RNA干扰, 沉默Sp3表达对HepG2细胞增殖能力的影响.
本研究中, Western blot和RT-PCR结果显示实验组的Sp3蛋白和mRNA的相对表达量明显少于阴性对照组和空白对照组(P<0.05), 说明慢病毒转染成功, 并且Sp3-siRNA慢病毒载体能有效地下调HepG2细胞Sp3的表达.
流式细胞术检测发现, 与阴性对照组和空白对照组相比, 实验组细胞主要处于G1期, 处于S期的细胞所占比例明显减少(P<0.05), 此结果与Abdelrahim等[13]的结果相似. MTT法检测结果显示实验组细胞增殖活力明显弱于空白对照组和阴性对照组(P<0.05), 与流式细胞术检测结果相符. 提示可能是Sp3直接或间接地参与肝癌细胞周期的调控, 进而影响肝癌细胞的增殖.
众所周知, 肿瘤发生的根本原因就是本应停止增殖或生理性凋亡的细胞不停地进入细胞周期, 从而导致肿瘤细胞的恶性增殖. 而细胞周期是由一系列高度有序并循精确时相的G1→S→G2→M期构成. 许多肿瘤相关因子对增殖的作用首先是通过影响细胞周期的进程而起作用的. 如Cyclin D1是G1期细胞周期素, 与细胞周期素依赖激酶-4/6(cyclindependent kinase 4 and 6, CDK4/CDK6)结合而形成复合物, 驱动细胞由G1期进入S期促进细胞增殖[14]. 许多恶性肿瘤组织中都有CyclinD1的过表达. 过表达的CyclinD1与肿瘤的发生、发展及预后密切相关[15]. 研究表明, 与细胞增殖、损伤修复以及凋亡相关的多个基因, 包括 TopoⅡα、TopoⅡβ[16,17]、Bcl-2[18]、bax[19]、p53[20]、PCNA[21]、Cyclin D1[22]和Caspase 3[23]等, 启动子区都有GC盒. 而Sp3的氨基酸序列中靠近C端有3个C2H2型锌指结构, 此区是与DNA结合的关键区域, 他可以使得Sp3可以优先地与GT/CACCC盒结合, 从而激活这些基因的转录, 上调或下调这些基因的表达, 进而参与细胞的增殖、分化和凋亡. 在本实验中, 是否抑制Sp3表达后, 使得Cyclin D1表达也减少, 从而使肝癌细胞周期阻滞在G0/G1期, S期的细胞数减少, 进而抑制肝癌细胞DNA复制和蛋白质的合成, 从而阻断肝癌细胞增殖周期, 抑制其生长速度, 最终抑制细胞的增殖?
总之, 本研究结果提示Sp3基因在肝癌的发生发展中可能作为癌基因起作用, 抑制Sp3基因的表达可能使细胞停留在G0-G1期, 从而有效抑制肝癌细胞的增殖. 有研究表明, 肿瘤细胞对化疗的敏感程度与其增殖状态密切相关. 处于增殖期的细胞越多, 对于那些周期特异性化疗药物来说, 就有越多的作用靶点, 也能够发挥更强的化疗作用[24]. 因此, Sp3作为肝癌治疗候选靶点的研究值得深入和拓展. 而目前有研究表明[25,26], 同时应用RNAi技术和化疗药物, 可提高肿瘤细胞对药物的敏感性, 促使肿瘤细胞凋亡. RNAi技术下调Sp3表达是否有类似的应用前景也值得进一步研究.
原发性肝癌是我国最常见的恶性肿瘤之一, 近20年来其死亡率增加了41.17%, 其发病机制及治疗方法目前尚无明确定论. 特意蛋白3(Sp3)是一种核转录因子和Sp1一样广泛存在于哺乳动物细胞中. 目前发现许多癌症和疾病的发生过程都存在Sp1和Sp3异常调节. 通过RNAi技术干扰肝癌细胞中Sp3的表达来检测Sp3基因对肝癌细胞的生长和增殖的影响, 可以为肝癌的分子靶向治疗提供理论依据.
秦春宏, 副主任医师, 南华大学附属第二医院普外科
研究发现, 包括TopoⅡα、TopoⅡβ、Bcl-2、bax、p53、PCNA、Cyclin D1和Caspase 3等与细胞增殖、损伤修复以及凋亡相关的多个基因启动子区都有GC盒, 而Sp3可通过与GC盒的结合而发挥转录调节作用, 上调或下调这些基因的表达来共同参与细胞的生长、增殖和凋亡. RNAi技术可以阻断或降低其靶基因的表达, 在抑制肿瘤生长的基础研究方面取得一定的进展.
Abdrahim等用siRNA技术沉默Sp3基因能抑制胰腺癌细胞株的增殖, 使细胞停留在G1期; 而Essafi-Benkhadir等报道, 在人的结肠癌细胞株转染Sp3表达载体之后, 过表达Sp3诱导细胞凋亡.
Sp3在肝癌中的表达及其对肝癌发生发展的影响目前尚无文献报道. 本研究采用Sp3基因siRNA载体转染人肝癌细胞株HepG2细胞, 利用RT-PCR、Western blot、MTT试验、流式细胞术检测Sp3基因沉默后, 对目的细胞生长、增殖的影响, 具有一定创新性.
siRNA可有效地抑制肝癌细胞株HepG2中Sp3的表达, 有效抑制细胞生长及增殖能力, 为肝癌分子靶向治疗提供实验基础.
顺式作用元件: 与结构基因串联的特定DNA序列, 是转录因子的结合位点, 他们通过与转录因子结合而调控基因转录的精确起始和转录效率. 包括启动子、增强子、调控序列和可诱导元件等, 他们的作用是参与基因表达的调控. 顺式作用元件本身不编码任何蛋白质, 仅仅提供一个作用位点, 要与反式作用因子相互作用而起作用.
本文选题结合临床基础, 有一定的实用性, 论文的目的明确, 方法先进, 实验数据可信, 结论有一定说服力, 是一篇较好的论文.
编辑: 李军亮 电编:鲁亚静
| 1. | Li L, Davie JR. The role of Sp1 and Sp3 in normal and cancer cell biology. Ann Anat. 2010;192:275-283. [PubMed] [DOI] |
| 2. | Shi Q, Le X, Abbruzzese JL, Peng Z, Qian CN, Tang H, Xiong Q, Wang B, Li XC, Xie K. Constitutive Sp1 activity is essential for differential constitutive expression of vascular endothelial growth factor in human pancreatic adenocarcinoma. Cancer Res. 2001;61:4143-4154. [PubMed] |
| 3. | Zannetti A, Del Vecchio S, Carriero MV, Fonti R, Franco P, Botti G, D'Aiuto G, Stoppelli MP, Salvatore M. Coordinate up-regulation of Sp1 DNA-binding activity and urokinase receptor expression in breast carcinoma. Cancer Res. 2000;60:1546-1551. [PubMed] |
| 4. | Chiefari E, Brunetti A, Arturi F, Bidart JM, Russo D, Schlumberger M, Filetti S. Increased expression of AP2 and Sp1 transcription factors in human thyroid tumors: a role in NIS expression regulation? BMC Cancer. 2002;2:35. [PubMed] [DOI] |
| 5. | Kingsley C, Winoto A. Cloning of GT box-binding proteins: a novel Sp1 multigene family regulating T-cell receptor gene expression. Mol Cell Biol. 1992;12:4251-4261. [PubMed] |
| 6. | Kennett SB, Udvadia AJ, Horowitz JM. Sp3 encodes multiple proteins that differ in their capacity to stimulate or repress transcription. Nucleic Acids Res. 1997;25:3110-3117. [PubMed] [DOI] |
| 7. | Sapetschnig A, Koch F, Rischitor G, Mennenga T, Suske G. Complexity of translationally controlled transcription factor Sp3 isoform expression. J Biol Chem. 2004;279:42095-42105. [PubMed] [DOI] |
| 8. | Yu B, Datta PK, Bagchi S. Stability of the Sp3-DNA complex is promoter-specific: Sp3 efficiently competes with Sp1 for binding to promoters containing multiple Sp-sites. Nucleic Acids Res. 2003;31:5368-5376. [PubMed] [DOI] |
| 9. | Sowa Y, Orita T, Minamikawa-Hiranabe S, Mizuno T, Nomura H, Sakai T. Sp3, but not Sp1, mediates the transcriptional activation of the p21/WAF1/Cip1 gene promoter by histone deacetylase inhibitor. Cancer Res. 1999;59:4266-4270. [PubMed] |
| 10. | Gartel AL, Goufman E, Najmabadi F, Tyner AL. Sp1 and Sp3 activate p21 (WAF1/CIP1) gene transcription in the Caco-2 colon adenocarcinoma cell line. Oncogene. 2000;19:5182-5188. [PubMed] [DOI] |
| 11. | Yu JY, DeRuiter SL, Turner DL. RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc Natl Acad Sci USA. 2002;99:6047-6052. [PubMed] [DOI] |
| 12. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 13. | Abdelrahim M, Smith R, Burghardt R, Safe S. Role of Sp proteins in regulation of vascular endothelial growth factor expression and proliferation of pancreatic cancer cells. Cancer Res. 2004;64:6740-6749. [PubMed] [DOI] |
| 14. | Jiang W, Kahn SM, Zhou P, Zhang YJ, Cacace AM, Infante AS, Doi S, Santella RM, Weinstein IB. Overexpression of cyclin D1 in rat fibroblasts causes abnormalities in growth control, cell cycle progression and gene expression. Oncogene. 1993;8:3447-3457. [PubMed] |
| 15. | Kim SH, Lewis JJ, Brennan MF, Woodruff JM, Dudas M, Cordon-Cardo C. Overexpression of cyclin D1 is associated with poor prognosis in extremity soft-tissue sarcomas. Clin Cancer Res. 1998;4:2377-2382. [PubMed] |
| 16. | Kim JC, Yoon JB, Koo HS, Chung IK. Cloning and characterization of the 5'-flanking region for the human topoisomerase III gene. J Biol Chem. 1998;273:26130-26137. [PubMed] [DOI] |
| 17. | Ng SW, Liu Y, Schnipper LE. Cloning and characterization of the 5'-flanking sequence for the human DNA topoisomerase II beta gene. Gene. 1997;203:113-119. [PubMed] [DOI] |
| 18. | Grillot DA, González-García M, Ekhterae D, Duan L, Inohara N, Ohta S, Seldin MF, Nuñez G. Genomic organization, promoter region analysis, and chromosome localization of the mouse bcl-x gene. J Immunol. 1997;158:4750-4757. [PubMed] |
| 19. | Igata E, Inoue T, Ohtani-Fujita N, Sowa Y, Tsujimoto Y, Sakai T. Molecular cloning and functional analysis of the murine bax gene promoter. Gene. 1999;238:407-415. [PubMed] [DOI] |
| 20. | Innocente SA, Lee JM. p53 is a NF-Y- and p21-independent, Sp1-dependent repressor of cyclin B1 transcription. FEBS Lett. 2005;579:1001-1007. [PubMed] [DOI] |
| 21. | Ohashi Y, Sawada Y, Moriuchi T, Fujinaga K. Analysis of the 5' flanking region of the rat proliferating cell nuclear antigen (PCNA) gene. Biochim Biophys Acta. 1992;1130:175-181. [PubMed] [DOI] |
| 22. | Bartusel T, Schubert S, Klempnauer KH. Regulation of the cyclin D1 and cyclin A1 promoters by B-Myb is mediated by Sp1 binding sites. Gene. 2005;351:171-180. [PubMed] [DOI] |
| 23. | Liedtke C, Groger N, Manns MP, Trautwein C. The human caspase-8 promoter sustains basal activity through SP1 and ETS-like transcription factors and can be up-regulated by a p53-dependent mechanism. J Biol Chem. 2003;278:27593-27604. [PubMed] [DOI] |
| 24. | 姚 而固, 徐 世荣, 董 作仁. 新编白血病化疗学. 天津: 天津科学技术出版社 1999; 71, 82. |